а) угольной; б) бромоводородной HBr; в) сернистой H2SO3; г) хлорной HClO4. Проверьте выполнение этого задания у соседа по парте.

С бескислородными кислотами всё просто и понятно, но как составлять формулы кислородсодержащих кислот?
- Сначала пишем символ атома центрального элемента.
- Вокруг символа атома центрального элемента пишем атомы кислорода.
- Все атомы водорода должны быть соединены с атомом кислорода.
- Все атомы кислорода должны быть соединены с центральным атомом.
- Между атомом кислорода и центральным атомом ставятся двойные черточки.
- Проверьте число атомов в структурной формуле.
- Проверьте валентность центрального атома.
1. Какие вещества называют кислотами?
3. Определите валентность кислотных остатков следующих кислот: H2S, HBr, HNO3, H2CO3, HMnO4, H3PO4, H2SO4.
4. Выведите химическую формулу соединения, в состав которого входят 3,95 массовой части химического элемента селена (Ar (Se) = 79) и 0,1 массовой части водорода.
Тестовые задания.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 ноября 2022 года; проверки требуют 6 правок.
| Хлорная кислота | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Хлорная кислота | |
| Хим. формула | HClO4 | |
| Физические свойства | ||
| Состояние | бесцветная жидкость | |
| Молярная масса | 100,46 г/моль | |
| Плотность | 1,76 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | −102 °C | |
| • кипения | 203 °C | |
| Энтальпия | ||
| • образования | −40,4 кДж/моль | |
| Химические свойства | ||
Константа диссоциации кислоты  |
−10 | |
| Растворимость | ||
| • в воде | смешивается | |
| Классификация | ||
| Рег. номер CAS | 7601-90-3 | |
| PubChem | 24247 | |
| Рег. номер EINECS | 231-512-4 | |
| SMILES |
OCl(=O)(=O)=O |
|
| InChI |
InChI=1S/ClHO4/c2-1(3,4)5/h(H,2,3,4,5) VLTRZXGMWDSKGL-UHFFFAOYSA-N |
|
| RTECS | SC7500000 | |
| ChEBI | 29221 | |
| Номер ООН | 1873 | |
| ChemSpider | 22669 | |
| Безопасность | ||
| NFPA 704 |
0 3 3 OX |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
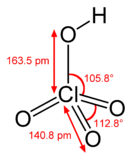
Хлорная кислота HClO4 — одноосновная кислота, одна из самых сильных (в водном растворе, pK ≈ −10), безводная — исключительно сильный окислитель, так как содержит хлор в высшей степени окисления +7.
Свойства[править | править код]
Физические свойства[править | править код]
Бесцветная летучая жидкость, сильно дымящая на воздухе, в парах мономерна. Безводная хлорная кислота очень реакционноспособна и неустойчива.
Химические свойства[править | править код]
Жидкая HClO4 частично димеризована, для неё характерна равновесная автодегидратация:
Безводная кислота взрывоопасна из-за наличия в ней оксида хлора(VII). Водные растворы с концентрацией ниже 72 % более безопасны, но на свету желтеют с образованием взрывоопасных оксидов хлора. Пожелтевшую кислоту рекомендуется аккуратно разбавить и нейтрализовать щелочами или карбонатами.
Являясь сильной неустойчивой кислотой, хлорная кислота разлагается:
Хлорную кислоту и её соли (перхлораты) применяют как окислители. Хлорная кислота, как одна из самых сильных кислот и окислитель, растворяет золото и платиновые металлы:
а в реакции с серебром образует хлорноватую кислоту:
Неметаллы и активные металлы восстанавливают концентрированную хлорную кислоту до хлороводорода
(данная реакция используется в металлургии для очистки руд.
Аммиак окисляется в концентрированной хлорной кислоте до азотной кислоты:

В отличие от других кислот, хлорная при этом не образует соответствующей соли аммония.
Разбавленная хлорная кислота обладает слабыми окислительными свойствами (не окисляет сероводород, диоксид серы, иодоводород, хром(II), азотистую кислоту) и при реакции с металлами до водорода в электрохимическом ряду выделяет водород с образованием перхлоратов. Водные растворы хлорной кислоты устойчивы.
Хлорная кислота хорошо растворима во фтор- и хлорорганических растворителях, таких, как CF3COOH, CHCl3, CH2Cl2 и др. Смешивание с растворителями, проявляющими восстановительные свойства (например, с диметилсульфоксидом), может привести к воспламенению и взрыву.
С водой хлорная кислота смешивается в любых соотношениях и образует ряд гидратов HClO4·nH2O (где n = 0,25…4). Моногидрат HClO4·H2O имеет ионную природу и температуру плавления +50 °C.
Хлорная кислота с водой образует азеотропную смесь, кипящую при 203 °C и содержащую 72 % хлорной кислоты.
Растворы хлорной кислоты в хлорсодержащих углеводородах являются сверхкислотами (суперкислотами). Хлорная кислота является одной из сильнейших неорганических кислот, в её среде даже кислотные соединения ведут себя как основания, присоединяя протон и образуя катионы ацилперхлоратов: P(OH)4+ClO4−, NO2+ClO4−.
При слабом нагревании при пониженном давлении смеси хлорной кислоты с фосфорным ангидридом, отгоняется бесцветная маслянистая жидкость — хлорный ангидрид:
Соли хлорной кислоты называются перхлоратами. Их большинство растворимо в воде. Малорастворимы перхлораты калия, цезия и рубидия. Перхлорат йода в лаборатории получают при обработке раствора йода в безводной хлорной кислоте озоном:
Перхлорат фтора можно получить прямым синтезом:
2F2+4HClO4→4FClO3+2H2O+О2↑
Получение[править | править код]

- Для получения безводной хлорной кислоты требуется нагрев насыщенного раствора перхлората аммония с добавлением азотной, а затем и соляной кислоты, вследствие чего образуется хлорная кислота, вода, хлор и оксид азота (I):

Для получения особо чистого оксида хлора семь требуется нагрев сухих хлоратов металлов с жидким фторидом кислорода:
OF2 + 2KClO3 = Cl2O7 + 2KF
Применение[править | править код]
- Концентрированные водные растворы хлорной кислоты широко используются в аналитической химии, а также для получения перхлоратов.
- Хлорная кислота применяется при разложении сложных руд, при анализе минералов, а также в качестве катализатора.
- Соли хлорной кислоты: перхлорат калия малорастворим в воде, применяется в производстве взрывчатых веществ, перхлорат магния (ангидрон) — осушитель, перхлорат аммония — добавка к ракетному топливу и взрывчатое вещество.
Безводную хлорную кислоту нельзя длительно хранить и перевозить, так как при хранении в обычных условиях она медленно разлагается, окрашивается оксидами хлора, образующимися при её разложении, и может самопроизвольно взрываться. Зато её водные растворы вполне устойчивы.
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М., 2001.
- Реми Г. Курс неорганической химии. — М.: Иностранная литература, 1963.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Общее число найденных записей: 1.
Показано записей: 1.
Хлорная кислота
Брутто-формула:
HClO4
CAS# 7601-90-3
Категории:
Неорганические кислоты
PubChem CID: 24247
Названия
Русский:
- Хлорная кислота(IUPAC)
English:
- Acide perchlorique
- Hydronium perchlorate
- Hyperchloric acid
- Perchloric acid(IUPAC)(CAS)
- acido perclorico
Варианты формулы:
HClO4
H(+1)Cl(+7)O(-2)4
O//Cl<_(A75,N2)O>O“|O/H
O_(A-15,N2)Cl<_(A100,N2)O>O“|OH
$dots(LTlDl)O=Cl<||$dots(LdDRd)O><`||$dots(LtTRt)O>-$dots(TD)O-H
Вещества, имеющие отношение…
Ангидрид:
Оксид хлора(VII)
Анион:
Перхлораты
Химический состав
Реакции, в которых участвует Хлорная кислота
-
{M}OH + H{X} -> {M}{X} + H2O
, где M =
Li Na K Rb Cs; X =
F Cl Br I NO3 CN IO3 BrO4 ClO4 N3 [AuCl4] ClO2 ReO4 -
{M}2O + 2H{X} = 2{M}{X} + H2O
, где M =
Li Na K Rb Cs; X =
F Cl Br I NO3 CN IO3 ClO4 BrO4 -
NH3 + H{X} -> NH4{X}
, где X =
F Cl Br I NO3 ClO3 ClO4 N3 -
Na2MoO4 + H2O + 2HClO4 -> MoO3 * 2H2O + 2NaClO4
-
NaClO4 + H2SO4 = HClO4 + NaHSO4
И ещё 9 реакций…
как составить структурные формулы кислот:бромоводородной, хлорной
Яна Чевгун
Ученик
(123),
на голосовании
14 лет назад
Голосование за лучший ответ
Vladimir Matvejev
Мыслитель
(6273)
14 лет назад
структурные формулы HBr(H-Br), HClO4(H-O-Cl дальше от атома хлора отходят три пары химических связей и на каждой паре по одному атому кислорода
Похожие вопросы
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,893 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.