
CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
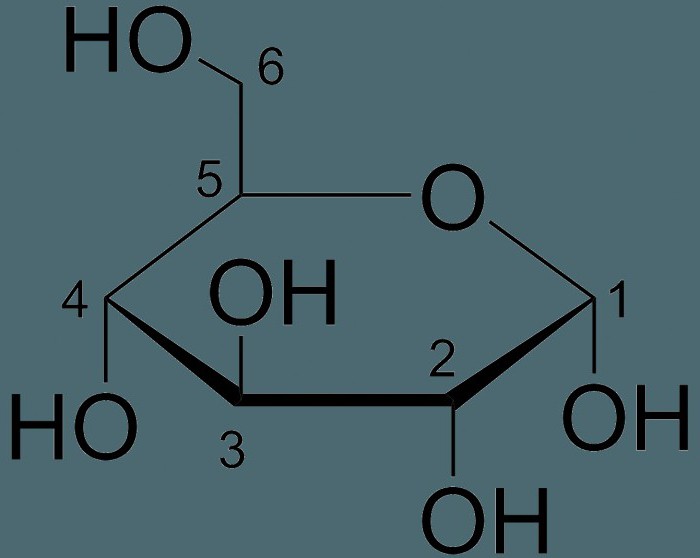
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
Как написать структурную формулу
Структурная формула – это графическое изображение химического строения молекулы вещества, в котором показывается порядок связи атомов, их геометрическое расположение. Кроме того, она наглядно показывает валентность атомов входящих в ее состав.
Вам понадобится
- – ручка;
- – бумага;
- – периодическая система элементов.
Инструкция
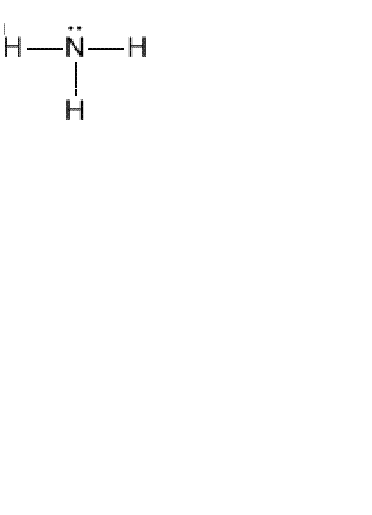
Для правильного написания структурной формулы того или иного химического вещества вы должны хорошо знать и представлять, что такое способность атомов образовывать определенное количество электронных пар с другими атомами. Ведь именно валентность поможет вам нарисовать химические связи. Например, дана молекулярная формула аммиака NH3. Вы должны написать структурную формулу. Учитывайте то, что водород всегда одновалентен, поэтому его атомы не могут быть связаны между собой, следовательно, они будут соединены с азотом.
Чтобы правильно написать структурные формулы органических соединений, повторите основные положения теории А.М. Бутлерова, согласно которой существуют изомеры – вещества с одинаковым элементарным составом, но с разными химическими свойствами. Например, изобутан и бутан. Молекулярная формула у них одинаковая: C4H10, а структурные – отличаются.
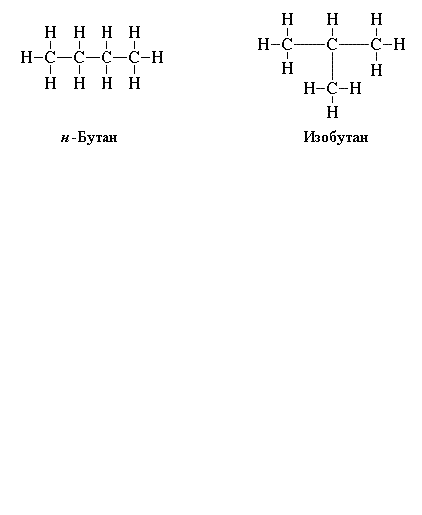
В линейной формуле каждый атом записывается отдельно, поэтому такое изображение занимает много места. Однако при составлении структурной формулы, вы можете указать общее число атомов водорода при каждом атоме углерода. А между соседними углеродами нарисуйте химические связи в виде линий.

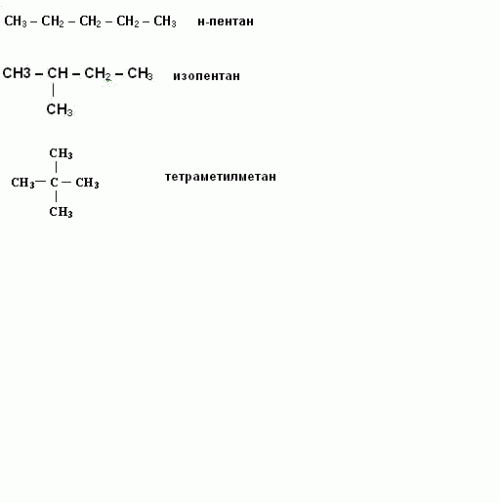
Написание изомеров начните с углеводорода нормального строения, то есть с неразветвленной цепью углеродных атомов. Затем сократите на один атом углерода, который присоедините к другому, внутреннему углероду. Исчерпав все варианты написания изомеров с данной длиной цепи, сократите ее еще на один углеродный атом. И опять присоедините его к внутреннему углеродному атому цепи. Например, структурные формулы н-пентана, изопентана, тетраметилметана. Таким образом, углеводород с молекулярной формулой C5H12 имеет три изомера.
Полезный совет
Для определения валентности атомов при составлении структурных формул используйте периодическую систему. Показать точно расстояние атомов в молекуле поможет трехмерная структурная формула.
Источники:
- структурная формула веществ
- Составление формул комплексных соединений
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Онлайн-урок: Составление структурных формул
Начиная изучать органическую химию очень важно научиться составлять структурные формулы веществ, ведь это буквально письменная химическая речь. Правильно записанная структурная формула дает возможность определить класс вещества, его гомологический ряд, представить его форму в пространстве, а самое главное понять, как именно соединены между собой атомы в молекуле, сколько у них связей, каков углеродный скелет и структура молекулы. Зная структуру вещества, мы можем говорить о его химических, а так же физических свойствах.
Если молекулярная формула показывает качественный и количественный состав (С2Н6), то есть число атомов каждого элемента в молекуле, то структурная формула показывает последовательность соединения атомов в молекуле, дает представление о взаимном расположении атомов в молекуле друг относительно друга, дает понимание химического строения вещества.
Для правильного составления структурных формул нужно знать валентности атомов в молекуле, рассмотрим основные из них:
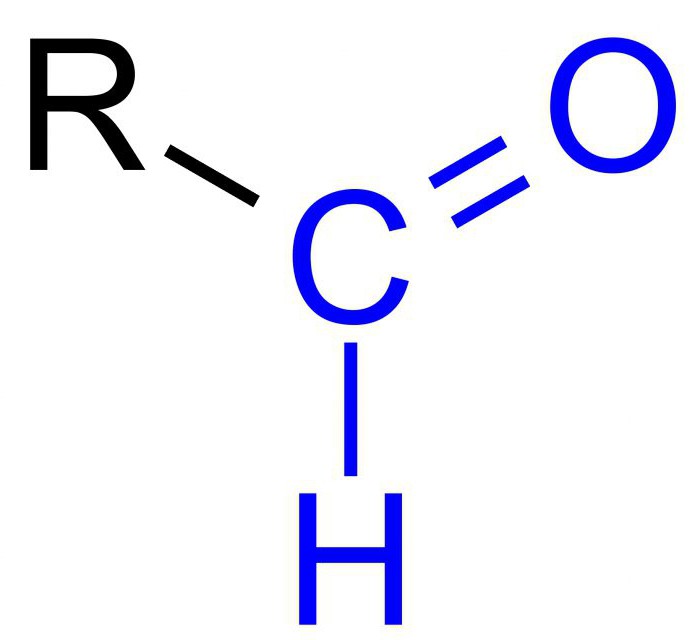
1. атом углерода (С) в органической химии всегда четырехвалентен, это означает, что он образует 4 связи с другими атомами:
2. атом кислорода (О) имеет валентность равную двум, значит, образует 2 связи с другими атомами:
3. атом водорода одновалентен, образует одну связь с другими атомами
4. азот – трехвалентен, три связи с другими атомами
Существует несколько видов структурных формул. Рассмотрим их на примере молекулы глицина (C2H5NO2), аминоуксусной кислоты, которая нормализует работу нервной системы и улучшает память. Научимся составлять структурные формулы от самой объемной к более упрощенной.
1. Самый подробный, дает возможность увидеть, как связан каждый атом в молекуле. Данную запись используют в самом начале изучения химии или есть необходимость показать связь каждого атома. Для ее составления сначала расположим атомы азота (N), углерода (С), кислород (О) в одну линию, затем, учитывая валентности каждого атома, дорисуем водороды (H) и кислород (О). Проверим еще раз валентности, чему равна валентность, столько и образует связей атом.
2. Более упрощенной записью является запись, в которой указывают общее число атомов водорода (Н) при каждом атоме. Такая запись является наиболее распространенной, говоря о структурной формуле, обычно записывают именно так, при этом главную цепь записывают в одну линию, а заместители располагают выше и ниже, учитывая валентности.
3.Существует еще более упрощенная форма записи структурных формул веществ, в которых опускают запись углерода (С) и водорода (Н), заменяют их на так называемые «удлиненные связи», по каждым образующимся углом подразумевается атом углерода с нужным количеством водородов. Такую запись используют в основном студенты вузов или продвинутые пользователи, на уровне абитуриента достаточно владеть предыдущим способом записи.
Структурная формула представляет собой графическое изображение химического строения вещества. В ней указывается порядок расположения атомов, а также связь между отдельными частями вещества. К тому же структурные формулы веществ наглядно демонстрируют валентности всех атомов, включенных в молекулу.
Особенности написания структурной формулы
Для составления потребуется бумага, ручка, периодическая система элементов Менделеева.
Если нужно нарисовать графическую формулу аммиака, нужно учитывать, что водород способен образовывать только одну связь, поскольку его валентность равна единице. Азот находится в пятой группе (главной подгруппе), имеет на внешнем энергетическом уровне пять валентных электронов.
Три из них он использует для образования простых связей с атомами водорода. В итоге структурная формула будет представлять собой следующий вид: в центре находится азот, вокруг него располагаются атомы водорода.
Инструкция по написанию формул
Чтобы структурная формула была написана правильно для определенного химического вещества, важно иметь представление о строении атома, валентности элементов.
Именно с помощью данного понятия можно изображать графическое строение органических и неорганических веществ.
Органические соединения
Органическая химия предполагает использование графического строения химических веществ разных классов при написании химических реакций. Структурная формула составляется на основе теории строения органических веществ Бутлерова.
Она включает в себя четыре положения, согласно которым записываются структурные формулы изомеров, выдвигается предположение о химических свойствах анализируемого вещества.
Пример составления структур изомеров
Изомерами называют в органической химии вещества, которые имеют одинаковый качественный и количественный состав, но отличаются по расположению атомов в молекуле (структуре), химической активности.
Вопросы, касающиеся составления графического строения органических веществ, включены в вопросы единого государственного экзамена, проводимого в 11 классе. Например, нужно составить, а также дать название структурных формул изомеров состава С6Н12. Как справиться с подобной задачей?
Для начала нужно понять, к какому классу органических веществ, могут принадлежать вещества с таким составом. Учитывая, что общую формулу CnH2n имеют сразу два класса углеводородов: алкены и циклоалканы, нужно составить структуры всех возможных веществ для каждого класса.
Для начала можно рассмотреть формулы всех углеводородов, принадлежащих к классу алкенов. Они характеризуются наличием одной кратной (двойной) связи, что должно быть отражено при составлении структурной формулы.
Учитывая, что в молекуле шесть атомов углерода, составляем главную цепь. После первого углерода ставим двойную связь. Пользуясь первым положением теории Бутлерова, для каждого атома углерода (валентность четыре) ставим необходимое количество водородов. Называя полученное вещество, используем систематическую номенклатуру, получаем гексен-1.
Оставляем в главной цепи шесть углеродных атомов, перемещаем положение двойной связи после второго углерода, получаем гексен-2. Продолжая передвигать по структуре кратную связь, составляем формулу гексена-3.
Далее приступаем к составлению изомеров углеродного скелета. Для этого один из углеродов в качестве алкильного радикала (СН3) передвигаем по цепи, которая стала короче на один углерод.
Пользуясь правилами систематической номенклатуры, получаем 2 метилпентен-1; 3 метилпентен-1; 4 метилпентен-1. Затем перемещаем кратную связь после второго углерода в главной цепи, а алкильный радикал располагаем у второго, затем у третьего углеродного атома, получая 2 метилпентен-2, 3 метилпентен-2.
Аналогичным образом продолжаем составлять и называть изомеры. Рассмотренные структуры представляют собой два вида изомерии: углеродного скелета, положения кратной связи. Необязательно указывать по отдельности все водородные атомы, можно использовать варианты сокращенных структурных формул, суммируя каждого атома углерода число водорода, указывая их соответствующими индексами.
Учитывая, что у алкенов и циклоалканов сходна общая формула, при составлении структур изомеров необходимо учитывать этот факт. Сначала можно составить структуру замкнутого циклогексана, затем посмотреть возможные изомеры боковой цепи, получив метилциклопентан, диметилциклобутан, и т. д.
Линейные структуры
Структурные формулы кислот являются типичными представителями подобного строения. Предполагается указание каждого отдельного атома при создании их графических формул, указанием черточками числа валентностей между атомами.
Заключение
По готовым структурным формулам можно определить валентность каждого элемента, входящего в состав вещества, предположить возможные химические свойства молекулы.
После того как была разработана теория строения органических веществ Бутлерова, удалось объяснить различие в свойствах между веществами, которые имеют одинаковый качественный и количественный составом явлением изомерии. Пользуясь определением валентности, периодической системой элементов Менделеева, можно представить в графическом виде любое неорганическое и органическое вещество. В органической химии структурные формулы составляют для того, чтобы понять алгоритм протекания химических превращений и объяснить их суть.
Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:

Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:

Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
![]()
соответствуют структурные формулы

Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.

2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:

3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:

Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:

Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |
Найди девять отличий |
Правила составления изомеров на примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:
![]()
4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность С – IV. В результате получают изомер а):
![]()
5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):

Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):

6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4с углеродным заместителем при С-2 и С-3:

Записывают структурные формулы новых изомеров:

7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:

8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:

Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.
