Содержание
- 1 Формула и строение
- 2 Изомерия октана
- 2.1 Структурная изомерия
- 2.2 Оптическая изомерия
- 2.3 Наименования и формулы изомеров октана
- 3 Физические свойства
- 4 Химические свойства
- 5 Получение октанов
- 6 Применение октанов
Октан – восьмой член в гомологическом ряду алканов. Изомеры октана характеризуются структурным разнообразием, вследствие чего свойства этих веществ различны. Они, в свою очередь, определяют сферу применения того или иного изомера. Главным источником для получения октанов служит нефть и продукты ее переработки.
Формула и строение
Являясь типичными предельными углеводородами ациклического строения, октаны содержат наибольшее возможное количество атомов водорода. Построение углеродного скелета и удержание на нем водородных атомов осуществляется только за счет прочных одинарных ![]() -связей.
-связей.
Состав октана выражается химической формулой С8H18. Простейшее строение молекулы октана представляет собой неразветвленную и не содержащую циклов цепь, так называемый нормальный, или н-октан. Она образована восемью углеродными атомами, валентности которых полностью насыщены.
Структурная формула октана:
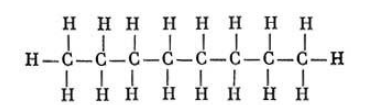
Строение молекулы можно также изобразить с помощью скелетной формулы, где символы водорода и углерода опускаются. Вершины и концы ломаной линии означают углеродные атомы:
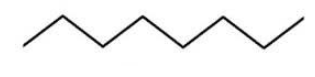
Зигзагообразная форма линии точнее отражает молекулярную структуру углеводородов, так как углеродные атомы связываются между собой не линейно, а подчиняясь валентным углам, возникающим у атома в sp3-гибридизованном состоянии.
Поскольку вокруг ![]() -связей возможно вращение, молекула может образовывать ряд конформаций – вариантов расположения атомов по отношению друг к другу. Для линейных алканов наиболее энергетически выгодной и стабильной является конформация в виде зигзага.
-связей возможно вращение, молекула может образовывать ряд конформаций – вариантов расположения атомов по отношению друг к другу. Для линейных алканов наиболее энергетически выгодной и стабильной является конформация в виде зигзага.

Изомерия октана
У соединений состава С8H18 изомеры возникают не только вследствие вариантов ветвления цепочки. Октаны способны образовывать изомеры на основе оптических различий между структурно одинаковыми молекулами. Все изомеры октана являются насыщенными ациклическими углеводородами – кратные связи в них не появляются.
Структурная изомерия
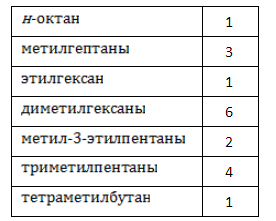
Алканы образуют структурные изомеры лишь по одному признаку – по порядку связывания атомов, формирующих углеродный скелет. Таких изомеров насчитывается 18, и их удобно разделить на группы по типу и количеству алкильных радикалов:
Оптическая изомерия
Пространственные изомеры данного типа, называемые также энантиомерами, при идентичной структуре не обладают зеркальной симметрией. Такие молекулы-энантиомеры представляют собой взаимные зеркальные отражения, которые не могут совпасть при вращении, – антиподы. Отсутствие зеркальной симметрии носит название хиральности (пример – правая и левая руки).
Хиральность возникает, если все четыре заместителя при каком-либо углеродном атоме оказываются разными. В этом случае в молекуле отсутствует плоскость симметрии. Как бы ни вращался этот атом (центр хиральности) вместе с радикалами, молекулу невозможно совместить с ее зеркальным отражением.
Если же молекула обладает плоскостью симметрии, она не является оптическим изомером. Возникает другой тип пространственной изомерии – диастереомерия.
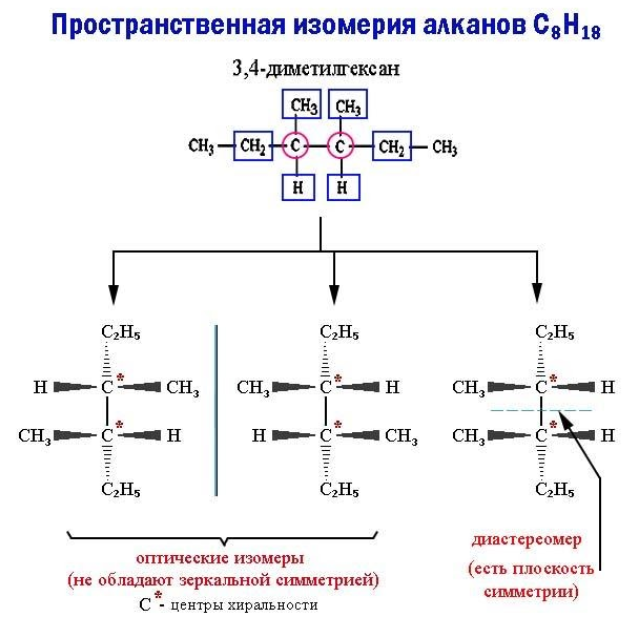
Энантиомеры проявляют свои различия только в оптически активной среде. Так, являясь антиподами, они поворачивают в противоположных направлениях плоскость поляризации света. В химических взаимодействиях с хиральными соединениями (например, аминокислотами) оптические изомеры существенно различаются по реакционной способности.
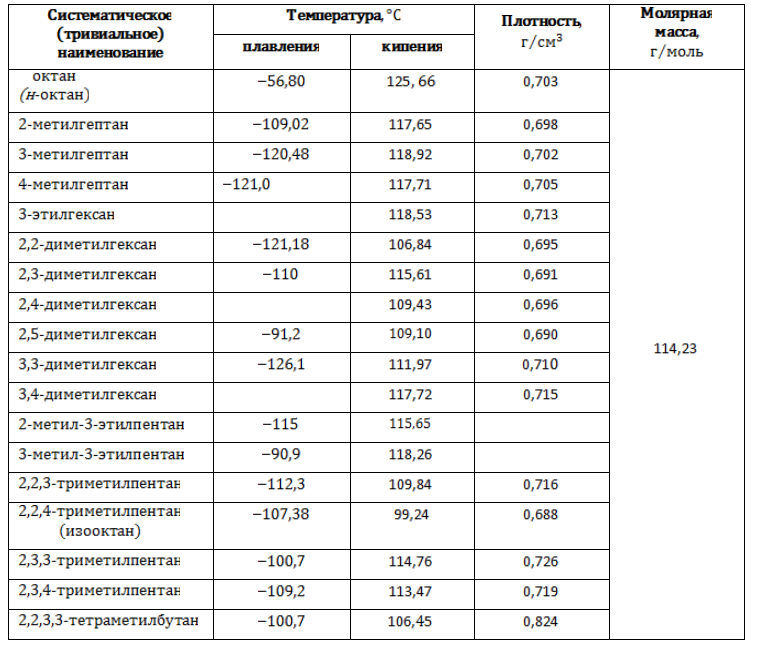
Наименования и формулы изомеров октана




Физические свойства
Октаны – прозрачные жидкости без цвета, со слабо выраженным запахом. Появление боковых ветвей в молекулах изомерных форм прежде всего влияет на межмолекулярные связи, что приводит к изменению температур, при которых вещества совершают фазовые переходы.
Изомеры состава С8H18, подобно всем алканам, нерастворимы в воде, но растворяются в эфирах, бензоле и других органических растворителях.
Основные физические характеристики октанов приводятся в таблице.
Химические свойства
Изомерные октаны принадлежат к одному классу веществ – насыщенным ациклическим углеводородам. Поэтому в химических взаимодействиях они проявляют типичные для алканов свойства:
- не участвуют в реакциях присоединения;
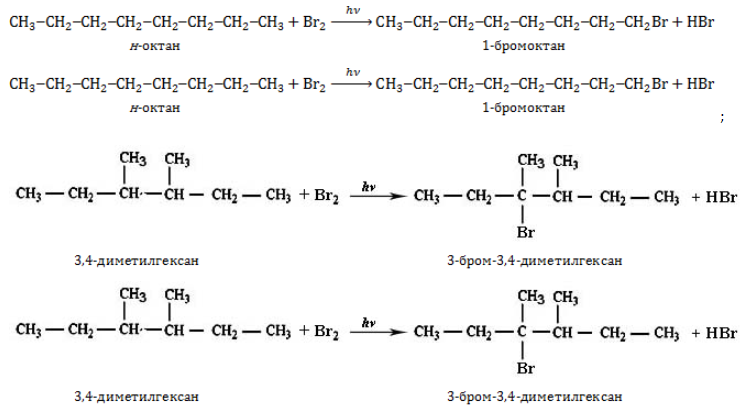
- вступают в реакции замещения:
- при комнатной температуре устойчивы к действию окислителей;
- отличаются горючестью:
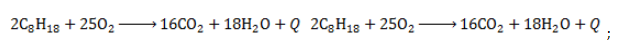
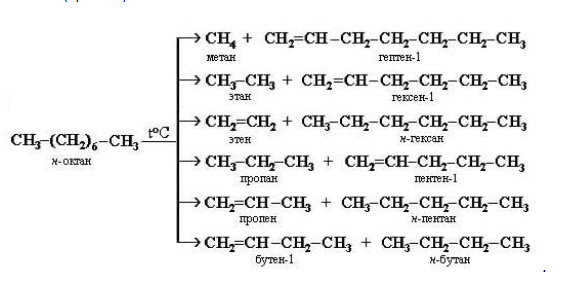
- разлагаются при температурах свыше 500 С без доступа воздуха на смесь низших алканов и алкенов (крекинг):
- дегидрируются при температуре
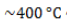 на катализаторе с образованием циклоалкана и последующим превращением в ароматический углеводород бензольного ряда:
на катализаторе с образованием циклоалкана и последующим превращением в ароматический углеводород бензольного ряда:
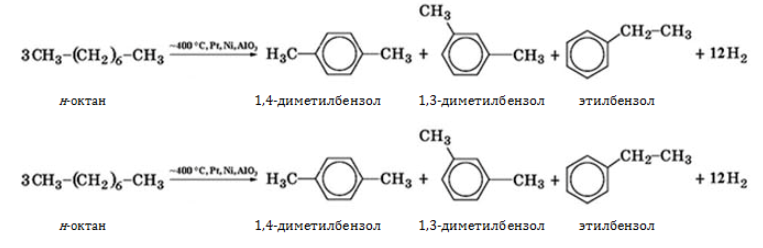
- изомеризуются с образованием разветвленной молекулы:
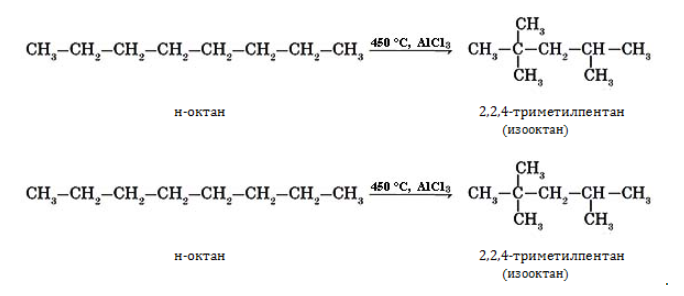
Получение октанов
Для лабораторного синтеза октана и его изомеров применяются следующие методы:
- гидрирование ненасыщенных линейных углеводородов – алкенов и алкинов:
- гидрирование циклоалканов:
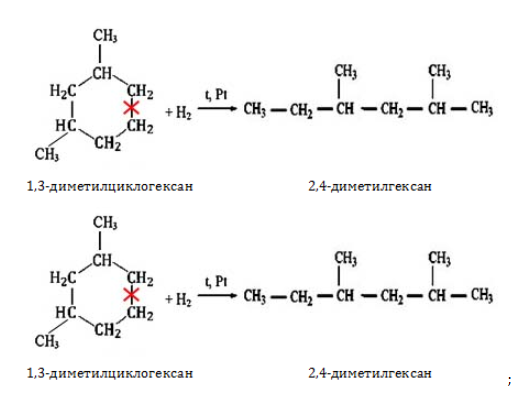
- восстановление галогеналканов:

- синтез низших галогеналканов с участием металлического натрия, отнимающего галоген (реакция Вюрца):

В промышленности октан и его изомеры получают в процессах бензиновой фракции нефти или в числе прочих углеводородов при синтезе по методу Фишера–Тропша:

Применение октанов

Как сырье или промежуточный продукт октан используется в органическом синтезе. С его помощью получают ароматические углеводороды бензольного ряда – этилбензол и ортоксилол – а также другие соединения. Октан также применяется в качестве растворителя. Как компонент топлива октан играет скорее отрицательную роль, так как понижает устойчивость горючего к детонации.
Изооктан благодаря разветвленной структуре молекулы не склонен к детонации, вследствие чего принят в качестве эталона для определения качества бензина. Изооктан входит в состав авиационного топлива. Как химическое сырье изооктан не находит применения. Сфера его использования ограничена топливной отраслью, в которой изооктан играет важную роль.
Это интересно:
Изомеры органических веществ
Галогеналканы
Гомологический ряд алкадиенов
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 января 2021 года; проверки требуют 2 правки.
У этого термина существуют и другие значения, см. Октан (значения).
| Октан | ||
|---|---|---|
|
||
| Общие | ||
| Хим. формула | C8H18 | |
| Физические свойства | ||
| Молярная масса | 114,2285 г/моль | |
| Плотность | 0,703 г/см³ | |
| Энергия ионизации | 9,82 ± 0,01 эВ | |
| Термические свойства | ||
| Температура | ||
| • плавления | −57 °C | |
| • кипения | 125,52 °C | |
| • вспышки | 14 °C | |
| • воспламенения | 19 °C | |
| • самовоспламенения | 215 °C | |
| Пределы взрываемости | 1 ± 1 об.% | |
| Энтальпия | ||
| • образования | –208 кДж/моль | |
| • сгорания | −5470 кДж/моль[1] | |
| Давление пара | 10 ± 1 мм рт.ст. | |
| Оптические свойства | ||
| Показатель преломления | 1,398 | |
| Классификация | ||
| Рег. номер CAS | 111-65-9 | |
| PubChem | 356 | |
| Рег. номер EINECS | 203-892-1 | |
| SMILES |
CCCCCCCC |
|
| InChI |
InChI=1S/C8H18/c1-3-5-7-8-6-4-2/h3-8H2,1-2H3 TVMXDCGIABBOFY-UHFFFAOYSA-N |
|
| RTECS | RG8400000 | |
| ChEBI | 17590 | |
| Номер ООН | 1262 | |
| ChemSpider | 349 | |
| Безопасность | ||
| NFPA 704 |
3 1 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Октан (н-октан) — органическое соединение класса алканов.
Свойства[править | править код]
Бесцветная жидкость со сладковатым специфическим запахом, похожим на запах бензина; октановое число 17—19;
Получение[править | править код]
Вместе с изооктаном и др. изомерами содержится в нефти, бензине прямой перегонки (до 10 %), а также в большом количестве в синтетическом бензине, получаемом из CO и H2. В промышленности октан выделяют ректификацией, а затем подвергают очистке мочевиной с помощью молекулярных сит.
Применение[править | править код]
При пропускании над алюмомолибденовым или алюмохромовым катализатором в присутствии водорода октан превращается (при 500 °C и давлении 1—2 Мн/м², или 10—20 кгс/см²) в смесь ароматических углеводородов (о-ксилол и этилбензол). Эта реакция дегидроциклизации — одна из основных в процессах каталитического риформинга.
Изомеры[править | править код]
Октан имеет 18 структурных изомеров.
- Октан (н-октан)
- 2-метилгептан
- 3-метилгептан (+ имеет оптическую изомерию)
- 4-метилгептан
- 3-этилгексан
- 2,2-диметилгексан
- 2,3-диметилгексан (+ имеет оптическую изомерию)
- 2,4-диметилгексан (+ имеет оптическую изомерию)
- 2,5-диметилгексан
- 3,3-диметилгексан
- 3,4-диметилгексан (+ имеет оптическую изомерию (два хиральных центра))
- 2-метил-3-этилпентан
- 3-метил-3-этилпентан
- 2,2,3-триметилпентан (+ имеет оптическую изомерию)
- 2,2,4-триметилпентан (так же известный как изооктан)
- 2,3,3-триметилпентан
- 2,3,4-триметилпентан
- 2,2,3,3-тетраметилбутан
Примечания[править | править код]
- ↑ https://sites.google.com/site/ellesmerealevelchemistry/module-3-periodic-table-energy/3-2-physical-chemistry-1/3-2-1-enthalpy-changes/3-2-1-d-enthalpy-change-definitions
Литература[править | править код]
- Корольченко А. Я.,Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х ч. — 2-е изд., перераб. и доп. — М.: Асс. “Пожнаука”, 2004. — Ч.II. — 713 с. — ISBN 5-901283-02-3, УДК (658.345.44+658.345.43)66.
Октан C8H18 – это предельный углеводород, содержащий восемь атомов углерода в углеродной цепи. Бесцветная жидкость с характерным запахом, нерастворим в воде и не смешивается с ней.
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3
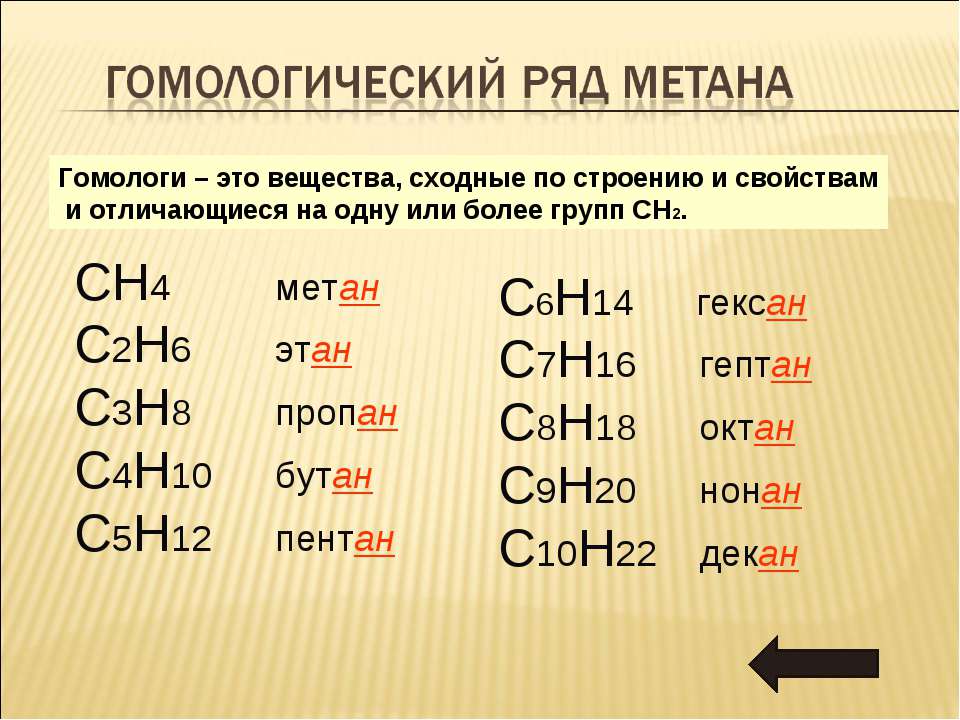
Гомологический ряд октана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4. , или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение октана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp3:

При образовании связи С–С происходит перекрывание sp3-гибридных орбиталей атомов углерода:

При образовании связи С–H происходит перекрывание sp3-гибридной орбитали атома углерода и s-орбитали атома водорода:

Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109о 28′ друг к другу:

Это соответствует тетраэдрическому строению.
Например, в молекуле октана C8H18 атомы водорода располагаются в пространстве в вершинах тетраэдров, центрами которых являются атомы углерода. При этом углеродный скелет имеет зигзагообразное строение.
Изомерия октана
Структурная изомерия
Для октана характерна структурная изомерия – изомерия углеродного скелета.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Изомеры углеродного скелета отличаются строением углеродного скелета.
Для углеводородов состава С8Н18 существуют 18 изомеров углеродного скелета: н-октан, 2-метилгептан, 3 -метилгептан, 4-метилгептан, и др.
| Октан | 2-Метилгептан |
| CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 | CH3-CH(CH3)-CH2-CH2-CH2-CH2-CH3 |
Для октана не характерна пространственная изомерия.
Химические свойства октана
Октан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для октана характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для октана характерны радикальные реакции.
Октан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Октан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании октана образуется смесь хлорпроизводных.
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH-CH2-CH2-CH2-CH2-CH2-CH2Cl + HCl
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + Cl2 → CH3-CH2-CH2-CH2-CH2-CH2-CHCl-CH3 + HCl
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 → CH3-CH2-CH2-CH2-CHCl-CH2-CH2-CH3 + HCl
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + Br2 → CH3-CH2-CH2-CH2-CH2-CH2-CHBr-CH3 + HBr
CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + Br2 → CH3-CH2-CH2-CH2-CHBr-CH2-CH2-CH3 + HBr
1.2. Нитрование октана
Октан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в октане замещается на нитрогруппу NO2.
Например. При нитровании октана образуются преимущественно 2-нитрооктан, 4-нитрооктан и 3-нитрооктан.
2. Дегидрирование октана
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Октан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать этилциклогексан и потом этилбензол.
3. Крекинг
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы с более короткой углеродной цепью и алкены.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Например, при крекинге н-октана образуется смесь, в состав которой входят этилен, пропан, метан, бутилен, пропилен, этан и другие углеводороды.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
4. Окисление октана
Октан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
Полное окисление – горение
Октан горит с образованием углекислого газа и воды. Реакция горения октана сопровождается выделением большого количества теплоты.
2C8H18 + 25O2 → 16CO2 + 18H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении октана в недостатке кислорода может образоваться угарный газ СО или сажа С.
5. Изомеризация октана
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Например, н-октан под действием катализатора хлорида алюминия и при нагревании образует 2-метилгептан, 3-метилгептан и другие изомеры.
Получение октана
1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета.
Реакция больше подходит для получения симметричных алканов.
Октан можно получить из 1-хлорбутана и натрия:
2CH3-CH2-CH2-CH2-Cl + 2Na → CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH3 + 2NaCl
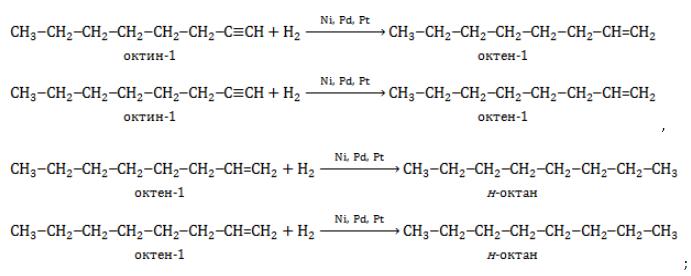
2. Гидрирование алкенов и алкинов
Октан можно получить из октенов или октинов:
![]()
При гидрировании октена-1, октена-2 или октена-3 образуется октан:
CH2=CH-CH2-CH2-CH2-CH2-CH2-CH3 + H2 → CH3-CH2-CH2-CH2-CH2-CH2-CH3
CH3-CH=CH-CH2-CH2-CH2-CH2-CH3 + H2 → CH3-CH2-CH2-CH2-CH2-CH2-CH3
При полном гидрировании октина-1, октина-2 или октина-3 также образуется октан:
CH≡C-CH2-CH2-CH2-CH2-CH2-CH3 + 2H2 → CH3-CH2-CH2-CH2-CH2-CH2-CH3
CH3-C≡C-CH2-CH2-CH2-CH2-CH3 + 2H2 → CH3-CH2-CH2-CH2-CH2-CH2-CH3
4. Получение октана в промышленности
В промышленности октан получают из нефти и каменного угля. При переработке нефти используют ректификацию, крекинг и другие способы.
Химия – это один из нелегких предметов, преподаваемых в школах. Сложность его заключается в том, что мало кто в повседневной жизни применяет химическую терминологию. Многие даже понятия не имеют, как можно получить или из чего состоит то или иное вещество.
На самом деле химия – это очень интересный увлекательный предмет. Благодаря знаниям, полученным на уроке, можно поэкспериментировать и получить интересные вещества.

В данной статье будет рассмотрено, что такое октан, структурная формула, получение вещества и его свойства.
Углеводородное соединение октан
Октаны являются частью алканового класса, образующего гомологический ряд. Они состоят из атомов водорода и углерода, являются насыщенными углеводородами.
Гомологический ряд алканов начинается с метана (содержит один атом углерода и четыре атома водорода), далее идет этан (2 углерода, 5 водорода), пропан (3 и 8), бутан (4 и 10), пентан (5 и 12), гексан (6 и 14), гептан (7 и 16), октан (8 и 18) и так далее. Из этого можно понять, что октан состоит из восьми атомов углерода и 18 атомов водорода.
Структурная формула октана C8H18. Это вещество в виде жидкости без цвета, имеющее своеобразный запах. Получают его из нефти и бензина. При температуре 56,8 °С вещество плавится, а при 125,67 °С – кипит.
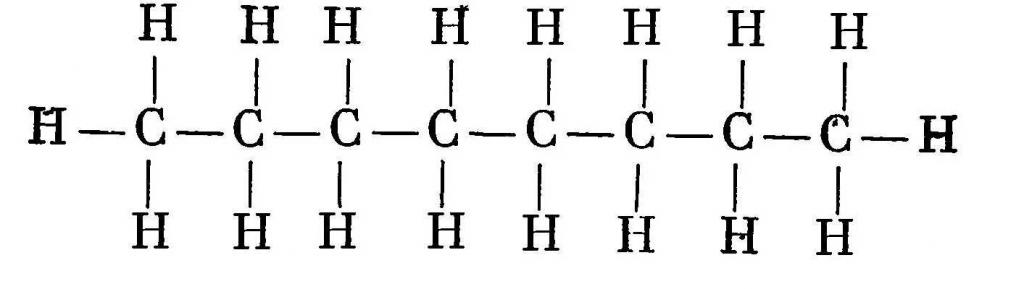
Октан используется в виде топлива для автомобилей, самолетов.
Алканы с атомами углерода больше трех имеют определенные изомеры. Рассмотрим, какие изомеры имеют октаны.
Структурные формулы изомеров октана
Изомеры – это такие вещества, которые имеют такой же состав, как сам алкан. Количество углеродов и водородов одинаковое, но разное строение и свойства. У октана 18 изомеров.
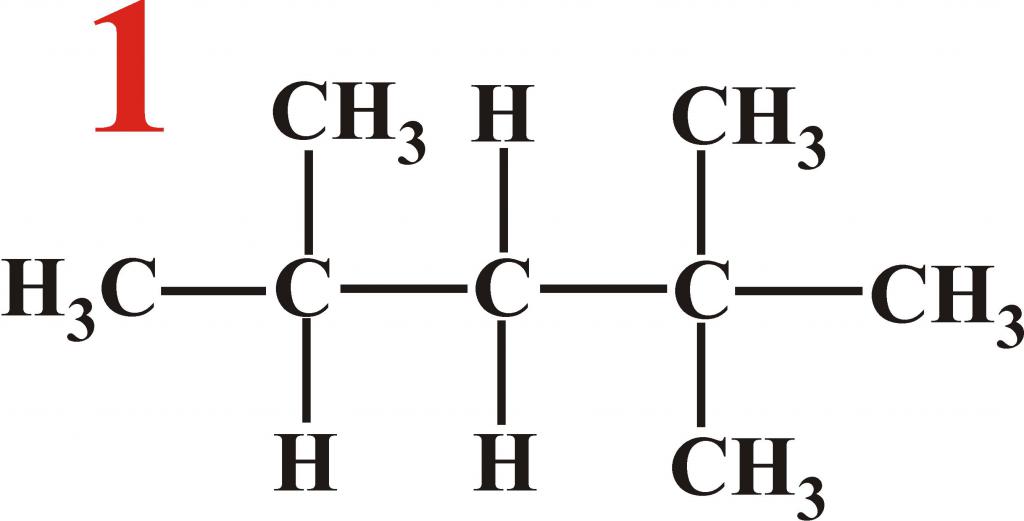
У каждого из них по восемь атомов углерода и восемнадцать атомов водорода. К ним можно отнести:
- метилгептаны;
- этилгексан;
- диметилгексаны;
- метил-3-этилпентаны;
- триметилпентаны;
- тетраметилбутан.
Структурный изомер октана – изооктан. Это бесцветная жидкость, пахнущая бензином. В воде она не растворяется. Применяется как добавка к бензину, повышающая его антидетонационные свойства.
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.


