а) угольной; б) бромоводородной HBr; в) сернистой H2SO3; г) хлорной HClO4. Проверьте выполнение этого задания у соседа по парте.

С бескислородными кислотами всё просто и понятно, но как составлять формулы кислородсодержащих кислот?
- Сначала пишем символ атома центрального элемента.
- Вокруг символа атома центрального элемента пишем атомы кислорода.
- Все атомы водорода должны быть соединены с атомом кислорода.
- Все атомы кислорода должны быть соединены с центральным атомом.
- Между атомом кислорода и центральным атомом ставятся двойные черточки.
- Проверьте число атомов в структурной формуле.
- Проверьте валентность центрального атома.
1. Какие вещества называют кислотами?
3. Определите валентность кислотных остатков следующих кислот: H2S, HBr, HNO3, H2CO3, HMnO4, H3PO4, H2SO4.
4. Выведите химическую формулу соединения, в состав которого входят 3,95 массовой части химического элемента селена (Ar (Se) = 79) и 0,1 массовой части водорода.
Тестовые задания.
| Сернистая кислота | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Сернистая кислота | |
| Хим. формула | H2SO3 | |
| Физические свойства | ||
| Состояние | Жидкость | |
| Молярная масса | 82.07 г/моль | |
| Плотность | 1,03 г/см³ | |
| Химические свойства | ||
Константа диссоциации кислоты  |
1,81 | |
| Растворимость | ||
| • в воде | 14.73 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | 7782-99-2 | |
| PubChem | 1100 | |
| Рег. номер EINECS | 231-973-1 | |
| SMILES |
OS(=O)O |
|
| InChI |
InChI=1S/H2O3S/c1-4(2)3/h(H2,1,2,3) LSNNMFCWUKXFEE-UHFFFAOYSA-N |
|
| ChEBI | 48854 | |
| ChemSpider | 1069 | |
| Безопасность | ||
| Пиктограммы ECB |
|
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Серни́стая кислота́ (химическая формула — H2SO3) — химическая неорганическая кислота средней силы, существующая только в водном растворе. Образуется при растворении диоксида серы в воде.
Её соли и эфиры называются сульфи́тами и ги́дросульфи́тами.
Физические свойства[править | править код]
Сернистая кислота — это двухосновная кислота средней силы. Образуется при растворении диоксида серы в воде. Ввиду неустойчивости не может быть выделена в чистом виде из водных растворов.
Химические свойства[править | править код]
Кислота средней силы:
Существует лишь в разбавленных водных растворах (в свободном состоянии не выделена):
- Баланс реакции лежит далеко слева.
Растворы H2SO3 всегда имеют резкий специфический запах химически не связанного водой SO2.
Двухосновная кислота, образует два ряда солей: кислые — гидросульфиты (в недостатке щёлочи):
и средние — сульфиты (в избытке щёлочи):
Как и сернистый газ, сернистая кислота и её соли являются сильными восстановителями:

При взаимодействии с ещё более сильными восстановителями может играть роль окислителя:
Качественная реакция на сульфит-ионы — обесцвечивание раствора перманганата калия:
Необратимо окисляется кислородом до серной кислоты при +70 °C под давлением и в присутствии сульфата меди (II). Образующийся сульфит меди (II) окисляется кислородом до сульфата меди (II):

Физиологические свойства[править | править код]
Пары сернистой кислоты имеют примерно те же свойства воздействия на организм человека, что и её ангидрид, сернистый газ, — с той только разницей, что концентрация таких паров в случае кислоты будет всегда ниже. Тем не менее, сернистая кислота всегда приводит к стойкому раздражению дыхательных путей, не позволяющему человеку продолжительного пребывания в атмосфере, сколько-нибудь богатой такими парами. При постоянном действии на человека даже разрежённых испарений сернистой кислоты, сразу не производящей заметного раздражения дыхательных органов, всё равно проявляются катаральные воспаления соединительной оболочки глаз, возникают трудности дыхания, расстройство пищеварения, что, в конце концов, приводит к общему упадку сил организма.[1]
Применение[править | править код]
- Восстановитель, для беления шерсти, шелка и других материалов, которые не выдерживают отбеливания с помощью сильных окислителей;
- Консервирование плодов, овощей, винных изделий;
- Осветление фруктовых соков, долгое время производимое при посредстве сернистого газа, на самом деле в своём механизме использует химическое воздействие сернистой кислоты;[2]
Примечания[править | править код]
- ↑ Ф. Ф. Эрисман. «Профессиональная гигиена». Избранные произведения: в 2 т. — М.: Медгиз, 1959 г.
- ↑ И. Н. Вольпер. Сахар: сладкий, горький, соленый — М.: «Химия и жизнь», № 10, 1965 г.
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4 (Пол-Три). — 639 с. — ISBN 5-82270-092-4.
Sulfurous Acid consists of the elements Hydrogen, Sulfur, and Oxygen. Hydrogen is a colorless, odorless, tasteless, and flammable gas. Its atomic number is 1 and is represented with the symbol H. Sulfur is an abundant non-metal present in Group 16 of the periodic table. Its atomic number is 16 and is represented with the symbol S. At room temperature, It appears in bright yellow, crystalline solid form. Oxygen is a highly reactive nonmetal and a good oxidizing agent. It is present in Group 16 of the periodic table. Its atomic number is 8 and is represented by the symbol O.
What is Sulfurous Acid (H2SO3)?
Sulfurous Acid is a colorless, weak inorganic acid with a pungent burning sulfur smell. The chemical formula of Sulfurous Acid is H2SO3.
It is corrosive to metals and tissues. H2SO3 is a sulfur oxoacid, tautomer of a sulfonic acid, and conjugate acid of a Hydrogen sulfite. The other names for Sulfurous Acid are hydrogen thiosulfate, Sulfur dioxide solution, and trioxosulfuric acid. It is an intermediate species to forms Acid rain from SO2 (Sulfur dioxide).
Preparation of Sulfurous Acid (H2SO3)
- Sulfurous Acid (H2SO3) is prepared by dissolving Sulfur dioxide (SO2) in water (H2O). Its chemical reaction of it is given below-
SO2 + H2O ⇢ H2SO3
Structure of Sulfurous Acid (H2SO3)
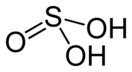
Sulfurous acid has the chemical formula H2SO3 and a molar mass of 82.07 g/mol. The chemical structure is illustrated in the diagram below. It is made up of one sulfur atom with two single bonds to hydroxyl groups and one double bond to oxygen.
Properties of Sulfurous Acid (H2SO3)
Physical Properties of Sulfurous Acid
- Sulfurous Acid is a colorless liquid.
- The odor of Sulfurous Acid is a pungent odor.
- The molecular weight of Sulfurous Acid is 82.07 g/mol.
- Its Monoisotopic mass is 81.97 g/mol.
- The boiling point of Sulfurous Acid is -60 °C.
- The density of Sulfurous Acid is 1.03 g/mL.
Chemical Properties of Sulfurous Acid
- Sulfurous Acid is unstable and has never been isolated in its pure state. H2SO3 decomposes into Sulfur dioxide and Water. The chemical reaction is given below-
H2SO3 ⇢ SO2+H2O
- Sulfurous Acid when exposed to air turns out to be Sulfuric Acid.
2H2SO3 + O2 ⇢ 2H2SO4
Uses of Sulfurous Acid (H2SO3)
- Sulfurous Acid is used in manufacturing paper products.
- H2SO3 and its salts are used as powerful reducing agents and disinfectants.
- H2SO3 is used as an intermediate in industries.
- Sulfurous Acid is used as a mild bleaching agent for applications having chlorine-sensitive materials.
FAQs on Sulfurous Acid Formula
Question 1: Is Sulfurous Acid a strong acid or weak acid?
Answer:
Unlike sulfuric acid, sulfurous acid is a weak acid because it dissociates partially in water. Here bisulfite ion is comparatively stronger in maintaining a proton when there is a base like water.
Question 2: Determine the molar mass of Sulfurous Acid.
Answer:
Sulfurous Acid consists of 2 Hydrogens, 1 Sulfur and 3 Oxygen atoms.
Atomic weight of each Hydrogen = 1.00784
Atomic weight of sulfur = 32.065
Atomic weight of each Oxygen = 15.999
Molecular weight of H2SO4 = (2 × 1.00784) + 32.065 +(3 × 15.999)
=82.07 g/mol
Question 3: Is Sulfurous Acid hazardous to health?
Answer:
Yes, Sulfurous Acid is dangerous compound. On contact may cause burns and by inhalation it irritate the neck and throat. This compound liberates toxic, corrosive and irritating gases. It also effects reproduction.
Question 4: Sulfurous acid is soluble in water?
Answer:
Sulfurous acid is a colorless liquid soluble in water. It hydrates to sulfuric acid which in turn dissociates into Bisulfite (HSO4–) and sulfite (SO32-) ions.
Question 5: What are the uses of Sulfurous acid?
Answer:
Sulfurous acid is used in manufacturing of paper products. It acts as disinfectant, reducing agent and bleaching agent and also as an electrolyte.
Question 6: Is Sulfurous acid an electrolyte?
Answer:
In Lead acid storage batteries, Sulfurous acid (H2SO3) is used as an electrolyte. It has high electrical conductivity.
Related Article
- Types of Acids
- Sulfuric Acid Formula
- Hyposulfurous Acid Formula
Last Updated :
09 Nov, 2022
Like Article
Save Article