Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:
Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:
Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.
2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:
3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |
Найди девять отличий |
Правила составления изомеров на примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:
4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность С – IV. В результате получают изомер а):
5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):
Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):
6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4с углеродным заместителем при С-2 и С-3:
Записывают структурные формулы новых изомеров:
7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:
8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:
Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.
Как написать структурную формулу
Структурная формула – это графическое изображение химического строения молекулы вещества, в котором показывается порядок связи атомов, их геометрическое расположение. Кроме того, она наглядно показывает валентность атомов входящих в ее состав.
Вам понадобится
- – ручка;
- – бумага;
- – периодическая система элементов.
Инструкция
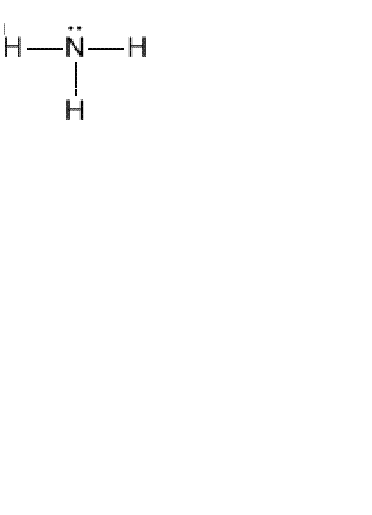
Для правильного написания структурной формулы того или иного химического вещества вы должны хорошо знать и представлять, что такое способность атомов образовывать определенное количество электронных пар с другими атомами. Ведь именно валентность поможет вам нарисовать химические связи. Например, дана молекулярная формула аммиака NH3. Вы должны написать структурную формулу. Учитывайте то, что водород всегда одновалентен, поэтому его атомы не могут быть связаны между собой, следовательно, они будут соединены с азотом.
Чтобы правильно написать структурные формулы органических соединений, повторите основные положения теории А.М. Бутлерова, согласно которой существуют изомеры – вещества с одинаковым элементарным составом, но с разными химическими свойствами. Например, изобутан и бутан. Молекулярная формула у них одинаковая: C4H10, а структурные – отличаются.
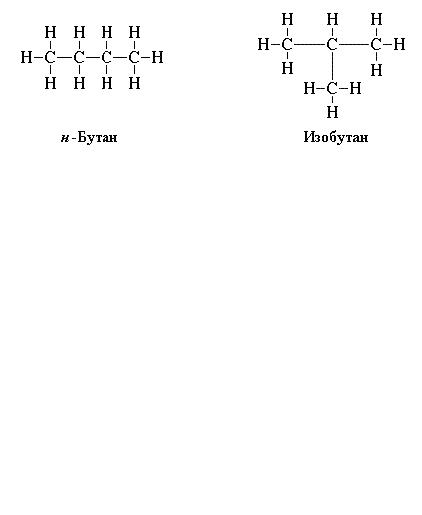
В линейной формуле каждый атом записывается отдельно, поэтому такое изображение занимает много места. Однако при составлении структурной формулы, вы можете указать общее число атомов водорода при каждом атоме углерода. А между соседними углеродами нарисуйте химические связи в виде линий.

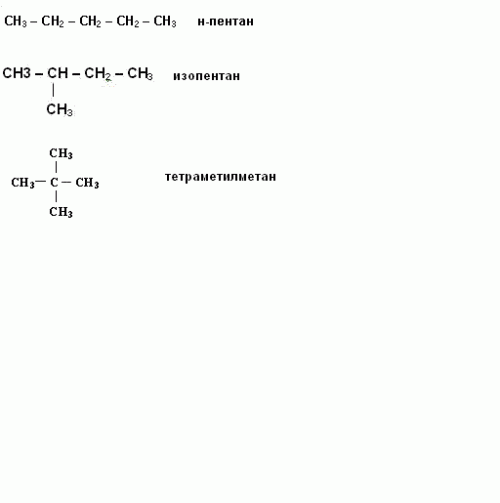
Написание изомеров начните с углеводорода нормального строения, то есть с неразветвленной цепью углеродных атомов. Затем сократите на один атом углерода, который присоедините к другому, внутреннему углероду. Исчерпав все варианты написания изомеров с данной длиной цепи, сократите ее еще на один углеродный атом. И опять присоедините его к внутреннему углеродному атому цепи. Например, структурные формулы н-пентана, изопентана, тетраметилметана. Таким образом, углеводород с молекулярной формулой C5H12 имеет три изомера.
Полезный совет
Для определения валентности атомов при составлении структурных формул используйте периодическую систему. Показать точно расстояние атомов в молекуле поможет трехмерная структурная формула.
Источники:
- структурная формула веществ
- Составление формул комплексных соединений
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Алгоритмы составления химических формул
Составлениехимических формул для соединений двуххимических элементов в тех случаях,когда для каждого элемента существуеттолько одна стехиометрическая валентность.
| Алгоритм действия | Составление химической формулы оксида алюминия | |
| Установление (по названию соединения) химических символов элементов | Аl | О |
| Определение валентности атомов элементов | АIII | ОII |
| Вычисление наименьшего общего кратного | 6 | |
| Определение дополнительных множителей | 2 | 3 |
| Указание числового отношения атомов в соединении | 2 : 3 | |
| Указание стехиометрических индексов | Аl2 | О3 |
| Составление формулы | Аl2О3 |
Составлениехимических формул для соединений,которые существуют в водном растворев виде ионов.
| Алгоритм действия | Составление химической формулы сульфата алюминия | |
| Установление (по названию соединения) химических формул ионов | Аl3+ | SО42– |
| Определение числа зарядов ионов | 3 | 2 |
| Вычисление наименьшего общего кратного | 6 | |
| Определение дополнительных множителей | 2 | 3 |
| Указание числового отношения ионов | 2 : 3 | |
| Указание стехиометрических индексов | Аl2 | (SО4)3 |
| Составление формулы | Аl2(SО4)3 |
Написание химических формул
Дляуказания в химических формулахстехиометрических индексов и зарядовионов существуют следующие правила.
1. Еслистехиометрический индекс относится кгруппе атомов, обозначающие эту группухимические символы ставятся в скобки:
С3Н5(ОН)3– в молекуле глицерина содержатся 3гидроксигруппы;
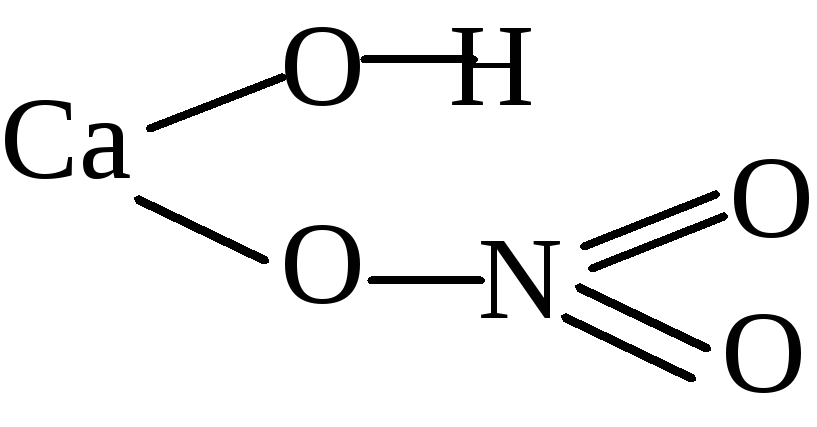
Ca(NО3)2– в формульной единице нитрата кальциясодержатся ионы кальция и нитрат-ионыв соотношении 1 : 2.
2.Данные о заряде сложного многоатомногоиона в химической формуле относятся ковсему иону:
SО42– – сульфат-ион – имеет двухкратныйотрицательный заряд;
NН4+ – ион аммония – имеет одинарныйположительный заряд.
3.Химическая формула комплексного ионаставится в квадратные скобки, за которымиуказывается его заряд; она состоит из:
– химическогосимвола центрального атома;
– химической формулы лиганда в круглых скобках;
– нижнегоиндекса, указывающего число лигандов.
[Fe(CN)6]4–– гексацианоферрат(II)-ион; в имеющемчетыре отрицательных заряда ионе шестьлигандов СN–(цианид-ион) связаны с центральным атомомFеII(катион железа Fe2+).
[Cu(NH3)4]2+–ион тетраамминмеди (II); в имеющем дваположи-тельных заряда ионе четырелиганда NH3(молекула аммиака) связаны с центральныматомом меди (ион Сu2+).
4.Химическая формула воды в гидратах икристаллогидратах отделяется точкойот химической формулы основноговещества.
CuSO4· 5H2O– пентагидрат сульфата меди (II)(медный купорос).
Классификация неорганических веществ и их свойства
Всенеорганические вещества делятся напростые и сложные.
Простыевещества подразделяются на металлы,неметаллы и инертные газы.
Важнейшимиклассами сложных неорганических веществявляются: оксиды,основания, кислоты, амфотерные гидрооксиды,соли.
Оксиды—это соединения двух элементов, один изкоторых кислород. Общая формулаоксидов:
ЭmOn
где m–числоатомов элемента Э;
n– число атомов кислорода.
Примерыоксидов: К2О,CaO,SO2,P2O5
Основания– это сложные вещества, молекулы которыхсостоят из атома металла и одной илинескольких гидроксидных групп – ОН.Общая формула оснований:
Me(ОН)y
где у– числогидроксидных групп, равное валентностиметалла (Me).
Примерыоснований: NaOH,Ca(OH)2,Со(ОН)3
Кислоты—это сложные вещества, содержащие атомыводорода, которые могут замещатьсяатомами металла.
Общаяформула кислот
НхАсу
где Ас – кислотный остаток (от англ., acid– кислота);
х– числоатомов водорода, равное валентностикислотного остатка.
Примерыкислот: НС1, HNO3,H2SO4,H3PO4
Амфотерныегидроксиды– это сложные вещества, которые имеютсвойства кислот и свойства оснований.Поэтому формулы амфотерных гидроксидовможно записывать в форме основанийи в форме кислот. Примеры амфотерныхгидроксидов:
Zn(OH)2= H2ZnO2
Al(OH)3= H3AlO3
форма форма
оснований кислот
Соли– это сложные вещества, которые являютсяпродуктами замещения атомов водородав молекулах кислот атомами металла илипродуктами замещения гидроксидныхгрупп в молекулах оснований кислотнымиостатками. Например:
| Са(ОН)2 основание | Са(NО3)2 соль |
Составнормальных солей выражается общейформулой:
Мех(Ас)у
где х— числоатомов металла; у—число кислотных остатков.
Примерысолей: K3PO4;MgSO4;Al2(SO)3;FeCl3.
Оксиды
| Название оксида | = | «Оксид» | + | Название элемента (в род, пад.) | + | Валентность элемента (римскими цифрами) |
Например:СО – оксид углерода (II)– (читается: «оксид углерода два»);СО2– оксид углерода (IV);Fe2O3– оксид железа (III).
Еслиэлемент имеет постоянную валентность,ее в названии оксида не указывают.Например: Nа2О– оксид натрия; Аl2О3– оксид алюминия.
Классификация
Всеоксиды делятся на солеобразующие и несолеобразующие (или индифферентные).
Несолеобразующие(индифферентные) оксиды— это оксиды, которые не образуютсолей при взаимодействии с кислотамии основаниями. Их немного. Запомнитечетыре несолеобразующих оксида: СО,SiO,N2O,NO.
Солеобразующиеоксиды— это оксиды, которые образуют солипри взаимодействии с кислотами илиоснованиями. Например:
Na2O+ 2НС1 = 2NaCl+ Н 2О
оксид кислота соль
| SO3 | + | 2NaOH | = | Na2SO4 | + | Н2О |
| оксид | основание | соль |
Многиесолеобразующие оксиды взаимодействуютс водой. Продукты взаимодействия оксидовс водой называются гидратами оксидов(или гидроксидами). Например:
| Na2O | = | H2O | + | 2NaOH |
| оксид | гидроксид |
Некоторыеоксиды с водой не взаимодействуют, ноим соответствуют гидроксиды, которыеможно получить косвенным (непрямым)путем. В зависимости от характерасоответствующих гидроксидов всесолеобразующие оксиды делятся на тритипа: основные, кислотные, амфотерные.
Основныеоксиды— это оксиды, гидраты которых являютсяоснованиями. Например:
| Основные оксиды | Основания |
Всеосновные оксиды являются оксидамиметаллов.
Кислотныеоксиды— это оксиды, гидраты которых являютсякислотами. Например:
Большинствокислотных оксидов являются оксидаминеметаллов. Кислотными оксидамиявляются также оксиды некоторых металловс высокой валентностью. Например: ,
Амфотерныеоксиды— это оксиды, которым соответствуютамфотерные гидроксиды.
Всеамфотерные оксиды являются оксидамиметаллов.
Следовательно,неметаллыобразуют только кислотныеоксиды;металлыобразуютвсе основные,все амфотерныеи некоторые кислотныеоксиды.
Всеоксиды одновалентныхметаллов (Na2O,K2O,Cu2Oи др.) являются основными. Большинствооксидов двухвалентныхметаллов (CaO,BaO,FeOи др.) также являются основными.
Исключения:BeO,ZnO,PbO,SnO,которые являются амфотерными. Большинствооксидов трех-ичетырехвалентныхметаллов являютсяамфотерными: ,,,,и др. Оксиды металлов свалентностью V, VI, VII.
являются кислотными: ,,идр.
Металлыс переменной валентностью могутобразовывать оксиды всех трех типов.
Например:СrО – основный оксид, Сr2О3– амфотерный оксид, СrО3– кислотный оксид.
Графическиеформулы
Вмолекуле оксида атом металла непосредственносоединяется с атомами кислорода.
Химические формулы веществ
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe, Cuprum – Cu, Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
| Сведения | На примере Cl |
| Название элемента | Хлор |
| Принадлежность элемента к данному классу химических элементов | Неметалл, галоген |
| Один атом элемента | 1 атом хлора |
| Относительная атомная масса (Ar) данного элемента | Ar(Cl) = 35,5 |
| Абсолютная атомная масса химического элемента
m = Ar · 1,66·10-24г = Ar · 1,66 · 10-27кг |
M(Cl) = 35,5 · 1,66 · 10-24 = 58,9 · 10-24г |
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака
(произношение) |
| Азот | N | Эн |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Медь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гидраргиум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Цэ |
| Фосфор | P | Пэ |
Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Так вещество железо и химический элемент железо обозначаются одинаково – Fe.
Если простое вещество имеет молекулярную структуру (существует в виде молекул, то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H2, O2, O3, N2, F2, Cl2, Br2, P4, S8.
Таблица 3: Информация, которую дает химический знак
| Сведения | На примере C |
| Название вещества | Углерод (алмаз, графит, графен, карбин) |
| Принадлежность элемента к данному классу химических элементов | Неметалл |
| Один атом элемента | 1 атом углерода |
| Относительная атомная масса (Ar) элемента, образующего вещество | Ar(C) = 12 |
| Абсолютная атомная масса | M(C) = 12 · 1,66 · 10-24 = 19,93 · 10-24г |
| Один моль вещества | 1 моль углерода, т.е. 6,02 · 1023 атомов углерода |
| Молярная масса вещества | M(C) = Ar(C) = 12 г/моль |
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Me, Si, B, Te, H, P, As, I, Se, C, S, Br, Cl, N, O, F
Например, H2O, CaSO4, Al2O3, CS2, OF2, NaH.
Исключение составляют:
- некоторые соединения азота с водородом (например, аммиакNH3, гидразинN2H4);
- соли органических кислот (например, формиат натрияHCOONa, ацетат кальция(CH3COO)2Ca);
- углеводороды (CH4, C2H4, C2H2).
Химические формулы веществ, существующих в виде димеров (NO2, P2O3, P2O5, соли одновалентной ртути, например: HgCl, HgNO3 и др.), записывают в виде N2O4, P4O6, P4O10, Hg2Cl2, Hg2(NO3)2.
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Например:
2Al3+ +3SO42- =Al2(SO4)3
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
- 3Fe – три атома железа, 3 моль атомов железа,
- 2H – два атома водорода, 2 моль атомов водорода,
- H2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
| Сведения | На примере CaCO3 |
| Название вещества | Карбонат кальция |
| Принадлежность элемента к определенному классу веществ | Средняя (нормальная) соль |
| Одна молекула вещества | 1 молекула карбоната кальция |
| Один моль вещества | 6,02 · 1023 молекул CaCO3 |
| Относительная молекулярная масса вещества (Мr) | Мr(CaCO3) = Ar(Ca)+Ar(C) +3Ar(O)=100 |
| Молярная масса вещества (M) | М(CaCO3) = 100 г/моль |
| Абсолютная молекулярная масса вещества (m) | M(CaCO3) = Mr(CaCO3) · 1,66 · 10-24г = 1,66 · 10-22 г |
| Качественный состав (какие химические элементы образуют вещество) | кальций, углерод, кислород |
| Количественный состав вещества: | |
| Число атомов каждого элемента в одной молекуле вещества: | молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. |
| Число молей каждого элемента в 1 моле вещества: | В 1 моль СаСО3 (6,02 ·1023 молекулах) содержится 1 моль (6,02 ·1023 атомов) кальция, 1 моль (6,02 ·1023 атомов) углерода и 3 моль (3·6,02·1023 атомов) химического элемента кислорода) |
| Массовый состав вещества: | |
| Масса каждого элемента в 1 моле вещества: | 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода. |
| Массовые доли химических элементов в веществе (состав вещества в процентах по массе): | Состав карбоната кальция по массе:
W(Ca) = (n(Ca)·Ar(Ca))/Mr(CaCO3) = (1·40)/100= 0,4 (40%) W(C) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (1·12)/100= 0,12 (12%) W(О) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (3·16)/100= 0,48 (48%) |
| Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества: | Молекула СаСО3 состоит из иона Са2+ и иона СО32-
1 моль (6,02·1023 молекул) СаСО3 содержит 1 моль ионов Са2+и 1 моль ионов СО32-; 1 моль (100г) карбоната кальция содержит 40г ионов Са2+ и 60г ионов СО32- |
| Молярный объем вещества при нормальных условиях (только для газов) |
Графические формулы
Для получения более полной информации о веществе пользуются графическими формулами, которые указывают порядок соединения атомов в молекуле и валентность каждого элемента.
Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными.
Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками.
Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
Примеры графических формул:
Метельский А.В.
Дата в источнике: 1999 год
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe, Cuprum – Cu, Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
| Сведения | На примере Cl |
| Название элемента | Хлор |
| Принадлежность элемента к данному классу химических элементов | Неметалл, галоген |
| Один атом элемента | 1 атом хлора |
| Относительная атомная масса (Ar) данного элемента | Ar(Cl) = 35,5 |
| Абсолютная атомная масса химического элемента
m = Ar · 1,66·10-24г = Ar · 1,66 · 10-27кг |
M(Cl) = 35,5 · 1,66 · 10-24 = 58,9 · 10-24г |
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака
(произношение) |
| Азот | N | Эн |
| Водород | H | Аш |
| Железо | Fe | Феррум |
| Золото | Au | Аурум |
| Кислород | O | О |
| Кремний | Si | Силициум |
| Медь | Cu | Купрум |
| Олово | Sn | Станум |
| Ртуть | Hg | Гидраргиум |
| Свинец | Pb | Плюмбум |
| Сера | S | Эс |
| Серебро | Ag | Аргентум |
| Углерод | C | Цэ |
| Фосфор | P | Пэ |
Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Так вещество железо и химический элемент железо обозначаются одинаково – Fe.
Если простое вещество имеет молекулярную структуру (существует в виде молекул, то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H2, O2, O3, N2, F2, Cl2, Br2, P4, S8.
Таблица 3: Информация, которую дает химический знак
| Сведения | На примере C |
| Название вещества | Углерод (алмаз, графит, графен, карбин) |
| Принадлежность элемента к данному классу химических элементов | Неметалл |
| Один атом элемента | 1 атом углерода |
| Относительная атомная масса (Ar) элемента, образующего вещество | Ar(C) = 12 |
| Абсолютная атомная масса | M(C) = 12 · 1,66 · 10-24 = 19,93 · 10-24г |
| Один моль вещества | 1 моль углерода, т.е. 6,02 · 1023 атомов углерода |
| Молярная масса вещества | M(C) = Ar(C) = 12 г/моль |
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Me, Si, B, Te, H, P, As, I, Se, C, S, Br, Cl, N, O, F
Например, H2O, CaSO4, Al2O3, CS2, OF2, NaH.
Исключение составляют:
- некоторые соединения азота с водородом (например, аммиак NH3, гидразин N2H4);
- соли органических кислот (например, формиат натрия HCOONa, ацетат кальция (CH3COO)2Ca);
- углеводороды (CH4, C2H4, C2H2).
Химические формулы веществ, существующих в виде димеров (NO2, P2O3, P2O5, соли одновалентной ртути, например: HgCl, HgNO3 и др.), записывают в виде N2O4, P4O6, P4O10, Hg2Cl2, Hg2(NO3)2.
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Например:
2Al3+ +3SO42- =Al2(SO4)3
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
- 3Fe – три атома железа, 3 моль атомов железа,
- 2H – два атома водорода, 2 моль атомов водорода,
- H2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
| Сведения | На примере CaCO3 |
| Название вещества | Карбонат кальция |
| Принадлежность элемента к определенному классу веществ | Средняя (нормальная) соль |
| Одна молекула вещества | 1 молекула карбоната кальция |
| Один моль вещества | 6,02 · 1023 молекул CaCO3 |
| Относительная молекулярная масса вещества (Мr) | Мr(CaCO3) = Ar(Ca)+Ar(C) +3Ar(O)=100 |
| Молярная масса вещества (M) | М(CaCO3) = 100 г/моль |
| Абсолютная молекулярная масса вещества (m) | M(CaCO3) = Mr(CaCO3) · 1,66 · 10-24г = 1,66 · 10-22 г |
| Качественный состав (какие химические элементы образуют вещество) | кальций, углерод, кислород |
| Количественный состав вещества: | |
| Число атомов каждого элемента в одной молекуле вещества: | молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. |
| Число молей каждого элемента в 1 моле вещества: | В 1 моль СаСО3 (6,02 ·1023 молекулах) содержится 1 моль (6,02 ·1023 атомов) кальция, 1 моль (6,02 ·1023 атомов) углерода и 3 моль (3·6,02·1023 атомов) химического элемента кислорода) |
| Массовый состав вещества: | |
| Масса каждого элемента в 1 моле вещества: | 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода. |
| Массовые доли химических элементов в веществе (состав вещества в процентах по массе): | Состав карбоната кальция по массе:
W(Ca) = (n(Ca)·Ar(Ca))/Mr(CaCO3) = (1·40)/100= 0,4 (40%) W(C) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (1·12)/100= 0,12 (12%) W(О) = (n(Ca) ·Ar(Ca))/Mr(CaCO3) = (3·16)/100= 0,48 (48%) |
| Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества: | Молекула СаСО3 состоит из иона Са2+ и иона СО32-
1 моль (6,02·1023 молекул) СаСО3 содержит 1 моль ионов Са2+и 1 моль ионов СО32-; 1 моль (100г) карбоната кальция содержит 40г ионов Са2+ и 60г ионов СО32- |
| Молярный объем вещества при нормальных условиях (только для газов) |
Графические формулы
Для получения более полной информации о веществе пользуются графическими формулами, которые указывают порядок соединения атомов в молекуле и валентность каждого элемента.
Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными.
Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками. Каждая черточка обозначает электронную пару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
Примеры графических формул:
Автор:
Источник: Метельский А.В., Химия в Экзаменационных вопросах и ответах, Минск, изд. «Беларуская энцыклапедыя», 1999 год
Дата в источнике: 1999 год
Эмпирические
формулы дают информацию о качественном
и количественном составе соединений.
Взаимное расположение атомов в молекуле
вещества отражают структурно-графические
формулы, однако они не показывают
пространственное расположение атомов.
При
составлении структурно-графических
формул можно руководствоваться
следующими правилами:
1.
Элементы соединяются в соответствии с
их валентностью.
2.
Черточка в формуле обозначает единичную
химическую связь, количество черточек
соответствует валентности, например:
K2O
записывается так: K‑O
‑K
.
3.
Состав кислот и оснований следует
начинать изображать с центрального
атома,
|
например H4SiO4 |
|
4.
Если в молекуле кислоты содержится
больше атомов кислорода, чем водорода,
то «избыточные» атомы кислорода соединены
с центральным атомом двойной связью,
|
например: |
|
5.
При написании графических формул солей
исходят из графических формул кислот,
заменяя атомы водорода на атомы металла,
учитывая его валентность, например:
|
Na3PO4 |
|
Fe2(SO4)3 |
|
|
KHCO3 |
|
||
|
CaOHNO3 |
|
Структурно-графические
формулы некоторых кислот приведены в
табл. 5.
2.4. Общие химические свойства основных классов неорганических веществ
Оксиды
‑
вещества, состоящие из атомов двух
элементов, один из которых – кислород
в степени окисления (–2). По
химическим свойствам их подразделяют
на индифферентные, или несолеобразующие
(CO,
NO),
и солеобразующие, которые бывают
основными, кислотными и амфотерными.
Химические
свойства основных оксидов
1.
Взаимодействуют с кислотами с образованием
соли и воды, например:
MgO
+ 2HCl
= MgCl2
+ H2O.
2.
Взаимодействие с кислотными оксидами
с образованием солей:
CaO
+ CO2
= CaCO3.
3.
Оксиды щелочных и щелочноземельных
металлов взаимодействуют с водой с
образованием растворимых в воде
оснований – щелочей:
K2O
+ H2O
= 2KOH.
Химические
свойства кислотных оксидов
1.
Общим свойством всех кислотных оксидов
является их способность взаимодействовать
с основаниями с образованием соли и
воды:
СО2
+ 2NaOH
= Na2CO3
+ Н2О.
2.
Кислотные оксиды взаимодействуют с
основными оксидами с образованием
солей.
3.
Большинство кислотных оксидов
взаимодействует с водой с образованием
кислот:
SО3
+ Н2О
= H2SO4.
Очень
немногие кислотные оксиды не взаимодействуют
с водой. Наиболее известный из них оксид
кремния (SiO2).
Химические
свойства амфотерных оксидов
1.
Амфотерные оксиды взаимодействуют с
кислотами с образованием солей и воды.
ZnO
+ 2HNO3
= Zn(NO3)2
+ 2Н2О.
В
этих реакциях амфотерные оксиды играют
роль основных.
2.
Амфотерные оксиды взаимодействуют с
щелочами с образованием солей и воды.
ZnO
+ 2КОН
K2ZnO2
+ Н2О,
ZnO
+ 2КОН + H2O
K2[Zn(OH)4].
В
этих реакциях амфотерные оксиды играют
роль кислотных.
3.
Амфотерные оксиды при нагревании
взаимодействуют с кислотными оксидами
с образованием солей:
ZnO
+ CO2
= ZnCO3.
4.
Амфотерные оксиды при нагревании
взаимодействуют с основными оксидами
с образованием солей:
ZnO
+ Na2O
= Na2ZnO2.
Получение
оксидов
Оксиды
могут быть получены различными способами:
1.
Взаимодействием простых веществ с
кислородом:
2Mg
+ О2
= 2MgO;
2.
Разложением некоторых оксокислот:
H2SO3
=
SO2
+ Н2О.
3.
Разложением нерастворимых оснований:
Сu(OH)2CuO
+ H2O.
4.
Разложением некоторых солей:
СаСО3
СаО + СО2.
Основания
‑
сложные
вещества, при диссоциации которых в
воде образуются гидроксид-ионы и никаких
других анионов.
По
растворимости в воде основания делятся
на две группы: нерастворимые [Fe(OH)3,
Си(ОН)2
и др.] и растворимые в воде [КОН, NaOH,
Са(ОН)2,
Ва(ОН)2
], или щелочи.
Химические
свойства оснований
Общие
свойства оснований объясняются наличием
в растворах анионов ОН–,
которые образуются в результате
электролитической диссоциации молекул
оснований:
NaOHNa+
+ OH–.
1.
Водные растворы щелочей изменяют окраску
индикаторов.
Таблица
6 ‑ Изменение
цвета индикаторов в растворах
щелочей
и кислот
|
Индикатор |
Цвет |
Цвет |
Цвет |
|
Лакмус |
Фиолетовый |
Синий |
Красный |
|
Фенолфталеин |
Бесцветный |
Малиновый |
Бесцветный |
|
Метилоранж |
Оранжевый |
Желтый |
Красный |
2.
Основания взаимодействуют с кислотами
с образованием соли и воды (реакция
нейтрализации). Например:
КОН
+ НС1= КС1 + Н2О;
Fe(OH)2
+2HNO3
= Fe(NO3)2
+ 2Н2О.
3.
Щелочи взаимодействуют с кислотными
оксидами с образованием соли и воды:
Са(ОН)2
+ СО2
= СаСО2
+ Н2О.
4.
Растворы щелочей взаимодействуют с
растворами солей, если в результате
образуется нерастворимое основание
или нерастворимая соль. Например:
2NaOH
+ CuSO4
= Cu(OH)2↓
+ Na2SO4;
Ва(ОН)2
+ Na2SO4
= 2NaOH
+ BaSO4↓.
5.
Нерастворимые основания при нагревании
разлагаются на основный оксид и воду.
2Fе(ОН)3
Fе2О3
+ ЗН2О.
6.
Растворы щелочей взаимодействуют с
металлами, которые образуют амфотерные
оксиды и гидроксиды (Zn,
Al
и др.).
2AI
+ 2КОН + 6Н2О
= 2K[A1(OH)4]
+ 3H2↑.
Получение
оснований
-
Получение
растворимых
оснований:
а)
взаимодействием щелочных и щелочноземельных
металлов с водой:
2Na
+ 2Н2О
= 2NaOH
+ Н2↑;
б)
взаимодействием оксидов щелочных и
щелочноземельных металлов с
водой:
Na2O
+ Н2О
= 2NaOH.
2.
Получение нерастворимых
оснований
действием щелочей на растворимые соли
металлов:
2NaOH
+
FeSO4
= Fe(OH)2↓
+ Na2SO4.
Кислоты
‑ сложные вещества, при диссоциации
которых в воде, образуются ионы водорода
(гидроксония) и никаких других катионов.
Химические
свойства
Общие
свойства кислот в водных растворах
обусловлены присутствием ионов Н+
(вернее H3O+),
которые образуются в результате
электролитической диссоциации молекул
кислот:
1.
Кислоты одинаково изменяют цвет
индикаторов (табл. 7).
2.
Кислоты взаимодействуют с основаниями.
Например:
Н3РО4
+ 3NaOH=Na3PO4+ЗН2О;
Н3РО4
+ 2NaOH
= Na2HPO4
+ 2Н2О;
Н3РО4
+ NaOH
= NaH2PO4
+ Н2О;
2НС1
+ Сu(ОН)2
= СuС12
+ 2Н2О;
НС1
+ Сu(ОН)2
= СuОНСl
+ Н2О.
3.
Кислоты взаимодействуют с основными
оксидам:
2НСl
+ СаО = СаС12
+ Н2О;
H2SO4
+Fe2O3=Fe2(SO4)3+
ЗН2О.
4.
Кислоты взаимодействуют с амфотерными
оксидами:
2HNO3
+ ZnO
= Zn(NO3)2
+ Н2О.
5.
Кислоты взаимодействуют с некоторыми
средними солями с образованием новой
соли и новой кислоты, реакции возможны
в том случае, если в результате образуется
нерастворимая соль или более слабая
(или более летучая) кислота, чем исходная.
Например:
2НС1+Na2CO3=2NaCl+H2CO3;
NaCl
+ H2SO4
= HCl + Na2SO4.
6.
Кислоты взаимодействуют с металлами.
Характер продуктов этих реакций зависит
от природы и концентрации кислоты и от
активности металла. Например, разбавленная
серная кислота, хлороводородная кислота
и другие кислоты‑неокислители
взаимодействуют с металлами, которые
находятся в электрохимическом ряду
напряжения левее водорода. В результате
реакции образуются соль и газообразный
водород:
H2SO4
(разб))
+ Zn
= ZnSO4
+ Н2↑;
НС1
+ Mg
= MgО
+ H2↑.
Кислоты-окислители
(концентрированная серная кислота,
азотная кислота HNO3
любой концентрации) взаимодействуют и
с металлами, стоящими в ряду напряжения
после водорода с образованием соли и
продукта восстановления кислоты.
Например:
2H2SO4
(конц)
+ Zn = ZnSO4
+SO2↑+
2H2O;
Получение
кислот
1.
Бескислородные кислоты получают путем
синтеза из простых веществ и последующим
растворением продукта в воде.
S
+ Н2
= Н2S.
2.
Оксокислоты получают взаимодействием
кислотных оксидов с водой.
SO3
+ Н2О
= H2SО4.
3.
Большинство кислот можно получить
взаимодействием солей с кислотами.
Na2SiО3
+ H2SO4
= H2SiО3
+ Na2SO4.
Амфотерные
гидроксиды
1.
В нейтральной среде (чистая вода)
амфотерные гидроксиды практически не
растворяются и не диссоциируют на
ионы.
Они растворяются в кислотах и щелочах.
Диссоциацию амфотерных гидроксидов в
кислой и щелочной средах можно выразить
следующими уравнениями:
Zn
+ OH–
Zn(OH)
H+
+ ZnO
А13+
+ ЗОН–
Al(OH)3
H+
+ AlO+
H2O
2.
Амфотерные гидроксиды взаимодействуют
как с кислотами, так и со щелочами,
образуя соль и воду.
Взаимодействие
амфотерных гидроксидов с кислотам:
Zn(OH)2
+ 2НCl
+ ZnCl2
+ 2Н2О;
Sn(OH)2+
H2SO4
= SnSO4
+ 2Н2О.
Взаимодействие
амфотерных гидроксидов со щелочами:
Zn(OH)2
+ 2NaOH
Na2ZnO2
+ 2H2O;
А1(ОН)3
+ NaOH
NаАlO2
+ 2Н2О;
Zn(OH)2
+ 2NaOH
Na2[Zn(OH)4];
Pb(OH)2
+ 2NaOH
Na2[Pb(OH)4].
Соли
–
продукты замещения атомов водорода в
молекуле кислоты на атомы металла или
замещения гидроксид-иона в молекуле
основания кислотными остатками.
Общие химические
свойства солей
1. Соли в водных
растворах диссоциируют на ионы:
а)
средние соли диссоциируют на катионы
металлов и анионы кислотных остатков:
NaCN
=Na++СN–
;
Ва(СН3СОО)2
= Ва2+
+ 2(СН3СОО)–
.
6)
кислые
соли диссоциируют на катионы металла
и сложные
анионы:
KHSО3
= К+
+ HSO32-;
NaH2PO4
=
Na+
+ Н2РО4–.
в)
основные соли диссоциируют на сложные
катионы и анионы кислотных остатков:
АlОН(СН3СОО)2
=
АlОН2+
+ 2СН3СОО–.
2.
Соли взаимодействуют с металлами с
образованием новой соли и нового металла.
Данный металл может вытеснять из
растворов солей только те металлы,
которые находятся правее его в
электрохимическом ряду напряжения:
CuSO4
+
Fe
= FeSO4
+ Сu.
3.
Растворимые соли взаимодействуют со
щелочами с образованием новой соли и
нового основания. Реакция возможна,
если образующееся основание или соль
выпадают в осадок. Например:
FeCl3+3КОН=Fe(OH)3↓+3КС1;
К2СО3+Ba(OH)2=ВаCO3↓+
2КОН.
4. Соли взаимодействуют
с кислотами с образованием новой более
слабой кислоты или новой нерастворимой
соли:
Na2CO3
+ 2HC1 = 2NaCl + CO2↑
+ H2O.
При
взаимодействии соли с кислотой, образующей
данную соль, получается кислая соль
(это возможно в том случае, если соль
образована многоосновной кислотой).
Например:
Na2S
+ H2S
= 2NaHS;
CaCO3
+ CO2+
H2O
= Ca(HCО3)2
.
5.
Соли могут взаимодействовать между
собой с образованием новых солей, если
одна из солей выпадает в осадок:
AgNO3
+ KC1
= AgCl↓
+ KNO3.
6. Многие соли
разлагаются при нагревании:
MgCО3
MgO
+
CО2↑;
2NaNO3
2NaNO2
+ O2↑.
7.
Основные соли взаимодействуют с кислотами
с образованием средних солей и воды:
Fe(OH)2NO3+HNO3=FeOH(NO3)2+H2O;
FeOH(NO3)2+HNO3=Fe(NO3)3
+ H2O.
8.
Кислые соли взаимодействуют с щелочами
с образованием средних солей и воды:
NaHSO4
+ NaOH
= Na2SO3
+ H2O;
КН2РО4
+ КОН = К2НРО4
+ Н2О.
Получение солей
Все
способы получения солей основаны на
химических свойствах важнейших классов
неорганических соединений. Десять
классических способов получения солей
представлены в табл. 8. Кроме общих
способов получения солей, возможны и
некоторые частные способы:
1.
Взаимодействие металлов, оксиды и
гидроксиды которых являются амфотерными,
с щелочами.
2. Сплавление солей
с некоторыми кислотными оксидами.
K2CO3
+ SiO2
K2SiO3
+ CO2↑.
3. Взаимодействие
щелочей с галогенами:
2КОН
+Сl2
KCl
+KClO
+ H2O;
4. Взаимодействие
галогенидов с галогенами:
2КВг
+ Cl2
= 2КС1 +Вг2
Таблица
8 ‑ Основные
способы получения солей
|
Неметалл |
Кислотный |
Кислота |
Соль |
|
|
Металл |
Соль |
– |
Соль + … |
Соль +металл |
|
Основный |
– |
Соль |
Соль |
– |
|
Основание |
– |
Соль + вода |
Соль + вода |
Соль |
|
Соль |
– |
– |
Соль |
Соль + соль |