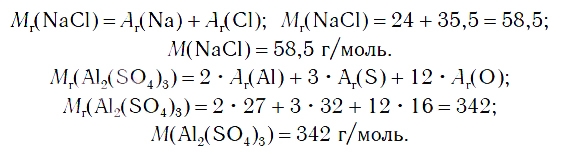В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
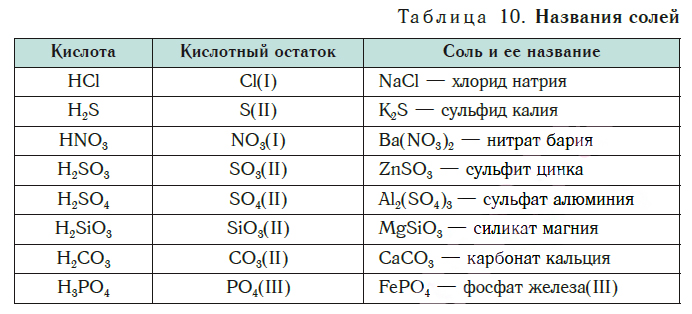
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
При
графическом изображении формул веществ указывается последовательность расположения
атомов в молекуле с помощью, так называемых валентных штрихов (термин
«валентный штрих» предложил в 1858 г. А. Купер для обозначения химических сил
сцепления атомов), иначе называемых валентной чертой (каждая валентная черта,
или валентный штрих, эквивалентны одной паре электронов в ковалентных
соединениях или одному электрону, участвующему в образовании ионной связи).
Часто неправильно принимают графическое изображение формул за структурные
формулы, приемлемые только для соединений с ковалентной связью и показывающие
взаимное расположение атомов в молекуле.
Так, формула Nа—СL не является структурной, так как NаСI — ионное соединение, в его
кристаллической решетке отсутствуют молекулы (молекулы NаСL существуют только в газовой фазе).
В узлах кристаллической решетки NаСI
находятся ионы, причем каждый Nа+
окружен шестью хлорид-ионами. Это графическое изображение формулы вещества,
показывающее, что ионы натрия не связаны между собой, а с хлорид-ионами. Не
соединяются между собой и хлорид-ионы, они соединены с ионами натрия.
Покажем
это на примерах. Мысленно предварительно «разбиваем» лист бумаги на несколько
столбцов и выполняем действия согласно алгоритмам по графическому изображению
формул оксидов, оснований, кислот, солей в следующем порядке.
Графическое
изображение формул оксидов (например, Аl2O3)
III II
1. Определяем
валентность атомов элементов в Аl2O3
2.
Записываем химические знаки атомов металлов на первое место (первый столбец).
Если атомов металлов больше одного, то записываем и в один столбец и обозначаем
валентность (число связей между атомами) валентными штрихами
З.
Второе место (столбец), тоже в один столбец, занимают химические знаки атомов
кислорода, причем к каждому атому кислорода должно подходить по два валентных
штриха, так как кислород двухвалентен
lll ll l
Графическое изображение формул оснований (например Fе(ОН)3)
1.
Определяем валентность атомов элементов Fе(ОН)3
2.
На первом месте (первый столбец) пишем химические знаки атомов металла,
обозначаем их валентность Fе
З.
Второе место (столбец) занимают химические знаки атомов кислорода, которые
присоединяются одной связью к атому металла, вторая связь пока «свободна»
4.
Третье место (столбец) занимают химические знаки атомов водорода,
присоединяющихся на «свободную»
валентность атомов кислорода
Графическое
изображение формул кислот (например, Н2SO4)
l Vl ll
1. Определяем
валентность атомов элементов Н2SO4.
2.
На первом месте (первый столбец) пишем химические знаки атомов водорода в один
столбец с обозначением валентности
Н—
Н—
З.
Второе место (столбец) занимают атомы кислорода, присоединяясь одной валентной
связью к атому водорода, при этом вторая валентность каждого атома кислорода
пока «свободна»
Н—
О —
Н—
О —
4.
Третье место (столбец) занимают химические знаки атомов кислотообразователя с
обозначением валентности
5.
На «свободные» валентности атома кислотообразователя присоединяются атомы
кислорода согласно правилу валентности
Графическое
изображение формул солей
Средние
соли
(например, Fe2SO4)3) В средних солях все
атомы водорода кислоты замещены на атомы металла, поэтому при графическом
изображении их формул первое место (первый столбец) занимают химические знаки
атомов металла с обозначением валентности, а далее — как в кислотах, то есть
второе место (столбец) занимают химические знаки атомов кислорода, третье место
(столбец) — химические знаки атомов кислотообразователя, их три и они присоединяются
к шести атомам кислорода. На «свободные» валентности кислотообразователя присоединяются
атомы кислорода согласно правилу валентности
Кислые
соли (например, Ва(Н2PO4)2) Кислые соли можно рассматривать
как продукты частичного замещения атомов водорода в кислоте атомами металла,
поэтому при составлении графических формул кислых солей на первое место (первый
столбец) записывают химические знаки атомов металла и водорода с обозначением
валентности
Н—
Н—
Ва
=
Н—
Н—
Второе
место (столбец) занимают химические знаки атомов кислорода
Третье
место (столбец) — химические знаки атомов кислотообразователя, на «свободные»
валентности кислотообразователя присоединяются атомы кислорода согласно
правилу валентности
Основные
соли
(например, А1ОНSO4) Основные соли определяем, чем как
продукт частичного замещения группы ОН основания на кислотный остаток. При
составлении графических формул основных солей первое место (столбец) занимают
химические знаки атомов металлов с обозначением валентности, второе (столбец) —
химические знаки атомов металлов кислорода, третье — химические знаки атомов
водорода и кислотообразователя с обозначением соответствующей валентности. На
«свободные» валентности атома
кислотообразователя присоединяются атомы кислорода согласно правилу валентности
По
графическому изображению формул веществ можно судить об их свойствах,
определяют истинную степень окисления, например, Na+1–О-1 –О-1– Na+1
или в органических соединениях
Структурная формула Фосфата кальция
Ca3(PO4)2 Ca+23(P+5O-24)2
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» – краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
–
HCl соляная
кислота Cl хлорид
–
HF фтороводородная
кислота F фторид
–
HBr бромоводородная
кислота Br бромид
–
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
–
HNO3
азотная кислота NO3 нитрат
–
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
–
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
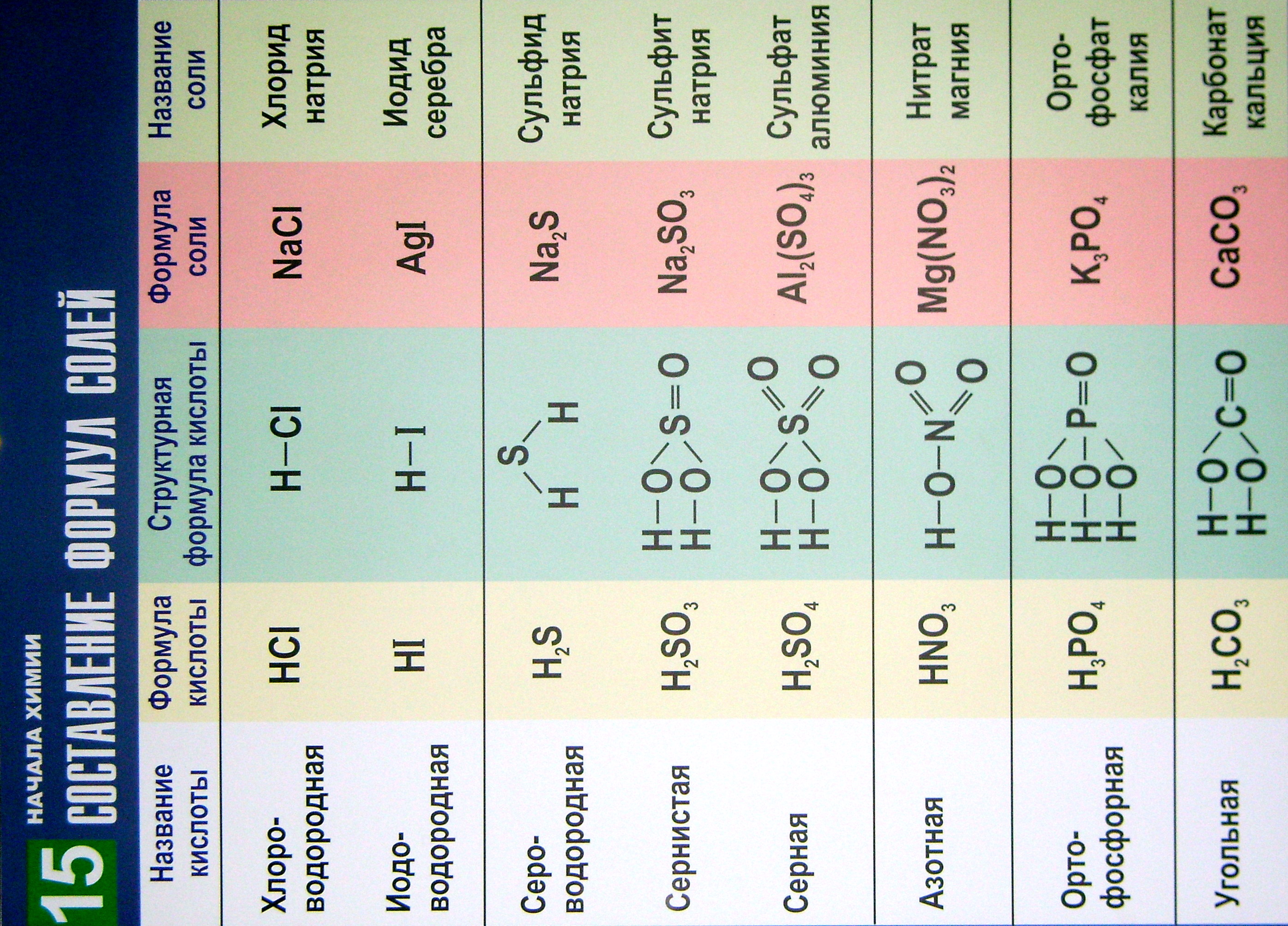
В таблице 15 приведены
названия часто встречающихся кислот,
их молекулярные и структурные формулы,
а также формульные единицы и названия
соответствующих солей.
Таблица помогает
составлять химические формулы солей
бескислородных и кислородсодержащих
кислот. Для образования химических
формул солей надо атомы водорода в
кислотах заменить на атомы металлов с
учётом их валентности.
Приведённые
названия кислот и солей соответствуют
принятой международной номенклатуре.
Название
бескислородных кислот образуются по
правилам для бинарных соединений.
Названия солей
начинаются с названия кислотного остатка
в именительном падеже. Это название
образуется из корня латинского названия
химического элемента, образующего
кислоту, и окончания “ат” или “ит”
в случае солей кислородсодержащих
кислот, для солей бескислородных кислот
– “ид”.
Затем в солях бескислородных кислот
называется металл в родительном падеже.
Причём если атом металла может иметь
разную валентность, то её отмечают
римской цифрой (в скобках) после названия
химического элемента (без пробела).
Например, хлорид железа(II) и хлорид
олова(IV).
Включение в таблицу
названий молекулярных и структурных
формул часто встречающихся кислот
позволяет легко запомнить приведённые
в ней сведения.
Названия кислот
типа HnXOm
составляют с учётом валентности (степени
окисления) центрального атома:
-
атом X
имеет высшую (или единственную)
валентность (степень окисления): H2SО4
–
серная; HNО3
–
азотная; Н2СО3
– угольная; -
атом X
имеет промежуточные степени окисления:
H2SO3
–
сернистая; HNО2
–
азотистая; НСlО – хлорноватистая.
Таблица 15
Составление химических формул солей
16. Генетическая связь классов неорганических веществ
Таблица 16 показывает
в виде схемы взаимосвязь неорганических
веществ разных классов. Изучение свойств
веществ показывает, что можно при помощи
химических реакций переходить от простых
веществ к сложным и от одних сложных
веществ к другим. Связь между веществами
разных классов, основанная на их
взаимопревращениях и отражающая единство
их происхождения, называется
генетической.
Вещества по составу
подразделяются на простые и сложные.
Среди простых веществ различают
металлы и неметаллы. Эти две группы
веществ могут образовывать многочисленные
сложные вещества. К основным классам
неорганических соединений принадлежат
оксиды, гидроксиды и соли. Связь между
этими классами веществ обозначена при
помощи стрелок.
По таблице можно
проследить переходы металлов и неметаллов
в оксиды и гидроксиды:
|
металл |
+ |
О2 |
→ |
оксид, |
оксид металла |
+ |
Н2О |
→ |
гидроксид1 |
|
|
неметалл |
+ |
О2 |
→ |
оксид, |
оксид неметалла |
+ |
Н2О |
→ |
кислород |
Эти две цепочки
превращений аналогичны и роднят металлы
и неметаллы.
Однако надо
подчеркнуть, что простое вещество металл
является родоначальником сложных
веществ, обладающих оснóвными
свойствами (оснóвных оксидов и оснований).
Простое вещество неметалл выступает в
качестве родоначальника сложных
веществ, проявляющих кислотные свойства
(кислотных оксидов и кислот).
Различие свойств
кислотных и оснóвных оксидов, а также
свойств кислот и оснований приводит к
их взаимодействию друг с другом с
образованием солей. Таким образом, соли
генетически связаны с исходными
веществами – металлами и неметаллами
– посредством
их оксидов и гидроксидов.
Так как соли
представляют собой продукты реакций
кислот и оснований, то по составу
различают средние (нормальные), кислые
и оснóвные соли. Кислые соли содержат
в своём составе атомы водорода, оснóвные
– гидроксогруппы. Названия кислых солей
складываются из названий солей с
прибавлением слова “гидро”, а
основных –
“гидроксо”.
Существуют также
двойные соли (соли двух металлов), к ним
относят, например, алюмокалиевые квасцы
KA1(SО4)2
· 12Н2О,
смешанные соли NаСl · NаF, СаВrСl, комплексные
соли Nа2[Zn(ОН)4],
К3[Fе(СN)6],
К4[Fе(СN)6],
включая кристаллогидраты СuSО4
· 5Н2О
(медный купорос), Nа2SО4
· 10Н2О
(глауберова соль)
Необходимо научиться
составлять химические формулы гидроксидов
(кислородсодержащих кислот и оснований)
для атома элемента Э с валентностью
“n”. Гидроксиды получают по реакции
присоединения воды к соответствующим
оксидам. При этом не имеет значение,
происходит ли эта реакция в реальных
условиях. Например, химическую формулу
угольной кислоты получают сложением
всех атомов по уравнению реакции
СО2
+ Н2О
= Н2СО3.
Химические формулы
метафосфорной,
пирофосфорной
и ортофосфорной
кислот составляют из формулы оксида
фосфора(V)1
и соответственно одной, двух и трёх
молекул воды:
Р2О5
+ Н2О
= 2НРО3;
Р2О5
+ 2Н2О
= Н4Р2О7;
Р2О5
+ 3Н2О
= 2Н3РО4.
Приведённая схема
взаимосвязи между классами неорганических
веществ не охватывает всего многообразия
химических соединений. В этой схеме в
качестве бинарных веществ выступают
оксиды,
Таблица 16
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как составить структурную формулы солей?
-Artur4aDays-
Профи
(533),
на голосовании
14 лет назад
Скажите пожалуйста, как составить структурную формулы солей?
примерно это выглядит на картинки а как это делать и составлять я не знаю!
Помогите пожалуйста!
Дополнен 14 лет назад
Например: CaCO3
Голосование за лучший ответ