а) угольной; б) бромоводородной HBr; в) сернистой H2SO3; г) хлорной HClO4. Проверьте выполнение этого задания у соседа по парте.

С бескислородными кислотами всё просто и понятно, но как составлять формулы кислородсодержащих кислот?
- Сначала пишем символ атома центрального элемента.
- Вокруг символа атома центрального элемента пишем атомы кислорода.
- Все атомы водорода должны быть соединены с атомом кислорода.
- Все атомы кислорода должны быть соединены с центральным атомом.
- Между атомом кислорода и центральным атомом ставятся двойные черточки.
- Проверьте число атомов в структурной формуле.
- Проверьте валентность центрального атома.
1. Какие вещества называют кислотами?
3. Определите валентность кислотных остатков следующих кислот: H2S, HBr, HNO3, H2CO3, HMnO4, H3PO4, H2SO4.
4. Выведите химическую формулу соединения, в состав которого входят 3,95 массовой части химического элемента селена (Ar (Se) = 79) и 0,1 массовой части водорода.
Тестовые задания.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 апреля 2021 года; проверки требуют 38 правок.
| Угольная кислота | |
|---|---|
  |
|
| Систематическое название | Угольная кислота |
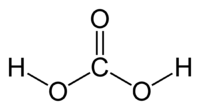
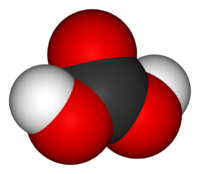
| Химическая формула | H2CO3 |
| Внешний вид | Бесцветный раствор |
| Свойства | |
| Молярная масса | 62,025 г/моль |
| Температура плавления | -80°C |
| Температура кипения | 333,6°C |
| Температура возгонки | ? |
| Температура разложения | ? |
| Температура стеклования | ? |
| Плотность | 1,668 г/см³ |
| Константа диссоциации pKa |
реальные: 1) 3,60; 2) 10,33 кажущаяся[1]: 6,37 |
| Растворимость в воде | 0,21[1] г/100 мл |
| Термодинамические свойства | |
| Стандартная энтальпия образования | −700 кДж/моль |
| Стандартная молярная энтропия | +187 Дж/(К·моль) |
| Стандартная энергия образования Гиббса | −623 кДж/моль |
| Классификация | |
| Регистрационный номер CAS | 463-79-6 |
| PubChem | 463-79-6 |
| Код SMILES | C(=O)(O)O |
| Безопасность | |
| Пиктограммы опасности СГС |
|
| NFPA 704 |
0 0 1 |
| Где это не указано, данные приведены при стандартных условиях (25 °C, 100 кПа). |
У́гольная кислота́ (химическая формула — H2CO3) — слабая химическая неорганическая кислота. Образуется в малых количествах при растворении углекислого газа в воде[1], в том числе и углекислого газа из воздуха.
При нормальных условиях, угольная кислота неустойчива и разлагается на углекислый газ и воду. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.
Физические свойства[править | править код]
Угольная кислота существует в водных растворах в равновесии с диоксидом углерода, причём при нормальных условиях равновесие сильно сдвинуто в сторону разложения кислоты.
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp2-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 130 пм.
Безводная угольная кислота представляет собой бесцветные кристаллы, устойчивые при низких температурах, сублимирующиеся при температуре –30 °C, а при дальнейшем нагревании полностью разлагающиеся. Поведение чистой угольной кислоты в газовой фазе исследовано в 2011 г. австрийскими химиками[2].
Химические свойства[править | править код]
Равновесие в водных растворах и кислотность[править | править код]
Угольная кислота существует в водных растворах в состоянии равновесия с гидратом диоксида углерода:
, константа равновесия при 25 °C
Скорость прямой реакции 0,039 с−1, обратной — 23 с−1.
В свою очередь растворённый гидрат диоксида углерода находится в равновесии с газообразным диоксидом углерода:
Данное равновесие при повышении температуры сдвигается вправо, а при повышении давления — влево (подробнее см. Абсорбция газов).
Угольная кислота подвергается обратимому гидролизу, создавая при этом кислую среду:
, константа кислотности при 25 °C
Однако, для практических расчётов чаще используют кажущуюся константу кислотности, учитывающую равновесие угольной кислоты с гидратом диоксида углерода:
Гидрокарбонат-ион подвергается дальнейшему гидролизу по реакции
, константа кислотности при 25 °C
Таким образом, в растворах, содержащих угольную кислоту, создается сложная равновесная система, которую можно изобразить в общем виде следующим образом:
Значение водородного показателя pH в такой системе, соответствующего насыщенному раствору диоксида углерода в воде при 25 °C и давлении 760 мм рт. ст., можно рассчитать по формуле:
, где C₀ = 0,034 моль/л — растворимость CO2 в воде при указанных условиях.
Разложение[править | править код]
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие смещается в сторону разложения угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:
Взаимодействие с основаниями и солями[править | править код]
Угольная кислота вступает в реакции нейтрализации с растворами оснований, образуя средние и кислые соли — карбонаты и гидрокарбонаты соответственно:
(конц.)
(разб.)
При взаимодействии угольной кислоты с карбонатами образуются гидрокарбонаты:
Получение[править | править код]
Угольная кислота образуется при растворении в воде диоксида углерода:
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода:
Применение[править | править код]
Угольная кислота всегда присутствует в водных растворах углекислого газа (см. «Газированная вода»).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора.
Также применяется для производства хладагента, солнечных генераторов и морозильников.
Органические производные[править | править код]
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот[3].
Некоторые представители подобных соединений перечислены в таблице.
| Класс соединений | Пример соединения |
|---|---|
| Сложные эфиры | поликарбонаты |
| Хлорангидриды | фосген |
| Амиды | мочевина |
| Нитрилы | циановая кислота |
| Ангидриды | пироугольная кислота |
Примечания[править | править код]
- ↑ 1 2 3 В водном растворе бо́льшая часть угольной кислоты обратимо переходит в гидрат диоксида углерода по реакции H2CO3 ⇄ CO2·H2O
- ↑ International first: Gas-phase carbonic acid isolated
- ↑ Нейланд О. Я. Органическая химия. — М.: Высшая школа, 1990. — С. 640—652. — 751 с. — ISBN 5-06-001471-1.
Литература[править | править код]
- Лидин Р. А., Молочко В. А., Андреева Л. Л. Реакции неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2007. — 637 с. — ISBN 978-5-358-01303-2.
- Лидин Р.А., Андреева Л. Л., Молочко В. А. Константы неорганических веществ: справочник / Под ред. Р. А. Лидина. — 2-е изд., перераб. и доп. — М.: Дрофа, 2006. — 685 с. — ISBN 5-7107-8085-5.
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,896 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Языки:
По умолчанию |
Все возможные |
Из списка
|
Применить к найденному
Угольная кислота
Брутто-формула:
CH2O3
CAS# 463-79-6
Категории:
Неорганические кислоты
PubChem CID: 767
Названия
Русский:
- Угольная кислота
English:
- Aerial acid
- Carbon dioxide solution
- Carbonic acid
- Dihydrogen carbonate
- Hydroxymethanoic acid
- acid of air
Варианты формулы:
H2CO3
HO/C`|O|O/H
OC(OH)2
HO|O`|/OH
H(+)2C(+4)O(-2)3
Вещества, имеющие отношение…
Ангидрид:
Углекислый газ
Анион:
Карбонаты; Гидрокарбонат
Сложные эфиры:
диметилкарбонат; Угольной кислоты монометиловый эфир, натриевая соль; Угольной кислоты монометиловый эфир, рубидиевая соль
Химический состав
Реакции, в которых участвует Угольная кислота
-
{M}(OH)2 + H2{X} = {M}{X} + 2H2O
, где M =
Mg Ca Ba Sr Cu Zn; X =
SO4 SO3 CO3 -
H2CO3 + Na2WO4 -> H2WO4 + Na2CO3
-
Sb2(SO4)3 + 3Na2CO3 + 3H2O -> Sb2O3 + 3Na2SO4 + 3H2CO3

![{displaystyle K_{p}={frac {mathsf {[H_{2}CO_{3}]}}{mathsf {[CO_{2}cdot H_{2}O]}}}=1{,}70cdot 10^{-3}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d37e7cded585ef31bd6c1e0bffe2059cb4c31301)

![{displaystyle K_{a1}={frac {mathsf {[HCO_{3}^{-}]cdot [H_{3}O^{+}]}}{mathsf {[H_{2}CO_{3}]}}}=2{,}5cdot 10^{-4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60b755cc59015e8c81c7ef9c5ae032be5d82f54d)
![{displaystyle K_{a}'={frac {mathsf {[HCO_{3}^{-}]cdot [H_{3}O^{+}]}}{mathsf {[CO_{2}cdot H_{2}O]}}}=4{,}27cdot 10^{-7}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a59a9846bcab31633f769c9446951defde2b6250)
![{displaystyle K_{a2}={frac {mathsf {[CO_{3}^{2-}]cdot [H_{3}O^{+}]}}{mathsf {[HCO_{3}^{-}]}}}=4{,}68cdot 10^{-11}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/92eeeb8da9932abda580009c8475b23d9108b697)











