CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
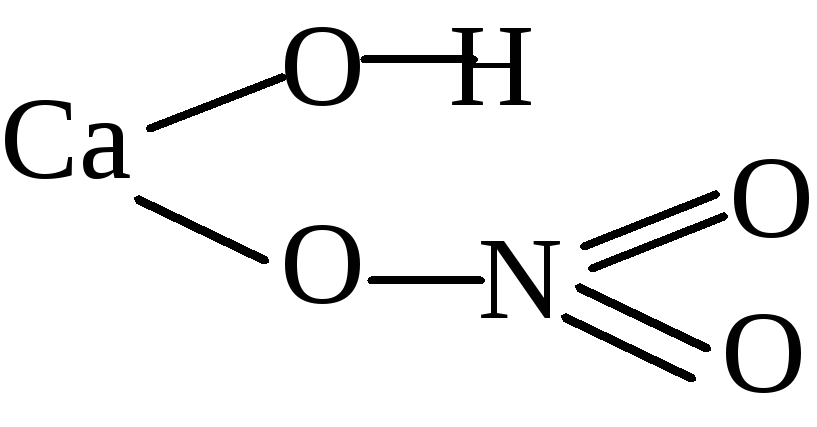
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
Как написать структурную формулу
Структурная формула – это графическое изображение химического строения молекулы вещества, в котором показывается порядок связи атомов, их геометрическое расположение. Кроме того, она наглядно показывает валентность атомов входящих в ее состав.
Вам понадобится
- – ручка;
- – бумага;
- – периодическая система элементов.
Инструкция
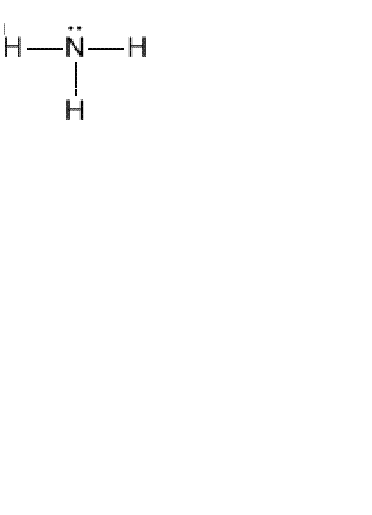
Для правильного написания структурной формулы того или иного химического вещества вы должны хорошо знать и представлять, что такое способность атомов образовывать определенное количество электронных пар с другими атомами. Ведь именно валентность поможет вам нарисовать химические связи. Например, дана молекулярная формула аммиака NH3. Вы должны написать структурную формулу. Учитывайте то, что водород всегда одновалентен, поэтому его атомы не могут быть связаны между собой, следовательно, они будут соединены с азотом.
Чтобы правильно написать структурные формулы органических соединений, повторите основные положения теории А.М. Бутлерова, согласно которой существуют изомеры – вещества с одинаковым элементарным составом, но с разными химическими свойствами. Например, изобутан и бутан. Молекулярная формула у них одинаковая: C4H10, а структурные – отличаются.
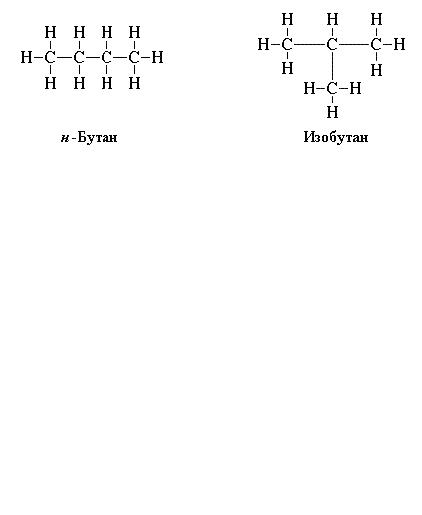
В линейной формуле каждый атом записывается отдельно, поэтому такое изображение занимает много места. Однако при составлении структурной формулы, вы можете указать общее число атомов водорода при каждом атоме углерода. А между соседними углеродами нарисуйте химические связи в виде линий.

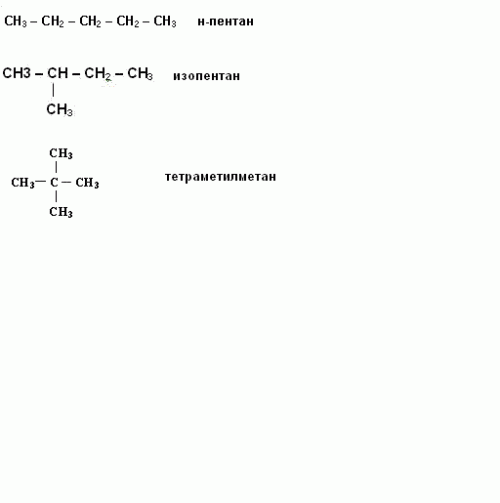
Написание изомеров начните с углеводорода нормального строения, то есть с неразветвленной цепью углеродных атомов. Затем сократите на один атом углерода, который присоедините к другому, внутреннему углероду. Исчерпав все варианты написания изомеров с данной длиной цепи, сократите ее еще на один углеродный атом. И опять присоедините его к внутреннему углеродному атому цепи. Например, структурные формулы н-пентана, изопентана, тетраметилметана. Таким образом, углеводород с молекулярной формулой C5H12 имеет три изомера.
Полезный совет
Для определения валентности атомов при составлении структурных формул используйте периодическую систему. Показать точно расстояние атомов в молекуле поможет трехмерная структурная формула.
Источники:
- структурная формула веществ
- Составление формул комплексных соединений
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
В предыдущей главе, вы уже могли заметить, что атомы, группируясь друг с другом, не обязательно образуют двухатомные молекулы, т.е. соединяются в соотношении один к одному. В молекуле воды, например, к одному атома кислорода прикрепляется два атома водорода. Количество связей, которые атом химического элемента образует с другими атомами, называется его валентностью.
Обозначается валентность римскими цифрами — I,II, III и т.д. в соответствии со своим значением. Давайте в качестве примера рассмотрим такие соединения как хлороводород HCl, воду Н2О, аммиак NH3 и метан CH4. Смотри рисунок 7.
 Рисунок 7. Трехмерные модели молекул HCl (a), H2O (б), NH3 (в) и CH4 (г)
Рисунок 7. Трехмерные модели молекул HCl (a), H2O (б), NH3 (в) и CH4 (г)
Если схематично изобразить строение этих молекул, обозначая атомы химических элементов соответствующими им символами, а связь между ними отрезком,
получаются формулы следующего вида, называемые структурными:
 Рисунок 8. Структурные формулы молекул хлороводорода, воды, аммиака и метана соответственно
Рисунок 8. Структурные формулы молекул хлороводорода, воды, аммиака и метана соответственно
Из представленных на рисунке ХХ структурных формул можно сделать вывод о том, что валентность водорода и хлора равна I, кислорода II, азота — III, углерода -IV.
Валентность химических элементов в соединениях принято указывать надстрочным индексом справа от символа химического элемента, либо над ним, как, например, это сделано ниже:
![]()
Для некоторых элементов характерна постоянная валентность, то есть в соединениях их валентность равна всегда одному и тому же числу.
Так, например, постоянная валентность, равная единице, наблюдается для ряда металлов, называемых щелочными — лития, натрия, калия, рубидия и цезия, Постоянная валентность, равная двум, наблюдается у кислорода, магния, кальция, стронция, бария, цинка. Постоянная валентность равная трем наблюдается у алюминия Al.
Элементы с переменной валентностью — это элементы, которые в разных соединениях могут иметь различные значения валентности. Следовательно, атомы этих элементов в разных соединениях могут образовывать различное число химических связей (таблица 2).
Таблица 2. Наиболее характерные значения валентности некоторых элементов
|
Химические элементы |
Их основные валентности |
|
Cl, Br, I |
I, III, V, VII |
|
S, Se |
II, IV, VI |
|
C, Si, Sn, Pb |
II, IV |
|
P |
III, V |
|
Cu |
I, II |
|
Fe |
II, III |
|
Cr |
II, III, VI |
Часто в определении валентности таких элементов в каждом отдельном случае может помочь так называемое правило валентности, согласно которому, в соединениях, образованных только двумя химическими элементами практически всегда произведение валентности одного химического элемента на количество его атомов в молекуле равно произведению валентности на количество атомов в молекуле второго элемента. Другими словами для вещества формулу которого в общем виде можно записать как AxBy с валентностями элементов А и В равными n и m соответсвенно, справедливо выражение:
X*n = y*m
Давайте в качестве примера установим валентность серы в соединениях SO2 (диоксид серы) и Al2S3 (сульфид алюминия). Как уже было сказано выше, кислород и алюминий являются элементами с постоянными валентностями. Для кислорода валентность во всех его соединениях равна двум, а алюминия трем.
Рассчитаем валентность серы в диоксиде серы обозначив ее как «х»:

Аналогично рассчитаем валентность серы в сульфиде алюминия:

Следует отметить, что правило валентности не применимо для некоторых соединений, в которых есть связи между атомами одного химического элемента. В частности, нельзя использовать правило валентности в случе такого соединения как перекись водорода поскольку его структурную формулу можно записать как Н-О-О-Н, то есть в каждой молекуле данного соединения есть связь кислород-кислород.
Очевидно, что правило валентности может быть использовано не только для нахождения валентности какого-либо элемента, но также и для составления формулы соединения, если известны валентности образующих его элементов.
Рассмотрим в качестве примера следующую задачу:
«Определите формулу соединения образованного атомами хлора и кислорода, если валентность хлора в данном соединении VII »
Решение:
Кислород имеет только одно значение валентности, равное двум, соответственно можем записать:
Наименьшее общее кратное (НОК) чисел 7 и 2 равно 14.
Индекс, относящийся к хлору, будет равен х = 14:7 = 2,
Индекс, относящийся к кислороду, будет равен y = 14:2 = 7.
Т.е. искомая формула Cl2O7.
Следует отметить тот факт, что в большинстве сложных веществ атомы одного химического друг с другом не связаны, например:
Рисунок 9. Структурные формулы молекул фосфорной кислоты, фосфина, серной кислоты и оксида хлора (VII)
Совет 1: Как написать структурную формулу
Структурная формула – это графическое изображение химического строения молекулы вещества, в котором показывается порядок связи атомов, их геометрическое расположение. Помимо того, она наглядно показывает валентность атомов входящих в ее состав.

Вам понадобится
- – ручка;
- – бумага;
- – периодическая система элементов.
Инструкция
1. Для верного написания структурной формулы того либо другого химического вещества вы обязаны отлично знать и представлять, что такое способность атомов образовывать определенное число электронных пар с другими атомами. Чай именно валентность поможет вам нарисовать химические связи. Скажем, дана молекулярная формула аммиака NH3. Вы обязаны написать структурную формулу. Рассматривайте то, что водород неизменно одновалентен, следственно его атомы не могут быть связаны между собой, следственно, они будут объединены с азотом.
2. Дабы положительно написать структурные формулы органических соединений, повторите основные расположения теории А.М. Бутлерова, согласно которой существуют изомеры – вещества с идентичным элементарным составом, но с различными химическими свойствами. Скажем, изобутан и бутан. Молекулярная формула у них идентичная: C4H10, а структурные – отличаются.
3. В линейной формуле весь атом записывается отдельно, следственно такое изображение занимает много места. Впрочем при составлении структурной формулы, вы можете указать всеобщее число атомов водорода при всяком атоме углерода. А между соседними углеродами нарисуйте химические связи в виде линий.
4. Написание изомеров начните с углеводорода типичного строения, то есть с неразветвленной цепью углеродных атомов. После этого сократите на один атом углерода, тот, что присоедините к иному, внутреннему углероду. Исчерпав все варианты написания изомеров с данной длиной цепи, сократите ее еще на один углеродный атом. И вновь присоедините его к внутреннему углеродному атому цепи. Скажем, структурные формулы н-пентана, изопентана, тетраметилметана. Таким образом, углеводород с молекулярной формулой C5H12 имеет три изомера.
Совет 2: Как составлять структурные формулы
Некоторые до сего времени с содроганием припоминают школьные уроки химии, на которых необходимо было составлять структурные формулы углеводородов и их изомеров. А между тем, ничего сверхсложного в этом нет. Довольно руководствоваться при составлении формул определенным алгорифмом.
Инструкция
1. Ознакомьтесь с молекулярной формулой углеводорода. Исходя из нее, составьте формулу вначале неразветвленного углеродного скелета (углеродную цепь).
2. Над всяким атомом углерода надпишите его порядковый номер.
3. Дальше расставьте атомы водорода в цепи. Не позабудьте: углерод четырехвалентен.
4. Уменьшите углеродную цепь на один атом. Расположите его как боковое ответвление углеродной цепи. Не позабудьте, что атомы, которые располагаются у крайних атомов цепи, не могут являться боковыми ответвлениями.
5. Определите, к какому краю ближе боковое ответвление. Пронумеруйте снова углеродную цепь, начиная с этого края. Расставьте атомы водорода в соответствии с валентностью углерода.
6. Определите, дозволено ли располагать боковое ответвление у прочих атомов углерода в цепи. В случае правильных итогов составьте формулы изомеров. Если же такая вероятность отсутствует, уменьшите основную углеродную цепь еще на атом и расположите его в качестве еще одного бокового ответвления. Обратите внимание: вблизи одного атома углерода дозволено располагать не огромнее 2-х боковых ответвлений.
7. Расставьте порядковые номера над атомами углерода с того края, к которому ближе каждого располагается боковое ответвление. Расположите вблизи всего атома атомы водорода с учетом валентности углерода.
8. Вновь проверьте, есть ли вероятность расположить боковые ответвления у прочих атомов углерода в стержневой цепи. Если такая вероятность существует, то составьте формулы допустимых изомеров, если нет – уменьшите углеродную цепь еще на атом и расположите его как боковое ответвление. Сейчас пронумеруйте всю цепь атомов и вновь испробуйте составить формулы изомеров. В том случае, если теснее два боковых ответвления находятся на идентичном удалении от краев цепи, начинайте нумерацию с края, у которого боковых ответвлений огромнее.
9. Продолжайте исполнять эти действия до тех пор, пока не исчерпаете все вероятности для расположения боковых ответвлений.
Совет 3: Как писать химические формулы
Для комфорта записи химического состава и конструкции химического вещества были сделаны определенные правила составления химических формул с подмогой особых символов-обозначений, чисел и вспомогательных знаков.
Инструкция
1. Химические формулы участвуют в написании уравнений химических реакций, схематичного изображения химических процессов, связей. Для их написания применяется так называемый язык химии, тот, что представляет собой комплект условных обозначений, таких как символы химических элементов, число атомов всякого элемента в описываемом веществе и пр.
2. Символы химических элементов – одна либо несколько букв латинского алфавита, из которых первая заглавная. Это схематичная запись полного называния элемента, скажем, Ca – это кальций либо лат. Calcium.
3. Число атомов выражается математическими числами, скажем, H_2 – это два атома водорода.
4. Существует несколько методов записи химической формулы : простейшая, эмпирическая, разумная и структурная. Простейшая формула записи отражает соотношение химических элементов с указанием ядерной массы, которая указывается позже знака химического элемента в виде нижнего индекса. Скажем, H_2O – простейшая формула молекулы воды, т.е. два атома водорода и один атом кислорода.
5. Эмпирическая химическая формула отличается от примитивной тем, что отражает состав вещества, но не конструкцию молекул. Формула показывает число атомов в одной молекуле, которое также изображается в виде нижнего индекса.
6. Отличие между примитивной и эмпирической формулами показывает запись формулы бензола: CH и C_6H_6 соответственно. Т.е. простейшая формула показывает прямое соотношение атомов углерода и водорода, в то время как эмпирическая говорит, что в молекуле вещества содержится 6 атомов углерода и 6 – водорода.
7. Разумная формула отчетливо показывает присутствие групп атомов элементов в соединении. Такие группы выдаются круглыми скобками, а их число указывается нижним индексом позже скобок. В формуле применяются также квадратные скобки, в которые заключаются комплексные соединения атомов (соединений с нейтрально заряженной молекулой, ионом).
8. Структурная формула изображается графически в 2-х- либо трехмерном пространстве. Химические связи между атомами изображаются в виде линий, при этом атомы указываются столько раз, сколько их участвует в соединении. Особенно наглядно формулу вещества выражает трехмерное изображение, которые показывают взаимное расположение атомов и расстояния между ними.
Видео по теме
Совет 4: Как определить ярус структурной безработицы
Структурная безработица обусловлена структурными изменениями в экономике. Почаще каждого это связано с процессами усовершенствования и инновациями в разных областях экономики и сельского хозяйства. Эти процессы делают невостребованными многие устаревающие специальности и профессии. Они единовременно порождают потребность на работников новых специальностей, тот, что остается неудовлетворенным из-за отсутствия профессиональных кадров.
Инструкция
1. Структурная безработица, наравне с фрикционной составляет обычную. Фрикционная безработица характерна для людей, незадолго утративших место работы и занятых поиском нового рабочего места. Как водится, она относится к тем экспертам, профессии которых остаются актуальными на рынке труда. Фрикционная безработица характерна недолгим периодом поиска и ожидания новой работы.
2. Вторая составляющая обычной – структурная безработица, характеризуется длинным сроком, от того что работники, оставшиеся невостребованными позже усовершенствования производства, обязаны проходить переобучение и менять профессию. А это не неизменно легко как в моральном, так и физическом плане. Помимо того, к этому типу безработицы относится отток и перемещение рабочей силы из депрессивных областей, что также сказывается на сроках поиска нового рабочего места.
3. Дабы определить уровень структурной безработицы , нужно взять статистические данные по безработным и проанализировать их. Из всеобщего числа работоспособного населения, занятого поиском работы, нужно предпочесть тех из них, высокопрофессиональная конструкция которых не соответствует структуре существующих на рынке труда вакансий. Так, в частности, такой вид безработицы характеризует военных экспертов трудоспособного возраста, оставшихся невостребованными в связи с сокращением вооруженных сил. Им доводится переучиваться и приобретать новые, «миролюбивые» специальности. Определите число ищущих работу людей, чьи случаи относятся именно к структурной безработице.
4. Ярус структурной безработицы (УСБ) определите по формуле:УСБ = (СБ / РС) *100%, где СБ – число структурных безработных, РС – рабочая сила.К рабочей силе относятся все категории населения трудоспособного возраста, которые хотят трудиться, работают либо ищут работу.
Обратите внимание!
Если экономика страны характеризуется наличием только фрикционной и структурной безработицы, то это обозначает полную занятость рабочей силы, ее особенно результативное и разумное применение.
Совет 5: Как вывести молекулярную формулу углеводорода
Углеводород – это органическое вещество, в состав которого входят только два элемента: углерод и водород. Он может быть предельным, непредельным с двойственный либо тройной связью, циклическим и ароматическим.

Инструкция
1. Представим, у вас есть такие данные: плотность углеводорода по водороду – 21, массовый процент водорода составляет 14,3%, массовый процент углерода составляет 85,7%. Определить формулу данного углеводорода .
2. Обнаружьте молярную массу этого вещества, исходя из его плотности по водороду. Помните, что молекула водорода состоит из 2-х атомов. Таким образом, вы получите 21*2 = 42 г/моль.
3. После этого вычислите, какова массовая доля углерода и водорода в молярной массе. 42*0,857 = 35,994 г – для углерода, 42*0,143 = 6,006 г – для водорода. Округлив эти величины, получите: 36г и 6 г. Следственно, в одной молекуле данного вещества содержится 36/12 = 3 атома углерода и 6/1 = 6 атомов водорода. Формула вещества: С3Н6 – это пропилен (пропен), непредельный углеводород.
4. Либо вам даны такие данные: при окислении, то есть при сгорании газообразного углеводорода , плотность паров которого по воздуху равна 0,552, образовалось 10 г углекислого газа и 8,19 г водяного пара. Требуется вывести его молекулярную формулу .
5. Запишите всеобщее уравнение окисления углеводорода : СnНm + O2 = CO2 + H2O.
6. Молярная масса углеводорода 0,552*29 = 16,008 г/моль. Собственно, теснее на этом задачу дозволено было бы считать решенной, от того что видимо, что только один углеводород удовлетворяет этому условию – метан, СН4. Но доведите решение до конца:
7. В 10 г углекислого газа содержится 10*12/44 = 2,73 г углерода. Следственно, это же число углерода содержалось в начальном углеводороде. В 8,19 г водяного пара содержалось 8,19*2/18 = 0,91 г водорода. Следственно, такое же число водорода было в начальном веществе. А всеобщая масса углеводорода составляет: 2,73 + 0,91 = 3,64 г.
8. Вычислите массовые проценты компонентов: 2,73/3,64 = 0,75 либо 75% для углерода, 0,91/3,64 = 0,25 либо 25% для водорода. Вы вновь видите, что таким условиям удовлетворяет только одно вещество – метан. Задача решена.
Видео по теме
Полезный совет
Для определения валентности атомов при составлении структурных формул используйте периодическую систему. Показать верно расстояние атомов в молекуле поможет трехмерная структурная формула.
Эмпирические
формулы дают информацию о качественном
и количественном составе соединений.
Взаимное расположение атомов в молекуле
вещества отражают структурно-графические
формулы, однако они не показывают
пространственное расположение атомов.
При
составлении структурно-графических
формул можно руководствоваться
следующими правилами:
1.
Элементы соединяются в соответствии с
их валентностью.
2.
Черточка в формуле обозначает единичную
химическую связь, количество черточек
соответствует валентности, например:
K2O
записывается так: K‑O
‑K
.
3.
Состав кислот и оснований следует
начинать изображать с центрального
атома,
|
например H4SiO4 |
|
4.
Если в молекуле кислоты содержится
больше атомов кислорода, чем водорода,
то «избыточные» атомы кислорода соединены
с центральным атомом двойной связью,
|
например: |
|
5.
При написании графических формул солей
исходят из графических формул кислот,
заменяя атомы водорода на атомы металла,
учитывая его валентность, например:
|
Na3PO4 |
|
Fe2(SO4)3 |
|
|
KHCO3 |
|
||
|
CaOHNO3 |
|
Структурно-графические
формулы некоторых кислот приведены в
табл. 5.
2.4. Общие химические свойства основных классов неорганических веществ
Оксиды
‑
вещества, состоящие из атомов двух
элементов, один из которых – кислород
в степени окисления (–2). По
химическим свойствам их подразделяют
на индифферентные, или несолеобразующие
(CO,
NO),
и солеобразующие, которые бывают
основными, кислотными и амфотерными.
Химические
свойства основных оксидов
1.
Взаимодействуют с кислотами с образованием
соли и воды, например:
MgO
+ 2HCl
= MgCl2
+ H2O.
2.
Взаимодействие с кислотными оксидами
с образованием солей:
CaO
+ CO2
= CaCO3.
3.
Оксиды щелочных и щелочноземельных
металлов взаимодействуют с водой с
образованием растворимых в воде
оснований – щелочей:
K2O
+ H2O
= 2KOH.
Химические
свойства кислотных оксидов
1.
Общим свойством всех кислотных оксидов
является их способность взаимодействовать
с основаниями с образованием соли и
воды:
СО2
+ 2NaOH
= Na2CO3
+ Н2О.
2.
Кислотные оксиды взаимодействуют с
основными оксидами с образованием
солей.
3.
Большинство кислотных оксидов
взаимодействует с водой с образованием
кислот:
SО3
+ Н2О
= H2SO4.
Очень
немногие кислотные оксиды не взаимодействуют
с водой. Наиболее известный из них оксид
кремния (SiO2).
Химические
свойства амфотерных оксидов
1.
Амфотерные оксиды взаимодействуют с
кислотами с образованием солей и воды.
ZnO
+ 2HNO3
= Zn(NO3)2
+ 2Н2О.
В
этих реакциях амфотерные оксиды играют
роль основных.
2.
Амфотерные оксиды взаимодействуют с
щелочами с образованием солей и воды.
ZnO
+ 2КОН
![]()
K2ZnO2
+ Н2О,
ZnO
+ 2КОН + H2O
![]()
K2[Zn(OH)4].
В
этих реакциях амфотерные оксиды играют
роль кислотных.
3.
Амфотерные оксиды при нагревании
взаимодействуют с кислотными оксидами
с образованием солей:
ZnO
+ CO2
= ZnCO3.
4.
Амфотерные оксиды при нагревании
взаимодействуют с основными оксидами
с образованием солей:
ZnO
+ Na2O
= Na2ZnO2.
Получение
оксидов
Оксиды
могут быть получены различными способами:
1.
Взаимодействием простых веществ с
кислородом:
2Mg
+ О2
= 2MgO;
2.
Разложением некоторых оксокислот:
H2SO3
![]() =
=
SO2
+ Н2О.
3.
Разложением нерастворимых оснований:
Сu(OH)2![]() CuO
CuO
+ H2O.
4.
Разложением некоторых солей:
СаСО3
![]()
СаО + СО2.
Основания
‑
сложные
вещества, при диссоциации которых в
воде образуются гидроксид-ионы и никаких
других анионов.
По
растворимости в воде основания делятся
на две группы: нерастворимые [Fe(OH)3,
Си(ОН)2
и др.] и растворимые в воде [КОН, NaOH,
Са(ОН)2,
Ва(ОН)2
], или щелочи.
Химические
свойства оснований
Общие
свойства оснований объясняются наличием
в растворах анионов ОН–,
которые образуются в результате
электролитической диссоциации молекул
оснований:
NaOH![]() Na+
Na+
+ OH–.
1.
Водные растворы щелочей изменяют окраску
индикаторов.
Таблица
6 ‑ Изменение
цвета индикаторов в растворах
щелочей
и кислот
|
Индикатор |
Цвет |
Цвет |
Цвет |
|
Лакмус |
Фиолетовый |
Синий |
Красный |
|
Фенолфталеин |
Бесцветный |
Малиновый |
Бесцветный |
|
Метилоранж |
Оранжевый |
Желтый |
Красный |
2.
Основания взаимодействуют с кислотами
с образованием соли и воды (реакция
нейтрализации). Например:
КОН
+ НС1= КС1 + Н2О;
Fe(OH)2
+2HNO3
= Fe(NO3)2
+ 2Н2О.
3.
Щелочи взаимодействуют с кислотными
оксидами с образованием соли и воды:
Са(ОН)2
+ СО2
= СаСО2
+ Н2О.
4.
Растворы щелочей взаимодействуют с
растворами солей, если в результате
образуется нерастворимое основание
или нерастворимая соль. Например:
2NaOH
+ CuSO4
= Cu(OH)2↓
+ Na2SO4;
Ва(ОН)2
+ Na2SO4
= 2NaOH
+ BaSO4↓.
5.
Нерастворимые основания при нагревании
разлагаются на основный оксид и воду.
2Fе(ОН)3
![]()
Fе2О3
+ ЗН2О.
6.
Растворы щелочей взаимодействуют с
металлами, которые образуют амфотерные
оксиды и гидроксиды (Zn,
Al
и др.).
2AI
+ 2КОН + 6Н2О
= 2K[A1(OH)4]
+ 3H2↑.
Получение
оснований
-
Получение
растворимых
оснований:
а)
взаимодействием щелочных и щелочноземельных
металлов с водой:
2Na
+ 2Н2О
= 2NaOH
+ Н2↑;
б)
взаимодействием оксидов щелочных и
щелочноземельных металлов с
водой:
Na2O
+ Н2О
= 2NaOH.
2.
Получение нерастворимых
оснований
действием щелочей на растворимые соли
металлов:
2NaOH
+
FeSO4
= Fe(OH)2↓
+ Na2SO4.
Кислоты
‑ сложные вещества, при диссоциации
которых в воде, образуются ионы водорода
(гидроксония) и никаких других катионов.
Химические
свойства
Общие
свойства кислот в водных растворах
обусловлены присутствием ионов Н+
(вернее H3O+),
которые образуются в результате
электролитической диссоциации молекул
кислот:
1.
Кислоты одинаково изменяют цвет
индикаторов (табл. 7).
2.
Кислоты взаимодействуют с основаниями.
Например:
Н3РО4
+ 3NaOH=Na3PO4+ЗН2О;
Н3РО4
+ 2NaOH
= Na2HPO4
+ 2Н2О;
Н3РО4
+ NaOH
= NaH2PO4
+ Н2О;
2НС1
+ Сu(ОН)2
= СuС12
+ 2Н2О;
НС1
+ Сu(ОН)2
= СuОНСl
+ Н2О.
3.
Кислоты взаимодействуют с основными
оксидам:
2НСl
+ СаО = СаС12
+ Н2О;
H2SO4
+Fe2O3=Fe2(SO4)3+
ЗН2О.
4.
Кислоты взаимодействуют с амфотерными
оксидами:
2HNO3
+ ZnO
= Zn(NO3)2
+ Н2О.
5.
Кислоты взаимодействуют с некоторыми
средними солями с образованием новой
соли и новой кислоты, реакции возможны
в том случае, если в результате образуется
нерастворимая соль или более слабая
(или более летучая) кислота, чем исходная.
Например:
2НС1+Na2CO3=2NaCl+H2CO3;
NaCl
+ H2SO4
= HCl + Na2SO4.
6.
Кислоты взаимодействуют с металлами.
Характер продуктов этих реакций зависит
от природы и концентрации кислоты и от
активности металла. Например, разбавленная
серная кислота, хлороводородная кислота
и другие кислоты‑неокислители
взаимодействуют с металлами, которые
находятся в электрохимическом ряду
напряжения левее водорода. В результате
реакции образуются соль и газообразный
водород:
H2SO4
(разб))
+ Zn
= ZnSO4
+ Н2↑;
НС1
+ Mg
= MgО
+ H2↑.
Кислоты-окислители
(концентрированная серная кислота,
азотная кислота HNO3
любой концентрации) взаимодействуют и
с металлами, стоящими в ряду напряжения
после водорода с образованием соли и
продукта восстановления кислоты.
Например:
2H2SO4
(конц)
+ Zn = ZnSO4
+SO2↑+
2H2O;
Получение
кислот
1.
Бескислородные кислоты получают путем
синтеза из простых веществ и последующим
растворением продукта в воде.
S
+ Н2
= Н2S.
2.
Оксокислоты получают взаимодействием
кислотных оксидов с водой.
SO3
+ Н2О
= H2SО4.
3.
Большинство кислот можно получить
взаимодействием солей с кислотами.
Na2SiО3
+ H2SO4
= H2SiО3
+ Na2SO4.
Амфотерные
гидроксиды
1.
В нейтральной среде (чистая вода)
амфотерные гидроксиды практически не
растворяются и не диссоциируют на
ионы.
Они растворяются в кислотах и щелочах.
Диссоциацию амфотерных гидроксидов в
кислой и щелочной средах можно выразить
следующими уравнениями:
Zn![]()
+ OH–
![]()
Zn(OH)![]()
![]() H+
H+
+ ZnO![]()
А13+
+ ЗОН–
![]()
Al(OH)3
![]()
H+
+ AlO![]() +
+
H2O
2.
Амфотерные гидроксиды взаимодействуют
как с кислотами, так и со щелочами,
образуя соль и воду.
Взаимодействие
амфотерных гидроксидов с кислотам:
Zn(OH)2
+ 2НCl
+ ZnCl2
+ 2Н2О;
Sn(OH)2+
H2SO4
= SnSO4
+ 2Н2О.
Взаимодействие
амфотерных гидроксидов со щелочами:
Zn(OH)2
+ 2NaOH
![]()
Na2ZnO2
+ 2H2O;
А1(ОН)3
+ NaOH
![]()
NаАlO2
+ 2Н2О;
Zn(OH)2
+ 2NaOH
![]()
Na2[Zn(OH)4];
Pb(OH)2
+ 2NaOH![]()
Na2[Pb(OH)4].
Соли
–
продукты замещения атомов водорода в
молекуле кислоты на атомы металла или
замещения гидроксид-иона в молекуле
основания кислотными остатками.
Общие химические
свойства солей
1. Соли в водных
растворах диссоциируют на ионы:
а)
средние соли диссоциируют на катионы
металлов и анионы кислотных остатков:
NaCN
=Na++СN–
;
Ва(СН3СОО)2
= Ва2+
+ 2(СН3СОО)–
.
6)
кислые
соли диссоциируют на катионы металла
и сложные
анионы:
KHSО3
= К+
+ HSO32-;
NaH2PO4
=
Na+
+ Н2РО4–.
в)
основные соли диссоциируют на сложные
катионы и анионы кислотных остатков:
АlОН(СН3СОО)2
=
АlОН2+
+ 2СН3СОО–.
2.
Соли взаимодействуют с металлами с
образованием новой соли и нового металла.
Данный металл может вытеснять из
растворов солей только те металлы,
которые находятся правее его в
электрохимическом ряду напряжения:
CuSO4
+
Fe
= FeSO4
+ Сu.
3.
Растворимые соли взаимодействуют со
щелочами с образованием новой соли и
нового основания. Реакция возможна,
если образующееся основание или соль
выпадают в осадок. Например:
FeCl3+3КОН=Fe(OH)3↓+3КС1;
К2СО3+Ba(OH)2=ВаCO3↓+
2КОН.
4. Соли взаимодействуют
с кислотами с образованием новой более
слабой кислоты или новой нерастворимой
соли:
Na2CO3
+ 2HC1 = 2NaCl + CO2↑
+ H2O.
При
взаимодействии соли с кислотой, образующей
данную соль, получается кислая соль
(это возможно в том случае, если соль
образована многоосновной кислотой).
Например:
Na2S
+ H2S
= 2NaHS;
CaCO3
+ CO2+
H2O
= Ca(HCО3)2
.
5.
Соли могут взаимодействовать между
собой с образованием новых солей, если
одна из солей выпадает в осадок:
AgNO3
+ KC1
= AgCl↓
+ KNO3.
6. Многие соли
разлагаются при нагревании:
MgCО3
![]()
MgO
+
CО2↑;
2NaNO3
![]()
2NaNO2
+ O2↑.
7.
Основные соли взаимодействуют с кислотами
с образованием средних солей и воды:
Fe(OH)2NO3+HNO3=FeOH(NO3)2+H2O;
FeOH(NO3)2+HNO3=Fe(NO3)3
+ H2O.
8.
Кислые соли взаимодействуют с щелочами
с образованием средних солей и воды:
NaHSO4
+ NaOH
= Na2SO3
+ H2O;
КН2РО4
+ КОН = К2НРО4
+ Н2О.
Получение солей
Все
способы получения солей основаны на
химических свойствах важнейших классов
неорганических соединений. Десять
классических способов получения солей
представлены в табл. 8. Кроме общих
способов получения солей, возможны и
некоторые частные способы:
1.
Взаимодействие металлов, оксиды и
гидроксиды которых являются амфотерными,
с щелочами.
2. Сплавление солей
с некоторыми кислотными оксидами.
K2CO3
+ SiO2
![]()
K2SiO3
+ CO2↑.
3. Взаимодействие
щелочей с галогенами:
2КОН
+Сl2
![]() KCl
KCl
+KClO
+ H2O;
4. Взаимодействие
галогенидов с галогенами:
2КВг
+ Cl2
= 2КС1 +Вг2
Таблица
8 ‑ Основные
способы получения солей
|
Неметалл |
Кислотный |
Кислота |
Соль |
|
|
Металл |
Соль |
– |
Соль + … |
Соль +металл |
|
Основный |
– |
Соль |
Соль |
– |
|
Основание |
– |
Соль + вода |
Соль + вода |
Соль |
|
Соль |
– |
– |
Соль |
Соль + соль |