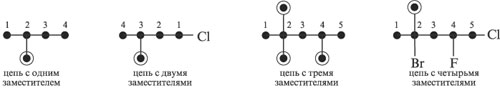
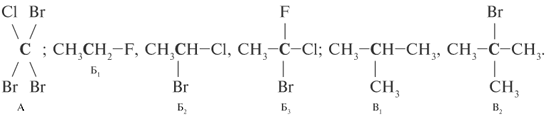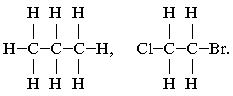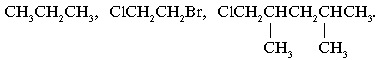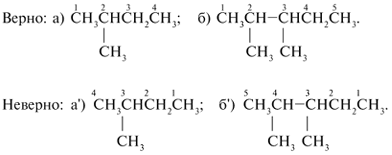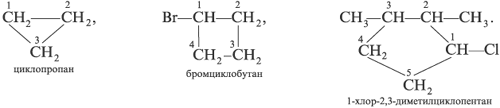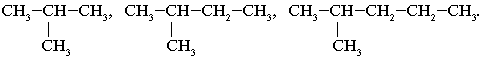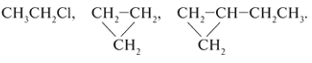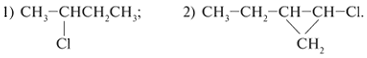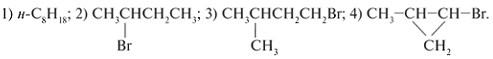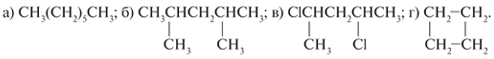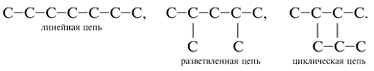Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляютуглеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:
Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
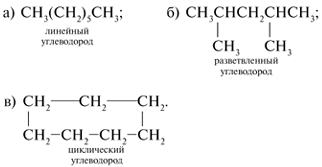
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:
Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий разветвленных и замещенных алканов
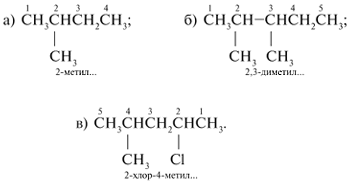
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.
2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:
3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Явление существования разных по строению и свойствам веществ, у которых одинаковый качественный и количественный состав, носит название и……. .
Вещества, у которых одинаковая м……….. формула, но разные с………. формулы – это и……
(табл. 2).
Таблица 2
Примеры изомерных углеводородов
| Молекулярная формула | Структурные формулы |
|---|---|
| С4Н10 | СН3СН2СН2СН3,  |
| С5Н12 | СН3СН2СН2СН2СН3,  |
| С6Н14 | СН3(СН2)4СН3,  |
 |
Найди девять отличий |
Правила составления изомеров на примере соединения С5Н11Сl.
1. Записывают линейную углеродную цепь С5:
С–С–С–С–С.
2. Определяют, к какому классу углеводородов принадлежит данное соединение. Определение производят с помощью общих формул для углеводородов разных классов (CnH2n+2, CnH2n и т. п.). Вещество С5Н11Сl – хлоралкан, т.е. является производным алкана вида CnH2n+2 (n = 5), в котором один атом Н замещен на Cl. Значит, все связи в молекуле одинарные и нет циклов.
3. Нумеруют атомы С углеродной цепи (углеродного скелета) и при С-1 помещают гетероатом Cl:
4. Записывают необходимое число атомов водорода при каждом углероде цепи, учитывая, что валентность С – IV. В результате получают изомер а):
5. Перемещают атом хлора по главной цепи С5, последовательно соединяя его с атомами С-2 и С-3. Так получают изомеры б) и в):
Дальнейшее смещение хлора вправо по цепи новых изомеров не дает. Так, изомер а*) тождественен изомеру а), изомер б*) идентичен изомеру б). Просто в изомерах а*) и б*) меняется направление нумерации атомов С, счет ведется справа налево (без звездочек было слева направо):
6. Исходя из углеродного скелета (см. пункт 3), крайний (пятый) атом С отрывают и помещают заместителем к внутреннему углероду цепи (сначала к С-2, потом к С-3). Получают главные цепи С4с углеродным заместителем при С-2 и С-3:
Записывают структурные формулы новых изомеров:
7. Помещая хлор при внутренних атомах С главной углеродной цепи С4, получают два дополнительных изомера:
8. Вещество формулы С5Н11Сl может иметь трехуглеродную главную цепь С3:
Таким образом, для вещества с молекулярной формулой С5Н11Сl можно составить восемь структурных формул изомеров а)–з), различающихся строением.
CharChem
:
Система описания химических формул для WEB.
Химические формулы для “чайников”
Научно-популярная статья о химических формулах.
Изначально сайт был задуман, как ресурс для профессиональных химиков. Содержание Структурные формулы – это просто!
Я думаю, что знакомство с формулами лучше всего начать со структурных формул органических веществ. Перед нами структурная формула метана – самого простого органического вещества. H-C-H;H|#2|H
Что мы видим? В центре латинская буква C, а от неё четыре палочки, на концах которых четыре латинских буквы H.
Структурные формулы могут слегка менять свой внешний вид.
H-C-H; H|#2|H = Все эти картинки означают одно и то же. И считаются одинаковыми формулами.
В общем, структурные формулы не являются какими-то жесткими конструкциями.
Но в химии приняты не только структурные формулы. И здесь мы познакомимся с некоторыми из них. CH4
Палочки исчезли, а вместо четырёх букв H осталась одна, но с маленькой цифрой 4, которая указывает количество атомов.
Стоит упомянуть, что метан – это природный газ, который знаком всем, у кого есть газовая плита. Углеводороды
Прежде, чем мы начнём знакомство с многочисленными органическими соединениями, хочу напомнить –
Здесь представлены органические вещества, называемые углеводородами.
Теперь посмотрим на колонку, где представлены упрощённые структурные формулы.
Некоторые функциональные группы получают собственные названия и даже специальные обозначения. Двойные и тройные связи
Итак, за короткое время мы уже разобрались, что такое структурные формулы и выяснили, что они бывают развёрнутые и упрощённые.
Представленные здесь вещества тоже относятся к углеводородам.
Кроме того, появились дополнительные названия. Тут тоже нет ничего страшного. Циклические углеводороды
Продолжим знакомство с формулами углеводородов. Они ещё не раскрыли нам всех своих секретов.
Изомеры
До сих пор мы не особенно обращали внимания на последнюю колонку, где выведены брутто-формулы.
В химии существует такое понятие как изомеры. Классическими изомерами среди углеводородов можно назвать бутан и изобутан. Посмотрим на их формулы:
Изобутан является изомером бутана. Обратите внимание, что брутто-формулы одинаковы.
Как видно, разнообразие углеводородов не перестаёт удивлять.
А у вещества декан, имеющего формулу C10H22, существует 75 изомеров.
Обратите внимание, что научное название зависит от числа звеньев в прямой цепочке, Бензол и скелетные формулы
Думаю, что пора познакомиться ещё с одним весьма примечательным представителем углеводородов.
Чем же этот бензол так примечателен? Дело в том, что это шестиугольное колечко входит в состав огромного
Конечно, скелетные формулы не так просты, как развёрнутые, но зато их гораздо легче записывать. Давайте посмотрим, как выглядят формулы других веществ, производных от бензола.
Как видите, появился ещё и смешанный вариант. Опять какой-то новый вид формул? На этот раз уже нет. А вот скелетная формула углеводорода, который называется коронен. Причём, другие варианты здесь уже использовать нет смысла. |/`/|“/|`|“|/`/“||/\/\|||`/|`//“/`\`|/`/“||/
Впечатляет? Но это далеко не самая сложная структура для органического вещества.
Скелетные формулы существуют не только для циклических молекул.
Трехмерные изображения
Иногда плоского изображения становится недостаточно.
В качестве примера посмотрим на формулы уже известных нам углеводородов:
Конечно, здесь потребуется включать воображение, чтобы представить трёхмерную структуру. Формулы с окружностью
Думаю, что стоит упомянуть ещё одну интересную конструкцию, которая нередко встречается при изображении циклических структур. /\|`//“|| <-> /=`//`-`\ <-> //||`/`\`| <-> /|`/“|_o <-> H|</H>|<H>`/<|H>`<`/H>`|<`H>/_o
Само собой, все они означают одно и то же. Но первые три отличаются только поворотом вокруг собственного центра.
Формулы бензола, где используется чередование одинарных и двойных связей называются формулами Кекуле в честь немецкого учёного,
На самом деле, среди химиков нет единого мнения по поводу того, насколько правильно использование формул с кружком. Вот пара примеров записи уже для уже знакомых нам веществ:
Знакомство с кислородом. Спирты
До сих пор мы знакомились со структурными формулами углеводородов, которые состоят только из углерода и водорода.
Кислород – очень распространённый элемент на нашей планете.
Не правда ли, что в этом есть что-то знакомое? Метан – метанол, этан – этанол, пропан – пропанол.
Все спирты можно описать в виде обобщённой формулы {R}-OH,
Конечно же стоит упомянуть, что этанол – это тот самый спирт, который входит в состав алкогольных напитков.
Ещё здесь из четырёх спиртов есть два изомера: 1-пропанол и 2-пропанол.
CH3-CH2-CH2-OH = $slope(45)CH3CH2CH2OH = CH3|CH2|CH2|OH = HO/CH2/CH2/CH3 = Поэтому первый номер – тот, который ближе к гидроксильной группе.
Все спирты, с которыми мы уже успели познакомиться, имеют в своём составе одну гидроксильную группу.
Ну и чтобы завершить знакомство со спиртами, приведу ещё формулу другого известного вещества – холестерина.
|`/`\`|<`|w>“/|<`/w$color(red)HO$color()>/`|0/`|/<`|w>|_q_q_q<-dH>:a_q|0<|dH>`/<`|wH>`|dH; Гидроксильную группу в нём я обозначил красным цветом. Карбоновые кислоты
Любой винодел знает, что вино должно храниться без доступа воздуха. Иначе оно скиснет.
Отличительной особенностью органических кислот является наличие карбоксильной группы (COOH),
Все, кто пробовал уксус, знают что он весьма кислый. Причиной этого является наличие в нём уксусной кислоты.
Карбоновые кислоты могут иметь несколько карбоксильных групп. В пищевых продуктах содержится немало других органических кислот. Вот только некоторые из них:
Название этих кислот соответствует тем пищевым продуктам, в которых они содержатся. Радикалы
Радикалы – это ещё одно понятие, которое оказало влияние на химические формулы.
Выше по тексту уже несколько раз упоминались обобщённые формулы: спирты – {R}-OH и
Если выражаться более определённо, то одновалентным радикалом называется часть молекулы, лишённая одного атома водорода.
Радикалы в химии получили собственные названия.
Думаю, что здесь всё понятно. Хочу только обратить внимание на колонку, где приводятся примеры спиртов.
Существует ещё такое явление, как свободные радикалы. Знакомство с азотом. Амины
Предлагаю познакомиться с ещё одним элементом, который входит в состав многих органических соединений. Это азот. Посмотрим, какие вещества получаются, если к знакомым нам углеводородам присоединить азот:
Как Вы уже наверное догадались из названий, все эти вещества объединяются под общим названием амины.
В общем, никаких особых новшеств здесь нет. Рациональные формулы
Не следует делать вывод о том, что неорганическая химия проще, чем органическая.
Так вот, ничего этого я рассказывать не буду. Тема моей статьи – химические формулы.
Для начала, познакомимся с ещё одним элементом – кальцием. Это тоже весьма распространённый элемент.
При первом взгляде можно заметить, что рациональная формула является чем то средним между структурной и брутто-формулой.
Кальций в чистом виде – это мягкий белый металл. В природе он не встречается. 2Ca + O2 -> 2CaO
Цифра 2 перед формулой вещества означает, что в реакции участвуют 2 молекулы. CaO + H2O -> Ca(OH2)
Получается гидроксид кальция. Если присмотреться к его структурной формуле (в предыдущей таблице), то видно,
Но и гидроксид кальция не встречается в природе из-за наличия в воздухе углекислого газа. CO2 + H2O <=> H2CO3 Знак <=> говорит о том, что реакция может проходить в обе стороны при одинаковых условиях.
Таким образом, гидроксид кальция, растворённый в воде, вступает в реакцию с угольной кислотой Ca(OH)2 + H2CO3 -> CaCO3″|v” + 2H2O
Стрелка вниз означает, что в результате реакции вещество выпадает в осадок. CaCO3 + CO2 + H2O <=> Ca(HCO3)2
Этот процесс влияет на жесткость воды.
Из карбоната кальция в значительной степени состоят мел, известняк, мрамор, туф и многие другие минералы.
Этот небольшой рассказ о круговороте кальция в природе должен пояснить, для чего нужны рациональные формулы.
Кроме того, отдельные элементы – Ca, H, O(в оксидах) – тоже являются самостоятельными группами. Ионы
Думаю, что пора знакомиться с ионами. Это слово наверняка всем знакомо.
В общем, природа химических связей обычно заключается в том, что одни элементы отдают электроны, а другие их получают. H2O <=> H^+ + OH^-
Здесь мы видим, что в результате электролитической диссоциации вода распадается на положительно заряженный H2CO3 = H^+ + HCO3^- <=> 2H^+ + CO3^2- Карбонат-ион имеет заряд 2-. Это означает, что к нему присоединились два электрона.
Отрицательно заряженные ионы называются анионы. Обычно к ним относятся кислотные остатки.
И вот здесь наверное можно полностью понять смысл рациональных формул. В них сначала записывается катион, а за ним – анион.
Вы наверное уже догадываетесь, что ионы можно описывать не только рациональными формулами. O^-|O`|/OH
Здесь заряд указан непосредственно возле атома кислорода, который получил лишний электрон, и поэтому лишился одной чёрточки. NH3 + H2O <=> NH4^+ + OH^- То же самое, но с использованием структурных формул: H|N<`/H>H + H-O-H <=> H|N^+<_(A75,w+)H><_(A15,d+)H>`/H + O`^-# -H
В правой части мы видим два иона.
2H|N^+<`/H><_(A75,w+)H>_(A15,d+)H + O^-C|O`|/O^- <=>
Но в таком виде уравнение реакции дано в демонстрационных целях. 2NH4^+ + CO3^2- <=> (NH4)2CO3 Система Хилла
Итак, можно считать, что мы уже изучили структурные и рациональные формулы.
В принципе, рациональная формула угольной кислоты вполне может считаться истинной формулой,
Вместо заключения мне хотелось бы рассказать о системе CharChem.
Зачем вообще нужна какая-то система для вывода формул?
Рациональные и брутто-формулы вполне можно изобразить при помощи текста. H H
| |
H-C-C-O-H
| |
H H
Выглядит конечно не очень красиво, но тоже осуществимо.
Настоящая проблема возникает при попытке изобразить бензольные кольца и при использовании скелетных формул.
Система CharChem позволяет хранить все формулы прямо в HTML-документе в текстовом виде. По-моему, это очень удобно.
Таким образом, для подготовки этой статьи я пользовался только текстовым редактором. Вот несколько примеров, раскрывающих секрет подготовки текста статьи:
Описания из левого столбца автоматически превращаются в формулы во втором столбце. Здесь есть гораздо более подробная документация по использованию системы CharChem. На этом разрешите закончить статью и пожелать удачи в изучении химии. Краткий толковый словарь использованных в статье терминов
|
Органическая химия – это химия углерода и его соединений с другими элементами.
В молекулах органических веществ могут присутствовать также атомы: водорода Н, кислорода О, азота N, серы S, фосфора P, галогенов, металлов и других элементов.
Количество известных органических соединений в настоящее время превышает 20 миллионов.
Углерод в органических веществах
Атомы углерода могут соединяться друг с другом с образованием цепей различного строения (разветвленные, неразветвленные, замкнутые) и длины (от двух до сотен тысяч атомов углерода).
В органических веществах углерод имеет валентность IV (образует 4 связи).
- Атом углерода может образовывать одинарные, двойные и тройные связи.
CH3-CH3 CH2=CH2 CH≡CH
В основе современной органической химии лежит теория строения органических соединений.
Основные положения теории строения органических соединений
Атомы в молекулах соединены друг с другом в определенной последовательности согласно их валентностям. Последовательность межатомных связей в молекуле называется ее химическим строением и отражается структурной формулой (формулой строения).
- Свойства веществ зависят не только от вида и числа атомов в молекуле, но и от их взаимного расположения – т.е. от строения молекулы.
Это приводит к тому, что вещества одного и того же состава могут иметь разное строение, т. е. к появлению изомерии.
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
| Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилпропан) с разветвленным скелетом | |
|
н-Бутан CH3-CH2-CH2-CH3 |
Изобутан CH3-CH(CH3)-CH3 |
При этом температура кипения н-бутана -0,5оС, а изобутана -11,4оС.
- По свойствам данного вещества можно определить строение его молекулы, а по строению молекулы – определить свойства.
- Атомы и группы атомов в молекуле оказывают взаимное влияние друг на друга. Это отражается на химических и физических свойствах вещества.
Формулы строения органических веществ
Состав органического вещества можно описать химическими формулами.
Химические формулы органических веществ бывают следующих типов:
Простейшая формула – может быть получена опытным путем через определение соотношения количества атомов химических элементов в веществе.
Например, простейшая формула метана CH4, а вот бензола – СН.
Истинная формула (брутто-формула) – показывает истинный состав молекулы, но не показывает ее структуру. Истинная формула показывает точное количество атомов каждого элемента в одной молекуле.
Например, истинная формула бензола C6H6.
Полная (развернутая) структурная формула однозначно описывает порядок соединения атомов в молекуле.
Например, полная структурная формула бутана:
Сокращенная структурная формула – это структурная формула, в которой не указываются связи между углеродом и водородом.
Например, сокращенная структурная формула бутана:
CH3-CH2-CH2-CH3
Типы углеродных атомов в составе органических молекул
Типы углеродных атомов в составе органических молекул
|
Атомы углерода |
|||
| Первичные | Вторичные | Третичные | Четвертичные |
| Атомы углерода, которые в углеродной цепи соединены с одним атомом углерода | Атомы углерода, которые в углеродной цепи соединены с двумя атомами углерода | Атомы углерода, которые в углеродной цепи соединены с тремя атомами углерода | Атомы углерода, которые в углеродной цепи соединены с четырьмя атомами углерода |
Типы связей в молекулах органических веществ
Одна из характеристик химических связей — тип перекрывания орбиталей атомов в молекуле.
По характеру перекрывания различают σ-(сигма) и π‑(пи) связи.
σ-Связь — это связь, в которой перекрывание орбиталей происходит вдоль оси, соединяющей ядра атомов.
σ-Связь может быть образована любыми типами орбиталей (s, p, d, гибридизованными).
σ-Связь — это основная связь в молекуле, которая преимущественно образуется между атомами.
Между двумя атомами возможна только одна σ-связь.
Виды σ-связей
π-Связь — это связь, в которой перекрывание орбиталей происходит в плоскости, перпендикулярной оси, соединяющей ядра атомов, сверху и снизу от оси связи.
π-Связь образуется при перекрывании только р- (или d) орбиталей, перпендикулярных линии связи и параллельных друг другу.
π-Связь является дополнительной к σ-связи, она менее прочная и легче разрывается при химических реакциях.
| Одинарная связь
С–С, С–Н, С–О |
Двойная связь
С=С, С=О |
Тройная связь
С≡С, С≡N |
| σ-связь | σ-связь + π-связь | σ-связь + две π-связи |
Гибридизация атомных орбиталей углерода
Электронная формула атома углерода в основном состоянии:
+6С 1s22s22p2
+6С 1s 2s
2p
В возбужденном состоянии: один электрон переходит с 2s-подуровня на 2р-подуровень.
+6С* 1s22s12p3
+6С* 1s2 2s1
2p3
Таким образом, в возбужденном состоянии углерод содержит четыре неспаренных электрона, может образовать четыре химические связи и проявляет валентность IV в соединениях.
При образовании четырех химических связей атомом углерода происходит гибридизация атомных орбиталей.
Гибридизация атомных орбиталей — это выравнивание электронной плотности атомных орбиталей разного типа с образованием новых, молекулярных орбиталей, форма и энергия которых одинаковы.
В гибридизацию вступают атомные орбитали с небольшой разницей в энергии (как правило, орбитали одного энергетического уровня). В зависимости от числа и типа орбиталей, участвующих в гибридизации, для атома углерода возможны sp3, sp2 и sp-гибридизация.
sp3-Гибридизация
В sp3-гибридизацию вступают одна s-орбиталь и три p-орбитали. При этом образуются четыре sp3-гибридные орбитали:
Изображение с портала orgchem.ru
Четыре sp3-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в состоянии sp3-гибридизации направлены в пространстве под углом 109о 28’ друг к другу, что соответствует тетраэдрическому строению.
Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода. Валентный угол Н–С–Н в метане равен 109о 28’
Молекулам линейных алканов с большим числом атомов углерода соответствует зигзагообразное расположение атомов углерода.
Например, пространственное строение н-бутана
sp2-Гибридизация
В sp2-гибридизацию вступают одна s-орбиталь и две p-орбитали. Одна p-орбиталь не гибридизуется:
Три sp2-гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому три sp2-гибридные орбитали атома углерода направлены в пространстве под углом 120о друг к другу, что соответствует плоскому строению (треугольник).
При этом негибридная р-орбиталь располагается перпендикулярно плоскости, в которой расположены три гибридные sp2— орбитали.
Изображение с портала orgchem.ru
Например, молекула этилена C2H4 имеет плоское строение. Сигма-связь между атомами углерода образуется за счет перекрывания sp2-гибридных орбиталей. Пи-связь между атомами углерода образуется за счет перекрывания негибридных р-орбиталей.
Модель молекулы этилена:
sp-Гибридизация
В sp-гибридизацию вступают одна s-орбиталь и одна p-орбиталь. Две p-орбитали не вступают в гибридизацию:
Две sp-гибридные орбитали атома углерода направлены в пространстве под углом 180о друг к другу, что соответствует линейному строению.
Изображение с портала orgchem.ru
При этом две р-орбитали располагаются перпендикулярно друг другу и перпендикулярно линии, на которой расположены гибридные орбитали.
Например, молекула ацетилена имеет линейное строение.
Изомерия
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5оС, а изобутана –11,4оС.
Виды изомерии
Различают два основных вида изомерии: структурную и пространственную (стереоизомерию).
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
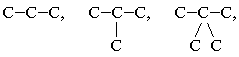
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.1. Изомерия положения функциональной группы. Например, существует два изомерных предельных спирта с общей формулой С3Н8О: пропанол-1 (н-пропиловый спирт) пропанол-2 (изопропиловый спирт):
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия)
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла.
Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 оС, а транс-бутена-2 0,88оС.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Например, в молекуле бутена-1 CH2=CH-CH2-CH3 заместители у первого атома углерода при двойной связи (два атома водорода) одинаковые, и цис—транс-изомеры бутен-1 не образует. А вот в молекуле бутена-2 CH3—CH=CH-CH3 заместители у каждого атома углерода при двойной связи разные (атом водорода и метильная группа CH3), поэтому бутен-2 образует цис— и транс-изомеры.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Классификация органических соединений
Классификацию органических веществ определяют строение углеродной цепи (углеродного скелета) и наличие и особенности строения функциональных групп.
Углеродный скелет – это последовательность соединенных между собой атомов углерода в органической молекуле.
Функциональная группа – это атом или группа атомов, которая определяет принадлежность молекулы к определенному классу органических веществ и химические свойства, соответствующие данному классу веществ.
|
Классификация органических веществ по составу |
||
| Углеводороды | Кислородсодержащие вещества | Азотсодержащие вещества |
| Состоят из атомов углерода и водорода | Содержат также атомы кислорода | Содержат также атомы азота |
Углеводороды
Углеводороды– это вещества, состав которых отражается формулой СхНу, то есть в их составе только атомы углерода и водорода.
В зависимости от типа связей между атомами С, они делятся на предельные или насыщенные (все связи одинарные) и непредельные (ненасыщенные) — в молекуле присутствуют двойные и тройные связи.
Кроме того, углеводороды делятся на циклические (углеродная цепь образует кольцо) и ациклические или алифатические (углеродная цепь не замкнута в кольцо).
| Углеводороды | |||||
| Предельные (содержат только одинарные связи) | Непредельные (содержат двойные или тройные связи между атомами углерода) | ||||
| Алканы | Циклоалканы | Алкены | Алкадиены | Алкины | Ароматические углеводороды |
| Углеводороды с открытой (незамкнутой) углеродной цепью | Атомы углерода соединены в замкнутый цикл | Одна двойная связь | Две двойные связи | Одна тройная связь | Циклические углеводороды с тремя двойными связями (бензольное кольцо) |
| CnH2n+2 | CnH2n | CnH2n | CnH2n-2 | CnH2n-2 | CnH2n-6 |
| Этан
CH3-CH3 |
Циклобутан
|
Этилен
CH2=CH2 |
Дивинил
CH2=CН-СН=СH2 |
Ацетилен
СН≡СН |
Бензол
|
| Ациклические углеводороды | |
| С неразветвленной цепью | С разветвленной углеродной цепью |
| н-Бутан
CH3-CH2-CH2-CH3 |
Изобутан
|
Кислородсодержащие органические вещества
Так как кислород имеет валентность II, он может образовать либо 2 одинарные связи, либо одну двойную. Соответственно, в органической молекуле он соединяется с водородом и углеродом.
- группа –О-Н (гидроксильная)
- группа >С=О (карбонильная)
- группа –СОО- (карбоксильная)
|
Кислородсодержащие органические вещества |
|||||
| Группа ОН | Группа С=О | Группа -СОО- | |||
| Гидроксил | Карбонил | Карбоксил | |||
| Спирт | Фенол | Альдегид | Кетон | Карбоновая кислота | Сложный эфир |
| R-OH |  |
 |
 |
 |
|
| Метанол
CH3-OH |
Фенол
|
Ацетальдегид
|
Пропанон
|
Уксусная кислота
|
Метилацетат
|
Азотсодержащие органические вещества
Азотсодержащие вещества можно также разделить на классы по наличию определенных функциональных групп.
- амины – содержат группы –NН2, –NH–, либо -N< ,
- нитрилы (группа –СºN),
- азотистые гетероциклы.
Некоторые органические вещества содержат и азот, и кислород.
К ним относятся:
- нитросоединения –NO2
- амиды –CONH2,
- аминокислоты – полифункциональные соединения, которые содержат и карбоксильную группу –COOH, и аминогруппу –NH2
| Азотсодержащие вещества | |||||
| Амины | Нитрилы | Нитросоединения | Амиды | Аминокислоты | Гетероциклы |
| -NH2
-NH- -N< |
-C≡N | R-NO2 | R-C(NH2)=O | -NH2, -COOH | |
| Метиламин
CH3-NH2 |
Нитрил уксусной кислоты
CH3-C≡N |
Нитрометан
CH3-NO2 |
Амид уксусной кислоты
CH3-C(NH2)=O |
Аминоуксусная кислота
CH2(NH2)-COOH |
Пиррол
|
Другие органические вещества
Органические соединения очень многочисленны и разнообразны.
К важным классам органических соединений также относятся галогенопроизводные органические вещества R–Hal ,которые содержат также атомы галогенов (хлора, фтора, брома и др.).
В состав органических соединений также могут входить несколько одинаковых или различных функциональных групп.
Гомологи. Гомологический ряд
Органические вещества разных классов тесно взаимосвязаны.
Соединения, содержащие одинаковые функциональные свойства, проявляют схожие химические и физические свойства.
Вещества, которые содержат одинаковые функциональные группы, имеют сходное строение, но отличаются друг от друга на одну или несколько групп –СH2–, образуют гомологический ряд.
Гомологи – это вещества, которые входят в один и тот же гомологический ряд.
Группу –СH2– называют гомологической разностью.
Органическая химия – это наука о соединениях углерода. Мистер Углерод будет проводником по этому пособию.
Углеводороды – органические соединения, состоящие из атомов двух элементов – у……. и в……. .
Многообразие органических соединений обусловлено способностью атомов С образовывать ц… , т.е. соединяться друг с другом. Углеродные цепи бывают л……. , р………… и ц………. .
|
|
Мистер Углерод |
Линейные цепи – такие, в которых все атомы С располагаются на одной линии (прямой, ломаной или закрученной). Если атомы С обозначать точками, а химические связи между атомами черточками, то линейные цепи выглядят так:
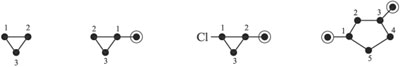
Разветвленные цепи – такие, в которых некоторые атомы С не попадают на непрерывную линию, соединяющую наибольшее число углеродных атомов молекулы. Самую длинную цепь из атомов С называют г…… у……… ц….. . Чтобы выделить главную углеродную цепь, ее атомы С нумеруют. Атомы и группы атомов, не входящие в главную цепь (в том числе гетероатомы* для производных углеводородов), связанные с главной цепью атомов С, называют з………… .
В условной сокращенной записи разветвленных цепей атомы углерода – заместители – будем показывать точками в кружочке, а гетероатомы – химическими символами.
Примеры разветвленных углеродных цепей:
Циклические цепи (циклы) содержат 3, 4, 5, 6 и большее число атомов С, замкнутых в кольцо. Главной цепью в циклических соединениях служат атомы углерода цикла, причем их счет начинают от более сложного заместителя, входящего в цепь.
Примеры циклических цепей:
Группы звезд на небе тоже можно представить как цепи разных видов:
|
|
Небесные созвездия |
Задание 1. Запишите по одному примеру углеродных цепей трех видов: линейной, разветвленной, циклической, – каждая из которых включала бы семь атомов С.
Задание 2. В ряду химических символов подчеркните гетероатомы: Н, Li, С, N, O, F, Cl.
Углеводороды линейного и разветвленного строения, все связи между атомами углерода в которых одинарные (насыщенные или предельные):
имеют название «а…..».
Общая формула алканов – СnH2n+2, где n = 1, 2, 3, 4 и т. д. (любое целое число). Например, если в молекуле предельного углеводорода три атома углерода (n = 3), то число атомов водорода будет восемь (2n + 2 = 2•3 + 2 = 8), молекулярная формула этого вещества – С3Н8. Для алканов с пятью и пятьюдесятью атомами С молекулярные формулы – С5Н… и С50Н… .
Алканы, имеющие циклическое строение (содержащие в составе молекулы цикл), называют ц………… . Общая формула циклоалканов – СnH2n. Так, для циклических углеводородов, содержащих пять атомов С, молекулярная формула будет С5Н10. Для циклических цепей состава С5Н10, у которых при атомах углерода (валентность С – IV) указано необходимое число атомов H, формулы имеют вид:
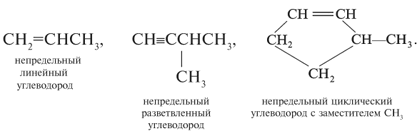
Известны непредельные углеводороды. В них имеются углерод-углеродные связи двойные (С=С) или тройные (СС) обычно наряду с одинарными (С–С) связями:
Интересно, что при единичном углероде может быть четыре гетероатомных заместителя (структура А), при краевых атомах С углеродной цепи – до трех гетероатомных заместителей (структуры Б1–Б3), а при внутренних атомах цепи – один или два заместителя (структуры В1, В2):
* Гетероатомами в органической химии называют все атомы, отличные от С и Н, например, гетероатомы – F, Cl, Вr, N, О и т. д.
Урок 2. Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому при записи структурных формул от углерода должно отходить четыре черточки, изображающие химические связи.
Форму записи состава органической молекулы, в которой каждый атом C показан отдельно со связями, называют с………. ф…….. . Химически связанные атомы углерода представляют углеродный скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы углеводорода – это когда каждый атом молекулы показан отдельно:
Такая запись громоздкая, занимает много места и используется редко.
2. Форма записи, в которой указывают общее число атомов водорода при каждом атоме С, а между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой черточки между атомами, расположенными в записи на одной строке, не указывают, тогда как атомы, выходящие на другие строки, соединяют черточками с прямой цепью:
Иногда углеродные цепи изображают ломаными линиями, геометрическими фигурами (треугольник, квадрат, куб). При этом в каждом изломе цепи, а также в начале и в конце цепи подразумевают атом С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных предельных углеводородов и формы их записи (табл. 1).
Таблица 1
Названия предельных углеводородов (алканов) линейного строения
|
Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|
Метан |
СН4 |
СН4 |
Газ |
–161,6 |
|
Этан |
С2Н6 |
СН3СН3 |
Газ |
–88,6 |
|
Пропан |
С3Н8 |
СН3СН2СН3 |
Газ |
–42,1 |
|
Бутан |
С4Н10 |
СН3СН2СН2СН3 |
Газ |
–0,5 |
|
Пентан |
С5Н12 |
СН3(СН2)3СН3 |
Жидкость |
36,1 |
|
Гексан |
С6Н14 |
СН3(СН2)4СН3 |
Жидкость |
68,7 |
|
Гептан |
С7Н16 |
СН3(СН2)5СН3 |
Жидкость |
98,5 |
|
Октан |
С8Н18 |
СН3(СН2)6СН3 |
Жидкость |
125,6 |
|
Нонан |
С9Н20 |
СН3(СН2)7СН3 |
Жидкость |
150,7 |
|
Декан |
С10Н22 |
СН3(СН2)8СН3 |
Жидкость |
174,0 |
Составление названий разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и нумеруют ее таким образом (слева или справа), чтобы входящие заместители получили наименьшие номера.
2. Название начинают с цифрового локанта – номера углерода, при котором находится заместитель. После цифры через черточку пишут название заместителя. Разные заместители указывают последовательно. Если одинаковые заместители повторяются два раза, то в названии после цифровых локантов, указывающих положение этих заместителей, пишут приставку «ди». Соответственно при трех одинаковых заместителях приставка «три», при четырех – «тетра», при пяти заместителях – «пента» и т. д.
Названия заместителей
|
СН3– |
С2Н5– |
СН3СН2СН2– |
|
Сl– |
F– |
Br– |
–NO2 |
|
метил |
этил |
пропил |
изопропил |
хлор |
фтор |
бром |
нитро |
Примеры:
3. Слитно с приставкой и заместителем пишут название углеводорода, пронумерованного в качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в) 2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично, только к названию углеводорода – по числу атомов углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся на одну или несколько групп –СН2–, известны как г……. .
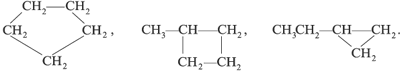
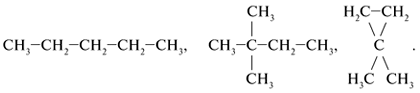
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3, СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего примера – в каждом случае при втором атоме С главной углеродной цепи находится одинаковый заместитель – группа СН3.
Упражнения.
1. Укажите, к каким классам могут принадлежать следующие соединения (алканы подчеркните одной чертой, циклоалканы – двумя):
С5Н8, С4Н8, С4Н10, С5Н12, С3Н4, С3Н8, С4Н6, С6Н12, С7Н16, С6Н6.
2. Составьте структурные формулы углеводородов, содержащих семь атомов С в молекуле:
а) линейного строения; б) с разветвленной цепью; в) с цепью, включающей цикл.
3. Выберите гомологи из следующих веществ (выделите одинаковым образом). Поясните, в чем их сходство и различие:
СН3Сl, СН3СН2СН3, СН3СН2СН2СН3,
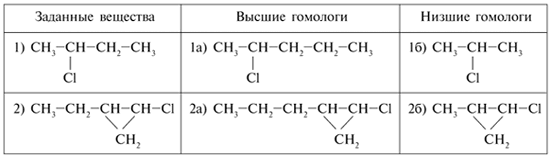
4. Составьте структурные формулы: а) более высшего гомолога (+СН2); б) более низшего гомолога – для следующих веществ:
5. Выберите главные цепи атомов углерода, пронумеруйте их и соотнесите названия (приведены ниже) со структурой следующих соединений:
а) 1-Бром-2-метилциклопропан; б) 1-бром-3-метилбутан; в) н-октан; г) 2-бромбутан.
6. Назовите соединения по их структурным формулам:
7. По химическим названиям составьте структурные формулы веществ:
а) нормальный гептан; б) 2-метилгексан; в) 2,3-диметилпентан; г) 2-хлор-2,3-диметилбутан.
Ответы и решения
заданий и упражнений к теме 1
Урок 1
1.
Урок 2
1. Принадлежность соединений к классам углеводородов определяем по их соответствию общим формулам – алканы СnH2n+2, циклоалканы :
2.
3. Гомологи:
а) СН3Сl и СН3СН2Сl; сходство состоит в том, что оба вещества – хлорзамещенные углеводороды, причем атом хлора находится у крайнего атома С, т.е. на конце цепи, а различие этих веществ в одном – на группу СН2 больше;
б) СН3СН2СН3 и СН3СН2СН2СН3; сходство – это линейные углеводороды, они различаются на группу СН2;
сходство – оба вещества содержат
трехуглеродное кольцо, а различаются на две группы СН2.
4.
РАБОЧИЕ ТЕТРАДИ
Предисловие
«Практическое пособие по химии. 10 класс»
предназначено для изучения химии в 10-м классе
средней школы по одному из современных
учебников, например, по книге Э.Е.Нифантьева и
Л.А.Цветкова «Химия 10–11». Настоящее пособие
представляет собой третью книгу практических
разработок по четырехгодичному курсу химии.
При несомненной связи с неорганической химией,
изучаемой в 8-м и 9-м классах, органическая химия
(10-й класс) по существу самостоятельный предмет. У
нее свой язык, специфическая терминология,
повторяющийся циклический характер подачи
материала о соединениях разных классов.
Например, порядок изучения алканов следующий:
состав соединений, их строение, изомерия,
названия, реакции получения и химических
превращений, применение и расчетные задачи.
Такой же порядок используется при рассмотрении
последующих классов органических соединений –
алкенов, спиртов и т. д.
По своей сути «Практическое пособие» является
лаконичным и доступным изложением курса
органической химии за 10-й класс по двум темам:
«Углеводороды» (14 уроков) и «Кислородсодержащие
соединения» (22 урока). После каждой темы следует
тестовая контрольная работа. Итоговая проверка
знаний по курсу органической химии базового
уровня образования также предложена в форме
тестов (31 вопрос).
Каждый урок этого пособия начинается кратким
изложением теоретических основ конкретного
вопроса. Рассмотрены типичные примеры,
иллюстрирующие материал, подходы к решению
задач. Урок заканчивается упражнениями (6–8
вопросов), контролирующими умения и навыки
учащихся. Ответы на многие задания, в том числе
решения расчетных и сложных задач, также
приведены в пособии. Первые уроки (№ 1–3, 7–12)
включают понятия органической химии, вводимые в
9-м классе. Эти уроки составлены в форме
химического диктанта. В диктанте названия
ключевых терминов обозначены только первыми
буквами и далее точками. Такие термины учащиеся
вписывают самостоятельно.
Пособие рассчитано на школьников с разным
уровнем подготовки. Одни сумеют воспроизвести
рассмотренные примеры, другие справятся с
предложенными заданиями и аналогичными
вопросами из других источников. В результате
такой формы работы учащиеся получают
необходимые теоретические и практические
сведения, которые позволяют им ориентироваться в
главных закономерностях органической химии.
Это «Практическое пособие» поможет учащимся в
изучении химии. Оно будет полезно учителям при
организации учебного процесса и абитуриентам
при подготовке к экзаменам в вуз.
СОДЕРЖАНИЕ
Тема 1. Углеводороды.
Урок 1. Строение органических соединений.
Урок 2. Структурные формулы и названия предельных
углеводородов.
Урок 3. Изомерия предельных углеводородов.
Урок 4. Ковалентные связи органических
соединений.
Урок 5. Гибридизация атомных орбиталей углерода.
Урок 6. Классификация реакций в органической
химии.
Урок 7. Химические свойства алканов.
Урок 8. Непредельные углеводороды.
Урок 9. Химические свойства алкенов.
Урок 10. Получение и применение алкенов.
Урок 11. Диены. Природный каучук.
Урок 12. Ацетилен и его гомологи.
Урок 13. Ароматические углеводороды (арены).
Урок 14. Получение, химические свойства и
применение бензола.
Урок 15. Контрольная работа № 1 (тесты) по теме 1
«Углеводороды».
Тема 2. Кислородсодержащие соединения.
Урок 16. Одноатомные предельные спирты.
Урок 17. Получение спиртов.
Урок 18. Химические свойства спиртов.
Урок 19. Применение спиртов. Цепочки химических
превращений с участием спиртов.
Урок 20. Многоатомные спирты.
Урок 21. Фенолы.
Урок 22. Задачи по теме «Спирты и фенолы».
Урок 23. Альдегиды.
Урок 24. Химические свойства и применение
альдегидов.
Урок 25. Кетоны.
Урок 26. Карбоновые кислоты.
Урок 27. Химические свойства карбоновых кислот.
Урок 28. Распознавание кислородсодержащих
веществ.
Урок 29. Сложные эфиры и другие производные
карбоновых кислот.
Урок 30. Происхождение и применение карбоновых
кислот и сложных эфиров.
Урок 31. Генетическая связь углеводородов, их
галогенопроизводных и кислородсодержащих
соединений.
Урок 32. Жиры.
Урок 33. Углеводы.
Урок 34. Циклические формы моносахаридов.
Урок 35. Дисахариды и олигосахариды.
Урок 36. Полисахариды.
Урок 37. Химические свойства углеводов.
Урок 38. Контрольная работа № 2 (тесты) по теме
«Кислородсодержащие соединения».
Урок 39. Итоговая работа «Вся органическая химия».
Словарь терминов
Нам не дано предугадать,
как слово наше в сердце отзовется.
Р.Казакова
Тема 1. Углеводороды
Урок 1. Строение органических
соединений
Органическая химия – это наука о соединениях
углерода. Мистер Углерод будет проводником по
этому пособию.
Углеводороды – органические соединения,
состоящие из атомов двух элементов – у……. и
в……. .
Многообразие органических соединений
обусловлено способностью атомов С образовывать
ц… , т.е. соединяться друг с другом. Углеродные
цепи бывают л……. , р………… и ц………. .
 |
Мистер Углерод |
Линейные цепи – такие, в которых
все атомы С располагаются на одной линии (прямой,
ломаной или закрученной). Если атомы С обозначать
точками, а химические связи между атомами
черточками, то линейные цепи выглядят так:
Разветвленные цепи – такие, в которых
некоторые атомы С не попадают на непрерывную
линию, соединяющую наибольшее число углеродных
атомов молекулы. Самую длинную цепь из атомов С
называют г…… у……… ц….. . Чтобы выделить главную
углеродную цепь, ее атомы С нумеруют. Атомы и
группы атомов, не входящие в главную цепь (в том
числе гетероатомы* для производных
углеводородов), связанные с главной цепью атомов
С, называют з………… .
В условной сокращенной записи разветвленных
цепей атомы углерода – заместители – будем
показывать точками в кружочке, а гетероатомы –
химическими символами.
Примеры разветвленных углеродных цепей:
Циклические цепи (циклы) содержат 3, 4, 5, 6 и
большее число атомов С, замкнутых в кольцо.
Главной цепью в циклических соединениях служат
атомы углерода цикла, причем их счет начинают от
более сложного заместителя, входящего в цепь.
Примеры циклических цепей:
Группы звезд на небе тоже можно представить как
цепи разных видов:
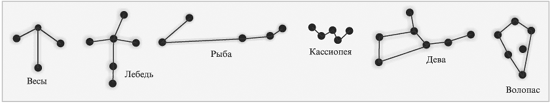 |
Небесные созвездия |
Задание 1. Запишите по
одному примеру углеродных цепей трех видов:
линейной, разветвленной, циклической, – каждая
из которых включала бы семь атомов С.
Задание 2. В ряду химических
символов подчеркните гетероатомы: Н, Li, С, N, O, F,
Cl.
Углеводороды линейного и разветвленного
строения, все связи между атомами углерода в
которых одинарные (насыщенные или предельные):
имеют название «а…..».
Общая формула алканов – СnH2n+2,
где n = 1, 2, 3, 4 и т. д. (любое целое число).
Например, если в молекуле предельного
углеводорода три атома углерода (n = 3), то
число атомов водорода будет восемь (2n + 2 = 2•3 +
2 = 8), молекулярная формула этого вещества – С3Н8.
Для алканов с пятью и пятьюдесятью атомами С
молекулярные формулы – С5Н… и С50Н…
.
Алканы, имеющие циклическое строение
(содержащие в составе молекулы цикл), называют
ц………… . Общая формула циклоалканов –
СnH2n. Так, для циклических
углеводородов, содержащих пять атомов С,
молекулярная формула будет С5Н10. Для
циклических цепей состава С5Н10, у
которых при атомах углерода (валентность С – IV)
указано необходимое число атомов H, формулы имеют
вид:
Известны непредельные углеводороды. В
них имеются углерод-углеродные связи двойные
(С=С) или тройные (СС) обычно
наряду с одинарными (С–С) связями:
Интересно, что при единичном углероде может
быть четыре гетероатомных заместителя
(структура А), при краевых атомах С углеродной
цепи – до трех гетероатомных заместителей
(структуры Б1–Б3), а при внутренних
атомах цепи – один или два заместителя
(структуры В1, В2):
* Гетероатомами в органической химии
называют все атомы, отличные от С и Н, например,
гетероатомы – F, Cl, Вr, N, О и т. д.
Урок 2. Структурные формулы и названия
предельных углеводородов
Валентность углерода равна … (цифра). Поэтому
при записи структурных формул от углерода должно
отходить четыре черточки, изображающие
химические связи.
Форму записи состава органической молекулы, в
которой каждый атом C показан отдельно со
связями, называют с………. ф…….. . Химически
связанные атомы углерода представляют углеродный
скелет молекулы вещества.
Три разновидности структурных формул
1. Самая полная форма записи формулы
углеводорода – это когда каждый атом молекулы
показан отдельно:
Такая запись громоздкая, занимает много места и
используется редко.
2. Форма записи, в которой указывают
общее число атомов водорода при каждом атоме С, а
между соседними углеродами ставят черточки,
означающие х……… с…. :
СН3–СН2–СН3, Сl–СН2–СН2–Br.
3. Структурная формула, в которой
черточки между атомами, расположенными в записи
на одной строке, не указывают, тогда как атомы,
выходящие на другие строки, соединяют черточками
с прямой цепью:
Иногда углеродные цепи изображают ломаными
линиями, геометрическими фигурами (треугольник,
квадрат, куб). При этом в каждом изломе цепи, а
также в начале и в конце цепи подразумевают атом
С. Например, изображениям
соответствуют структурные формулы
Ниже приведены некоторые свойства отдельных
предельных углеводородов и формы их записи (табл.
1).
Таблица 1
Названия предельных углеводородов
(алканов) линейного строения
| Название алкана |
Молекулярная формула |
Структурная формула |
Агрегатное состояние |
Температура кипения, °С |
|---|---|---|---|---|
| Метан | СН4 | СН4 | Газ | –161,6 |
| Этан | С2Н6 | СН3СН3 | Газ | –88,6 |
| Пропан | С3Н8 | СН3СН2СН3 | Газ | –42,1 |
| Бутан | С4Н10 | СН3СН2СН2СН3 | Газ | –0,5 |
| Пентан | С5Н12 | СН3(СН2)3СН3 | Жидкость | 36,1 |
| Гексан | С6Н14 | СН3(СН2)4СН3 | Жидкость | 68,7 |
| Гептан | С7Н16 | СН3(СН2)5СН3 | Жидкость | 98,5 |
| Октан | С8Н18 | СН3(СН2)6СН3 | Жидкость | 125,6 |
| Нонан | С9Н20 | СН3(СН2)7СН3 | Жидкость | 150,7 |
| Декан | С10Н22 | СН3(СН2)8СН3 | Жидкость | 174,0 |
Составление названий
разветвленных и замещенных алканов
1. Выбирают главную углеродную цепь и
нумеруют ее таким образом (слева или справа),
чтобы входящие заместители получили наименьшие
номера.
2. Название начинают с цифрового
локанта – номера углерода, при котором находится
заместитель. После цифры через черточку пишут
название заместителя. Разные заместители
указывают последовательно. Если одинаковые
заместители повторяются два раза, то в названии
после цифровых локантов, указывающих положение
этих заместителей, пишут приставку «ди».
Соответственно при трех одинаковых заместителях
приставка «три», при четырех – «тетра», при пяти
заместителях – «пента» и т. д.
Названия заместителей
| СН3– | С2Н5– | СН3СН2СН2– | Сl– | F– | Br– | –NO2 | |
| метил | этил | пропил | изопропил | хлор | фтор | бром | нитро |
Примеры:
3. Слитно с приставкой и заместителем
пишут название углеводорода, пронумерованного в
качестве главной углеродной цепи:
а) 2-метилбутан; б) 2,3-диметилпентан; в)
2-хлор-4-метилпентан.
Названия циклоалканов составляют аналогично,
только к названию углеводорода – по числу атомов
углерода в цикле – добавляют приставку «цикло»:
Вещества, сходные по строению, но различающиеся
на одну или несколько групп –СН2–,
известны как г……. .
Примеры гомологов:
СН3–СН3, СН3–СН2–СН3,
СН3–СН2–СН2–СН3.
Элемент сходства – алканы с линейной цепью:
Cходство трех формул веществ последнего
примера – в каждом случае при втором атоме С
главной углеродной цепи находится одинаковый
заместитель – группа СН3.
Упражнения.
1. Укажите, к каким классам могут
принадлежать следующие соединения (алканы
подчеркните одной чертой, циклоалканы – двумя):
С5Н8, С4Н8, С4Н10,
С5Н12, С3Н4, С3Н8,
С4Н6, С6Н12, С7Н16,
С6Н6.
2. Составьте структурные формулы
углеводородов, содержащих семь атомов С в
молекуле:
а) линейного строения; б) с разветвленной цепью; в)
с цепью, включающей цикл.
3. Выберите гомологи из следующих
веществ (выделите одинаковым образом). Поясните,
в чем их сходство и различие:
СН3Сl, СН3СН2СН3,
СН3СН2СН2СН3,
4. Составьте структурные формулы: а)
более высшего гомолога (+СН2); б) более
низшего гомолога – для следующих веществ:
5. Выберите главные цепи атомов
углерода, пронумеруйте их и соотнесите названия
(приведены ниже) со структурой следующих
соединений:
а) 1-Бром-2-метилциклопропан; б)
1-бром-3-метилбутан; в) н-октан; г) 2-бромбутан.
6. Назовите соединения по их структурным
формулам:
7. По химическим названиям составьте
структурные формулы веществ:
а) нормальный гептан; б) 2-метилгексан; в)
2,3-диметилпентан; г) 2-хлор-2,3-диметилбутан.
Ответы и решения
заданий и упражнений к теме 1
Урок 1
1.
Урок 2
1. Принадлежность соединений к классам
углеводородов определяем по их соответствию
общим формулам – алканы СnH2n+2,
циклоалканы :
2.
3. Гомологи:
а) СН3Сl и СН3СН2Сl; сходство
состоит в том, что оба вещества – хлорзамещенные
углеводороды, причем атом хлора находится у
крайнего атома С, т.е. на конце цепи, а различие
этих веществ в одном – на группу СН2 больше;
б) СН3СН2СН3 и СН3СН2СН2СН3;
сходство – это линейные углеводороды, они
различаются на группу СН2;
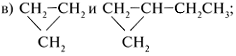
вещества содержат
трехуглеродное кольцо, а различаются на две
группы СН2.
4.