|
Главная › СульфатыСульфаты – соли серной кислоты; соединения состоящие из сульфат-аниона SO42- и катиона металла. Ниже представлен перечень некоторых солей серной кислоты.
Другие соединения, содержащие сульфат-ион.
|
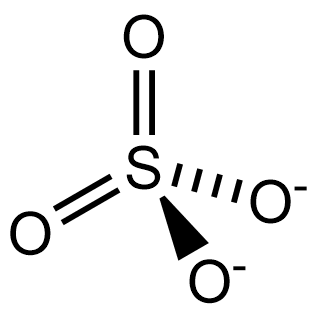
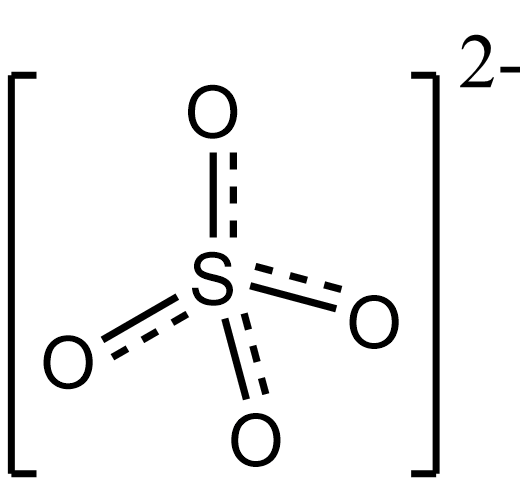
Сульфат-ион:
|
Информация о статье: Обновлено: Создано: 27.09.2015 22:27 Просмотров: 11897 Оценка информации: 5.0 з 5 Количество голосов – 1
|
Физические свойства
Сульфат натрия — соль щелочного металла натрия и серной кислоты. Белый. Плавится и кипит без разложения. Хорошо растворяется в воде (гидролиз не идет).
Относительная молекулярная масса Mr = 142,04; относительная плотность для тв. и ж. состояния d = 2,66; tпл = 884º C; tкип = 1430º C.
Способ получения
1. В результате взаимодействия разбавленной серной кислоты и гидроксида натрия образуется сульфат натрия и вода:
2NaOH + H2SO4 = Na2SO4 + H2O
2. При температуре 450–800º C гидросульфат натрия реагирует с хлоридом натрия. В результате реакции образуется сульфат натрия и хлороводородная кислота:
NaHSO4 + NaCl = Na2SO4 + HCl
3. В состоянии кипения в результате реакции между твердым хлоридом натрия и концентрированной серной кислотой происходит образование сульфата натрия и газа хлороводорода:
2NaCl + H2SO4 = Na2SO4 + 2HCl↑
4. Твердый сульфид натрия и кислород взаимодействуют при температуре выше 400º C с образованием сульфата натрия:
Na2S + 2O2 = Na2SO4
5. При взаимодействии концентрированного раствора пероксида водорода и сульфида натрия образуется сульфат натрия и вода:
Na2S + 4H2O2 = Na2SO4 + 4H2O
Качественная реакция
Качественная реакция на сульфат натрия — взаимодействие его с хлоридом бария, в результате реакции происходит образование белого осадка , который не растворим в азотной кислоте:
1. При взаимодействии с хлоридом бария, сульфат натрия образует сульфат бария и хлорид натрия:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Химические свойства
1. Сульфат натрия может реагировать с простыми веществами:
1.1. Сульфат натрия реагирует со фтором при температуре 100–150º C. При этом образуются фторид натрия, сульфурилфторид и кислород:
Na2SO4 + 2F2 = 2NaF + SO2F2 + O2
1.2. С водородом сульфат натрия реагирует при температуре 550–600º C, в присутствии катализатора Fe2O3 с образованием сульфида натрия и воды:
Na2SO4 + 4H2 = Na2S + 4H2O
2. Сульфат натрия вступает в реакцию со многими сложными веществами:
2.1. Сульфат натрия реагирует с гидроксидом бария с образованием гидроксида натрия и сульфата бария:
Na2SO4 + Ba(OH)2 = BaSO4↓ + 2NaOH
2.2. При взаимодействии с концентрированной серной кислотой твердый сульфат натрия образует гидросульфат натрия:
Na2SO4 + H2SO4 = 2NaHSO4
2.3. Сульфат натрия реагирует с оксидом серы (VI). Взаимодействие сульфата натрия с оксидом серы (VI) приводит к образованию пиросульфата натрия:
Na2SO4 + SO3 = Na2S2O7
2.4. Сульфат натрия взаимодействует с хлоридом бария. При этом образуются хлорид натрия и сульфат бария:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Как получить сульфат натрия
Сульфат натрия (другое название – натрий сернокислый) имеет химическую формулу Na2SO4. Представляет собою бесцветное кристаллическое вещество. Широко распространен в природе, главным образом, в виде «глауберовой соли» – кристаллогидрата, в котором одна молекула натрия сернокислого удерживает десять молекул воды. Пожаро- и взрывобезопасен. Как получают сульфат натрия?

Инструкция
Поскольку сульфат натрия – это соль, образованная сильным основанием NaOH и сильной кислотой H2SO4, ее раствор имеет показатель рН, близкий к нейтральному. То есть индикаторы типа лакмуса и фенолфталеина в растворе этой соли не меняют цвет.
Основное количество этого вещества добывается открытым способом, в местах, где имеются большие залежи глауберовой соли и других подобных минералов.
Также существует промышленный способ – взаимодействие серной кислоты с хлоридом натрия при высоких температурах (порядка 550 градусов). Реакция идет следующим образом:
2NaCl + H2SO4 = Na2SO4 + 2HCl
Натрий сернокислый также может быть получен при переработке т.н. «фосфогипса» – отходов производства фосфорных удобрений, содержащих сульфат кальция – CaSO4.
В лабораторных условиях, можно получить сульфат натрия, воздействуя серной кислотой на соду кальцинированную (натрий углекислый). Реакция идет до конца, поскольку в результате образуется слабая угольная кислота, которая сразу же разлагается на воду и углекислый газ:
H2SO4 + Na2CO3 = Na2SO4 + H2CO3
H2CO3 = H2O + CO2
Можно получить сульфат натрия также с помощью реакции нейтрализации (взаимодействием едкого натра с серной кислотой):
2NaOH + H2SO4 = Na2SO4 + 2H2O
Полезный совет
Сульфат натрия используется во многих отраслях промышленности. Главным образом, при производстве моющих средств (как один из компонентов), а также при производстве стекла. Натрий сернокислый также находит применение в целлюлозно-бумажной промышленности, при производстве текстиля, обработке кожи и т.д. В лабораторном деле сульфат натрия широко используется для осушения органических растворителей. Может применяться также в пищевой промышленности, как добавка, код по международной номенклатуре – Е514. До сих пор находит ограниченное применение в медицине и ветеринарии.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Какие бывают сульфаты, как образуются?

Сульфаты представляют собой сырье в виде кристаллического порошка. По сути – это сернокислые соли полученные в результате реакции серной кислоты. Поэтому их называют: магний сернокислый, цинк сернокислый, марганец сернокислый, железо сернокислое, медь сернокислая.

Как правило, все соли этой группы имеют светлый оттенок, определенную степень твердости, а многие из них прекрасно растворимы в водной среде.
Основная группа обладает осадочным происхождением. К примеру, это химически выявленные морские осадки. Львиная доля – это минеральное сырье после окисления.
Сульфаты
В научных кругах известны как продукты, которые можно получить в результате вулканической деятельности (натуральные).
Также они могут быть не только на основе реакции серной кислоты, но также водными, безводными. Различают варианты сложных, когда к комплексу [SO4]2 добавляется пара анионов (ОН).

Где можно встретить сульфаты?
Это природная составляющая, которая присутствует в самых разных уголках нашей планеты. Любые озерные и речные воды содержат. «Как они попадают в воду?», – спросите вы. Все достаточно просто, когда вода проходит через пласты земли в виде дождя (из воздуха вода забирает частички, образовавшиеся в результате распада оксида серы) и потом попадает в родники, которые в свою очередь образуют реки. То на своем пути она может встретить гипс, который при размывании даёт определенное количество.
В промышленных сточных водах продукт может оказаться в нескольких случаях: 1. На предприятии используются непосредственно сырьевые добавки на основе сульфатов. 2. В производстве используется оксид серы, который при окислении дает искомые вещества. 3. На предприятии используются добавки для изготовления удобрений.
На человека содержание рассматриваемых веществ не производит влияния. Но вот вкус воды меняется из-за присутствия таковых добавок из списка ниже (вкус ощутим при концентрации от 300 – 400 миллиграмм на литр), поэтому желательно дополнительно очищать воду, при использовании в пище – фильтрами на основе многоуровневой очистки.
При смешивании вод с разными составами могут возникать белые налеты на трубопроводах, кранах и в самом чайнике при кипячении.
Как проверить концентрацию анионов?
Для этого берется в качестве основного компонента сульфат бария и в зависимости от того, сколько его получится в супензии (при разведении с водой), можно узнать количество анионов. Применяется способ турбидиметричности. Критерии определения: плотность, высота суспензионного столба, прозрачность. Также для анализа потребуется максимально очищенная вода и мутномер. Прибор можно изготовить самостоятельно.

Какой уровень ПДК допустим в водохранилищах
И естественных водоемах. Если рассматривать водоемы, предназначенные для хозяйственно-питьевого характера, то ПДК составляет около 500 мг/л.
Сульфаты купить в Москве / приобрести с доставкой
Компания ООО ТПК осуществляет прямые поставки продукта в Москву и Московскую область.
Наши склады расположены в Тульской области. Это пара часов езды после погрузки
товара до вашего склада. Логисты просчитают максимально быстрый маршрут, и наш автотранспорт доставит все в срок. Поставка и покупки производятся с заводов
производителей, без посредников и третьих лиц.
Благодаря этому вы получаете
цену, которая не просто конкурентоспособна, она сэкономит ваш бюджет. Плюс вы
получаете постоянного поставщика в нашем лице (на рынке промышленной химии
более 14 лет).
Осуществляем импорт и экспорт любого вида промышленной химии по России, в СНГ и зарубежье.

Предлагаем вашему вниманию химическое сырье следующих вариантов:
Продажа сульфат натрия оптом – ознакомиться с сырьем более подробно.
Природный продукт, который применяется в качестве премиксов для комбикормов. Помогает птице и животным набрать необходимый вес за счет увеличения аппетита.
Также сырье используется в пищевой сфере и на производствах. Страна изготовитель: Турция и Китай.
Продажа сульфат цинка оптом (цинк сернокислый) – ссылка на карточку товара.
Применяется в качестве удобрения для сельхоз культур, а также в качестве добавки в медицинской сфере и химической. Производство – Китай. Мешки по 25 кг.
Продажа марганца сернокислого оптом – информация о продукте.
Используется в медицинской сфере, в качестве добавки для БАДов. Производство – Китай, прямые поставки. Фасовка – по 25 килограмм.
Продажа сульфат меди оптом (медный купорос) – где применяется, для чего используется.
Используется как удобрение. Производитель – Китай. Фасовки – мешки по 25 кг.
Продажа сульфат железа оптом (железный купорос) – всегда в наличии.
Производитель – Китай, Россия. Поставляется в мешках по 25 кг. А также возможны поставки в других вариантах (фасовка на заводе заранее оговаривается: 50 кг мешки или МКР).
Продажа магнезии оптом от производителя (магний сернокислый) – продукт в наличии.
Производство – Россия или Китай. Быстрая доставка. Почитать поподробнее о сырье.
Все вышеперечисленные позиции вы можете приобрести с сертификатами качества, изготовленные по ГОСТ и соответствующие нормам выпуска.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 ноября 2020 года; проверки требуют 6 правок.
Сульфа́ты — соли серной кислоты H2SO4, а также (в органической химии) полные эфиры серной кислоты (диалкилсульфаты R−O−SO2−O−R) и алкилсульфаты — соли алкилсерных кислот HSO3OR.
Классификация[править | править код]
Неорганические сульфаты являются ионными соединениями, содержат анион SO2−
4, образуют три ряда солей:
- нормальные, или средние соли (собственно сульфаты, например сульфат калия K2SO4);
- кислые соли (гидросульфаты, или бисульфаты, кроме катионов металла содержат катионы водорода H+, например гидросульфат натрия NaHSO4);
- осно́вные соли (содержат наряду с сульфат-анионом SO2−
4 группы ОН, например Cu3(OH)4SO4
Большинство неорганических сульфатов образуют кристаллы, средние и кислые сульфаты, как правило, растворимы в воде. Нерастворимыми являются сульфаты тяжёлых щёлочноземельных металлов (BaSO4, RaSO4), сульфаты лёгких щёлочноземельных металлов (CaSO4, SrSO4) и сульфат свинца плохо растворимы. Основные сульфаты обычно малорастворимы или нерастворимы либо гидролизуются.
Кристаллогидраты сульфатов некоторых металлов (железа, меди и др.) называют купоросами. Кристаллогидраты сульфатов двойных солей однозарядного и трёхзарядного катионов M+M3+(SO4)2−
2·12H2O называют квасцами (безводные — жжёными квасцами). Кристаллогидраты сульфатов двойных солей однозарядного и двухзарядного катионов M+
2M2+(SO4)2−
2·6H2O называют шенитами, или солями Туттона.
Средние сульфаты щелочных металлов термически устойчивы. Кислые сульфаты щелочных металлов при нагревании разлагаются с отщеплением воды, превращаясь в пиросульфаты (дисульфаты, соли дисерной кислоты):
Осно́вные сульфаты, а также кислые сульфаты металлов, не являющихся щелочными, при нагревании, как правило, разлагаются с отщеплением оксида серы (VI) SO3, образуя оксиды металлов.
Сульфаты широко распространены в природе, образуя целую группу минералов (см. сульфаты (минералы)), в частности гипс (дигидрат сульфата кальция), мирабилит (декагидрат сульфата натрия), ангидрит (безводный сульфат кальция), барит (сульфат бария), алунит (основный сульфат алюминия и калия) и др. Входят в состав морской воды и минеральных вод.
Качественная реакция на растворимые сульфаты — образование белого нерастворимого осадка сульфата бария при добавлении к раствору хлорида бария.
Используется также осаждение белого сульфата свинца(II) при добавлении к раствору ацетата свинца(II).
Примеры[править | править код]
- Сульфат димагния-дикалия
- Сульфат димарганца-дикалия
- Сульфат марганца-дикалия
- Сульфат мышьяка(III)
- Сульфат нептуния(IV)
- Сульфат плутония(III)
- Сульфат празеодима(III)-аммония
- Сульфат празеодима(III)-калия
- Сульфат цинка(II)-дикалия
- Сульфат натрия
См. также[править | править код]
- Сульфаты (минералы)
- Органические сульфаты
Литература[править | править код]
- Сульфаты неорганические // Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 551. — 792 с. — 100 000 экз..
- Сульфаты органические // Химический энциклопедический словарь / гл. ред. И. Л. Кнунянц. — М.: Советская энциклопедия, 1983. — С. 551. — 792 с. — 100 000 экз..
- Данилов В. П. Сульфаты неорганические // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные — Трипсин. — С. 456. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.