Квантовые числа электронов
Существует четыре квантовых числа электронов и о каждом из них – по порядку.
Главное квантовое число N характеризует энергетический уровень, другими словами это размер энергетического уровня,
чем больше число N – тем больше радиус, на котором находятся электроны.
Орбитальное квантовое число L обозначает форму той области, в которой может находится электрон, число L имеет
значения s (L=0),p (L=1), d (L=2),f (L=3) и также называется энергетической оболочкой или энергетическим подуровнем.
На каждой орбитали находится «2·L + 1» орбиталей, магнитное квантовое число Ml
обозначает орбиталь, на котором находится электрон. Ml может принимать значения ±L.
И последнее квантовое число – спин, он принимает два значения: +½ и -½, обозначающий соответственно
прямое и обратное вращение электрона.
Квантовые числа элемента, или квантовые числа электрона – это четыре квантовых числа, характеризующих состояние
внешнего электрона в атоме, ниже дана таблица квантовых чисел электронов любого атома:
1
H
водород
1s 1
N = 1 L = 0 Ml = 0 Ms = +½
2
He
гелий
1s 2
N = 1 L = 0 Ml = 0 Ms = -½
3
Li
литий
2s 1
N = 2 L = 0 Ml = 0 Ms = +½
4
Be
бериллий
2s 2
N = 2 L = 0 Ml = 0 Ms = -½
5
B
бор
2p 1
N = 2 L = 1 Ml = -1 Ms = +½
6
C
углерод
2p 2
N = 2 L = 1 Ml = 0 Ms = +½
7
N
азот
2p 3
N = 2 L = 1 Ml = 1 Ms = +½
8
O
кислород
2p 4
N = 2 L = 1 Ml = -1 Ms = -½
9
F
фтор
2p 5
N = 2 L = 1 Ml = 0 Ms = -½
10
Ne
неон
2p 6
N = 2 L = 1 Ml = 1 Ms = -½
11
Na
натрий
3s 1
N = 3 L = 0 Ml = 0 Ms = +½
12
Mg
магний
3s 2
N = 3 L = 0 Ml = 0 Ms = -½
13
Al
алюминий
3p 1
N = 3 L = 1 Ml = -1 Ms = +½
14
Si
кремний
3p 2
N = 3 L = 1 Ml = 0 Ms = +½
15
P
фосфор
3p 3
N = 3 L = 1 Ml = 1 Ms = +½
16
S
сера
3p 4
N = 3 L = 1 Ml = -1 Ms = -½
17
Cl
хлор
3p 5
N = 3 L = 1 Ml = 0 Ms = -½
18
Ar
аргон
3p 6
N = 3 L = 1 Ml = 1 Ms = -½
19
K
калий
4s 1
N = 4 L = 0 Ml = 0 Ms = +½
20
Ca
кальций
4s 2
N = 4 L = 0 Ml = 0 Ms = -½
21
Sc
скандий
3d 1
N = 3 L = 2 Ml = -2 Ms = +½
22
Ti
титан
3d 2
N = 3 L = 2 Ml = -1 Ms = +½
23
Vd
ванадий
3d 3
N = 3 L = 2 Ml = 0 Ms = +½
24
Cr
хром
3d 5
N = 3 L = 2 Ml = 2 Ms = +½
25
Mn
марганец
3d 5
N = 3 L = 2 Ml = 2 Ms = +½
26
Fe
железо
3d 6
N = 3 L = 2 Ml = -2 Ms = -½
27
Co
кобальт
3d 7
N = 3 L = 2 Ml = -1 Ms = -½
28
Ni
никель
3d 8
N = 3 L = 2 Ml = 0 Ms = -½
29
Cu
медь
3d 10
N = 3 L = 2 Ml = 2 Ms = -½
30
Zn
цинк
3d 10
N = 3 L = 2 Ml = 2 Ms = -½
31
Ga
галлий
4p 1
N = 4 L = 1 Ml = -1 Ms = +½
32
Ge
германий
4p 2
N = 4 L = 1 Ml = 0 Ms = +½
33
As
мышьяк
4p 3
N = 4 L = 1 Ml = 1 Ms = +½
34
Se
селен
4p 4
N = 4 L = 1 Ml = -1 Ms = -½
35
Br
бром
4p 5
N = 4 L = 1 Ml = 0 Ms = -½
36
Kr
криптон
4p 6
N = 4 L = 1 Ml = 1 Ms = -½
37
Rb
рубидий
5s 1
N = 5 L = 0 Ml = 0 Ms = +½
38
Sr
стронций
5s 2
N = 5 L = 0 Ml = 0 Ms = -½
39
Y
иттрий
4d 1
N = 4 L = 2 Ml = -2 Ms = +½
40
Zr
цирконий
4d 2
N = 4 L = 2 Ml = -1 Ms = +½
41
Nb
ниобий
4d 4
N = 4 L = 2 Ml = 1 Ms = +½
42
Mo
молибден
4d 5
N = 4 L = 2 Ml = 2 Ms = +½
43
Tc
технеций
4d 5
N = 4 L = 2 Ml = 2 Ms = +½
44
Ru
рутений
4d 7
N = 4 L = 2 Ml = -1 Ms = -½
45
Rh
родий
4d 8
N = 4 L = 2 Ml = 0 Ms = -½
46
Pd
палладий
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
47
Ag
серебро
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
48
Cd
кадмий
4d 10
N = 4 L = 2 Ml = 2 Ms = -½
49
In
индий
5p 1
N = 5 L = 1 Ml = -1 Ms = +½
50
Sn
олово
5p 2
N = 5 L = 1 Ml = 0 Ms = +½
51
Sb
сурьма
5p 3
N = 5 L = 1 Ml = 1 Ms = +½
52
Te
теллур
5p 4
N = 5 L = 1 Ml = -1 Ms = -½
53
I
йод
5p 5
N = 5 L = 1 Ml = 0 Ms = -½
54
Xe
ксенон
5p 6
N = 5 L = 1 Ml = 1 Ms = -½
55
Cs
цезий
6s 1
N = 6 L = 0 Ml = 0 Ms = +½
56
Ba
барий
6s 2
N = 6 L = 0 Ml = 0 Ms = -½
57
La
лантан
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
58
Ce
церий
4f 2
N = 4 L = 3 Ml = -2 Ms = +½
59
Pr
празеодим
4f 3
N = 4 L = 3 Ml = -1 Ms = +½
60
Nd
неодим
4f 4
N = 4 L = 3 Ml = 0 Ms = +½
61
Pm
прометий
4f 5
N = 4 L = 3 Ml = 1 Ms = +½
62
Sm
самарий
4f 6
N = 4 L = 3 Ml = 2 Ms = +½
63
Eu
европий
4f 7
N = 4 L = 3 Ml = 3 Ms = +½
64
Gd
гадолиний
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
65
Tb
тербий
4f 9
N = 4 L = 3 Ml = -2 Ms = -½
66
Dy
диспрозий
4f 10
N = 4 L = 3 Ml = -1 Ms = -½
67
Ho
гольмий
4f 11
N = 4 L = 3 Ml = 0 Ms = -½
68
Er
эрбий
4f 12
N = 4 L = 3 Ml = 1 Ms = -½
69
Tm
тулий
4f 13
N = 4 L = 3 Ml = 2 Ms = -½
70
Yb
иттербий
4f 14
N = 4 L = 3 Ml = 3 Ms = -½
71
Lu
лютеций
5d 1
N = 5 L = 2 Ml = -2 Ms = +½
72
Hf
гафний
5d 2
N = 5 L = 2 Ml = -1 Ms = +½
73
Ta
тантал
5d 3
N = 5 L = 2 Ml = 0 Ms = +½
74
W
вольфрам
5d 4
N = 5 L = 2 Ml = 1 Ms = +½
75
Re
рений
5d 5
N = 5 L = 2 Ml = 2 Ms = +½
76
Os
осмий
5d 6
N = 5 L = 2 Ml = -2 Ms = -½
77
Ir
иридий
5d 7
N = 5 L = 2 Ml = -1 Ms = -½
78
Pt
платина
5d 9
N = 5 L = 2 Ml = 1 Ms = -½
79
Au
золото
5d 10
N = 5 L = 2 Ml = 2 Ms = -½
80
Hg
ртуть
5d 10
N = 5 L = 2 Ml = 2 Ms = -½
81
Tl
таллий
6p 1
N = 6 L = 1 Ml = -1 Ms = +½
82
Pb
свинец
6p 2
N = 6 L = 1 Ml = 0 Ms = +½
83
Bi
висмут
6p 3
N = 6 L = 1 Ml = 1 Ms = +½
84
Po
полоний
6p 4
N = 6 L = 1 Ml = -1 Ms = -½
85
At
астат
6p 5
N = 6 L = 1 Ml = 0 Ms = -½
86
Rn
радон
6p 6
N = 6 L = 1 Ml = 1 Ms = -½
87
Fr
франций
7s 1
N = 7 L = 0 Ml = 0 Ms = +½
88
Ra
радий
7s 2
N = 7 L = 0 Ml = 0 Ms = -½
89
Ac
актиний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
90
Th
торий
7d 2
N = 7 L = 2 Ml = -1 Ms = +½
91
Pa
протактиний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
92
U
уран
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
93
Np
нептуний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
94
Pu
плутоний
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
95
Am
америций
5f 7
N = 5 L = 3 Ml = 3 Ms = +½
96
Cm
кюрий
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
97
Bk
берклий
7d 1
N = 7 L = 2 Ml = -2 Ms = +½
98
Cf
калифорний
5f 10
N = 5 L = 3 Ml = -1 Ms = -½
99
Es
эйнштейний
5f 11
N = 5 L = 3 Ml = 0 Ms = -½
100
Fm
фермий
5f 12
N = 5 L = 3 Ml = 1 Ms = -½
101
Md
менделеевий
5f 13
N = 5 L = 3 Ml = 2 Ms = -½
102
No
нобелий
5f 14
N = 5 L = 3 Ml = 3 Ms = -½
103
Lr
лоуренсий
6d 1
N = 6 L = 2 Ml = -2 Ms = +½
104
Rf
резерфордий
6d 2
N = 6 L = 2 Ml = -1 Ms = +½
105
Db
дубний
6d 3
N = 6 L = 2 Ml = 0 Ms = +½
106
Sg
сиборгий
6d 4
N = 6 L = 2 Ml = 1 Ms = +½
107
Bh
борий
6d 5
N = 6 L = 2 Ml = 2 Ms = +½
108
Hs
хассий
6d 6
N = 6 L = 2 Ml = -2 Ms = -½
109
Mt
мейтнерий
6d 7
N = 6 L = 2 Ml = -1 Ms = -½
110
Ds
дармштадтий
6d 8
N = 6 L = 2 Ml = 0 Ms = -½
111
Rg
рентгений
6d 9
N = 6 L = 2 Ml = 1 Ms = -½
112
Cn
коперниций
6d 10
N = 6 L = 2 Ml = 2 Ms = -½
113
Nh
нихоний
7p 1
N = 7 L = 1 Ml = -1 Ms = +½
114
Fl
флеровий
7p 2
N = 7 L = 1 Ml = 0 Ms = +½
115
Mc
московий
7p 3
N = 7 L = 1 Ml = 1 Ms = +½
116
Lv
ливерморий
7p 4
N = 7 L = 1 Ml = -1 Ms = -½
117
Ts
теннесcин
7p 5
N = 7 L = 1 Ml = 0 Ms = -½
118
Og
оганесон
7p 6
N = 7 L = 1 Ml = 1 Ms = -½
Электронная конфигурация атомов химических элементов
Для описания положения электрона в электронной оболочке используют четыре квантовых числа. Здесь мы не будем углубляться в квантово-механические подробности и опишем только утилитарный смысл данных чисел. Набор, состоящий из четырёх квантовых чисел – это «адрес» электрона в электронной оболочке.
Главное квантовое число `n` – определяет полную энергию электрона на энергетическом уровне и показывает, из скольких энергетических уровней состоит электронная оболочка атома. Принимает целочисленные положительные значения от `1` до `oo`. В периодической таблице Д. И. Менделеева `n` равно номеру периода.
Орбитальное квантовое число `l` показывает, сколько энергетических подуровней составляют данный уровень и характеризует форму орбиталей. Принимает значения от `0` до `(n-1)`.
При `n=1`, `l` принимает только одно значение `0` (этому числовому значению соответствует буквенное `s`), следовательно, на первом энергетическом уровне только один подуровень – `s`. Орбиталь `s`-подуровня имеет сферическую форму (рис. 1).
При `n=2`, `l` принимает два значения: `0` `(s)` и `1` `(p)`. Энергетический уровень состоит из двух подуровней – `s` и `p`. Форма `p`-орбитали похожа на объёмную восьмёрку (рис. 1).
При `n=3`, `l` принимает уже три значения: `0` `(s)`; `1` `(p)` и `2` `(d)`. Таким образом, на третьем уровне три подуровня. Орбитали `d`-подуровня имеют форму двух перекрещённых объёмных восьмёрок либо объёмной восьмерки с перемычкой (рис. 1).
При `n=4`, значений `l` уже четыре, следовательно, и подуровней на четвёртом уровне четыре. К перечисленным выше добавляется `3` `(f)`. Орбитали `f`-подуровня имеют более сложную, объёмную, форму.
Магнитное квантовое число `ml` определяет число орбиталей на каждом подуровне и характеризует их взаимное расположение.
Принимает значения `-l` до `+l`, включая `0`.
При `l=0`, `m_l` принимает только одно значение – `0`. Следовательно, орбиталь, находящаяся на данном подуровне (`s`-подуровне), только одна. Мы уже знаем, что она имеет форму сферы с центром в начале координат.
При `l=1`, `m_l` принимает три значения: `−1`; `0`; `+1`. Значит, орбиталей на данном подуровне (`p`-подуровне) три. Так как `p`-орбитали представляют из себя объёмные восьмёрки (то есть линейной структуры), располагаются они в пространстве по осям координат, перпендикулярно друг другу (`p_x`, `p_y`, `p_z`).
При `l=2`, `m_l` принимает уже пять значений: `−2`; `−1`; `0`; `+1`; `+2`. То есть на `d`-подуровне располагаются пять орбиталей. Это плоскостные структуры, в пространстве занимают пять положений.
При `l=3`, то есть на `f`-подуровне, орбиталей становится семь, так как `m_l` – принимает семь значений (от `−3` до `+3` через `0`). Орбитали являются более сложными объёмными структурами, и взаимное их расположение еще более сложно.
Спиновое квантовое число `m_s` характеризует собственный момент количества движения электрона и принимает только два значения: `+1//2` и `-1//2`.
Электронная ёмкость подуровня (максимальное количество электронов на подуровне) может быть рассчитана по формуле `2(2l+1)`, а уровня – по формуле `2n^2`.
Всё вышесказанное можно обобщить в Таблице 2.
Таблица 2. Квантовые числа, атомные орбитали и число электронов на подуровнях (для `n<=4`)
|
`n` |
`l` |
Обозначение орбитали |
`ml` |
Число орбиталей |
Число электронов на подуровне |
|
`1` |
`0` |
`1s` |
`0` |
`1` |
`2` |
|
`2` |
`0` `1` |
`2s` `2p` |
`0` `−1`; `0`; `+1` |
`1` `3` |
`2` `6` |
|
`3` |
`0` `1` `2` |
`3s` `3p` `3d` |
`0` `−1`; `0`; `+1` `−2`; `−1`; `0`; `+1`; `+2` |
`1` `3` `5` |
`2` `6` `10` |
|
`4` |
`0` `1` `2` `3` |
`4s` `4p` `4d` `4f` |
`0` `−1`; `0`; `+1` `−2`; `−1`; `0`; `+1`; `+2` `−3`; `−2`; `−1`; `0`; `+1`; `+2`; `+3` |
`1` `3` `5` `7` |
`2` `6` `10` `14` |
Химические свойства элементов и их соединений определяются электронным строением валентного уровня их атомов. Именно с участием электронов валентного уровня возникают химические связи между атомами и образуется соединение (вещество). Поэтому важно понимать правила заполнения электронных оболочек, строение валентного уровня и составлять электронную конфигурацию атомов элементов.
Материалы портала onx.distant.ru
Квантовые числа
Общая характеристика квантовых чисел
Принцип (запрет) Паули
Правило Хунда
Примеры решения задач
Задачи для самостоятельного решения
Общая характеристика квантовых чисел
Главное квантовое число n характеризует энергию электрона в атоме и размер электронной орбитали. Оно соответствует также номеру электронного слоя, на котором находится электрон. Совокупность электронов в атоме с одинаковым значением главного квантового числа n называют электронным слоем (энергетическим уровнем). n – принимает значения 1, 2, 3, …, ∞ . Энергетические уровни обозначают прописными латинскими буквами:
| Значение n | 1 | 2 | 3 | 4 | 5 | 6 |
| Обозначение слоя | K | L | M | N | O | P |
Различия в энергиях электронов, принадлежащих к различным подуровням данного энергетического уровня, отражает побочное (орбитальное) квантовое число l. Электроны в атоме с одинаковыми значениями n и l составляют энергетический подуровень (электронную оболочку). Максимальное число электронов в оболочке Nl:
Nl = 2(2l + 1). (1)
Побочное квантовое число принимает целые значения 0, 1, … (n – 1). Обычно l обозначается не цифрами, а буквами:
| Значение l | 0 | 1 | 2 | 3 | 4 |
| Обозначение орбитали | s | p | d | f | g |
Орбиталь – пространство вокруг ядра, в котором наиболее вероятно нахождение электрона.
Побочное (орбитальное) квантовое число l характеризует различное энергетическое состояние электронов на данном уровне, форму орбитали, орбитальный момент импульса электрона.
Таким образом, электрон, обладая свойствами частицы и волны, движется вокруг ядра, образуя электронное облако, форма которого зависит от значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет сферическую симметрию. При l = 1 (p-орбиталь) электронное облако имеет форму гантели. d-орбитали имеют различную форму: dz2 — гантель, расположенная по оси Z с тором в плоскости X – Y, dx2 — y2 — две гантели, расположенные по осям X и Y; dxy, dxz, dyz, — две гантели, расположенные под 45o к соответствующим осям.

- Формы электронных облаков для различных состояний электронов в атомах
Магнитное квантовое число ml характеризует ориентацию орбитали в пространстве, а также определяет величину проекции орбитального момента импульса на ось Z. ml принимает значения от +l до — l, включая 0. Общее число значений ml равно числу орбиталей в данной электронной оболочке.
Магнитное спиновое квантовое число ms характеризует проекцию собственного момента импульса электрона на ось Z и принимает значения +1/2 и –1/2 в единицах h/2p (h – постоянная Планка).
Принцип (запрет) Паули
В атоме не может быть двух электронов со всеми четырьмя одинаковыми квантовыми числами. Принцип Паули определяет максимальное число электронов Nn, на электронном слое с номером n:
Nn = 2n2. (2)
На первом электронном слое может находиться не более двух электронов, на втором – 8, на третьем – 18 и т. д.
Правило Хунда
Заполнение энергетических уровней происходит таким образом, чтобы суммарный спин был максимальным. Например, три р-электрона на орбиталях р-оболочки располагаются следующим образом:
![]()
Таким образом, каждый электрон занимает одну р-орбиталь.
Примеры решения задач
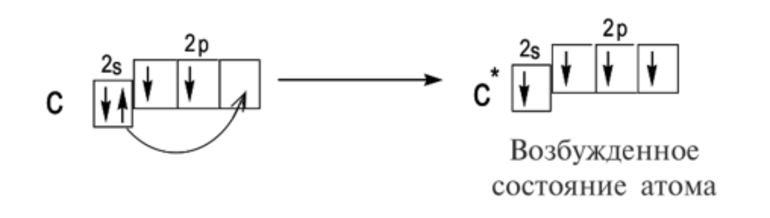
Задача 1. Охарактеризуйте квантовыми числами электроны атома углерода в невозбужденном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома углерода: 1s22s22p2. В первом слое атома углерода находятся два s-электрона с антипараллельными спинами, для которых n = 1. Для двух s-электронов второго слоя n = 2. Спины двух р-электронов второго слоя параллельны; для них m s= +1/2.
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
| 6 | 2 | 1 | 0 | +1/2 |
Задача 2. Охарактеризуйте квантовыми числами внешние электроны атома кислорода в основном состоянии. Ответ представьте в виде таблицы.
Решение. Электронная формула атома кислорода: 1s22s22p4. Во внешнем слое у этого атома находятся 6 электронов 2s22p4. Значения их квантовых чисел приведены в таблице.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 | 0 | 0 | –1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | –1 | +1/2 |
| 6 | 2 | 1 | 1 | –1/2 |
Задача 3. Охарактеризуйте квантовыми числами пять электронов, находящихся в состоянии 4d. Ответ представьте в виде таблицы.
Решение. Согласно правилу Хунда электроны в квантовых ячейках располагаются следующим образом:
![]()
Значения главного, побочного и спинового квантовых чисел у электронов одинаковы и равны n=4, l=2, ms=+1/2. Рассматриваемые электроны отличаются значениями квантовых чисел ml.
| № электрона | n | l | ml | ms |
| 1 | 4 | 2 | 2 | +1/2 |
| 2 | 4 | 2 | 1 | +1/2 |
| 3 | 4 | 2 | 0 | +1/2 |
| 4 | 4 | 2 | –1 | +1/2 |
| 5 | 4 | 2 | –2 | +1/2 |
Задача 4. Рассчитайте максимальное число электронов в электронном слое с n = 4.
Решение. Максимальное число электронов, обладающих данным значением главного квантового числа, рассчитываем по формуле (2). Следовательно, в третьем энергетическом уровне может быть не более 32 электронов.
Задача 5. Рассчитайте максимальное число электронов в электронной оболочке с l = 3.
Решение:
Максимальное число электронов в оболочке определяется выражением (1). Таким образом, максимальное число электронов в электронной оболочке с l = 3 равно 14.
Задачи для самостоятельного решения
1. Охарактеризуйте квантовыми числами электроны атома бора в основном состоянии. Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| № электрона | n | l | ml | ms |
| 1 | 1 | 0 | 0 | +1/2 |
| 2 | 1 | 0 | 0 | –1/2 |
| 3 | 2 | 0 | 0 | +1/2 |
| 4 | 2 | 0 | 0 | –1/2 |
| 5 | 2 | 1 | 1 | +1/2 |
2. Охарактеризуйте квантовыми числами d-электроны атома железа в основном состоянии. Ответ представьте в виде таблиц:
Расположение 3d-электронов атома железа на орбиталях:
| ? | ? | ? | ? | ? |
Значения квантовых чисел этих электронов:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
Шесть 3d-электронов атома железа располагаются на орбиталях следующим образом
![]()
Квантовые числа этих электронов приведены в таблице
| № электрона | n | l | ml | ms |
| 1 | 3 | 2 | 2 | +1/2 |
| 2 | 3 | 2 | 1 | +1/2 |
| 3 | 3 | 2 | 0 | +1/2 |
| 4 | 3 | 2 | — 1 | +1/2 |
| 5 | 3 | 2 | — 2 | +1/2 |
| 6 | 3 | 2 | 2 | — 1/2 |
3. Каковы возможные значения магнитного квантового числа ml, если орбитальное квантовое число l = 3?
Ответ: ml = +3; +2; +1; 0, — 1, — 2, — 3.
4. Охарактеризуйте квантовыми числами находящиеся во втором электронном слое электроны:
![]()
![]()
Ответ представьте в виде таблицы:
| № электрона | n | l | ml | ms |
| 1 | ? | ? | ? | ? |
| 2 | ? | ? | ? | ? |
| 3 | ? | ? | ? | ? |
| 4 | ? | ? | ? | ? |
| 5 | ? | ? | ? | ? |
| 6 | ? | ? | ? | ? |
| 7 | ? | ? | ? | ? |
Ответ: Электронная конфигурация 2s22p5. Главное квантовое число для всех электронов равно 2. Для s электронов l = 0, для р-электронов l = 1.
| № электрона | n | l | ml | ms |
| 1 | 2 | 0 | 0 | +1/2 |
| 2 | 2 |
0 |
0 | — 1/2 |
| 3 | 2 | 1 | 1 | +1/2 |
| 4 | 2 | 1 | 0 | +1/2 |
| 5 | 2 | 1 | — 1 | +1/2 |
| 6 | 2 | 1 | 1 | — 1/2 |
| 7 | 2 | 1 | 0 |
— 1/2 |
5. Определите максимальное число электронов на электронном слое, для которого главное квантовое число n = 6.
6. Определите максимальное число электронов на электронной оболочке, для которой побочное квантовое число l = 4.
7. Определите максимальное число электронов на третьем слое.
8. Определите максимальное число электронов на 5d электронной оболочке.
9. Какие значения может принимать орбитальное (побочное) квантовое число l?
Решение. 1. Электронную формулу
атома алюминия составим согласно формуле
(2.3):
![]()
![]()
.
Известно, что валентными для s
и p-элементов являются
электроны внешнего слоя. Для атома
алюминия это 3s23p1.
2. Состояние электрона в атоме описывается
набором четырех квантовых чисел в виде
групп символов nlx:
а) n – главное квантовое
число, определяется по номеру заполненного
уровня;
б) l – побочное (орбитальное)
квантовое число. Для s-подуровня
l=0; для р-подуровня l=1;
для d-подуровня l=2
и т.д.; х – число электронов на этом
подуровне;
в) m l
– магнитное квантовое число, принимающее
следующие значения:
![]()
;
г) m s
– спиновое квантовое число,
принимающее значения 1/2.
|
13 Al |
3s2 |
3p1 |
|||||
|
|
|
||||||
|
n= |
3 3 |
3 1 -1
|
|||||
|
l= |
0 0 |
||||||
|
ml ms= |
0 0 |
Для определения квантовых чисел
необходимо распределить валентные
электроны по квантовым ячейкам:
![]()
2.3. Геометрические и энергетические характеристики атомов
Атомный радиус. Атом не имеет строго
определенных границ. За его радиус
принимается расстояние от ядра до
главного максимума плотности внешних
электронных оболочек. С увеличением
заряда ядра в периодах атомный радиус
немонотонно уменьшается, а в группах
увеличивается.
Энергия ионизации Еi –
это энергия, необходимая для отрыва
наиболее слабо связанного электрона
от атома, количественно выражается в
кДж/моль или эВ. Чем меньше энергия
ионизации, тем легче атом отдает электрон
при образовании химической связи, т.е.
элемент является более сильным
восстановителем. Поэтому восстановительная
способность нейтральных атомов с ростом
заряда ядра в периоде уменьшается, в
главных подгруппах растет.
Энергия сродства к электрону Еср
– энергия, выделяющаяся при присоединении
электрона к нейтральному атому,
количественно выражается в кДж/моль
или эВ. Она определяет окислительные
свойства несвязанных атомов. Чем больше
электронное сродство, тем более сильным
окислителем является данный элемент.
Окислительной способностью не обладают
нейтральные атомы с устойчивыми
конфигурациями s2, s2р6.
У остальных элементов в таблице Д.И.
Менделеева окислительная способность
нейтральных атомов повышается слева
направо и снизу вверх.
Электроотрицательностью элемента
(ЭО) называют меру относительной
способности атомов оттягивать на себя
электроны при образовании химической
связи. Она пропорциональна как энергии
ионизации, так и энергии сродства к
электрону. Имеется несколько шкал
электроотрицательности. Согласно Р.
Малликену, абсолютная электроотрицательность
равна полусумме энергии ионизации и
сродства к электрону:
![]()
,
Л. Полинг ввел относительную шкалу
электроотрицательности (ОЭОR):
![]()
С ростом заряда в периодах
электроотрицательность в общем растет,
а в подгруппах падает.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
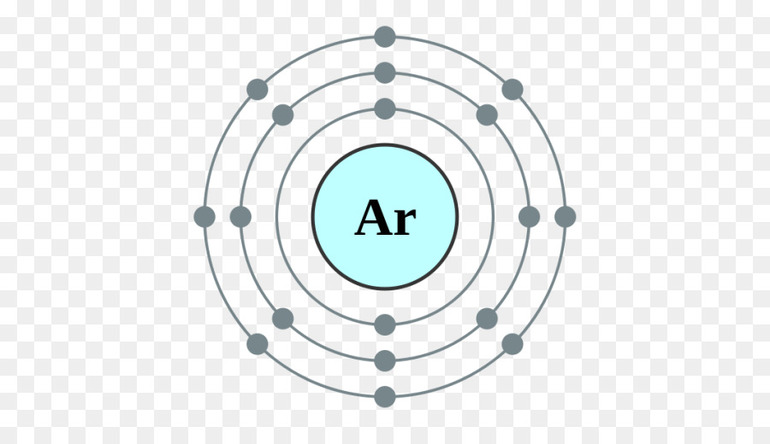
Электроны и валентность
Международный союз теоретической и прикладной химии определил валентность как максимальное число одновалентных атомов (первоначально — водорода или хлора), которые могут объединяться с атомом или фрагментом рассматриваемого элемента.
Современная альтернативная трактовка звучит несколько иначе: валентность — это число атомов водорода, которые могут объединяться с элементом в бинарном гидриде, или удвоенное количество атомов кислорода, объединяющихся с элементом в его оксиде или оксидах. Это определение отличается от формулировки МСТПХ, поскольку большинство веществ имеет более чем одну валентность.
Модель ядерного атома Резерфорда (1911) показала, что внешнюю оболочку атома занимают заряженные частицы, это свидетельствует о том, что электроны ответственны за взаимодействие атомов и образование химических связей.
В 1916 году Гилберт Н. Льюис объяснил валентность и химическую связь с точки зрения тенденции атомов достигать стабильного октета из 8 электронов в валентной оболочке.
Согласно Льюису, ковалентная связь приводит к октетам при совместном использовании электронов, а ионная связь — при передаче электронов от одного атома к другому. Термин ковалентность приписывается Ирвингу Лэнгмюру. Префикс ко– означает «вместе», то есть атомы разделяют валентность. Поэтому определение валентности по формуле соединения стало возможным.
В 1930-х годах Линус Полинг предположил, что существуют также полярные ковалентные связи, которые являются промежуточными, а степень ионного характера зависит от разницы электроотрицательности двух связанных атомов.
Полинг также рассматривал гипервалентные молекулы, в которых элементы имеют кажущиеся валентности, например, в молекуле гексафторида серы (SF6). Учёный считал, что сера образует 6 истинных двух электронных связей с использованием sp3 d2 гибридных атомных орбиталей, которые объединяют одну s, три p и две d орбитали.
Для основных элементов в периодической таблице Менделеева валентность может варьироваться от 1 до 7. Многие вещества имеют общую валентность, связанную с их положением в таблице. Для описания ионов в зарядовых состояниях 1, 2, 3 и т. д. (соответственно) используются греческие/латинские цифровые префиксы (моно- / уни- / би- / три-).

Виды с одним зарядом являются одновалентными. Например, Cs+ — одновалентный катион, тогда как Ca2+ является двухвалентным, а Fe3+ — трёхвалентным. Существуют также поливалентные катионы, которые не ограничены определённым количеством валентных связей.
В отличие от Cs и Ca, Fe может существовать в других зарядовых состояниях, особенно 2+ и 4+, и поэтому известен как многовалентный (поливалентный) ион.
Переходные металлы и металлы, как правило, многовалентны, но, к сожалению, не существует простой схемы, предсказывающей их валентность.
Определение количества
Можно определить количество электронов с помощью специального онлайн-калькулятора. Однако его нахождение под рукой не всегда возможно. Поэтому следующий вариант — обратиться к атомной конфигурации элемента и просто сосчитать число заряженных частиц в самой внешней оболочке атома. Однако это чрезвычайно утомительное занятие, так как, возможно, придётся пролистать много учебников, чтобы найти конфигурации, с которыми исследователь не знаком.

Количество ВЭ элемента и его валентность определить по таблице Менделеева проще всего. Нужно обратить внимание на вертикальный столбец, в котором указана классификация.
Исключением являются переходные металлы — 3−12 группы.
Цифра в порядковом номере группы показывает, сколько валентных электронов связано с нейтральным атомом вещества, указанного в этом конкретном столбце.
Пример в таблице:
| Группа | ВЭ |
|---|---|
| 1 (I) (щелочные металлы) | 1 |
| 2 (II) (щёлочноземельные металлы) | 2 |
| 3−12 (переходные металлы) | 3−12 |
| 13 (III) (борная группа) | 3 |
| 14 (IV) (углеродная) | 4 |
| 15 (V) (группа азота) | 5 |
| 16 (VI) (кислородная группа) | 6 |
| 17 (VII) (галогены) | 7 |
| 18 (VIII или 0) (благородные газы) | 8 |
Надо сказать, что периодическая таблица — это аккуратное расположение всех элементов, которые известны науке на данный момент.
Они располагаются слева направо в порядке возрастания их атомарных номеров или числа протонов (электронов), которые они содержат.
Все вещества в таблице Менделеева делятся на четыре категории:
- элементы основной группы;
- переходные элементы;
- лантаноиды;
- актиниды.
Последние два — это внутренние переходные элементы, образующие мост в группах 2 и 13. Таблица содержит строки — периоды — и 18 столбцов, известных как группы. Есть ещё подтаблица, которая содержит 7 строк и 2 столбца с более редкими веществами.
Номер строки (периода) элемента показывает количество оболочек, окружающих его ядро.
Химические реакции
Число электронов, содержащихся во внешней оболочке атома, которая ещё называется валентной, определяет его способность образовывать связи. Поэтому элементы с одинаковым количеством валентных электронов в атоме группируются в периодическую таблицу. Обычно вещества главной группы, исключая гелий и водород, имеют тенденцию вступать в реакцию с образованием замкнутой оболочки, которая соответствует конфигурации электронов s2 p6. Это называется правилом октетов, поскольку у каждого связанного атома будет восемь ВЭ, учитывая общие электроны.
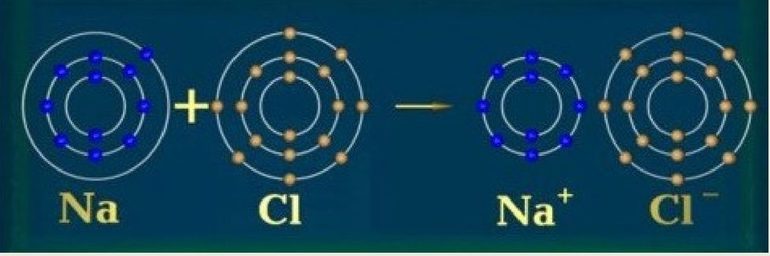
Из металлических элементов наиболее реакционноспособными являются щелочные металлы первой группы, например, калий и натрий. Такой атом имеет только один ВЭ. Эта единственная заряженная частица с лёгкостью теряется во время образования ионной связи, после чего образуется катион (положительный ион), например, K+ или Na+, оболочка которого будет закрыта.
Вторая группа — щёлочноземельные металлы, например, магний, — менее реактивны. Чтобы получить положительный ион (Mg2+), каждому их атому нужно отдать два ВЭ.
В любой группе (в столбце таблицы Менделеева) металлов реакционная способность становится больше, если двигаться от лёгкого вещества к более тяжёлому, то есть увеличивается с каждым нижним рядом таблицы. Происходит это просто потому, что у тяжёлых элементов больше оболочек. Их ВЭ приходится существовать в условиях более высоких главных квантовых чисел.
Они находятся дальше от атомного ядра и, следовательно, обладают более высокой потенциальной энергией, это означает, что связь между ними менее тесная.
Атом неметалла настроен привлекать дополнительные ВЭ, чтобы образовать полную валентную оболочку. Это может быть достигнуто одним из двух способов:
- посредством ковалентной связи, то есть атом поделится электронами с соседом;
- будет использована ионная связь, то есть электроны возьмут из другого атома.
Наиболее реактивными видами неметаллических элементов являются галогены. К ним можно отнести хлор (Cl) или, например, фтор (F).
Если двигаться от лёгкого элемента к тяжёлому, в пределах каждой группы неметаллов их реакционная способность будет уменьшаться. Это потому, что ВЭ будут терять тесную связь, поскольку приобретают более высокую энергию. По факту, самый лёгкий элемент в группе 16 — кислород — наиболее реакционноспособный неметалл, после фтора, конечно.
В таких простых случаях, когда соблюдается правило октета, валентность атома равна количеству разделённых электронов, потерянных или полученных для того, чтобы сформировался стабильный октет. Однако есть также много молекул, для которых валентность менее чётко определена, но это скорее исключения.
Электронная конфигурация
Заряженные частицы, определяющие химическую реакцию атома, — это те, чьё среднее расстояние от ядра самое большое, то есть они обладают самой высокой энергией. Для элемента основной группы ВЭ определяются как те, что находятся в электронной оболочке с наибольшим главным квантовым числом n.
Следовательно, число валентных электронов, которое может быть у вещества, зависит от конфигурации самих частиц. Например, чтобы определить валентные электроны фосфора, нужно записать его конфигурацию: 1s 2 2s 2 2p 6 3s 2 3p 3. Итак, получается 5 ВЭ (3s 2 3p 3), что соответствует максимальной валентности для P, равной 5.
Однако переходные элементы имеют частично заполненные (n — 1) d энергетические уровни, к слову, довольно близкие по энергии к уровню ns. Поэтому, в отличие от веществ основной группы, ВЭ для переходного металла определяется как частица, которая находится вне ядра благородного газа.
Как правило, d-электроны в переходных металлах ведут себя как валентные, хотя они не находятся в оболочке. Например, марганец (Mn) имеет конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d5, это сокращённо — [Ar] 4s2 3d5, где [Ar] — обозначение конфигурации ядра, идентичной благородному газу — аргону. Электрон 3d этого атома имеет энергию, аналогичную 4s, но превышающую 3s или 3p.
Вне аргоноподобного ядра, возможно, есть семь валентных электронов (4s2 3d5), это вполне согласуется с тем фактом, что, например, степень окисления марганца может достигать +7 (в перманганатном ионе MnO — 4).
Чем правее вещество расположено в ряду переходных металлов, тем энергия его заряженной частицы в субоболочке ниже, и тем меньше валентных свойств у такого электрона.
Например, хотя обычно у атома никеля десятая валентность (4s2 3d8), его степень окисления никогда не превышает четырёх. Для цинка 3d-оболочка является полной и ведёт себя подобно электронам ядра.
Поскольку количество ВЭ, участвующих в химических реакциях фактически, предсказать сложно, концепция этой частицы несёт мало пользы для переходных металлов, если сравнивать с элементами из основной группы. Однако подсчёт электронов для понимания химии переходных металлов является альтернативным инструментом.
Электрическая проводимость
Ответственность за электрическую проводимость вещества в том числе лежит и на электронах. Вследствие чего элементы классифицируются следующим образом:
- металлоиды (полупроводники);
- неметаллы;
- металлы.
В твёрдом состоянии металлические элементы обычно имеют высокую электропроводность. Поскольку валентный электрон металла обладает небольшой энергией ионизации, находясь в твёрдом состоянии, он относительно свободно покидает атом, чтобы связываться с другими.
Когда электрон свободный, он может перемещаться под воздействием электрического поля, то есть создавать электрический ток, отвечая за электропроводность металла. Примером хороших проводников могут служить серебро, равно как и золото, алюминий и, конечно, медь.

Как изолятор действует неметаллический элемент, поскольку имеет низкую электропроводность. В таблице Менделеева такие вещества находятся справа. Их валентная оболочка заполнена наполовину (исключение составляет бор). Когда на атом воздействует некоторое электрическое поле, заряженная частица не может его легко покинуть, поэтому такой элемент может проводить слабый постоянный или переменный электрический ток. Например, сера и алмаз — одни из таких веществ.
Изолятором также может быть твёрдое соединение, которое содержит металлы, если для образования ионных связей используются ВЭ атомов металла. К примеру, натрий, хоть он и представляет собой мягкий металл, однако твёрдый хлорид натрия является изолятором.
Поскольку для образования ионной связи ВЭ натрия переносятся в хлор, электроны не имеют возможности легко перемещаться.
Полупроводники обладают промежуточной между металлами и неметаллами электрической проводимостью. Интересно, что при увеличении температуры у этих веществ улучшается проводимость. Германий и кремний можно отнести к типичным элементарным полупроводникам, каждый их атом имеет 4 ВЭ. Надо сказать, что лучше всего свойства полупроводников объясняются с помощью теории зон.
