Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Состав комплексных соединений
Номенклатура комплексных соединений
Реакции образования комплексных соединений
Реакции разрушения комплексных соединений
Диссоциация комплексных соединений
Примеры решения задач
Задачи для самостоятельного решения
Состав комплексных соединений

Рис. 1. Состав комплексного соединения
Комплексное соединение, рисунок 1, состоит из внутренней и внешней сферы. Центральная частица, вокруг которой расположены окружающие ее лиганды, называется комплексообразователем. Число лигандов комплексообразователя называется координационным числом.
Номенклатура комплексных соединений
Комплексное соединение может состоять из комплексного катиона, комплексного аниона или может быть нейтральным.
Соединения с комплексными катионами. Вначале называют внешнесферный анион, затем перечисляют лиганды, затем называют комплексообразователь в родительном падеже (ему дается русское название данного элемента). После названия комплексообразователя в скобках римской цифрой указывается его степень окисления.
К латинскому названию анионного лиганда добавляется окончание “о” (F— — фторо, Cl— -хлоро, ОН— — гидроксо, CN— — циано и т.д). Аммиак обозначают термином “аммин”, СО – карбонил, NO – нитрозил, H2O – аква.
Число одинаковых лигандов называют греческим числительным: 2 –ди, 3 – три, 4 – тетра, 5 – пента, 6 – гекса, 7 – гепта и т.д.
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II),
[Ni(H2O)6]Cl2 – хлорид гексаакваникеля (II).
Вначале перечисляют лиганды анионные, затем нейтральные, затем катионные. Например,
[Pt(NH3)5Cl]Cl3 – хлорид хлоропентаамминплатины (IV) .
Если в комплексе имеются несколько лигандов одинакового знака заряда, то они называются в алфавитном порядке:
[CoCl2(H2O)(NH3)3]Cl – хлорид дихлороакватриамминкобальта (III).
Соединения с комплексными анионами. Вначале называют комплексный анион в именительном падеже: перечисляют лиганды, затем комплексообразователь (ему дается латинское название и к названию добавляется окончание “ат”). После названия комплексообразователя указывается его степень окисления. Затем в родительном падеже называется внешнесферный катион.
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия;
K4[Fe(CN)6] – гексацианоферрат (II) калия;
K2[СuCl4] – тетрахлорокупрат (II) калия.
Соединения без внешней сферы. Вначале называют лиганды, затем комплексообразователь в именительном падеже с указанием его степени окисления. Все название пишется слитно.
[Ni(CО)4] – тетракарбонилникель (0);
[Pt(NH3)2Cl4] – тетрахлородиамминплатина (IV).
Реакции образования комплексных соединений
Комплексные соединения обычно получают действием избытка лигандов на содержащее комплексообразователь соединение. Координационное число, как правило, в 2 раза больше степени окисления комплексообразователя. Из этого правила бывают, однако, исключения.
Образование гидроксокомплексов.
AlCl3 + 6NaOH(изб) = Na3[Al(OH)6] + 3NaCl
AlCl3 + 4NaOH(изб) = Na[Al(OH)4] + 3NaCl
ZnSO4 + 4NaOH(изб) = Na2[Zn(OH)4] + Na2SO4
Образование комплексных солей.
Если комплексообразователем является Fe2+ или Fe3+, то координационные числа в обоих случаях равны шести:
FeCl2 + 6KCN(изб) = K4[Fe(CN)6] + 2KCl
Fe2(SO4)3 + 12KCN(изб) = 2 K3[Fe(CN)6] + 3K2SO4
Координационные числа ртути и меди, как правило, равны четырем:
Hg(NO3)2 + 4KI(изб) = K2[HgI4] + 2KNO3
CuCl2 + 4NH3(изб) = [Cu(NH3)4]Cl2
Для большинства аква- и амминных комплексов ионов d-элементов координационное число равно шести:
NiCl2 + 6NH3 (изб) = [Ni(NH3)6]Cl2
Реакции разрушения комплексных соединений
Разрушение комплексных соединений происходит в результате:
-
-
- образования малорастворимого соединения с комплексообразователем:
-
[Cu(NH3)4]SO4 + Na2S = CuS↓ + 4NH3↑ + Na2SO4
-
-
- образования более прочного комплексного соединения с комплексообразователем или с лигандом:
-
[Cu(NH3)4]SO4 + 4KCN(изб) = K2[Cu(CN)4] + 4NH3↑ + K2SO4
[Cu(NH3)4]SO4 + 4HCl = 4NH4Cl + CuSO4
-
-
- образования малодиссоциированного электролита:
-
Na2[Zn(OH)4] + 4HCl(изб) = 2NaCl + ZnCl2 + 4H2O
-
-
- действия любой сильной кислоты на гидрокомплексы; в этом случае образуется соль и вода:
-
К3[Al(OH)6] + 6HCl(изб) = 3KCl + AlCl3 + 6H2O
-
-
- нагревания некоторых комплексных соединений:
-
[Cu(NH3)4]SO4 → CuSO4 + 4NH3↑
Na[Al(OH)4] → NaAlO2 + 2H2O
-
-
- окислительно-восстановительных реакций:
-
2Na[Ag(CN)2] + Zn = Na2[Zn(CN)4] + 2Ag
6K4[Fe(CN)6] +K2Cr2O7 +7H2SO4=6K3[Fe(CN)6] +Cr2(SO4)3 +4K2SO4 +7H2O
Диссоциация комплексных соединений
Комплексные соединения в водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы. В то же время комплексный ион диссоциирует в незначительной степени как ассоциированный электролит. Количественной характеристикой диссоциации внутренней сферы в растворе является константа нестойкости, представляющая собой константу равновесия процесса диссоциации комплексного иона.
Например, в растворе комплексное соединение [Ni(NH3)6]SO4 диссоциирует следующим образом:
[Ni(NH3)6]SO4 = [Ni(NH3)6]2+ + SO42-
Для комплексного иона [Ni(NH3)6]2+, диссоциирующего по уравнению
[Ni(NH3)6]2+ → Ni2+ + 6NH3
константа равновесия процесса диссоциации носит название константы нестойкости Кн. Для рассматриваемого процесса Кн равна
Кн = [Ni2+]·[NH3]6 / [[Ni(NH3)6]2+] (1)
Величина, обратная Кн, называется константой устойчивости:
Ку = 1/Кн (2)
Она представляет собой константу равновесия процесса образования комплексного иона:
Ni2+ + 6NH3 ↔ [Ni(NH3)6]2+
Константа нестойкости Кн связана с изменением энергии Гиббса процесса диссоциации комплекса уравнением:
ΔGTо = — RTln Кн (3)
Примеры решения задач:
Задача 1. Вычислите:
1) Концентрацию ионов NO3— в 0,01 М растворе [Ag(NH3)2]NO3.
2) Концентрацию Ag+ в 0,01 М растворе [Ag(NH3)2]NO3, содержащем 2 моль/л избыточного аммиака,
если Кн[Ag(NH3)2]+ = 5,7× 10— 8 при 298 К.
3) Величину ΔGo298 процесса диссоциации комплексного иона.
Решение:
1)
[Ag(NH3)2]NO3 = [Ag(NH3)2]+ + NO3—
[NO3— ] = 0,01М, поскольку комплекс диссоциирует как сильный электролит на комплексный ион и ионы внешней сферы.
2) Комплексный ион диссоциирует незначительно:
[Ag(NH3)2]+ → Ag+ + 2NH3
Положение равновесия комплексного иона в присутствии избытка NH3 еще больше смещено влево.
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Ag+ и 2x моль/л аммиака. Суммарная концентрация аммиака равна (2x+2) моль/л. Концентрация недиссоциированного комплексного иона [Ag(NH3)2]+ составляет: (0,01–x) моль/л.
Концентрация аммиака, связанная с диссоциацией комплексного иона, ничтожно мала по сравнению с избытком аммиака. Доля комплексного иона, подвергшегося диссоциации, также ничтожно мала. Значит,

x = 1,43× 10— 10
Следовательно, [Ag+] = 1,43× 10— 10 моль/л.
Константа нестойкости связана с изменением энергии Гиббса процесса диссоциации [Ag(NH3)2]+ уравнением:
ΔGоT = — RTln Кн .
Значит, при Т = 298 К получаем:
ΔGо298 = — 8,314× 298× ln5,7× 10— 8 = 41326 Дж = 413,3 кДж.
Задача 2. Произойдет ли осаждение AgCl при сливании 0,01М раствора [Ag(NH3)2]NO3, содержащего 2 моль/л избыточного NH3, с равным объемом 0,5М раствора KCl, если при 298 К ПР(AgCl) = 1,73× 10— 10, Кн.[Ag(NH3)2]+ = 5,7× 10— 8.
Решение. Осадок выпадет при условии: [Ag+][Сl— ] > ПР(AgCl), т.е. если произведение концентраций ионов Ag+ и Сl— в растворе будет больше ПР, то раствор окажется пересыщенным и из него будет выпадать осадок.
После смешения равных объемов растворов концентрации [Ag(NH3)2]NO3, NH3 и KCl уменьшатся в 2 раза и станут равными 5× 10-3, 1 и 0,25 М соответственно.
Найдем концентрацию [Ag+] тем же способом, что и в предыдущей задаче,
откуда x = 2,85× 10— 10.
Значит, [Ag+] = 2,85× 10— 10 моль/л, а [Сl— ] = 0,25 моль/л.
Следовательно, произведение концентраций ионов равно:
[Ag+][Сl— ] = 2,85× 10— 10× 0,25 = 7,1× 10— 11(моль/л)2.
Поскольку [Ag+][Сl— ] = 7,1× 10— 11 < 1,73× 10— 10, то осадок не выпадет.
Задача 3. При какой концентрации ионов S2- начнется выпадение осадка CdS из 0,6М раствора Na2[Cd(CN)4], содержащего 0,04 моль/л избыточного NaCN, если ПР(CdS) = 7,9× 10— 27, Кн[Cd(CN)4]2- = 7,8× 10— 18.
Решение. Осадок выпадет при условии: [Cd2+][S2- ] > ПР(CdS), т.е. если произведение концентраций ионов Cd2+ и S2- в растворе будет больше ПР. Следовательно, выпадение осадка начнется при [S2-] > ПР(CdS):[Cd2+].
Na2[Cd(CN)4] = [Cd(CN)4]2- + 2Na+
Комплексный ион диссоциирует незначительно:
[Cd(CN)4]2- → Cd2+ + 4CN—
Пусть продиссоциировало x моль/л комплексного иона, тогда образовалось x моль/л ионов Cd2+ и 4x моль/л ионов CN— . Суммарная концентрация ионов CN— равна (4x + 0,04) моль/л. Концентрация недиссоциированного комплексного иона [Cd(CN)4]2- составляет: (0,6 – x) моль/л.
Кн[Cd(CN)4]2- = [Cd2+ ] · [CN—]4/ [[Cd(CN)4]2-]
x = 1,8·10— 12 .
Следовательно, [Cd2+] = 1,8·10— 12 моль/л.
Выпадение осадка начнется при [S2- ] > 7,9·10— 27: 1,8·10— 12 > 4,39·10— 15 моль/л.
Задачи для самостоятельного решения
1. Назовите следующие комплексные соединения:
Na2[Pt(CN)4Cl2],
[Cu(NH3)4](NO3)2,
[Cu(H2O)4]SO4
|
Na2[Pt(CN)4Cl2] – дихлоротетрацианоплатинат (IV) натрия; [Cu(NH3)4](NO3)2 – нитрат тетраамминмеди (II); [Cu(H2O)4]SO4 – сульфат тетрааквамеди (II); |
2. Назовите следующие комплексные соединения
[Co(H2O)3Cl3],
[Ni(NH3)6][PtCl4].
|
[Co(H2O)3Cl3] – трихлоротриаквакобальт (III); [Ni(NH3)6][PtCl4] – тетрахлороплатинат (II) гексаамминникеля (II). |
3. Составьте уравнение химической реакции:
Cr2(SO4)3 + NaOH (изб.)→
4. Составьте уравнение химической реакции:
Cd(NO3)2 + Na2SO3 (изб.)→
5. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 + Na2S →
6. Составьте уравнение химической реакции:
[Ag(NH3)2]NO3 -t→
7. Составьте уравнение химической реакции:
K4[Fe(CN)6] + Н2O2 + H2SO4 →
8. Сколько граммов серебра содержится в виде ионов в 0,04М растворе K[Ag(CN)2], содержащем в избытке 1,3 г KCN в 1 л раствора. Константа нестойкости иона [Ag(CN)2] — равна 1,4·10— 20.
9. Произойдет ли осаждение сульфида ртути, если к 1 л 0,3 М раствора K2[HgI4], содержащему избыточных 0,01 моль KI, добавить 1·10— 4 моль K2S? ПР(HgS) = 1,6·10— 52, Кн [HgI4]2- = 1,5·10— 31.
10. При какой концентрации ионов Cl— начнется выпадение осадка AgCl из 0,6М раствора [Ag(NH3)2]NO3, содержащего 1,2 моль/л избыточного аммиака, если ПР(AgCl) = 1,73·10—10, Кн [Ag(NH3)2]+ = 5,7·10— 8.
Растворяясь в
воде, комплексные соли ведут себя как
обычные соли – они диссоциируют на
комплексный ион внутренней сферы и ионы
внешней сферы:
K3[Fe(CN)6]
= 3К+
+ [Fe(CN)6]3–.
Водным
растворам комплексных солей присущи
все свойства электролитов: понижение
давления пара растворителя над раствором,
повышение температуры кипения, понижение
температуры замерзания, осмотическое
давление, электропровод-ность и др. По
свойствам водных растворов комплексных
солей можно установить состав внешней
сферы соединения.
Комплексный
ион диссоциирует
как слабый электролит,
но эта диссоциация отличается тем, что
координационное
число
комплексообразователя (центрального
иона металла) сохраняется постоянным
за счет замены лиганда (молекулы или
иона, связанных с центральным ионом в
комплексном соединении) молекулой воды:
[Fe(CN)6]3–
+ Н2О
= [Fe(CN)5Н2О]2–
+ CN–,
[Fe(CN)5Н2О]2–
+ Н2О
= [Fe(CN)4(Н2О)2]–
+ CN–,
[Fe(CN)4(Н2О)2]–
+ Н2О
= [Fe(CN)3(Н2О)3]
+ CN–,
[Fe(CN)3(Н2О)3]
+ Н2О
= [Fe(CN)2(Н2О)4]+
+ CN–,
[Fe(CN)2(Н2О)4]+
+ Н2О
= [Fe(CN)(Н2О)5]2+
+ CN–,
[Fe(CN)(Н2О)5]2+
+ Н2О
= [Fe(Н2О)6]3+
+ CN–.
Формулы молекул
воды во внутренней сфере комплексного
соединения часто не записывают.
При
ступенчатой диссоциации комплексного
иона происходит изменение его заряда,
на одной из ступеней образуется
нейтральная молекула и конечным
результатом диссоциации является
образование иона [Fe(Н2О)6]3+,
формулу которого мы обычно записываем
привычным нам способом без молекул воды
– Fe3+.
Таким образом, диссоциация комплексного
иона – это замещение лиганда на молекулу
растворителя (воды).
Равновесия
диссоциации комплексных ионов подчиняются
всем правилам смещения ионных равновесий.
Прочность
комплексного иона характеризуется его
константой диссоциации, называемой
константой
нестойкости.
Для записи константы нестойкости К
уравнение диссоциации составляется
обычным способом (без участия молекул
воды):
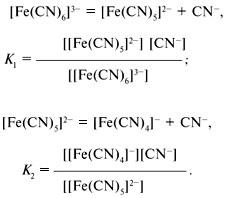
Аналогично
составляются выражения для К3,
К4,
К5,
К6,
в которых квадратными скобками обозначены
равновесные концентрации ионов.
Если справочные
данные по ступенчатым константам
нестойкости отсутствуют, пользуются
общей константой нестойкости комплексного
иона:
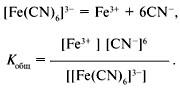
Общая константа
нестойкости равна произведению
ступенчатых констант нестойкости.
В
аналитической химии вместо констант
нестойкости в последнее время пользуются
константами
устойчивости
комплексного иона:

Константа
устойчивости относится к процессу
образования комплексного иона и равна
обратной величине константы
нестойкости: Куст
= 1/Кнест.
Константа
устойчивости характеризует равновесие
образования комплекса.
Константы нестойкости
или константы устойчивости определяются
различными физико-химическими методами.
Использование химических методов
затруднено, т.к. измерение равновесных
концентраций веществ часто приводит к
смещению равновесия.
5. Экспериментальная часть
Опыт №1.
Получение аммиаката меди.
2CuSO4
+ 2NH4OH
= ↓(CuOH)2SO4
+(NH4)
2SO4
голубой
+
↓(CuOH)2SO4
+10NH4OH
= 2[(Cu(NH3)4](OH)2
+ (NH4)
2SO4+
8H2O
2CuSO4
+ 12NH4OH
= 2[(Cu(NH3)4](OH)2
+2(NH4)2SO4+
8H2O
интенсивный
синий
цвет
Cu2++
6NH4OH
=[Cu(NH3)4]2++
2OH–+2NH4++
4H2O
[(Cu(NH3)4](OH)2
↔ [Cu(NH3)4]2++
2OH–
[(Cu(NH3)4]2+↔
Cu2++
4NH3
[Cu2+][
NH3]4
Kнест= [[Cu(NH3)4]2+]
Опыт №2. Получение
аммиаката никеля.
2NiSO4
+ 2NH4OH
= ↓(NiOH)2SO4
+(NH4)
2SO4
зеленоватый
+
↓(NiOH)2SO4
+14NH4OH
= 2[Ni (NH3)6](OH)2
+ (NH4)
2SO4+
12H2O
NiSO4
+ 8NH4OH
= [Ni(NH3)6
](OH)2
+ (NH4)2SO4+
6H2O
Ni2++
8NH4OH
=[ Ni(NH3)6]2++
2OH–+2NH4++
6H2O
Опыт
№3. Получение
аммиаката
серебра.
AgNO3
+
KCl = AgCl + KNO3
AgCl
+ 2NH4OH
= = [(Ag(NH3)2]Cl
+ 2H2O
[(Ag(NH3)2]Cl
↔ [(Ag(NH3)2]++
Cl–
[(Ag(NH3)2]+↔Ag++
NH3
[Ag+][
NH3]2
Kнест= [[Ag
(NH3)2]+]
[(Ag(NH3)2]Cl
+ 2HNO3
=
2NH4NO3
+
AgCl↓
белый
[(Ag(NH3)2]++
Cl–+2H+=
2NH4++
AgCl↓
[(Ag(NH3)2]Cl
+ KI
+ 2H2O
= AgI↓
+
KCl
+
2NH4OH
желтый
Так
как диссоциация комплексного иона
является процессом обратимым, то уводя
из сферы реакции посылаемые им ионы,
можно практически разрушить комплекс.
HNO3
связывает молекулы (NH3
+ Н+=
NH4+),
уводя NH3
из
сферы действия. В результате увеличивается
концентрация [Ag+].
Опыт №4. Получение
кобальтирадонитааммония.
+
изоамиловый спирт
CoCl2
+NH4CNS
(сух).
= (NH4)2[(Co(CNS)4]
+ 2NH4Cl
голубое
кольцо
Опыт №5. Получение
фторидного комплекса железа.
FeCl3
+ 3NH4CNS
(сух).
= Fe(CNS)3
+ 3NH4Cl
красное
окрашивание
Fe(CNS)3
+ 6NaF = Na3[FeF6]
+ 3NaCNS
бесцветный
Опыт №6. Получение
берлинской лазури.
4FeCl3
+ 3K4[Fe(CN)6]
= Fe4[Fe(CN)6]3
↓+
12KCl
синий
4Fe3+
+3[Fe(CN)6]4-
= Fe4[Fe(CN)6]3
↓
Опыт №7. Получение
турнбулевой сини.
3FeSO4
+ 2K3[Fe(CN)6]
= Fe3[Fe(CN)6]2
↓+
3K2SO4
синий
3Fe2+
+ 2[Fe(CN)6]3-
= Fe3[Fe(CN)6]2
↓
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Написание уравнений диссоциации комплексных солей
Решение задач по химии на свойства комплексных соединений
Задание 317
Напишите уравнения диссоциации солей К3[Fe(CN)6] и NH4Fe(SO4)2 в водном растворе. К каждой из них прилили раствор щелочи. В каком случае выпадает осадок гидроксида железа (III)? Напишите молекулярные и ионно-молекулярные уравнения реакций. Какие комплексные соединения называют двойными солями?
Решение:
1. Уравнения диссоциации комплексных солей:
К3[Fe(CN)6] ⇔ 3К+ + [Fe(CN)6]3-;
NH4Fe(SO4)2 ⇔ NH4+ + Fe3+ + 2SO42-
2. При приливании к растворам данных солей раствора щёлочи выпадает осадок в случае с NH4Fe(SO4)2, образуется нерастворимое основание Fe(OH)3:
Молекулярное уравнение реакции:
NH4Fe(SO4)2 + 4КОН ⇔ Fe(OH)3↓ + NH3 + 2K2SO4 + H2O
Ионно-молекулярное уравнение реакции:
NH4+ + Fe3+ + 4ОН– ⇔ Fe(OH)3↓ + NH3↑+ H2O
3. Двойными солями называются комплексные соединения с малоустойчивой внутренней сферой, которая в водных растворах легко разрушается, т.е. ионизирует. Например, комплексное соединение NH4[Fe(SO4)2] в водных растворах диссоциирует по схеме сильного электролита:
NH4[Fe(SO4)2] ⇔ NH4+ + [Fe(SO4)2]–
Имеет место равновесие по схеме:
[Fe(SO4)2]– ⇔ Fe3+ + 2SO42-
Это равновесие настолько смещено вправо, что в разбавленных растворах практически нет комплексных ионов, получим:
NH4[Fe(SO4)2] ⇔ NH4+ + Fe3+ + 2SO42-;
или
NH4Fe(SO4)2 ⇔ NH4+ + Fe3+ + 2SO42-
Обозначают двойные соли следующим образом: NH4Fe(SO4)2 или (NH4)2SO4 . Fe2(SO4)3.
Задание 318
Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия. Дайте этому объяснение и напишите молекулярные и ионно-молекулярные уравнения соответствующих реакций.
Решение:
Хлорид серебра растворяется в растворах аммиака и тиосульфата натрия, потому что при этом образуются растворимые комплексные соединения:
Молекулярные уравнения реакций:
а) AgCl + 2NH3 = [Ag(NH3)2]Cl;
б) AgCl + 2Na2S2O3 = Na3[Ag(S2O3)2] + NaCl
Ионно-молекулярные уравнения реакций:
а) AgCl + 2NH3 = [Ag(NH3)2] + Cl–;
б) AgCl + 2S2O32– = [Ag(S2O3)2]3– + Cl–
Задание 319
Какие комплексные соединения называют двойными солями? Напишите уравнения диссоциации солей К4[Fe(CN)6] и (NH4)2Fe(SO4)2 в водном растворе. В каком случае выпадает осадок гидроксида железа (II). если к каждой из них прилить раствор ще-лочи? Напишите молекулярное и ионно-молекулярное уравнения реакции.
Решение:
1. Уравнения диссоциации комплексных солей:
К4[Fe(CN)6] ⇔ 4К+ + [Fe(CN)6]3-;
(NH4)2Fe(SO4)2 ⇔ 2NH4+ + Fe2+ + 2SO42-
2. При приливании к растворам данных солей раствора щёлочи выпадает осадок в случае с (NH4)2Fe(SO4)2, образуется нерастворимое основание Fe(OH)2:
Молекулярное уравнение реакции:
(NH4)2Fe(SO4)2 + 4КОН ⇔ Fe(OH)2 ↓ + 2NH3↑ + 2K2SO4 + 2H2O
Ионно-молекулярное уравнение реакции:
NH4+ + Fe3+ + 4ОН– Fe(OH)3↓ + NH3↑ + H2O
3. Двойными солями называются комплексные соединения с малоустойчивой внутренней сферой, которая в водных растворах легко разрушается, т. е. ионизирует. Например, комплексное соединение (NH4)2[Fe(SO4)2] в водных растворах диссоциирует по схеме сильно-го электролита:
(NH4)2[Fe(SO4)2] ⇔ 2NH4+ + [Fe(SO4)2]2-
Имеет место равновесие по схеме:
[Fe(SO4)2]2- ⇔ Fe2+ + 2SO42-
Это равновесие настолько смещено вправо, что в разбавленных растворах практически нет комплексных ионов, получим:
(NH4)2[Fe(SO4)2] ⇔ 2NH4+ + Fe2+ + 2SO42-;
или
(NH4)2Fe(SO4)2 ⇔ 2NH4+ + Fe2+ + 2SO42-;
Обозначают двойные соли следующим образом: (NH4)2Fe(SO4)2 или (NH4)2SO4 . FeSO4.
