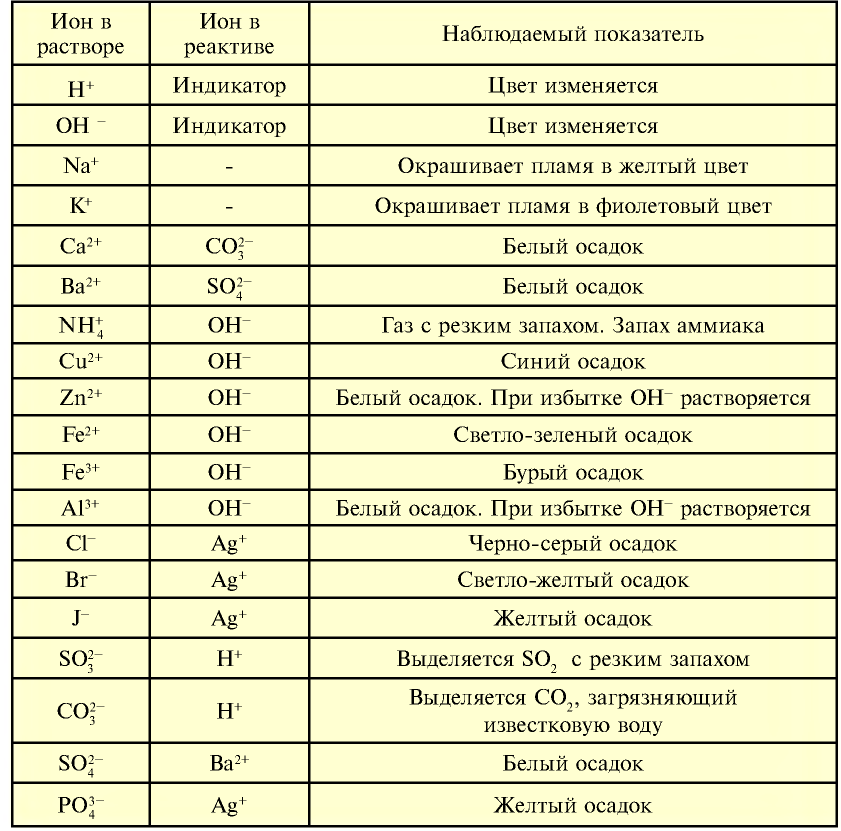
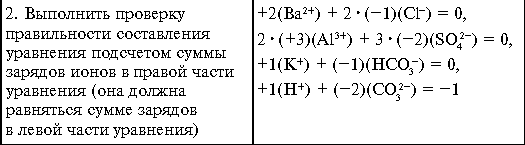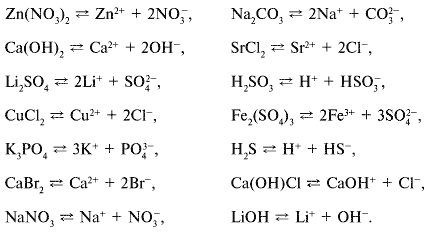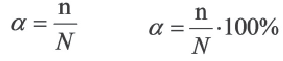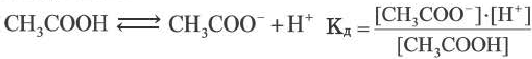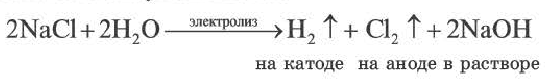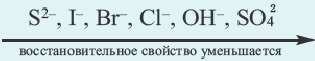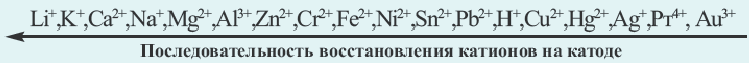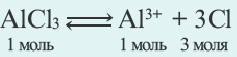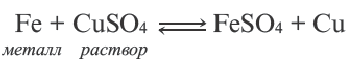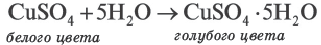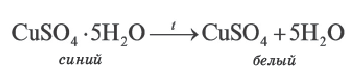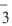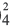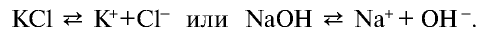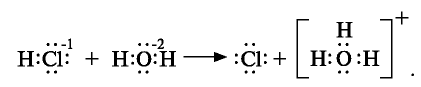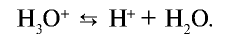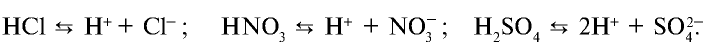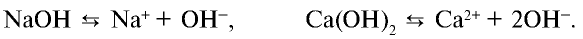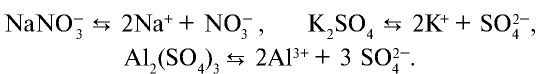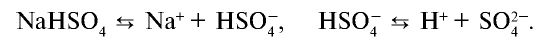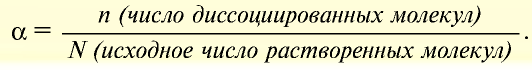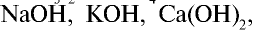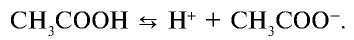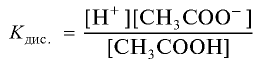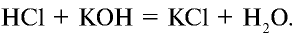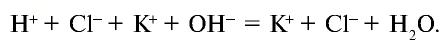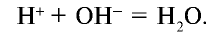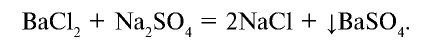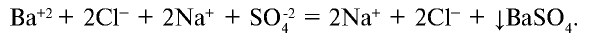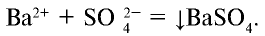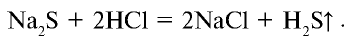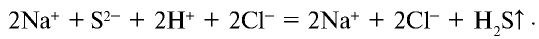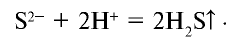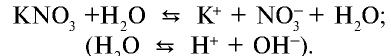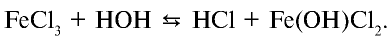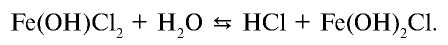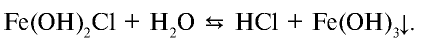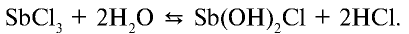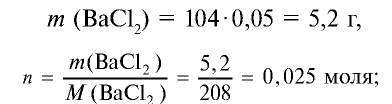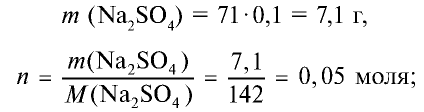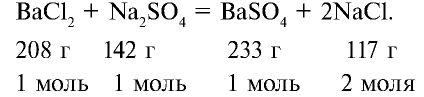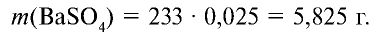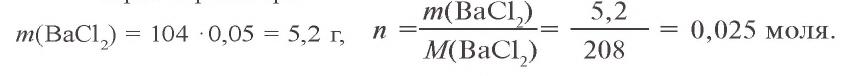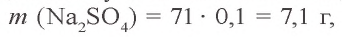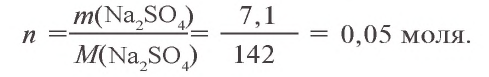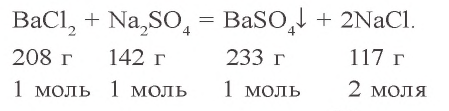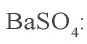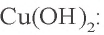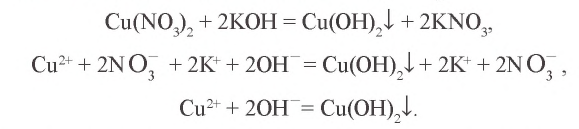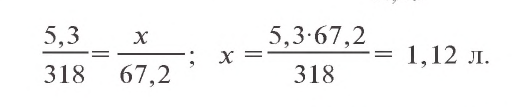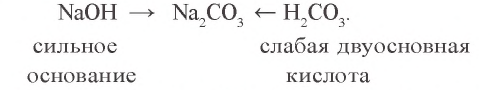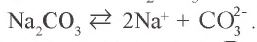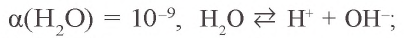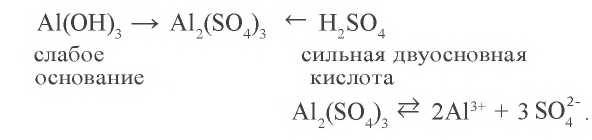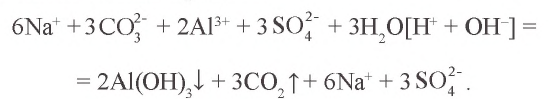Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
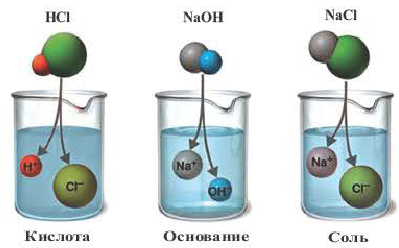
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
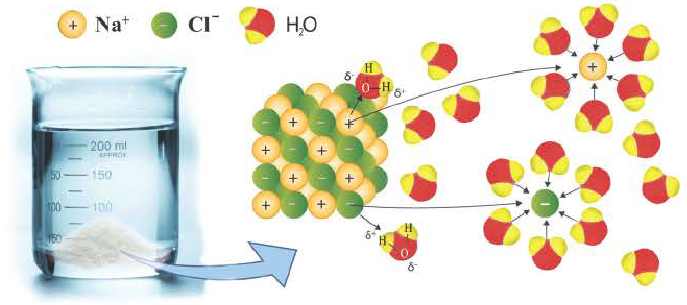
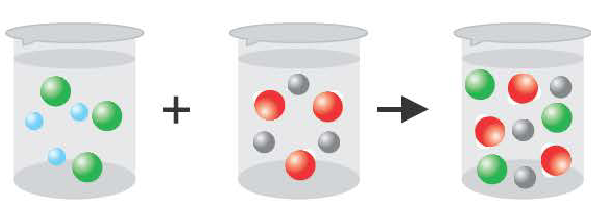
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na+ и Cl—. В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na+ и Cl— вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na+ + Cl–
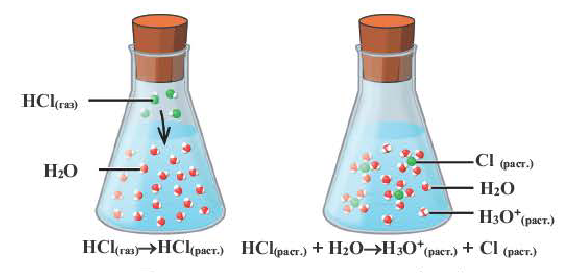
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H+ + Cl—.
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
α=Nпродисс/Nисх, где:
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α<1):
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na+ и PO43–:
Na3PO4 → 3Na+ +PO43-
NH4Cr(SO4)2 → NH4+ + Cr3+ + 2SO42–
Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
H2CO3 ↔ H+ + HCO3–
HCO3– ↔ H+ + CO32–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH–
Mg(OH)+ ⇄ Mg2+ + OH–
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K+ + HCO3– (α=1)
HCO3– ⇄ H+ + CO32– (α < 1)
Mg(OH)Cl ⇄ MgOH+ + Cl– (α=1)
MgOH+ ⇄ Mg2+ + OH– (α<< 1)
Степень диссоциации слабых электролитов намного меньше 1: α<<1.
Основные положения теории электролитической диссоциации, таким образом:
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
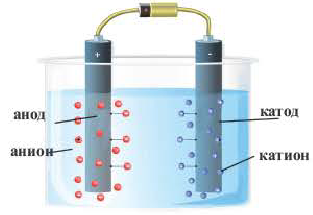
3. Под действием внешнего электрического поля положительно заряженные ионы двигаются к отрицательно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к положительному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K+ + S2–, при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba2+ + 2ClO3–, опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4++ NO3–, при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe3+ + 3NO3–, при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Ответ г).
Электролитическая диссоциация
Электролитическая диссоциация – распад электролитов в водных растворах на ионы.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД), С.А. Аррениус:
- Электролиты в водных растворах диссоциируют на ионы: положительные (катионы) и отрицательные (анионы). Перешедшие в раствор ионы окружены молекулами воды – гидратированы.
- Сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов (раствор в целом электронейтрален)
- Процесс электролитической диссоциации обратимый. Наряду с диссоциацией происходит обратный процесс – ассоциация ионов.
Процесс диссоциации записывают в виде уравнений (уравнений электролитической диссоциации):
KCl = K+ + Cl–; Al2(SO4)3 = 2Al3+ + 3SO42-; H3PO4 ↔ H+ + H2PO4–
СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Сила электролита определяется степенью диссоциации ά. На степень диссоциации влияют: виды связей в веществе, природа растворителя, концентрация раствора (с уменьшением концентрации ά увеличивается), температура ( с ростом t ά увеличивается, т.к. диссоциация – процесс эндотермический).
Сильные электролиты диссоциированы практически нацело. В растворе нет молекул, есть только ионы.
сильные кислоты (не все кислоты!)- HNO3– азотная; HCl– соляная; H2SO4-серная; HBr- бромоводородная; HI- иодоводородная
сильные основания (все щелочи) – LiOH – гидроксид лития; NaOH – гидроксид натрия; KOH – гидроксид калия; Ca(OH)2 – гидроксид кальция; Ba(OH)2 – гидроксид бария
все растворимые соли
Неперечисленные вещества являются слабыми или средней силы электролитами или неэлектролитами.
Н2О – очень слабый электролит.
Кислоты, основания и соли в свете ТЭД
Кислоты – это электролиты, диссоциирующие в растворах с образованием катионов водорода
HNO3 = Н+ + NO3– H2SO4 = 2Н+ + SO42- сероводородная кислота Н2S ↔ Н+ + НS–
Знак обратимости ↔ используется в уравнениях диссоциации
слабых и средней силы электролитов
Основания – это электролиты, диссоциирующие в растворах с образованием гидроксид – ионов (ОН–)
KOH = K+ + OH– Ba(OH)2 = Ba2+ + 2OH–
Соли – это электролиты, диссоциирующие в растворах с образованием катионов металлов и анионов кислотных остатков
К3РО4 = 3K+ + PO42- Al2(SO4)3 = 2Al3+ + 3SO42-
Формулы и заряды катионов металлов и анионов кислотных остатков есть в
таблице растворимости кислот, оснований, солей !
Итак.
1.Электролиты в водных растворах диссоциируют:
- кислота = катионы водорода + анион кислотного остатка HCl = H+ + Cl–
- основание = катион металла и гидроксид-анионы NaOH = Na+ + OH–
- соль = катионы металла + анионы кислотного остатка КCl = К+ + Cl–
2. Индекс в формуле вещества становится коэффициентом перед формулой иона в уравнении диссоциации
Na2CO3 = 2Na+ + CO32- FeCl3 = Fe3+ 3Cl–
ИОННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Реакции, протекающие с участием растворов электролитов, являются реакциями между ионами. Их принято записывать с помощью ионных уравнений.
Правила составления ионных уравнений:
- Напишите молекулярное уравнение (не забудьте про коэффициенты). По таблице растворимости определите растворимость всех веществ и запишите над формулами
Р Р Н Р
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
- Перепишите это уравнение, записывая сильные электролиты как сумму соответствующих ионов, а слабые электролиты, нерастворимые и газообразные вещества – в молекулярной форме. Получите полное ионное уравнение
2Na+ + SO42- + Ba2+ + 2Cl– = BaSO4↓ + 2Na+ + 2Cl–
- «Сократите» одинаковые ионы (выделены курсивом) в левой и правой части уравнения и запишите сокращенное ионно-молекулярное уравнение, отражающее суть процесса (показывает участвующие в реакции частицы и продукты реакции)
Ba2+ + SO42- = BaSO4↓
Реакции в растворах могут протекать: 1)необратимо; 2) обратимо; 3) практически не идут
Реакции идут до конца (необратимо), если концентрация
ионов в растворе уменьшается за счет связывания их c образованием:
А) нерастворимых и малорастворимых веществ
p p н p
KCl + AgNO3 = AgCl↓ + KCl
K+ + Cl– + Ag+ + NO3– = AgCl↓ + K+ + NO3–
Ag+ + Cl– = AgCl↓
p p н р
2H3PO4 + 3BaCl2 = Ba3(PO4)2↓ + 6HCl (H3PO4 – не сильный электролит, H3PO4↔Н+ + H2PO4–.
Иногда H3PO4 записывают в недиссоциированном виде)
Вариант 1. 2H3PO4 + 3Ba2+ + 6Cl– = Ba3(PO4)2↓ + 6H+ + 6Cl–
2H3PO4 + 3Ba2+ = Ba3(PO4)2↓ + 6H+
Вариант 2. 2H+ + 2H2PO4– + 3Ba2+ + 6Cl– = Ba3(PO4)2↓ + 6H+ + 6Cl–
2H2PO4– + 3Ba2+ = Ba3(PO4)2↓ + 4H+
В) газов
р р р
K2S + 2HCl = 2KCl + H2S↑ (↑ – газ)
2K+ + S2- + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S↑
2H+ + S2- = H2S↑
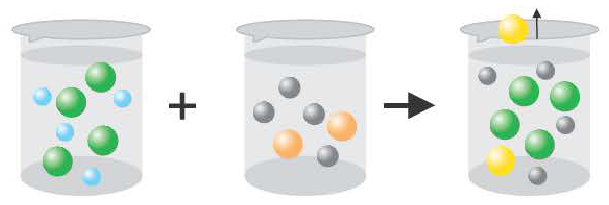
Газ получается также при образовании нестойких: угольной кислоты H2CO3 = H2O + CO2↑
сернистой кислоты H2SO3 = H2O + SO2↑
гидроксида аммония NH4OH = H2O + NH3↑
например:
p p p
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
2Na+ + CO32- + 2H+ + 2Cl– = 2Na+ + 2Cl– + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
В) слабых электролитов (обычно воды):
р р p
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Ba2+ + 2OH– + 2H+ + 2Cl– = Ba2+ + 2Cl– + 2H2O
2H+ + 2OH– = 2H2O
упростим коэффициенты H+ + OH– = H2O
Пример реакции, которая не идет до конца:
p p p p
2NaCl + Ba(NO3)2 = BaCl2 + 2NaNO3
2Na+ +2Cl– + Ba2+ + 2NO3– = Ba2+ + 2Cl– + 2Na+ + 2NO3–
Все ионы «сокращаются» – нет ионов, связывающихся и образующих продукты реакции.
Учебно-методическое пособие
9 класс
Содержание
Введение.
1. Электролитическая диссоциация.
Контрольные вопросы.
1.1. Уравнения диссоциации электролитов.
Составление уравнений диссоциации кислот.
(Алгоритм 1.)
Составление уравнений диссоциации щелочей
(растворимых оснований). (Алгоритм 2.)
Составление уравнений диссоциации солей.
(Алгоритм 3.)
Задания для самоконтроля.
1.2. Реакции ионного обмена.
Составление ионных уравнений реакций.
(Алгоритм 4.)
Составление уравнений реакций, характеризующих
общие химические свойства кислот. (Алгоритм 5.)
Составление уравнений реакций, характеризующих
общие химические свойства щелочей. (Алгоритм 6.)
Составление уравнений реакций, характеризующих
общие химические свойства солей. (Алгоритм 7.)
Задания для самоконтроля.
1.3. Качественные реакции.
1.4. Гидролиз солей.
Определение реакции среды раствора соли.
(Алгоритм 8.)
Задания для самоконтроля.
1.5. Вычисления по теме «Электролитическая
диссоциация».
Вычисления по теме «Степень диссоциации».
(Алгоритм 9.)
Задания для самоконтроля.
Массовая доля растворенного вещества. (Алгоритм
10.)
Задания для самоконтроля.
Молярная концентрация. (Алгоритм 11.)
Задания для самоконтроля.
Вычисления по уравнениям реакций, если одно из
веществ дано в избытке. (Алгоритм 12.)
Задания для самоконтроля.
Кристаллогидраты. (Алгоритм 13.)
2. Закономерности течения химических
реакций.
Контрольные вопросы.
2.1. Скорость химической реакции.
Вычисление скорости химической реакции.
(Алгоритм 14.)
Зависимость скорости химической реакции от
концентрации реагентов. (Алгоритм 15.)
Зависимость скорости реакции от температуры.
(Алгоритм 16.)
Задания для самоконтроля.
2.2. Термохимические уравнения.
Вычисление теплового эффекта реакции по
известному термохимическому уравнению.
(Алгоритм 17.)
Составление термохимического уравнения.
(Алгоритм 18.)
Вычисление теплоты сгорания вещества. (Алгоритм
19.)
Вычисление теплоты образования вещества.
(Алгоритм 20.)
Вычисление теплового эффекта реакции по закону
Гесса. (Алгоритм 21.)
Задания для самоконтроля.
2.3. Химическое равновесие.
Использование принципа Ле-Шателье. (Алгоритм 22.)
Вычисление константы равновесия реакции.
(Алгоритм 23.)
Вычисление исходных концентраций веществ.
(Алгоритм 24.)
Задания для самоконтроля.
3. Галогены.
Контрольные вопросы.
3.1. Характеристика подгруппы галогенов.
Характеристика галогенов по положению в
периодической системе химических элементов и
строению атомов. (Алгоритм 25.)
3.2. Характеристика веществ.
3.3. Некоторые соединения галогенов и их
свойства.
Задания для самоконтроля.
3.4. Расчетные задачи по теме «Галогены».
Определение массы и плотности газа. (Алгоритм
26.)
Использование объемных отношений газов.
(Алгоритм 27.)
Определение выхода продукта. (Алгоритм 28.)
Определение состава смеси. (Алгоритм 29.)
Задания для самоконтроля.
4. Подгруппа кислорода.
Контрольные вопросы.
4.1. Некоторые соединения кислорода и серы,
их свойства.
4.2. Решение задачи по теме «Подгруппа кислорода».
Задания для самоконтроля.
5. Подгруппа азота.
Контрольные вопросы.
5.1. Некоторые соединения азота и их
свойства.
5.2. Решение задач по теме «Подгруппа азота».
Задания для самоконтроля.
6. Подгруппа углерода.
Контрольные вопросы.
6.1. Решение задач по теме «Подгруппа
углерода»
Задания для самоконтроля.
7. Общие свойства металлов.
Контрольные вопросы.
7.1. Электролиз расплавов.
Электролиз расплавов солей. (Алгоритм 30.)
Электролиз расплавов щелочей. (Алгоритм 31.)
7.2. Электролиз растворов.
Электролиз водного раствора соли. (Алгоритм 32.)
Электролиз водного раствора щелочи. (Алгоритм 33.)
Задания для самоконтроля.
8. Металлы главных подгрупп.
Контрольные вопросы.
8.1. Решение задач по теме «Металлы главных
подгрупп».
Задания для самоконтроля.
9. Металлы побочных подгрупп.
Контрольные вопросы.
9.1. Свойства некоторых соединений металлов
побочных подгрупп.
9.2. Решение задач по теме «Металлы побочных
подгрупп».
Задания для самоконтроля.
10. Металлургия.
Контрольные вопросы.
10.1. Решение задач по теме «Металлургия».
Задания для самоконтроля.
11. Введение в органическую химию.
Контрольные вопросы.
11.1. Предмет органической химии.
11.2. Изомерия.
11.3. Классификация органических соединений.
11.4. Углеводороды.
11.5. Гомологический ряд алканов (предельных
углеводородов).
11.6. Ненасыщенные углеводороды.
11.7. Спирты, карбоновые кислоты.
11.8. Жиры.
11.9. Углеводы, белки.
Тесты для самоконтроля по теме «Введение в
органическую химию».
Литература.
Введение
Учебно-методическое пособие по химии
предназначено для учащихся 9-го класса. Это
логическое продолжение курса химии 8-го класса,
опубликованного в газете «Химия» (№ 31–41/2002).
Пособие наряду с возможностью его использования
в образовательном процессе способно обеспечить
самообразование и самоконтроль с целью
повышения уровня подготовки и качества знаний по
предмету.
Пособие включает материал курса химии 9-го
класса. В каждой теме курса указано, что ученик
должен знать и уметь, перечислены основные
понятия, даны контрольные задания. Перед
практической частью представлен справочный
материал (памятка). Здесь приведены ключевые
теоретические моменты темы, помогающие лучше
понять учебный материал. В некоторые темы курса
включен подраздел «Свойства отдельных
соединений», представляющий собой теоретический
материал, не повторяющий, а дополняющий материал
учебника.
С целью облегчения самоподготовки учащихся по
предмету приведены обучающие задания с
алгоритмами, задачи разного уровня сложности с
образцами решения. Предлагаемые контролирующие
задания содержат как упражнения, проверяющие
теоретические знания, так и расчетные задачи,
отличающиеся по своим дидактическим целям.
Представлен список основной, дополнительной и
справочной литературы.
Учебно-методическое пособие могут использовать
учащиеся общеобразовательной школы с целью
самообразования и коррекции знаний, при
повторении и подготовке к выпускному экзамену, а
также учителя химии для индивидуальной и
групповой работы со школьниками.
Авторы благодарят всех специалистов, чей труд
содействовал изданию пособия. Отдельная
признательность учителю средней школы № 82
Кузьминой Татьяне Юрьевне, любезно
предоставившей для использования в работе
контрольные вопросы.
1. Электролитическая диссоциация
Знать: сущностъ процесса
электролитической диссоциации; смысл ионных
уравнений в свете представлений об
электролитической диссоциации и о строении
вещества; важнейшие свойства кислот, оснований и
солей в свете теории электролитической
диссоциации; качественные реакции на катионы Li+,
Na+, К+, Са2+, Ва2+, Сu2+,
Аg+, Аl3+, NН4+, Fe2+, Fe3+ и
анионы ,
, Сl–, Br
–, I–; условия протекания
реакций ионного обмена.
Уметь: составлять уравнения
диссоциации кислот, щелочей, солей; составлять
полные и сокращенные ионные уравнения реакций;
характеризовать общие свойства кислот,
оснований, солей и выполнять химические опыты,
подтверждающие эти свойства; вычислять по
химическим уравнениям массу (объем, количество
вещества) продукта, если одно из исходных веществ
взято в избытке.
Основные понятия: электролиты,
неэлектролиты, электролитическая диссоциация,
катион, анион, диполь, донор, акцептор,
донорно-акцепторный механизм образования
химической связи, ион гидроксония,
гидратированный ион, кристаллогидрат,
кристаллизационная вода, степень
электролитической диссоциации, реакции ионного
обмена, качественные реакции, гидролиз солей,
сильные и слабые электролиты.
Содержание катионов гидроксония и
гидроксид-ионов выражают через водородный
показатель рН. Значение этого показателя
рассчитывают по концентрации катионов
гидроксония или гидроксид-ионов по формуле:
рН = –lg [H3O+] = 14 + lg [OH–].
В чистой воде значение рН равно 7, в кислотной
меньше 7, а в щелочной больше 7.
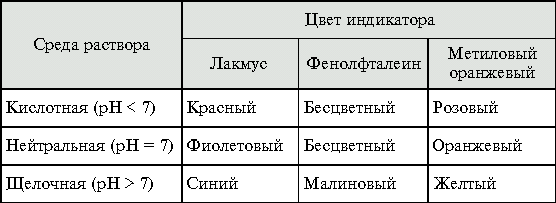
Окраска индикаторов в различных средах
Контрольные вопросы
1. Что называют степенью диссоциации
электролита? От чего она зависит?
2. Приведите примеры сильных и слабых
электролитов.
3. Напишите уравнение диссоциации воды.
4. Чем различаются атомы и ионы?
5. Назовите окрашенные ионы.
6. Дайте определение катионам и анионам.
7. Как протекают реакции ионного обмена?
8. Назовите условия протекания ионных реакций до
конца.
9. Как определить заряд иона электролита? От чего
он зависит?
10. Как определить растворимость вещества в воде?
11. Перечислите свойства кислот, назовите главный
действующий ион кислот.
12. Перечислите свойства щелочей, назовите их
главный действующий ион.
13. Перечислите свойства солей, вспомните способы
их получения.
14. Как амфотерные гидроксиды взаимодействуют с
растворами щелочей?
15. Что называют гидролизом солей?
16. Какие соли могут подвергаться гидролизу?
Приведите примеры уравнений реакций.
17. Какие вещества называют кристаллогидратами?
18. Перечислите формулы и названия наиболее
известных кристаллогидратов.
19. Как ведут себя кристаллогидраты при
нагревании?
20. Как вычислить молекулярную массу
кристаллогидрата?
21. Как вывести молекулярную формулу
кристаллогидрата по массовым долям безводной
соли и воды?
1.1. Уравнения диссоциации
электролитов
Диссоциация протекает в растворах и расплавах.
Растворимые кислоты диссоциируют на ионы
водорода и ионы кислотных остатков.
Растворимые основания распадаются на
положительно заряженные ионы металла и
отрицательно заряженные гидроксид-ионы.
Средние соли диссоциируют на катионы
металлов и анионы кислотных остатков.
Кислые соли распадаются на катионы металлов
и водорода и анионы кислотных остатков.
Катионами являются ионы металлов и
водорода Н+.
Анионами являются ионы кислотных
остатков и гидроксид-ионы ОН–.
Заряд иона численно равен
валентности иона в данном соединении.
При составлении уравнений диссоциации
пользуйтесь таблицей растворимости.
В химической формуле сумма зарядов положительно
заряженных ионов равна сумме зарядов
отрицательно заряженных ионов.
Составление уравнений
диссоциации кислот.
(Алгоритм 1.)
Задание. Составьте уравнение
диссоциации HNO3 и H2SO4.
Составление уравнений
диссоциации щелочей
(растворимых оснований).
(Алгоритм 2.)
Растворимые основания – это гидроксиды,
образованные ионами активных металлов:
одновалентных: Li+, Nа+, К+, Rb+,
Сs+, Fr+;
двухвалентных: Са2+, Sr2+, Ва2+.
Задание. Запишите уравнения
диссоциации гидроксида натрия и гидроксида
бария.
Составление уравнений
диссоциации солей.
(Алгоритм 3.)
Задание. Запишите уравнение
диссоциации хлорида бария, сульфата алюминия,
гидрокарбоната калия.
Задания для
самоконтроля
1. Составьте уравнения диссоциации следующих
электролитов: нитрата цинка, карбоната натрия,
гидроксида кальция, хлорида стронция, сульфата
лития, сернистой кислоты, хлорида меди(II),
сульфата железа(III), фосфата калия,
сероводородной кислоты, бромида кальция,
гидроксихлорида кальция, нитрата натрия,
гидроксида лития.
2. Разделите вещества на электролиты и
неэлектролиты: K3PO4, HNO3, Zn(OH)2,
BaCl2, Al2O3, Cr2(SO4)3,
NO2, FeBr3, H3PO4, BaSO4, Cu(NO3)2,
O2, Sr(OH)2, NaHSO4, CO2, AlCl3,
ZnSO4, KNO3, KHS.
Назовите вещества-электролиты.
3. Составьте формулы веществ, которые могут быть
образованы следующими ионами:
Назовите вещества, составьте уравнения их
диссоциации.
Ответы на задания для
самоконтроля
1.
2. Электролиты: K3PO4
– фосфат калия, HNO3 – азотная кислота, BaCl2
– хлорид бария, Cr2(SO4)3 – сульфат
хрома(III), FeBr3 – бромид железа(III), H3PO4
– фосфорная кислота, Сu(NO3)2 – нитрат
меди(II), Sr(OH)2 – гидроксид стронция, NaHSO4
– гидросульфат натрия, AlCl3 – хлорид
алюминия, ZnSO4 – сульфат цинка, KNO3 –
нитрат калия, KHS – гидросульфид калия, Zn(OH)2
– гидроксид цинка, BaSO4 – сульфат бария.
Неэлектролиты: Al2O3, NO2,
O2, CO2.
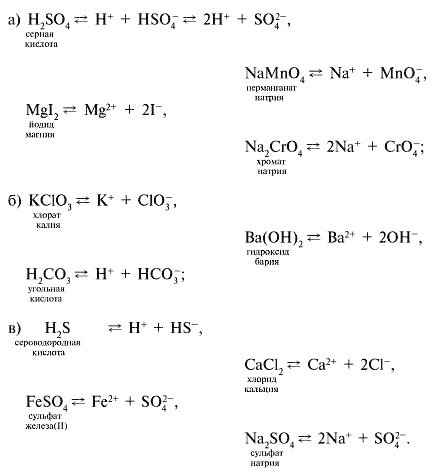
3.
а) Н2SO4, CaSO4, NaMnO4, MgI2, Na2CrO4
и др.;
б) KClO3, Ba(OH)2, AlPO4, H2CO3 и
др.;
в) Н2S, CaCl2, FeSO4, Na2SO4 и
др.
И.М.ХАРЧЕВА,
М.А.АХМЕТОВА
Печатается с
продолжением
Содержание:
Электролитическая диссоциация:
По электрической проводимости вещества делятся на две группы.
Вещества, водные растворы и расплавы которых проводят электрический ток, называются электролитами.
Na2SO4, KNO3, CuCl2, Al2(SO4)3, HCl, HBr, HI, HNO3, H3PO4, H2SO4 и др.
Вещества, водные растворы и расплавы которых не проводят электрический ток, называются неэлектролитами. Нерастворимые в воде неорганические вещества (H2SiO3, SiO2, AgCl, CaSO4 и др.), чистая вода, большинство органических веществ неэлектролиты.
Процесс распада электролитов на ионы при растворении их в воде или расплавлении называется электролитической диссоциацией.
Основные теоретические положения электролитической диссоциации дал в 1887 году шведский ученый Сванте Аррениус. Современная теория электролитической диссоциации состоит из трех основных положений:
1) Электролиты в растворе и в расплаве распадаются (диссоциируют) на ионы, обладающие положительным или отрицательным зарядом
HNO3 

Ионы в растворе находятся в беспорядочном движении в разных направлениях.
2) Под воздействием электрического тока ионы движутся направленно: положительно заряженные ионы направляются к катоду, а отрицательно заряженные ионы – к аноду. Поэтому положительно заряженные ионы называются катионами, а отрицательно заряженные ионы анионами.
3) Диссоциация – обратимый процесс: наряду с распадом молекул происходит также и соединение — ассоциация ионов.
KA 
Ионы и нейтральные атомы отличаются друг от друга как по строению, так и по свойствам. Например:
| 11Na0l s2∕2s22p6∕3s1 Электронная формула атома натрия |
11Na+ls2∕2s22p6/ Электронная формула иона натрия |
| 11Na0l)2e 2)8e 3)1е Схема строения атома натрия |
11Na+l)2e 2)8е Схема строения иона натрия |
| Восстановитель | Окислитель |
Несмотря на все это, С.Аррениус не смог полностью раскрыть сущность процесса электролитической диссоциации. Он не учитывал роль молекул растворителя и полагал, что в водном растворе находятся свободные ионы. При диссоциации электролитов в растворе образуются положительно и отрицательно заряженные частицы, состоящие из одного или нескольких атомов.
| Катионы | Анионы |
| LI+, Na+, K+, Be2+, Ca2+, Mg2+, Fe2+, Fe3+, Cu2+,Hg2+, Ag+ | CO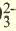 , Cl, S2-, SO , Cl, S2-, SO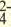 , NO3 , SiO , NO3 , SiO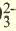 , ClO , ClO2 , ClO , ClO2 |
Причиной разложения электролита на ионы является его взаимодействие с полярными молекулами воды. При растворении в воде любой соли, например, кристаллов хлорида натрия, отрицательные полюсы полярных молекул воды притягиваются к положительно заряженным ионам натрия Na+, а положительные полюсы к отрицательно заряженным хлорид-ионам Cl . В результате растворения в воде ионы отщепляются от кристалла и, перейдя в раствор, гидратируются.
Диссоциация водного раствора хлорида натрия
Наряду с веществами, кристаллическая решетка которых имеет ионное строение, молекулы с полярной ковалентной связью также в воде распадаются на ионы. При растворении в воде хлорида водорода (хлороводорода) с полярно-ковалентной связью под действием полярных молекул воды связь между атомами разрывается. Молекула хлорида водорода распадается на два гидратированных иона. Электронная пара переходит к атому хлора, в результате полярная ковалентная связь превращается в ионную связь.
Диссоциация молекулы хлороводорода
Процесс диссоциации характеризуется степенью диссоциации.
Отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе, называется степенью диссоциации и обозначается знаком а (альфа).
Здесь а показывает степень диссоциации,n число диссоциированных молекул, N– общее число растворенных молекул.
Величина а принимает значения между 0÷1, при выражении в процентах между 0÷100%.
Если α=0, значит, диссоциация не произошла.
Если α=1 или а= 100%, значит, электролит полностью диссоциировал на ионы.
Величина n может принимать разные значения от 0 до N.
Если количество электролита дается в молях:
α= vдис./vобщ. или α=vобщ . 100%
vобщ. — общее растворенное молярное количество вещества.
vдис. — диссоциированное молярное количество вещества.
По значению степени диссоциации электролиты делят на три группы.
| Сильные Электролиты | Электролиты средней силы | Слабые электролиты |
| a ≥ 30% | a=3 ÷ 30% (или 0,03 ÷ 0,3) |
a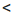 3% 3%(или a 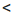 0,03) 0,03) |
| Щелочи: LiOH, NaOH, КОН, RbOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 Растворимые в воде соли, сильные кислоты | Mg(OH)2, H3PO4, H2C2O4 (щавелевая кислота) |
NH4OH, H2CO3, H2S, HCN, H2O, CH3COOH и другие органические кислоты |
Электролиты, которые при растворении в воде или расплаве полностью диссоциируются на ионы, называются сильными электролитами.
Электролиты, которые при растворении в воде или расплавлении частично диссоциируются на ионы, называются слабыми электролитами.
Факторы, влияющие на степень диссоциации
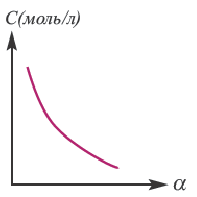
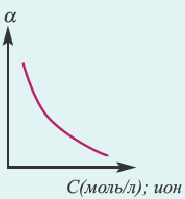
Значение степени диссоциации зависит от ряда факторов.
Природа электролита (характер связи в молекуле электролита). Слабые и средней силы электролиты диссоциируют в растворе частично, а сильные электролиты полностью.
Природа растворителя
Диэлектрическая постоянная показывает, во сколько раз сила взаимодействия между двумя электрическими зарядами, находящимися в определенной среде, меньше по отношению к вакууму. Поскольку диэлектрическая постоянная воды (проникающая способность) при 20oC высокая, способность ионизации также сравнительно высокая. Численное значение ее диэлектрической постоянной (81) показывает, что сила взаимодействия между ионами в растворе с водной средой в 81 раз слабее по сравнению с их силой взаимодействия в кристалле. Если в растворе, приготовленном с одинаковой концентрацией, в качестве среды берется вода, то степень диссоциации бывает сравнительно больше по отношению к растворителям.
Концентрация раствора электролита. При уменьшении концентрации раствора (т.е. разбавлении раствора), вероятность встречи ионов уменьшается и равновесие смещается в сторону ионизации (степень диссоциации повышается). При уменьшении числа столкновений между ионами в разбавленных растворах в заметной степени снижается и скорость образования молекул. Это, в свою очередь, способствует смещению равновесия в сторону диссоциации и повышению степени диссоциации. Значит, степень диссоциации находится в обратной зависимости от концентрации электролита.
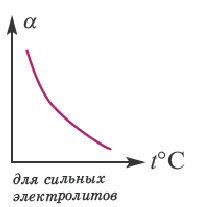
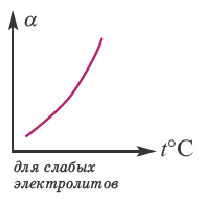
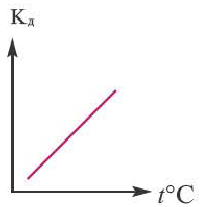
Влияние температуры
В процессе диссоциации электролитов в небольшом количестве поглощается или выделяется тепло. Обычно нагревание раствора на IoC усиливает процесс диссоциации большинства электролитов на 0,05%. При повышении температуры усиливается и электрическая проводимость электролита. Однако это связано как с понижением степени гидратации ионов и вязкости среды, так и с повышением скорости движения ионов. В этом отношении вода занимает особое место. Диссоциация воды эндотермический процесс, который протекает с затратой 57,3 кДж теплоты. Вот почему с повышением температуры повышается и степень диссоциации воды. При нагревании раствора сильных электролитов степень диссоциации понижается, а при нагревании слабых электролитов степень диссоциации повышается.
Влияние концентрации ионов. Повышением или понижением концентрации ионов, образованных в результате диссоциации, можно сместить равновесие. Например, NH4OH диссоциирует на ионы в воде по следующему
уравнению:
NH4OH
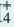
При добавлении в раствор немного NH4CI концентрация иона NH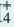
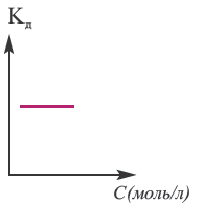
Постоянная диссоциации (Кд). Поскольку значение степени диссоциации зависит от концентрации электролита использование 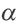
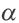
Постоянная диссоциации равна отношению произведения концентраций ионов на концентрацию молекул, не разложившихся на ионы.
Например, формула вычисления постоянной диссоциации для уксусной кислоты следующая:
Поскольку Кд не зависит от концентрации, это постоянная величина. Значение Кд зависит от природы /электролита и растворителя и температуры. Чем больше значение Ka, тем больше диссоциирует электролит.
Электрическая проводимость бывает более высокой в том из растворов с одинаковым мольным количеством растворенных в них различных электролитов, в котором образуется наибольшее количество ионов. В ряду NaCl, FeCl2, AlCl3 в
водном растворе каждого из них электрическая проводимость повышается.
Диссоциация кислот, оснований и солей
Все растворимые кислоты в водных растворах диссоциируют на ионы водорода и кислотных остатков. C точки зрения теории электролитической диссоциации кислотам можно дать такое определение:
Кислоты это сложные вещества, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Диссоциация кислот
Свойства кислот (кислый вкус, воздействие на индикаторы и т.д.) связаны с наличием в растворе гидратированных ионов водорода (Н3О+). Следовательно, общим для кислот является ион водорода H+ (или Н3О+). Отсюда становится ясно, что цвет индикатора меняет ион H+ (или Н3О+).
Одноосновные кислоты диссоциируют одноступенчато, двухосновные кислоты двуступенчато, а трехосновные кислоты (Н3РО4) грехступенчаго. Диссоциация двух- и трехосновных кислот в основном происходит в первой стадии (ступени). При ступенчатой диссоциации каждая последующая ступень протекает более слабо (т.е. при ступенчатой диссоциации процесс диссоциации протекает все медленнее). Основность кислот определяется количеством катионов водорода, образованных в процессе полной диссоциации.
Знак обратимости 
Если скорость распада на ионы больше, чем скорость образования исходных ионов, процесс диссоциации смещается вправо, если меньше то влево.
Диссоциация оснований
Электролиты, при диссоциации которых в качестве анионов образуются только гидроксоионы, называются основаниями.
Растворимые в воде основания называют щелочами. Как известно, кислотность оснований определяется количеством гидроксильных ионов (ОН ) в их молекуле. Количество гидроксильных групп показывает кислотность основания. Однокислотные щелочи диссоциируют одноступенчато, двукислотные щелочи двуступенчаго. Цвет индикагора также меняется под действием гидроксильного иона (ОН ).
Основания, которые в процессе диссоциации образуют как ион H+ так и ионы ОН , называют амфотерными гидроксидами. Амфотерные гидроксиды, взаимодействуя и с кислотами, и с основаниями, образуют соль и воду.
2OH + Zn2+ 
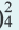
Диссоциация солей
Вещества, образующие в процессе диссоциации катион металла (или аммония) и анион кислотного остатка, называются солями.
В зависимости от вида, соли диссоциируют по-разному. Нормальные, двойные и смешанные соли диссоциируют одноступенчато.
Нерастворимые в воде соли (осадки) не диссоциируют. Они могут диссоциировать только в виде расплавов.
Кислые соли диссоциируют ступенчато. Гидросоли диссоциируют двуступенчато, а дигидросоли трехступенчаго. Процесс диссоциации постепенно, поступенчато, слабеет.
Основные соли также диссоциируют ступенчато: гидроксосоли диссоциируют двуступенчато, дигидроксосоли трехступенчато.
Реакции ионного обмена
Реакции обмена, протекающие между водными растворами электролитов, в прошлых разделах мы показывали молекулярными уравнениями. В действительности же, в этих реакциях участвуют не молекулы электролитов, а их диссоциированные ионы.
Взаимодействие водных растворов электролитов называют ионными реакциями, а уравнения таких реакций ионными уравнениями. Уравнение, полученное при сокращении ионов, не участвующих в реакции, называется сокращенным ионным уравнением.
Чтобы понять условия протекания реакций ионного обмена, нужно знать их важнейшие свойства.
Свойства ионов
Вам уже известно, что ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из них характерны специфические химические свойства.
При составлении ионных уравнений соблюдаются следующие правила:
- Полное уравнение реакции записывается в молекулярном виде. Т.е. химические формулы участвующих в реакции исходных веществ и конечных продуктов записываются вместе с их коэффициентами.
- Малодиссоциирующие (вода и в основном органические вещества), малорастворимые (осадок) и газообразные вещества записываются в молекулярной форме.
- Сильные электролиты, как полностью диссоциирующие вещества, записываются в ионном виде (такие уравнения называют полным ионным уравнением).
- Не участвующие в реакции ионы сокращаются. Уравнение, в котором указаны лишь участвующие в реакции ионы, называется сокращенным ионным уравнением.
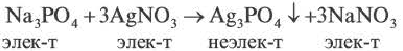
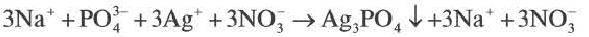
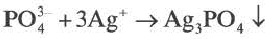
Если при реакциях заряды ионов не меняются, такие реакции называются реакциями ионного обмена.
Реакции ионного обмена протекают до конца в трех случаях:
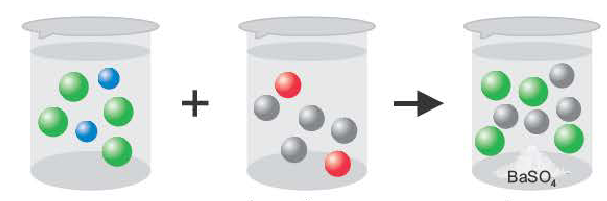
Если образуется осадок.
BaCI2 + Na2SO4 = BaSO4↓ + 2NaCI
Ba2++2CI + 2Na++SO
Ba2++SO
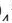
Если получается слабодиссоциирующее вещество (например: вода)
H++CI +Na++OH = Na+ + Cl + H2O
H++ОН =H2O
Если получается газообразное вещество.
2H++2CI + 2Na++S2 = H2S↑ + 2Na+ + 2CI
2H++S2 =H2S↑
Полное ионное уравнение и сокращенное ионное уравнение реакций, протекающих с участием или с образованием двух и более неэлектролитов, бывают одинаковыми.
Реакции ионного обмена используются для определения того или иного вещества или иона.
| Определяемый ион | Реактив, coσι ветствующнй иону (определитель) | Признаки реакции |
| H+(кислота) | индикатор | Изменение цвета |
| Cu2+ | OH- (щелочь) | Синий осадок |
| Fe2+ | Зеленоватый осадок, принимающий со временем бурый цвет | |
| Fe3+ | Осадок бурого цвета | |
| Zn2+ | Белый осадок, при избытке ОН растворяется | |
| Al3+ | Студенистый белый осадок | |
| Mg2+ | Белый осадок | |
| NT4+ | C запахом аммиака | |
| Cr3+ | Темно-зеленый осадок | |
| Cl– | Ag+ (AgNO3) |
Белый осадок |
| Br– | Желтоватый осадок | |
| l– | Газ без запаха, вызывающий помутнение известковой воды | |
CO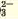 |
H+ (сильная кислота) | Белый осадок |
SO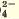 |
Ba2+ | Желтый осадок |
РО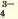 |
Ag+ | Черный осадок |
| S2- | Cu2+ | Черный осадок |
| Pb2+ | Черный осадок | |
| Zn2+ | Белый осадок | |
| Cd2+ | Желтый осадок | |
| Ca2+ | SO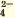 |
Белый осадок |
CO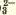 |
Белый осадок | |
| F– | Mg2+ | Желтый осадок |
| ОН– | индикатор | Изменение цвета |
| СН3СОО– | H+ (сильная кислота) | Уксусный запах |
Обменные реакции в растворах электролитов протекают только тогда, когда хотя бы одно из образованных в результате этих реакций веществ является малодиссоциирующим, или нерастворимым (осадком), или же находится в газообразном состоянии.
Сумма коэффициентов сокращенного ионного уравнения реакций, протекающих с образованием лишь одного неэлектролита (осадка или мало диссоциирующего вещества) всегда на 1 единицу бывает больше суммы ионов, образующих этот неэлектролит.
| Слабые электролиты и неэлектролиты | Сумма коэффиниентов сокращенного ионного уравнения его образования |
| СаСО3, MgCO3, ВаСО3, CaSO4, BaSO4, PbSO4, SrSO4, ZnCO3, CuS, PbS, ZnS, CdS, AgCl, Н2О, HCOOH, CH3COOH и др. | 3 |
| Be(OH)2, Mg(OH)2, Zn(OH)2, Fe(OH)2, Cr(OH)2, Cu(OH)2, PbCl2, Mn(OH)2, MgF2 и др. | 4 |
| Al(OH)3, Fe(OH)3, Cr(OH)3, Ag3PO4 и др. | 5 |
| Ca3(PO4)2, Ba3(PO4)2 и др. | 6 |
Растворы ионов, вступающих друг с другом в реакцию с выпадением осадка, вы делением газообразного вещества, образованием воды и мало диссоциирующего вещества, невозможно держать в одном сосуде.
Если ионы в растворе не образуют вещества, которые мало диссоциируют между собой, трудно растворяются и выделяются в виде газа, то между их растворами реакция не протекает до конца и растворы таких ионов можно держать в одном сосуде.
Следовательно, если при взаимодействии электролитов между собой не выпадает осадок, не выделяется газ и не образуются вода и органическое вещество, то такие реакции не протекают до конца. Примеры не протекающих в растворе реакций:
Na2SO4+Cu(NO3)2 → NaNO3 + BaCl2→ NaNO3 + KOH→
Соли, находящиеся в виде осадка, не вступают в реакцию с щелочами, основания в виде осадка не вступают в реакцию с солями, соли в виде осадка не вступают в реакцию с другими солями.
Электролиз
Электролиз это окислительно-восстановительные реакции, протекающие на электродах, если через раствор или расплав электролита пропускают постоянный электрический ток. В результате электролиза электрическая энергия превращается в химическую энергию. При пропускании через электролитический раствор или расплав постоянного электрического тока хаотическое движение ионов урегулируется, катионы (положительно заряженные ионы) движутся в сторону катода, а анионы (отрицательно заряженные ионы) в сторону анода и, теряя заряды, превращаются в нейтральные атомы или молекулы. В результате на катоде протекает процесс восстановления, а на аноде процесс окисления. В процессе электролиза между участками катода и анода существуют перегородки.
Электролизная ванна
Электролиз расплавов электролитов. Если через расплавы электролитов пропустить постоянный электрический ток, то происходит электролиз. При электролизе расплавов на катоде всегда восстанавливается катион, а на аноде окисляется анион. При электролизе расплавов любых солей, кроме солей аммония, на катоде всегда образуется металл. Рассмотрим процесс электролиза расплавленного хлорида натрия NaCl и гидроксида натрия (NaOH).
Электролиз расплава хлорида натрия
На катоде: Na+ + е → Na° восстановление
На аноде: Cl е → Cl° окисление
2Na++2Cl 
2NaCl
На катоде: Na+ + e– → Na0 восстановление
На аноде: OH–-e–→OH0 окисление
4OH0→2H2O+O2↑
4NaOH 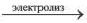
Электролиз расплава гидроксида натрия
Электролиз расплавов солей кислородсодержащих кислот в школьном курсе не изучается.
Г. Дэви, не зная химических свойств выделенного при электролизе металла, наполнил изготовленный из калия тигель водой. Как только вода соприкоснулась с металлом, произошел взрыв. Осколки тигеля и капли расплавленного металла попали в лицо Дэви. Он потерял правый глаз и получил глубокую рану. Рубцы, образовавшиеся на его лице во время взрыва, оставались до конца его жизни.
Электролиз водных растворов электролитов
При электролизе растворов электролитов характер происходящих на электродах электрохимических процессов зависит от природы иона, растворителя, концентрации электролита, материала, из которого изготовлен электрод, температуры, напряжения тока и других факторов. Для того, чтобы заранее определить на основе формулы солей, какие вещества будут образованы на электродах при электролизе водных растворов солей, следует знать следующие правила.
1. При электролизе растворов солей металлов, расположенных в электрохимическом ряду напряжения металлов начиная слития, включая алюминий (Li, К., Ca, Na, Mg, Al), на катоде молекулы воды восстанавливаются с выделением водорода.
На катоде: 2H2O + 2e → H2↑ +2ОН
2. При электролизе же растворов солей бескислородных кислот (НО, HBr, HI, H2S) этих металлов кислотный остаток на аноде окисляется с получением многоатомного простого вещества, и в растворе образуется основание, т.е. масса соли уменьшается.
При электролизе растворов солей кислородсодержащих кислот этих металлов (Li, Na, К, Ca, Ba, Mg, Al) вода на аноде окисляется с выделением кислорода (О2), на катоде вода восстанавливается с выделением водорода. Масса соли не изменяется. Поскольку при электролизе растворов этих солей соль не разлагается, концентрация раствора повышается.
Na2SO4 +2H2O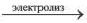
При электролизе водных растворов щелочей LiOH, NaOH, KOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 происходит такой же процесс. Т.е. на катоде вода восстанавливается а на аноде вода окисляется.
NaOH + 2H2O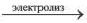
3. При электролизе растворов солей металлов, расположенных в ряду напряжения металлов между алюминием и водородом (Mn, Zn1 Cr, Fe, Ni,Sn, Pb), на катоде ионы металла вместе с молекулами воды восстанавливаются с выделением металла и водорода. На аноде вода окисляется, выделяется кислород. (Электролиз растворов бескислородных солей этих металлов в школьном курсе не изучается).
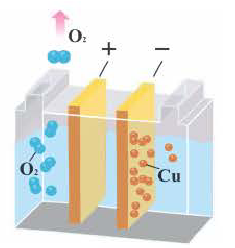
4. При электролизе растворов солей металлов, расположенных в электрохимическом ряду напряжения металлов после водорода (Cu, Hg1 Ag, Pt, Au), на катоде восстанавливаются только ионы металла с получением металла. Из этих металлов при электролизе растворов солей бескислородных кислот меди Cu на аноде кислотный остаток окисляется, получается соответствующее простое вещество. Масса воды не меняется. Следовательно, при электролизе как расплавов, так и растворов CuCh, CuBr2, CuI2, на электродах всегда получается один и тот же продукт (на катоде металл, на аноде галоген).
5. При электролизе растворов солей кислородсодержащих кислот этих металлов (например, Cu(NO2)2, CuSO4, AgNО3, Hg(NO3)2) вода на аноде окисляется с выделением кислорода (O2), в растворе образуется кислота. Значит, при элекгролизе растворов солей этих металлов соль всегда подвергается разложению, концентрация соли уменьшается.
Электролиз водного раствора CuSO4
2CuSO4 + 2H2O 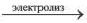
4AgNO3 + 2H2O
При электролизе как расплавов, так и растворов солей бескислородных кислот (НС1, HBr, HI, H2S) на аноде кислотные остатки, окисляясь, превращаются в соответствующие простые вещества. Последовательность окисления кислогных остатков на аноде представлена в следующем виде:
При проведении электролиза раствора смеси нескольких солей, в первую очередь, на аноде выделится S, при отсутствии этого элемента l2, при его отсутствии Вr2, при его отсутствии С12, при его отсутствии О2.
При электролизе растворов солей HF (MeFa) на аноде ионы F не окисляются, окислению подвергаются молекулы воды. Значит, процесс окисления 2F 2e → F2 в водном растворе не происходит. Процесс окисления возможен лишь при электролизе расплава.
При электролизе водных растворов солей кислородсодержащих кислот (HNO3, H2SO4, H3PO4, Н2СО3 и др.) на аноде окисляется не кислотный остаток, а вода с выделением кислорода (O2).
При электролизе растворов смеси солей различных металлов первоочередная последовательность восстановления металлов на катоде следующая:
Факторы, влияющие на процесс электролиза. Процесс электролиза связан с электропроводной способностью растворов. Способность растворов к электрической проводимости зависит, в первую очередь, от концентрации ионов. Чем больше концентрация ионов, тем сильнее электропроводность раствора. Например, среди растворов солей KCl, Ba(NO3)2, А1С13 с концентрацией в 1 моль/л (т.е. 1 М) каждой из них (при одинаковой а) наибольшая электрическая проводимость будет у А1С13. Это обусловлено тем, что раствор этой соли обладает как наибольшим количеством ионов, так и более высокой концентрацией.
Применение электролиза. Электролиз применяется при получении активных металлов (Na, К, Ca, Mg, Al), меди (Сu), некоторых неметаллов (Cl2, F2) и щелочей (NaOH, КОН). Электролизом также пользуются для покрытия поверхности металлических предметов никелем, хромом, цинком, оловом, золотом и другими стойкими против коррозии металлами.
Гидролиз
Несмотря на отсутствие ионов H+ и ОН в составе нормальных солей, их водные растворы показывают щелочную, кислую или нейтральную реакцию. Эта особенность водных растворов солей объясняется гидролизом hidro вода, Iizis разложение).
Реакции, протекающие с образованием слабых электролитов в результате взаимодействия ионов соли и молекул воды, называются гидролизом солей. Другими словами, гидролизом называют разложение солей под воздействием воды.
В зависимости от природы солей, они подвергаются или не подвергаются гидролизу. Если хотя бы одна из кислот или оснований, образующих соль, будет слабой, то такая соль подвергается гидролизу. Нерастворимые в воде соли гидролизу не подвергаются.
Так как гидролиз является обратимым процессом, в системе образуется динамическое равновесие. Гидролиз солей, образованных из многоосновных кислот или многокислотных оснований, протекает ступенчато. Гидролизные реакции записываются как в виде молекулярного, так и в виде ионного уравнений.
Для составления краткого ионного уравнения гидролиза следует:
- а) написать уравнение диссоциации соли;
- Ь) определить природу аниона и катиона (установить катион слабого основания или анион слабой кислоты);
- с) написать полное ионное уравнение реакции (так как вода является неэлектролитом, ее формулу оставить как есть);
- d) путем сокращения ионов, не участвующих в реакции, определить краткое ионное уравнение.
По наличию или отсутствию процесса гидролиза соли подразделяются на четыре группы:
- Соли, образованные сильными кислотами (HNO3, H2SO4, HCl, HBr, HI) и сильными основаниями (LiOH, NaOH, КОН, RbOH, CsOH, Ca(OH)2, Sr(OH)2).
- Соли, образованные сильными кислотами и слабыми основаниями (Me(OH)n Me
Be, Mg, Zn, Al, Cr, Fe, Cu,Hg, Ag, Mn, NH4 и др.).
- Соли, образованные слабыми кислотами (H3PO4, H2SO3, H2CO3, H2S, H2SiO3, HCOOH, CH3COOH и др.) и сильными основаниями.
- Соли, образованные слабыми кислотами и слабыми основаниями.
При гидролизе реакция среды определяется природой соответствующих кислоты и основания, образующих соль, иными словами, соотношением концентраций ионов H+ и ОН.
При N(H+) N(ОH ) среда бывает нейтральной; при N(H+)
Рассмотрим отдельно гидролиз группы солей, указанных выше.
1. Соли, образованные сильными кислотами и сильными основаниями (Na2SO4, K2SO4, Me(NO3)n, MeXn,Me =

2. Соли, образованные сильными кислотами и слабыми основаниями (Mex(SO4)y; MeXn);
X 

Me(NO3)n Me 
Определим ступени гидролиза Al(NO3)3.
I. Al(NO3)3 + H2O
Al3++ 3NO

AP++ H2O
II. Al(OH)(NO3)2 + H2O 
(AlOH)2+ + 2NO


(AlOH)2+ + H2O (A1(OH )2)+ + H+
III. Al(OH)2NO3 + H2O 
(Al(OH)2)+ + NO3 + H2O 
A1(OH)2)++ H2O 
Таким образом, гидролиз солей, образованных много кислотными основаниями, протекает ступенчато. Так как в результате скопления ионов H+ равновесие смещается влево, II и III ступени протекают очень слабо.
Из этого примера можно сделать такой вывод, что при гидролизе солей, образованных слабыми основаниями и сильными кислотами, гидролиз обуславливается каnионом (вот почему гидролиз таких солей называют гидролизом по катиону), среда реакции бывает кислой, лакмус окрашивается в красный цвет.
Если валентность металла и кислотного остатка равна двум, то на первой ступени гидролиза таких солей получается основная соль, число ступеней гидролиза равно валентности кислотного остатка.
I ступень. 2CuSO4 + 2H2O 
II ступень. (CuOH)2SO4 + 2H2O 
3. Соли, образованные сильными основаниями и слабыми кислотами (Na3PO3, K3PO4, HCOONa, HCOOK, CH3COOK, Na2CO3, K2CO3, Na2S, K2S, Na2SiO3, K2SiO3 и др.), подвергаются гидролизу, при этом среда показывает щелочную реакцию, лакмус окрашивается в синий цвет. Если валентность катиона меньше валентности аниона, то гидролиз соли протекает ступенчато (гидролиз в основном протекает на 1-ой ступени). Если валентность металла меньше валентности кислотного остатка, на 1-ой ступени гидролиза всегда получается кислая соль, число гидролизных ступеней бывает равным валентности кислотного остатка.
Так как при гидролизе этих солей анион подвергается гидролизу, то такой гидролиз называют гидролизом по аниону.
I. Na2S + H2O 
2Na+ + S2-+ H2O
S2- + H2O 
II. NaHS + H2O 
Na+ + HS– + H2O 
HS + H2O 
C увеличением концентрации скопившихся ионов ОН равновесие смещается влево. Поэтому гидролиз протекает только на 1-ой ступени.
4. Соли, образованные слабыми основаниями и слабыми кислотами ((NH4)2S, (NH4)2CO3, HCOONH4, CH3COONH4, Al2S3, Cr2S3), легче подвергаются гидролизу, среда реакции в основном нейтральная, цвет лакмуса (фиолетовый) не меняется. Так как при гидролизе этого типа солей гидролиз обуславливается как катионом, так и анионом, вид гидролиза определяется как по катиону, так и по аниону. Иногда при гидролизе такого типа солей реакция среды зависит от величины константы диссоциации кислоты и основания, полученных в результате диссоциации.
Но так как константа диссоциации (1,8∙ 10-5) гидроксида аммония (NH4OH), образованного при гидролизе карбоната аммония (NH4)2CO3), больше константы диссоциации иона НСО3 (4,8∙ 10-11), раствор проявляет слабое основное свойство,
(NH4)2CO3+H2O 
NH4+CO3 +H2O 
Так как гидролиз является обратимым процессом, то если исключить полученные продукты из среды реакции, т.е. при образовании нерастворимых в воде основания и кислоты, гидролиз протекает до конца.
Al2S3+ 6H2O 
Cr2S3 +6H2O 
Факторы, влияющие на гидролиз
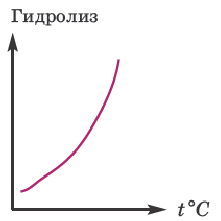
Влияние температуры:
Усиление гидролиза при нагревании раствора нормальной соли объясняется возрастанием диссоциации воды, являющейся эндотермическим процессом.
H2O 
Наоборот, при охлаждении раствора соли гидролиз ослабевает.
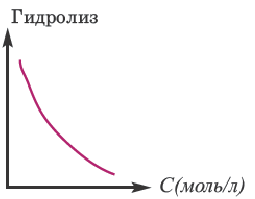
Влияние концентрации раствора:
При увеличении концентрации раствора соли (т.е. при добавлении одной и той же соли) гидролиз ослабевает.
Значит, для усиления гидролиза нормальной соли одновременно следует уменьшить концентрацию раствора (путем добавления воды) и увеличить температуру. Эти последовательности выражены посредством представленных графиков.
Для ослабления или предотвращения гидролиза следует добавить в раствор вещество или же той же соли, создающих среду. Если при гидролизе соли среда кислая, то при добавлении в раствор кислоты, создающей эту среду, гидролиз ослабевает. Точно так же, если среда основная, то добавлением в раствор этой же щелочи можно ослабить гидролиз. Например, для ослабления гидролиза Na2CO3 в раствор следует добавить создающую среду NaOH, при гидролизе AI2(SO4)3 добавить создающую среду H2SO4 или соответствующую соль.
Растворы солей, подвергающихся гидролизу, нельзя хранить в посуде, изготовленной из амфотерных металлов (Be, Zn и Al). Потому что, независимо от того, кислая это или щелочная среда, эти металлы (Be, Zn, Al), будучи амфотерными, вступят в реакцию с веществом, создающим среду.
Водный раствор любой соли нельзя хранить в посуде, изготовленной из металла, более активного по сравнению с ее катионом. Потому что металл, из которого изготовлена посуда, вытеснит катион соли.
В ряду электрохимической напряженности металлов начиная с Mg, каждый металл вытесняет следующие после него металлы из водного раствора их солей. Щелочные (Li, Na, К) и щелочноземельные металлы (Ca, Sr, Ba) не вытесняют ни один металл из водного раствора их солей, так как они, в первую очередь, вступая в реакцию с водой, выделяют Н2.
Степень гидролиза. Для количественной характеристики гидролиза солей используют понятие степень гидролиза (αг).
Степень гидролиза (αг) равна отношению числа подвергнутых гидролизу молекул (nг) к их исходному числу (Nг), то есть:
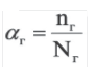
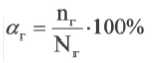
По мере повышения температуры степень гидролиза возрастает. Причиной этого является усиление диссоциации воды под действием температуры. Если в кислую среду, образованную в результате гидролиза, добавить кислоту, а в основную среду добавить щелочь, степень гидролиза уменьшится.
Гидратная теория
Представления о процессе электролитической диссоциации в дальнейшем были развиты в трудах русских ученых Ивана Алексеевича Каблукова и Владимира Александровича Кистяковского. Чтобы понять сущность представлений этих ученых, хотя бы вкратце рассмотрим явления, которые происходят при растворении веществ в воде.
При растворении в воде твердого гидроксида калия KOH или концентрированной серной кислоты H2SO4 происходит явление сильного разогревания. Необходимо осторожно растворять серную кислоту, так как из-за повышения температуры часть воды испаряется и под давлением пара может выбросить кислоту из сосуда. Чтобы этого избежать, серную кислоту тонкой струей наливают в воду (но не наоборот) при постоянном помешивании.
Если растворять аммонийную селитру (нитрат аммония) (NH4NO3) в тонкостенном стакане, поставленном на мокрую дощечку, то наблюдается столь сильное охлаждение, что стакан даже примерзает к ней. Почему при растворении веществ в воде в одних случаях наблюдается процесс разогревания, а в других охлаждения? При растворении твердых веществ происходит явление разрушения их кристаллических решеток и распределения образующихся частиц между молекулами растворителя. При этом необходимая энергия поглощается извне. Значит, разрушение кристаллических решеток твердых веществ (солей, щелочей) при их растворении в воде эндотермический процесс. Почему же при растворении некоторых веществ раствор разогревается?
Как вам известно, выделение теплоты это один из признаков химической реакции. Следовательно, при растворении происходит и химическая реакция. Например, молекулы серной кислоты реагируют с молекулами воды и образуются соединения состава H2SO4 ∙ Н2О (моногидрат серной кислоты) и H2SO4∙ 2Н2О (дигидрат серной кислоты). Иными словами, молекула серной кислоты присоединяет одну или две молекулы воды. Взаимодействие молекул серной кислоты с молекулами воды относится к реакциям гидратации, а вещества, которые при этом образуются, называются гидратами. Процесс же гидратации является экзотермическим.
При растворении твердых веществ (солей, щелочей и др.) в воде происходят как физический, так и химический процессы. Если энергии гидратации бывает больше энергии, которая гратится на разрушение кристаллической решетки вещества, то растворение сопровождается разогреванием, если наоборот охлаждением. Следовательно, растворение – это физико-химический процесс. Такое объяснение процесса растворения и природы растворов впервые было теоретически обосновано великим русским ученым Д.И.Менделеевым, и им была разработана гидратная теория растворов.
При выпаривании раствора вещество (щелочи, соли) обычно выделяется в виде кристаллов, содержащих химически связанную воду. Например, если к сульфату меди (II) (порошок белого цвета) прилить воду, то происходит процесс разогревания и получается раствор голубого цвета. При выпаривании воды выделяется кристаллическое вещество голубого цвета медный купорос, имеющий состав CuSO4∙ 5Н2О.
При прокаливании медного купороса (кристаллогидрат сульфата меди(II) происходит выделение (дегидратация) воды.
Кристаллические вещества, в состав которых входит химически связанная вода, называются кристаллогидратами, а воду, входящую в состав кристаллов, называют кристаллизационной водой.
| Кристаллогидраты | Гидраты |
| FeSO4∙ 7H2O железный купороса SO4∙ 2Н2О природный гипс Na2CO3 ∙ 10H2O кристаллическая сода Na2SO4 ∙ 10H2O глауберова соль MgSO4 ∙ 7H2O горькая соль CuSO4 ∙ 5H2O медный купорос (синий камень) |
H2SO4∙ H2O |
При изучении процессов гидратации нужно выяснить вопрос: с какими частицами вода вступает в реакцию?
И.А.Каблуков и В.А. Кистяковский независимо друг от друга предположили, что с молекулами воды реагируют ионы электролитов, то есть происходит гидратация ионов. Эта идея в дальнейшем подтвердилась. Так, например, было выяснено, что безводные ионы Cu2+ и SO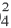
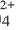
Установлено также, что при диссоциации молекул кислот получаются не свободные ионы водорода, а их гидраты – ионы гидроксония (Н3О+) или оксоний.
НNO3+nН2O
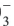
В краткой форме H+ + H2O → H3O+
Растворение галогеноводородов, щелочей, концентрированных HNO3 и H2SO4 является экзотермическим, а растворение большинства солей эндотермическим процессом.
В водном растворе всех неорганических кислот, кроме H2SiO3, всегда присутствует ион гидроксония.
Поскольку в большинстве случаев число молекул воды, присоединенных в растворе к иону, неизвестно, уравнения процессов электролитической диссоциации в краткой форме можно записать так:
NaOH
NaCl 
Na3PO4 
HNO3 
H2SO4 
HSO4 
Теория электролитической диссоциаци
Электролиты и неэлектролиты:
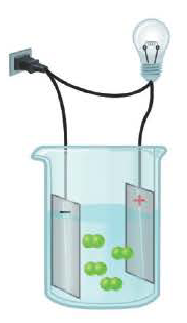
Проводит ли раствор поваренной соли электрический ток? А раствор сахара?
Вы хорошо знаете, что металлы обладают свойством проводить электрический ток. Проводят ли электрический ток другие вещества? Об этом мы узнаем из следующего опыта.
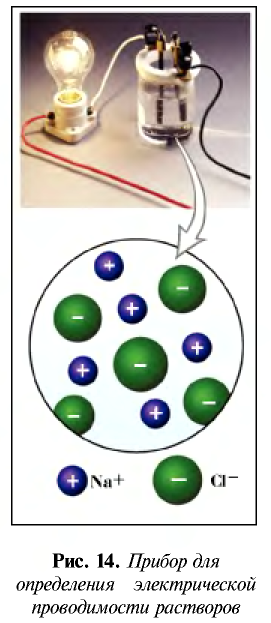
Соберем прибор, показанный на рис. 14, поместим его электроды в поваренную соль и подключим к сети постоянного электрического тока. Лампочка не загорается.
При опускании электродов в дистиллированную воду лампочка также не загорается. Следовательно, твердая поваренная соль и дистиллированная вода не пропускают электрический ток.
Теперь опустим электроды в водный раствор поваренной соли. Лампочка загорается. Следовательно, водный раствор поваренной соли проводит электрический ток.
Таким способом можно проверить электрическую проводимость любого вещества.
В зависимости от проводимости или непроводимости электрического тока все вещества подразделяются на две группы: электролиты и неэлектролиты.
- Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами. К электролитам относятся кислоты, щелочи и соли,
- Вещества, водные растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
К неэлектролитам относятся вещества с неполярной ковалентной связью, метан, диоксид углерода, сахар, спирты и дистиллированная вода.
Электролиты проводят электрический ток только в растворенном в воде или расплавленном состоянии. В кристаллическом состоянии они плохо проводят или вообще не проводят электрический ток.
Элементы знаний, умений и навыков: электролиты, неэлектролиты, умение определять электропроводимость различных веществ.
Почему электролиты проводят электрический ток только в водном растворе или в расплаве
Почему водные растворы или расплавы электролитов проводят электрический ток, а водные растворы неэлектролитов не пропускают его?
На этот вопрос дал ответ в 1887 г. шведский ученый С. Аррениус, создавший теорию электролитической диссоциации. За научные исследования в области электролитов С. Аррениус в 1903 г. был удостоен Нобелевской премии.
Согласно этой теории, все электролиты — соли, кислоты, а также щелочи — при растворении в воде или в расплаве разделяются на ионы. Например:
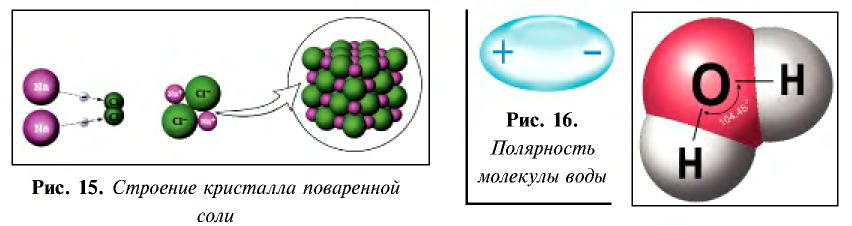
Ионы — это положительно заряженные (катионы) или отрицательно заряженные (анионы) частицы. Частицы могут быть представлены также одним или группой из нескольких атомов. Однако атомы и ионы резко отличаются друг от друга. Так, натрий, обладая едким свойством, является сильным восстановителем, хлор, будучи сильным ядом, является окислителем. А поваренная соль, состоящая из ионов натрия и хлора, вам хорошо известна (табл. 18).
Таблица 18
Электронное строение атомов и ионов натрия и хлора
Распад на ионы соединений с ионной связью при образовании водных растворов называется диссоциацией. Этот процесс можно объяснить следующим образом. Вы уже знаете, что поваренная соль в твердом состоянии не пропускает электрический ток. При растворении в воде она разделяется на ионы, так как:
- кристаллы поваренной соли представляют собой соединения с ионной связью и в узлах их кристаллической решетки расположены ионы (см. рис. 15);
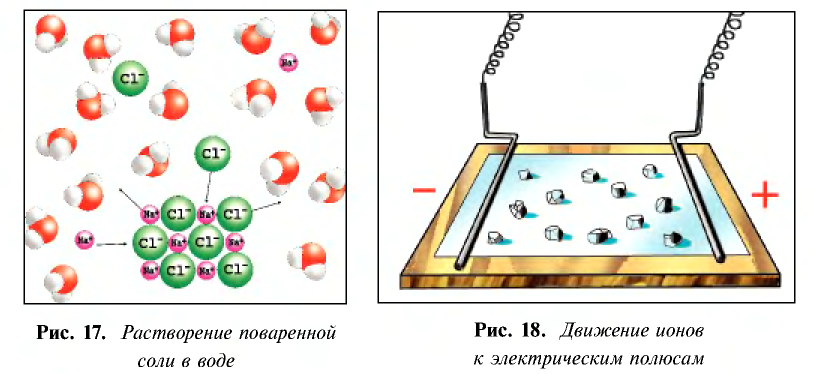
- молекула воды образована за счет полярной ковалентной связи и имеет строение, показанное на рис. 16;
- поваренная соль при растворении в воде диссоциирует по схеме, показанной на рис. 17.
Таким образом, при растворении в воде кристаллы поваренной соли под воздействием поляризованных молекул воды образуют гидра-тированные ионы.
Атомы водорода и металлов превращаются в катионы, отдавая электроны, а атомы аммиака — присоединяя протоны за счет электронной пары, не участвующей в образований химической связи (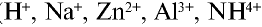
Кислотные остатки и гидроксильные группы являются анионами. В электрическом поле движение ионов происходит следующим образом (см. рис. 18).
Положительно заряженные ионы притягиваются катодом. Поэтому их называют катионами.
Отрицательно заряженные ионы притягиваются анодом, поэтому их называют анионами.
Соли и щелочи при плавлении также делятся на ионы за счет усиления колебательных движений частиц, приводящих к ослаблению связей между ними.
Кислоты представляют собой сильно поляризованные молекулы и при растворении в воде тоже распадаются на ионы, но этот процесс происходит у них иначе, чем у солей и щелочей:
При растворении хлорида водорода в воде атом водорода отдает электрон и переходит в молекулу воды. В результате образуется ион хлора с одним лишним электроном и ион Н30+ (гидроксония) с одним присоединенным протоном (ядро атома водорода). Следовательно, при растворении в воде НС1, 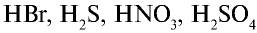
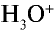
Изучая донорно-акцепторную связь, вы узнали, что 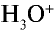
Уравнение диссоциации кислот обычно записывают в более кратком виде.
Элементы знаний, умений и навыков: элекролитическая диссоциация, теория электролитической диссоциации, катионы, анионы, ионы, ионная кристаллическая решетка, гидроксоний.
Диссоциация кислот, щелочей и солей
При диссоциации каких веществ образуются только ионы водорода?
Кислоты
Все кислоты, растворимые в воде, диссоциируют. При их диссоциации образуются ионы водорода и кислотный остаток:
Диссоциация многоосновных кислот протекает в несколько этапов:
Общие свойства кислот — кислый вкус, изменение цвета индикатора, способность вступать в реакцию с основаниями, основными оксидами и солями — объясняются образованием ионов водорода при их диссоциации. Исходя из этого можно дать следующее определение кислотам.
— Кислотами называются сложные вещества, при диссоциации которых в качестве катиона образуются только ионы водорода.
Основания
При диссоциации всех водорастворимых оснований выделяются катионы металла (ион гидроксида аммония 
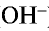
Все свойства, присущие водорастворимым основаниям — изменение цвета индикатора, способность вступать в реакцию с кислотами, кислотными оксидами и солями,— зависят от ионов 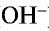
— Основаниями называются сложные вещества, при диссоциации которых в качестве аниона образуются только ионы гидроксида (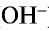
Соли
При диссоциации солей образуются катионы металла (в аммониевых солях катион 
Кислые соли диссоциируют, помимо ионов металла, на ионы водорода:
При диссоциации солей не образуются общие для всех солей ионы, поэтому они не имеют общих свойств.
— Солями называются сложные вещества, при диссоциации которых наряду с катионами металла образуются анионы кислотного остатка (а в кислых солях и катионы водорода).
Элементы знаний, умений и навыков: кислоты, щелочи и соли с точки зрения теории электролитической диссоциации. Многостадийная диссоциация.
Сильные и слабые электролиты
Почему уксусная кислота считается слабым электролитом?
— Отношение числа диссоциированных молекул к исходному числу растворенных молекул называется степенью диссоциации электролита, которая обозначается буквой а:
Степень диссоциации выражается в долях единицы или в процентах.
Если степень диссоциации равна 0,5, то это значит, что каждая из двух молекул распалась на ионы. Если а — 1, то на ионы распались все молекулы. При выражении степени диссоциации в процентах ее значение определяется так: если из ста молекул распались на ионы 85, то а будет равна 85%. Степень диссоциации зависит от природы растворенного электролита и растворителя, концентрации раствора, температуры среды. Поэтому вместе со степенью диссоциации указываются концентрация раствора и температура. Например, степень диссоциации 0,05 М серной кислоты при 18°С составляет 58 %.
— Электролиты с относительно высокой степенью диссоциации называются сильными.
Они практически полностью диссоциируют в растворах любой концентрации. Большинство солей (
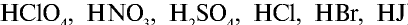
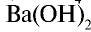
— Электролиты, степень диссоциации которых низка даже в разбавленных растворах, называются слабыми.
Все органические и некоторые неорганические кислоты (H2C03, НС10, H,S, HN02, H2C03, H2Si03, НС102 и др.), гидроксид аммония, нерастворимые гидроксиды металлов, вода считаются слабыми электролитами.
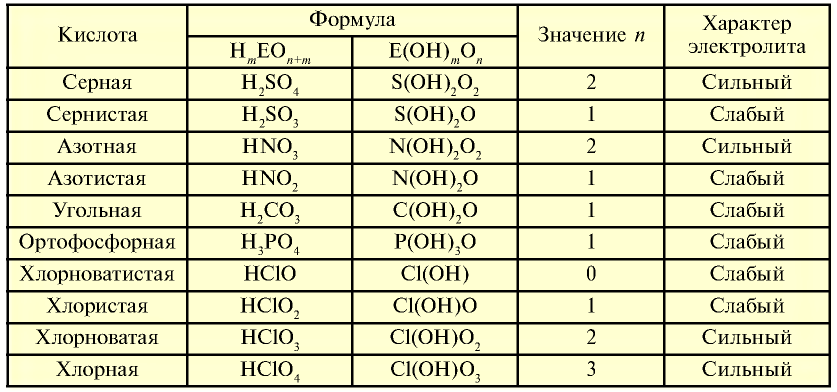
Таблица 19
Характер кислот
На основе общих формул кислородсодержащих кислот 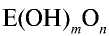
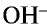
Сравнение характера электролитов по степени их диссоциации приемлемо только для растворов с одинаковой концентрацией, в остальных случаях этот способ неудобен. Поэтому для сопоставления характера слабых электролитов используется константа диссоциации.
В водных растворах слабые электролиты диссоциируют частично, так как в растворе между молекулами и ионами слабого электролита возникает равновесие. Например,
Отношение произведения равновесных концентраций ионов Н+ и 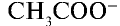
где К — константа диссоциации,
[Н+] — молярная концентрация ионов водорода,
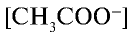
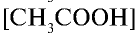
Константа диссоциации электролита зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Последняя служит количественной характеристикой диссоциации соединений. Чем больше константа диссоциации, тем сильнее диссоциирует электролит.
Ионообменные реакции
Какие индикаторы используются для определения среды раствора?
Что такое индикатор?
Реакции, протекающие в водных растворах электролитов, называются ионообменными, так как осуществляются с участием ионов, которые образуются при диссоциации электролита (табл. 20).
Уравнения ионообменных реакций составляются путем записи ионных формул диссоциировавшего сильного электролита, молекулярных формул слабых электролитов, не растворимых в воде осадков, а также выделившихся газообразных веществ.
Ионообменные реакции подразделяются на три группы.
Реакции нейтрализации
Вы знаете, что индикаторы изменяют свою окраску в зависимости от среды раствора (рис. 19).
Например, прильем к кислотному раствору (красного цвета) с лакмусовой добавкой немного щелочи. При этом окраска раствора станет фиолетовой. Это объясняется тем, что среда раствора стала нейтральной:
Запишем уравнение в ионном виде (вода очень слабый электролит и почти не распадается на ионы):
Сокращенное ионное уравнение реакции:
Следовательно, сущность реакции нейтрализации состоит в том, что при связывании ионов Н+, создающих кислотную среду, с ионами 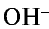
Реакции, протекающие с образованием не растворимого в воде осадка
Реакции, протекающие с образованием не растворимого в воде осадка, идут до конца. Например,
Образовавшийся в результате этой реакции сульфат бария не растворяется в воде, не делится на ионы.
Уравнение реакции в ионном виде:
Ионы бария и сульфата, образовавшиеся при диссоциации электролита, связываясь друг с другом, образуют осадок (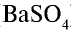
Составьте уравнение реакций между растворами 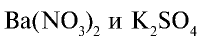
Реакции, протекающие с образованием газообразного вещества
Реакции, протекающие с образованием газообразного вещества, также идут до конца. Например,
Запишем уравнение реакции в ионном виде:
Сокращенное ионное уравнение реакции:
Следовательно, сущность этой реакции состоит в том, что при связывании ионов 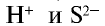
Составьте уравнения реакций между растворами хлорида аммония и едкого натра в молекулярном, ионном и кратком ионном виде. Сравните сокращенное ионное уравнение с сокращенным ионным уравнением предыдущей реакции.
Таблица 20
Характерные свойства ионов
Элементы знаний, умений и навыков: характерные свойства ионов, условия протекания до конца реакций между растворами электролитов.
Гидролиз солей
Происходят ли химические реакции при растворении солей в воде?
Чистая вода является очень слабым электролитом, ее степень диссоциации равна 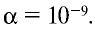
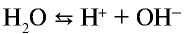
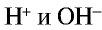
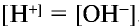
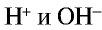
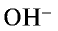
Водные растворы отдельных солей изменяют цвет индикатора, что свидетельствует о том, что произошла химическая реакция (табл. 21).
Таблица 21
Отношение отдельных солей к индикаторам
При изучении ионообменных реакций вы узнали, почему реакции растворов электролитов идут до конца и при связывании ионов в растворе образуются недиссоциирующие вещества. Рассмотрим, чем обусловлены изменения, указанные в табл. 21.
1. Водный раствор соли нитрата калия не изменяет цвет индикатора:
Ион калия К+ образует с ионом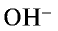
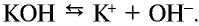

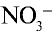
Следовательно, среда водных растворов солей, образованных сильным основанием и сильной кислотой, является нейтральной. То есть такие соли не гидролизуются.
— Слово “гидролиз” (от грен.”gidro” — вода, “lizis” — отделение) означает разделение.
2. Соль нитрат алюминия является продуктом взаимодействия слабого основания и сильной кислоты. Такие соли гидролизуются. О гидролизе соли нитрата алюминия можно судить по изменению цвета индикатора:
Ионы 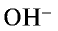
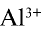
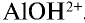
В этом процессе ион 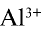
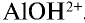
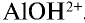
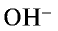
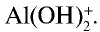
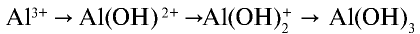
— Среда водных растворов солей, образованных слабым основанием и сильной кислотой, является кислотной.
3. Соль карбонат натрия является продуктом взаимодействия сильного основания и слабой кислоты. В водных растворах таких солей также происходит химический процесс. О гом, что среда является щелочной, можно узнать по изменению цвета индикатора (см.табл. 21).
При растворении в воде солей, образованных сильными основанием и слабой кислотой
анион слабой кислоты связывается с ионом Н+, возникшим при диссоциации воды, и образует недиссоциирующий ион 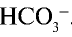
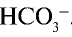
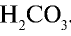
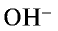
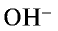
— Среда водных растворов солей, образованных сильным основанием и слабой кислотой, является щелочной.
4. Соли, образованные слабым основанием и слабой кислотой, полностью гидролизуются с образованием слабого основания и слабой кислоты:
Среда же раствора определяется относительной силой образовавшихся основания и кислоты. Следовательно, если сильнее основание, среда слабощелочная, если сильнее кислота, среда слабокислотная, если же силы основания и кислоты равны, среда будет нейтральной.
- Реакции между солями и водой называются гидролитическими.
- Образование слабого электролита в результате взаимодействия ионов, возникших при диссоциации соли, с водой называется гидролизом.
Элементы знаний, умений и навыков: нейтральная среда, кислотная среда, щелочная среда, гидролиз солей, образованных сильным основанием и сильной кислотой, гидролиз, слабокислотная и слабощелочная среда.
Влияние различных факторов на гидролиз солей
Какое влияние оказывает повышение температуры на гидролиз солей?
Гидролиз солей зависит от природы солей, концентрации раствора и температуры. Соли, образованные слабым основанием и слабой кислотой, гидролизуются полностью. С повышением температуры процесс гидролиза солей усиливается, так как равновесие ионов Н+ и 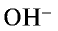
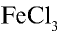
Однако при кипячении раствора осуществляется и вторая стадия гидролиза:
Если нагревание продолжить, происходит и третья стадия этого процесса:
Степень гидролиза повышается при разбавлении растворов. Это можно наблюдать на примере гидролиза соли 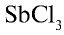
Если раствор соли разбавить водой, равновесие реакции сместится вправо и в осадок выпадет 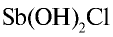
Таким образом, для ослабления процесса гидролиза в растворах необходимо сохранять низкую температуру и высокую концентрацию растворов. Кроме того, гидролиз солей можно предупредить путем обеспечения кислотной среды в растворах солей, образованных сильной кислотой и слабым основанием, и щелочной среды в растворах солей, образованных слабой кислотой и сильным основанием.
Пример №1
Сколько граммов сульфата бария выпадет в осадок, если смешать 104 г 5%-ного раствора хлорида бария и 71 г 10%-ного раствора сульфата натрия?
Решение:
1) найдем массу и количество вещества хлорида бария в растворе:
2) найдем массу и количество вещества сульфата натрия в растворе:
3) запишем уравнение реакции взаимодействия растворов 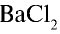
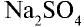
В соответствии с уравнением реакции 1 моль хлорида бария реагирует с 1 молем сульфата натрия, в результате чего выпадает 1 моль осадка сульфата бария. Молярные соотношения веществ, указанных в условиях задачи, следующие: 0,025 моля 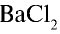
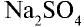
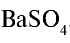
Ответ: образуется 5,825 г осадка.
Пример №2
104 г 5 % -ного раствора хлорида бария смешали с 71 г 10 %-ного раствора сульфата натрия. Сколько граммов сульфата бария выпало в осадок?
Решение. 1. Найдем массу и количество вещества хлорида бария в растворе:
2. Теперь найдем массу и количество вещества сульфата натрия в растворе:
3, Запишем уравнения реакции взаимодействия 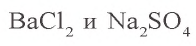
Согласно уравнению реакции, при взаимодействии 1 моля хлорида бария с 1 молем сульфата натрия в осадок выпадает 1 моль сульфата бария. Молярные соотношения веществ, данные в условии, следующие: 0,025 моля 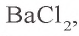
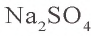
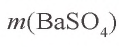
Ответ: образуется 5,825 г осадка.
Пример №3
Внимательно рассмотрите табл.7. Для определения иона, содержащегося в растворе, воспользуйтесь необходимыми реактивами и запишите молекулярное, ионное и краткое ионное уравнения происходящего процесса. Например, для определения иона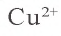

Вы также можете подобрать необходимые реактивы для определения четырех произвольных ионов и записать уравнения протекающих реакций.
Пример №4
Воздействуя на раствор хлорида железа(III) раствором карбоната калия, невозможно получить карбонат железа(III). Почему?
Решение. 1. Хлорид железа(III) – соль, образованная слабым основанием и сильной кислотой: 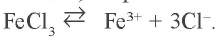
2. Карбонат калия – соль, образованная сильным основанием и слабой кислотой: 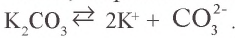
3. 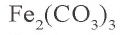
Пример №5
К 50 г 10,6 %-ного раствора карбоната натрия добавили избыточное количество раствора сульфата алюминия. Объясните происшедший процесс. Какой газ и в каком объеме (н.у.) выделился при этом?
Решение. 1. Найдем массу чистой соли 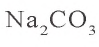
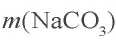
2. Запишем уравнения химической реакции
Ответ: образуется 1,12 л
Объясним ионообменные реакции между солями, взятыми для реакции:
a) 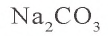
В растворе соли 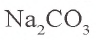
В растворе еще есть вода. Вода — очень слабый электролит:
б). 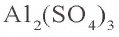
Содержащаяся в растворе вода, хотя и незначительно, диссоциирует на ионы 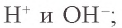
в) при добавлении к раствору карбоната натрия раствора сульфата алюминия между указанными выше ионами происходит химический процесс:
Значит, в результате ионообменной реакции образуются осадок гидроксида алюминия и углекислый газ.
- Электролиты и неэлектролиты в химии
- Металлы в химии
- Неметаллы в химии
- Галогены в химии
- Ковалентная связь
- Валентность и степень окисления
- Ионная связь
- Химические реакции