Уравне́ние состоя́ния идеа́льного га́за (иногда уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
,
где
Уравнение состояния идеального газа можно записать в виде:
,
где 


или в виде
,
где 


Эта форма записи носит имя уравнения (закона) Клапейрона — Менделеева.
Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную 
Менделеев обнаружил, что 


Связь с другими законами состояния идеального газа[править | править код]
В случае постоянной массы газа уравнение можно записать в виде:
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
— закон Бойля — Мариотта — Изотермический процесс.
— Закон Гей-Люссака — Изобарный процесс.
— закон Шарля (второй закон Гей-Люссака, 1808 г.) — Изохорный процесс
В форме пропорции 
С точки зрения химика этот закон может звучать несколько иначе: объёмы вступающих в реакцию газов при одинаковых условиях (температуре, давлении) относятся друг к другу и к объёмам образующихся газообразных соединений как целые числа. Например, 1 объём водорода соединяется с 1 объёмом хлора, при этом образуются 2 объёма хлороводорода:
.
1 объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
.
- Закон Бойля — Мариотта
Закон Бойля — Мариотта
назван в честь ирландского физика, химика и философа Роберта Бойля (1627—1691), открывшего его в 1662 г., а также в честь французского физика Эдма Мариотта (1620—1684), который открыл этот закон независимо от Бойля в 1677 году.
В некоторых случаях (в газовой динамике) уравнение состояния идеального газа удобно записывать в форме
где 

Эмиль Амага обнаружил, что при высоких давлениях поведение газов отклоняется от закона Бойля — Мариотта. Это обстоятельство может быть прояснено на основании молекулярных представлений.
С одной стороны, в сильно сжатых газах размеры самих молекул являются сравнимыми с расстояниями между молекулами. Таким образом, свободное пространство, в котором движутся молекулы, меньше, чем полный объём газа. Это обстоятельство увеличивает число ударов молекул в стенку, так как благодаря ему сокращается расстояние, которое должна пролететь молекула, чтобы достигнуть стенки.
С другой стороны, в сильно сжатом и, следовательно, более плотном газе молекулы заметно притягиваются к другим молекулам гораздо большую часть времени, чем молекулы в разреженном газе. Это, наоборот, уменьшает число ударов молекул в стенку, так как при наличии притяжения к другим молекулам молекулы газа движутся по направлению к стенке с меньшей скоростью, чем при отсутствии притяжения. При не слишком больших давлениях более существенным является второе обстоятельство и произведение 

См. также[править | править код]
- Совершенный газ
- Реальный газ
- Уравнение состояния реального газа
Примечания[править | править код]
Литература[править | править код]
- Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим. спец. вузов / Под ред. А. Г. Стромберга. — 7-е изд., стер. — М.: Высшая школа, 2009. — 527 с. — ISBN 978-5-06-006161-1.
Содержание:
Уравнение состояния идеального газа:
Уравнения Клапейрона и Менделеева — клапейрона; законы Шарля, Гей-Люссака, Бойля — Мариотта, Авогадро, Дальтона, — пожалуй, такого количества «именных» законов нет ни в одном разделе физики. за каждым из них — кропотливая работа в лабораториях, тщательные измерения, длительные аналитические размышления и точные расчеты. нам намного проще. Мы уже знаем основные положения теории, и «открыть» все вышеупомянутые законы нам не составит труда.
Уравнение состояния идеального газа
Давление газа полностью определяется его температурой и концентрацией молекул: p=nkT. Запишем данное уравнение в виде: pV = NkT. Если состав и масса газа известны, число молекул газа можно найти из соотношения 
Произведение числа Авогадро  на постоянную Больцмана k называют универсальной газовой постоянной (R): R=
на постоянную Больцмана k называют универсальной газовой постоянной (R): R= k 8,31 Дж/ (моль⋅К). Заменив в уравнении (*)
k 8,31 Дж/ (моль⋅К). Заменив в уравнении (*)  k на R, получим уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):
k на R, получим уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):

Обратите внимание! Состояние данного газа некоторой массы однозначно определяется двумя его макроскопическими параметрами; третий параметр можно найти из уравнения Менделеева — Клапейрона.
Уравнение Клапейрона
С помощью уравнения Менделеева — Клапейрона можно установить связь между макроскопическими параметрами газа при его переходе из одного состояния в другое. Пусть газ, имеющий массу m и молярную массу М, переходит из состояния ( ) в состояние (
) в состояние ( ) (рис. 30.1).
) (рис. 30.1).

Для каждого состояния запишем уравнение Менделеева — Клапейрона:  Разделив обе части первого уравнения на
Разделив обе части первого уравнения на  , а второго — на
, а второго — на  , получим:
, получим: 
 . Правые части этих уравнений равны; приравняв левые части, получим уравнение Клапейрона:
. Правые части этих уравнений равны; приравняв левые части, получим уравнение Клапейрона:

Для данного газа некоторой массы отношение произведения давления на объем к температуре газа является неизменным.
Изопроцессы
Процесс, при котором один из макроскопических параметров данного газа некоторой массы остается неизменным, называют изопроцессом. Поскольку состояние газа характеризуется тремя макроскопическими параметрами, возможных изопроцессов тоже три: происходящий при неизменной температуре; происходящий при неизменном давлении; происходящий при неизменном объеме. Рассмотрим их.
Какой процесс называют изотермическим. Закон Бойля — Мариотта
Пузырек воздуха, поднимаясь со дна глубокого водоема, может увеличиться в объеме в несколько раз, при этом давление внутри пузырька падает, поскольку вследствие дополнительного гидростатического давления воды ( ) давление на глубине больше атмосферного. Температура же внутри пузырька практически не изменяется. В данном случае имеем дело с процессом изотермического расширения.
) давление на глубине больше атмосферного. Температура же внутри пузырька практически не изменяется. В данном случае имеем дело с процессом изотермического расширения.

Рис. 30.2. Изотермическое сжатие газа. Если медленно опускать поршень, температура газа под поршнем будет оставаться неизменной и равной температуре окружающей среды. Давление газа при этом будет увеличиваться
Изотермический процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменной температуре.
Пусть некий газ переходит из состояния ( ) в состояние (
) в состояние (
 T), то есть температура газа остается неизменной (рис. 30.2). Тогда согласно уравнению Клапейрона имеет место равенство p
T), то есть температура газа остается неизменной (рис. 30.2). Тогда согласно уравнению Клапейрона имеет место равенство p . После сокращения на T получим:
. После сокращения на T получим:  .
.
Закон Бойля — Мариотта:
Для данного газа некоторой массы произведение давления газа на его объем остается постоянным, если температура газа не изменяется:

Графики изотермических процессов называют изотермами. Как следует из закона Бойля — Мариотта, при неизменной температуре давление газа данной массы обратно пропорционально его объему:  . Эту зависимость в координатах p, V можно представить в виде гиперболы (рис. 30.3, а). Поскольку при изотермическом процессе температура газа не изменяется, в координатах p, T и V, T изотермы перпендикулярны оси температур (рис. 30.3, б, в).
. Эту зависимость в координатах p, V можно представить в виде гиперболы (рис. 30.3, а). Поскольку при изотермическом процессе температура газа не изменяется, в координатах p, T и V, T изотермы перпендикулярны оси температур (рис. 30.3, б, в).


Какой процесс называют изобарным. Закон Гей-Люссака
Изобарный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном давлении.
Пусть некий газ переходит из состояния ( ) в состояние (
) в состояние ( ), то есть давление газа остается неизменным (рис. 30.4). Тогда имеет место равенство
), то есть давление газа остается неизменным (рис. 30.4). Тогда имеет место равенство  . После сокращения на p получим:
. После сокращения на p получим: 

Рис. 30.4. Изобарное расширение газа. Если газ находится под тяжелым поршнем массой M и площадью S, который может перемещаться практически без трения, то при увеличении температуры объем газа будет увеличиваться, а давление газа будет оставаться неизменным и равным p
Закон Гей-Люссака
Для данного газа некоторой массы отношение объема газа к температуре остается постоянным, если давление газа не изменяется:

Графики изобарных процессов называют изобарами. Как следует из закона Гей-Люссака, при неизменном давлении объем газа данной массы прямо пропорционален его температуре: V = const⋅T. График данной зависимости — прямая, проходящая через начало координат (рис. 30.5, а). По графику видно, что с приближением к абсолютному нулю объем идеального газа должен уменьшиться до нуля. Понятно, что это невозможно, поскольку реальные газы при низких температурах превращаются в жидкости. В координатах p, V и p, T изобары перпендикулярны оси давления (рис. 30.5, б, в).


Изохорный процесс. Закон Шарля
Если газовый баллон сильно нагреется на солнце, давление в нем повысится настолько, что баллон может взорваться. В данном случае имеем дело с изохорным нагреванием.
Изохорный процесс — процесс изменения состояния данного газа некоторой массы, протекающий при неизменном объеме.
Пусть некий газ переходит из состояния ( ) в состояние (
) в состояние ( ), то есть объем газа не изменяется (рис. 30.6). В этом случае имеет место равенство
), то есть объем газа не изменяется (рис. 30.6). В этом случае имеет место равенство  . После сокращения на V получим:
. После сокращения на V получим: 

Рис. 30.6. Изохорное нагревание газа. Если газ находится в цилиндре под закрепленным поршнем, то с увеличением температуры давление газа тоже будет увеличиваться. Опыт показывает, что в любой момент времени отношение давления газа к его температуре неизменно: 
Закон Шарля
Для данного газа некоторой массы отношение давления газа к его температуре остается постоянным, если объем газа не изменяется:

Графики изохорных процессов называют изохорами. Из закона Шарля следует, что при неизменном объеме давление газа данной массы прямо пропорционально его температуре: p T = ⋅ const . График этой зависимости — прямая, проходящая через начало координат (рис. 30.7, а). В координатах p, V и V, T изохоры перпендикулярны оси объема (рис. 30.7, б, в).


Пример №1
В вертикальной цилиндрической емкости под легкоподвижным поршнем находится 2 моль гелия и 1 моль молекулярного водорода. Температуру смеси увеличили в 2 раза, и весь водород распался на атомы. Во сколько раз увеличился объем смеси газов?

Анализ физической проблемы. Смесь газов находится под легкоподвижным поршнем, поэтому давление смеси не изменяется: , но использовать закон Бойля — Мариотта нельзя, так как вследствие диссоциации (распада) молярная масса и число молей водорода увеличились в 2 раза:
, но использовать закон Бойля — Мариотта нельзя, так как вследствие диссоциации (распада) молярная масса и число молей водорода увеличились в 2 раза: 
Решение:
Воспользуемся уравнением состояния идеального газа: pV = νRT. Запишем это уравнение для состояний смеси газов до и после распада: 
 Разделив уравнение (2) на уравнение (1) и учитывая, что
Разделив уравнение (2) на уравнение (1) и учитывая, что  получим:
получим:  где
где 
 Найдем значение искомой величины:
Найдем значение искомой величины: 
Ответ: примерно в 2,7 раза.
Пример №2
На рис. 1 представлен график изменения состояния идеального газа неизменной массы в координатах V, T. Представьте график данного процесса в координатах p, V и p, T.
Решение:
1. Выясним, какой изопроцесс соответствует каждому участку графика (рис. 1).

Зная законы, которым подчиняются эти изопроцессы, определим, как изменяются макроскопические параметры газа. Участок 1–2: изотермическое расширение; T = const, V ↑, следовательно, по закону Бойля — Мариотта p ↓. Участок 2–3: изохорное нагревание; V = const, T ↑, следовательно, по закону Шарля p ↑ . Участок 3–1: изобарное охлаждение; p = const , T ↓, следовательно, по закону Гей-Люссака V ↓ .
2. Учитывая, что точки 1 и 2 лежат на одной изотерме, точки 1 и 3 — на одной изобаре, а точки 2 и 3 на одной изохоре, и используя результаты анализа, построим график процесса в координатах p, V и p, T (рис. 2)

Выводы:
- Из соотношения p=nkT можно получить ряд важных законов, большинство из которых установлены экспериментально.
- Уравнение состояния идеального газа (уравнение Менделеева — Клапейрона):
 — универсальная газовая постоянная.
— универсальная газовая постоянная. - Уравнение Клапейрона:

- Законы, которым подчиняются изопроцессы, то есть процессы, при которых один из макроскопических параметров данного газа некоторой массы остается неизменным:

- Температура в физике
- Парообразование и конденсация
- Тепловое равновесие в физике
- Изопроцессы в физике
- Абсолютно упругие и неупругие столкновения тел
- Механизмы, работающие на основе правила моментов
- Идеальный газ в физике
- Уравнение МКТ идеального газа
Уравнение
состояния идеального
газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) —
формула, устанавливающая зависимость
между давлением, молярным
объёмом и абсолютной
температурой идеального
газа.
Уравнение имеет вид:
![]()
где
-
 — давление,
— давление, -
 — молярный
— молярный
объём, -
 — универсальная
— универсальная
газовая постоянная -
 — абсолютная
— абсолютная
температура,К.
Так
как ![]() ,
,
где![]() —количество
—количество
вещества,
а ![]() ,
,
где![]() —
—
масса,![]() —молярная
—молярная
масса,
уравнение состояния можно записать:
![]()
Эта
форма записи носит имя уравнения (закона)
Менделеева — Клапейрона.
В
случае постоянной массы газа уравнение
можно записать в виде:
![]()
![]()
Последнее
уравнение называют объединённым
газовым законом.
Из него получаются законы Бойля —
Мариотта, Шарля и Гей-Люссака:
![]() — закон
— закон
Бойля — Мариотта.
![]() — Закон
— Закон
Гей-Люссака.
![]() — закон Шарля (второй
— закон Шарля (второй
закон Гей-Люссака, 1808 г.).А
в форме пропорции ![]() этот
этот
закон удобен для расчёта перевода газа
из одного состояния в другое. С точки
зрения химика этот закон может звучать
несколько иначе: Объёмы вступающих в
реакцию газов при одинаковых условиях
(температуре, давлении) относятся друг
к другу и к объёмам образующихся
газообразных соединений как простые
целые числа. Например, 1 объёмводородасоединяется
с 1 объёмом хлора,
при этом образуются 2 объёма хлороводорода:
![]()
1 Объём азота соединяется с 3 объёмами водорода с образованием 2 объёмов аммиака:
![]()
![]() — закон
— закон
Бойля — Мариотта.
Закон Бойля — Мариотта назван в честь
ирландского физика, химика и философа Роберта
Бойля (1627—1691),
открывшего его в 1662 г., а также в честь
французского физика Эдма
Мариотта (1620—1684),
который открыл этот закон независимо
от Бойля в 1677 году. В некоторых случаях
(в газовой
динамике)
уравнение состояния идеального газа
удобно записывать в форме
![]()
где ![]() —показатель
—показатель
адиабаты, ![]() —
—
внутренняя энергия единицы массы
вещества.Эмиль
Амага обнаружил,
что при высоких давлениях поведение газов отклоняется
от закона Бойля — Мариотта. И это
обстоятельство может быть прояснено
на основании молекулярных представлений.
С
одной стороны, в сильно сжатых газах
размеры самих молекул являются сравнимыми
с расстояниями между молекулами. Таким
образом, свободное пространство, в
котором движутся молекулы, меньше, чем
полный объём газа. Это обстоятельство
увеличивает число ударов молекул в
стенку, так как благодаря ему сокращается
расстояние, которое должна пролететь
молекула, чтобы достигнуть стенки. С
другой стороны, в сильно сжатом и,
следовательно, более плотном газе
молекулы заметно притягиваются к другим
молекулам гораздо большую часть времени,
чем молекулы в разреженном газе. Это,
наоборот, уменьшает число ударов молекул
в стенку, так как при наличии притяжения
к другим молекулам молекулы газа движутся
по направлению к стенке с меньшей
скоростью, чем при отсутствии притяжения.
При не слишком больших давлениях более
существенным является второе обстоятельство
и произведение ![]() немного
немного
уменьшается. При очень высоких давлениях
большую роль играет первое обстоятельство
и произведение![]() увеличивается.
увеличивается.
5. Основное уравнение молекулярно-кинетической теории идеальных газов
Для
вывода основного уравнения
молекулярно-кинетической теории
рассмотрим одноатомный идеальный газ.
Предположим, что молекулы газа
движутся хаотически, число взаимных
столкновений между молекулами газа
пренебрежимо мало по сравнению с числом
ударов о стенки сосуда, а соударения
молекул со стенками сосуда абсолютно
упругие. Выделим на стенке сосуда
некоторую элементарную площадку DS и
вычислим давление, оказываемое на
эту площадку. При каждом соударении
молекула, движущаяся перпендикулярно
площадке, передает ей
импульс m0v-(-m0v)=2m0v, где т0 —
масса молекулы, v —
ее скорость.
За
время Dt площадки DS достигнут только те
молекулы, которые заключены в объеме
цилиндра с основанием DS и высотой vDt .Число
этих молекул равно nDSvDt (n—концентрация
молекул).
Необходимо,
однако, учитывать, что реально молекулы
движутся к площадке
DS
под разными углами и имеют различные
скорости, причем скорость молекул при
каждом соударении меняется. Для упрощения
расчетов хаотическое движение молекул
заменяют движением вдоль трех взаимно
перпендикулярных направлений, так
что в любой момент времени вдоль каждого
из них движется 1/3 молекул,
причем половина молекул (1/6)
движется вдоль данного направления
в одну сторону, половина — в противоположную.
Тогда число ударов молекул, движущихся
в заданном направлении, о площадку DS
будет 1/6nDSvDt.
При столкновении с площадкой эти
молекулы передадут ей импульс
DР =
2m0v•1/6nDSvDt=1/3nm0v2DSDt.
Тогда
давление газа, оказываемое им на стенку
сосуда,
p=DP/(DtDS)=1/3nm0v2.
(3.1)
Если
газ в объеме V содержит N молекул,
движущихся
со скоростями v1, v2, …, vN,
то
целесообразно
рассматривать среднюю
квадратичную скорость
характеризующую
всю совокупность молекул газа.
Уравнение
(3.1) с учетом (3.2) примет вид
р
= 1/3пт0 <vкв>2.
(3.3)
Выражение
(3.3) называется основным
уравнением молекулярно-кинетической
теории идеальных газов. Точный
расчет с учетом движения молекул по
все-
возможным
направлениям дает ту же формулу.
Учитывая,
что n = N/V, получим
где Е —
суммарная кинетическая энергия
поступательного движения всех молекул
газа.
Так
как масса газа m =Nm0,
то уравнение (3.4) можно переписать в
виде
pV=1/3m<vкв>2.
Для
одного моля газа т
= М (М — молярная
масса), поэтому
pVm=1/3M<vкв>2,
где Vm —
молярный объем. С другой стороны, по
уравнению Клапейрона —
Менделеева, pVm=RT. Таким
образом,
RT=1/3М
<vкв>2,
откуда
Так
как М = m0NA,
где m0—масса
одной молекулы, а NА —
постоянная Авогадро, то из уравнения
(3.6) следует, что
где k = R/NA—постоянная
Больцмана. Отсюда найдем, что при
комнатной температуре молекулы
кислорода имеют среднюю квадратичную
скорость 480 м/с, водорода — 1900 м/с. При
температуре жидкого гелия те же
скорости будут соответственно 40 и
160 м/с.
Средняя
кинетическая энергия поступательного
движения одной молекулы идеального
газа
<e0)
=E/N = m0 <vкв>)2/2
= 3/2kT(43.8)
(использовали
формулы (3.5) и (3.7)) пропорциональна
термодинамической температуре и
зависит только от нее. Из этого уравнения
следует, что при T=0 <e0>
=0,,т. е. при 0 К прекращается поступательное
движение молекул газа, а следовательно,
его давление равно нулю. Таким образом,
термодинамическая температура является
мерой средней кинетической энергии
поступательного движения молекул
идеального газа и формула (3.8) раскрывает
молекулярно-кинетическое толкование
температуры.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Уравнение состояния идеального газа


4.5
Средняя оценка: 4.5
Всего получено оценок: 144.
4.5
Средняя оценка: 4.5
Всего получено оценок: 144.
Идеальный газ – это теоретическая модель газа, хорошо описывающая поведение реальных газов при невысоких давлениях и температурах. Для описания его макроскопических параметров (температуры, давления и объема) используется специальное соотношение, называемое уравнением состояния. Рассмотрим его подробнее.
Уравнение состояния идеального газа
Основное уравнение состояния идеального газа выводится на основе положений молекулярно-кинетической теории. Согласно этой теории, идеальный газ – это вещество в газообразном состоянии, для которого справедливы следующие допущения:
- молекулы представляют собой материальные точки;
- силы взаимного притяжения молекул отсутствуют;
- молекулы движутся хаотично, при этом каждая движется в соответствии с законами механики Ньютона;
- взаимодействия между молекулами состоят только в абсолютно упругих соударениях.

Согласно основному уравнению молекулярно-кинетической теории, если концентрация молекул газа (количество в единице объема) равно $n$, масса одной молекулы $m_0$, а ее среднеквадратичная скорость $overline {v^2}$, то давление такого газа равно:
$$p={1over 3}nm_0overline {v^2},$$
Поскольку молекулы газа считаются материальными точками, то средняя кинетическая энергия движущейся молекулы равна:
$$overline E = {m_0overline {v^2}over 2}$$
Выразим из этого соотношения массу молекулы, и подставим в предыдущее. Получим:
$$p={2over 3}noverline E$$
Средняя энергия молекулы в молекулярно-кинетической теории связана с температурой газа через постоянную Больцмана ($k=1,38×10^{-23}Дж/К$):
$$overline E = {3over 2}kT$$
Подставив эту среднюю энергию в предыдущее выражение, получим:
$$p = nkT$$
Наконец, выразим концентрацию молекул как отношение их количества к объему ($n={Nover V}$). В итоге получим:
$$p = {Nover V}kT$$
Или:
$${pVover T} = Nk = const$$
Данное соотношение было впервые получено и практически доказано в 1834г. Б. Клапейроном, поэтому оно носит название «уравнение Клапейрона».
Уравнение Менделеева-Клапейрона
Уравнение Клапейрона хорошо описывает изменение в газовых процессах макроскопических параметров некоторого количества газа. Однако, заранее сказать, какими будут эти параметры для конкретной массы некоторого конкретного газа, нельзя. Константа, присутствующая в уравнении Клапейрона должна вычисляться каждый раз заново.
В 1874 г Д. Менделеев сделал вывод, что эта константа прямо пропорциональная количеству вещества газа, то есть отношению общей массы газа $m$ к его молярной массе $М$:
$${pVover T} thicksim nu= {mover M}$$

А поскольку один моль любого газа в одинаковых условиях занимает один и тот же объем, можно ввести специальный коэффициент, $R=8.31 {Дж over моль × К}$. С этим коэффициентом уравнение состояния идеального газа получит вид:
$${pVover T} ={mover M}R$$
Значение температуры чаще всего переносят в правую часть формулы. Окончательно имеем:
$$pV ={mover M}RT$$
Уравнение состояния идеального газа в таком виде называется уравнением Менделеева-Клапейрона. Данное уравнение связывает макроскопические параметры газа с его физическими параметрами.
Постоянная R, присутствующая в уравнении, называется универсальной газовой постоянной. Она равна произведению числа Авогадро на постоянную Больцмана, и представляет количество тепла, которое необходимо сообщить одному молю газа для увеличения его температуры на один кельвин.
Уравнение состояния для смеси газов
Уравнение состояния идеального газа описывает макроскопические параметры конкретного газа. Однако, в задачах нередко необходимо определять параметры смеси газов с разными молярными массами.
В этом случае применяется закон Дальтона.

Давление для каждой из компонент газа вычисляется отдельно, как если бы эта компонента была бы одна. Такое давление называется парциальным, а потом, общее давление смеси, в соответствии с законом Дальтона находится, как сумма парциальных давлений всех компонент.

Что мы узнали?
Уравнение состояния идеального газа связывает объем, давление и температуру (макроскопические газовые параметры) с общей и молярной массой газа. Данное уравнение называется уравнением Менделеева-Клапейрона. Для расчета параметров смеси газов используется закон Дальтона.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 144.
А какая ваша оценка?
Уравнение состояния идеального газа было открыто экспериментально. Оно носит название уравнения Клапейрона — Менделеева. Это уравнение устанавливает математическую зависимость между параметрами идеального газа, находящегося в одном состоянии. Математически его можно записать следующими способами:
Уравнение состояния идеального газа

Внимание! При решении задач важно все единицы измерения переводить в СИ.
Пример №1. Кислород находится в сосуде вместимостью 0,4 м3 под давлением 8,3∙105 Па и при температуре 320 К. Чему равна масса кислорода? Молярная масса кислорода равна 0,032 кг/моль.
Из основного уравнения состояния идеального газа выразим массу:

Уравнение состояния идеального газа следует использовать, если газ переходит из одного состояния в другое и при этом изменяется его масса (количество вещества, число молекул) или молярная масса. В этом случае необходимо составить уравнение Клапейрона — Менделеева отдельно для каждого состояния. Решая систему уравнений, легко найти недостающий параметр.
Подсказки к задачам
| Давление возросло на 15% | p2 = 1,15p1 |
| Объем увеличился на 2% | V2 = 1,02V1 |
| Масса увеличилась в 3 раза | m2 = 3m1 |
| Газ нагрелся до 25 оС | T2 = 25 + 273 = 298 (К) |
| Температура уменьшилась на 15 К (15 оС) | T2 = T1 – 15 |
| Температура уменьшилась в 2 раза | |
| Масса уменьшилась на 20% | m2 = 0,8m1 |
| Выпущено 0,7 начальной массы |
Важна только та масса, что осталась в сосуде. Поэтому: m2 = 0,3m1 |
| Какую массу следует удалить из баллона? | Нужно найти разность начальной и конечной массы:
m1 – m2 |
| Газ потерял половину молекул | |
| Молекулы двухатомного газа (например, водорода), диссоциируют на атомы | |
| Озон (трехатомный кислород) при нагревании превращается в кислород (двухатомный газ) | M (O3) = 3Ar (O)∙10–3 кг/моль
M (O2) = 2Ar (O)∙10–3 кг/моль |
| Открытый сосуд | Объем V и атмосферное давление pатм остаются постоянными |
| Закрытый сосуд | Масса m, молярная масса M, количество вещества ν, объем V, число N и концентрация n частиц, плотность ρ— постоянные величины |
| Нормальные условия | Температура T0 = 273 К
Давление p0 = 105 Па |
| Единицы измерения давления | 1 атм = 105 Па |
Пример №2. В баллоне содержится газ под давлением 2,8 МПа при температуре 280 К. Удалив половину молекул, баллон перенесли в помещение с другой температурой. Определите конечную температуру газа, если давление уменьшилось до 1,5 МПа.
2,8 МПа = 2,8∙106 Па
1,5 МПа = 1,5∙106 Па
Так как половина молекул была выпущена, m2 = 0,5m1. Объем остается постоянным, как и молярная масса. Учитывая это, запишем уравнение состояния идеального газа для начального и конечного случая:

Преобразим уравнения и получим:

Приравняем правые части и выразим искомую величину:

Задание EF19012
 На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
На графике представлена зависимость объёма постоянного количества молей одноатомного идеального газа от средней кинетической энергии теплового движения молекул газа. Опишите, как изменяются температура и давление газа в процессах 1−2 и 2−3. Укажите, какие закономерности Вы использовали для объяснения.
Алгоритм решения
1.Указать, в каких координатах построен график.
2.На основании основного уравнения МКТ идеального газа и уравнения Менделеева — Клапейрона выяснить, как меняются указанные физические величины во время процессов 1–2 и 2–3.
Решение
График построен в координатах (V;Ek). Процесс 1–2 представляет собой прямую линию, исходящую из начала координат. Это значит, что при увеличении объема растет средняя кинетическая энергия молекул. Но из основного уравнения МКТ идеального газа следует, что мерой кинетической энергии молекул является температура:
T=2−Ek3
Следовательно, когда кинетическая энергия молекул растет, температура тоже растет.
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество вещества одинаковое для обоих состояния 1 и 2, запишем:
νR=p1V1T1=p2V2T2
Мы уже выяснили, что объем и температура увеличиваются пропорционально. Следовательно, давление в состояниях 1 и 2 равны. Поэтому процесс 1–2 является изобарным, давление во время него не меняется.
Процесс 2–3 имеет график в виде прямой линии, перпендикулярной кинетической энергии. Так как температуры прямо пропорциональна кинетической энергии, она остается постоянной вместе с этой энергией. Следовательно, процесс 2–3 является изотермическим, температура во время него не меняется. Мы видим, что объем при этом процессе уменьшается. Но так как объем и давление — обратно пропорциональные величины, то давление на участке 2–3 увеличивается.
Ответ:
• Участок 1–2 — изобарный процесс. Температура увеличивается, давление постоянно.
• Участок 2–3 — изотермический процесс. Температура постоянно, давление увеличивается.
pазбирался: Алиса Никитина | обсудить разбор
Задание EF22473
На высоте 200 км давление воздуха составляет примерно 10–9 от нормального атмосферного давления, а температура воздуха Т – примерно 1200 К. Оцените плотность воздуха на этой высоте.
Ответ:
а) 8,31⋅ 10–11 кг/м3
б) 1,38⋅ 10–9 кг/м3
в) 3⋅ 10–10 кг/м3
г)29⋅ 10–8 кг/м3
Алгоритм решения
1.Записать исходные данные.
2.Записать уравнение Менделеева — Клапейрона.
3.Выразить из уравнения плотность.
4.Подставить известные данные и сделать вычисления.
Решение
Запишем исходные данные:
• Давление воздуха на высоте 200 км: p = 10–9∙105 Па. Или p = 10–4 Па.
• Температура воздуха на этой же высоте: T = 1200 К.
Запишем уравнение Менделеева — Клапейрона:
pV=mMRT
Плотность определяется формулой:
ρ=mV
Следовательно, масса равна произведению плотности на объем. Перепишем уравнение состояния идеального газа, учитывая, что объем сократится слева и справа:
p=ρMRT
Молярная масса воздуха — табличная величина, равная 28,97 г/моль. Переведем в СИ и получим 28,97∙10–3 кг/моль.
Выразим и вычислим плотность:
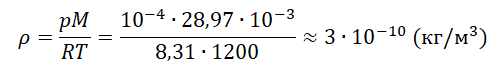
Ответ: в
pазбирался: Алиса Никитина | обсудить разбор
Задание EF22749
 Одноатомный идеальный газ в количестве ν моль помещают в открытый сверху сосуд под лёгкий подвижный поршень и начинают нагревать. Начальный объём газа V0, давление p0. Масса газа в сосуде остаётся неизменной. Трением между поршнем и стенками сосуда пренебречь. R– универсальная газовая постоянная.
Одноатомный идеальный газ в количестве ν моль помещают в открытый сверху сосуд под лёгкий подвижный поршень и начинают нагревать. Начальный объём газа V0, давление p0. Масса газа в сосуде остаётся неизменной. Трением между поршнем и стенками сосуда пренебречь. R– универсальная газовая постоянная.
Установите соответствие между физическими величинами, характеризующими газ, и формулами, выражающими их зависимость от абсолютной температуры T газа в условиях данной задачи.
К каждой позиции первого столбца подберите соответствующую позицию из второго столбца и запишите в таблицу выбранные цифры под соответствующими буквами.
Алгоритм решения
1.Записать уравнение состояния идеального газа и выразить из него объем. Выбрать из таблицы соответствующий номер формулы.
2.Определить, от чего зависит внутренняя энергия идеального газа.
3.Записать основное уравнение МКТ и выразить внутреннюю энергию идеального газа. Выбрать из таблицы соответствующий номер формулы.
Решение
Уравнение состояния идеального газа имеет вид:
pV=mMRT
Учтем, что отношение массы к молярной массе есть количество вещества.Отсюда объем равен:
V=νRTp
Следовательно, первой цифрой ответа будет «1».
Внутренняя энергия идеального газа равна сумме кинетических энергий всех молекул этого газа:
E=N−Ek
Запишем основное уравнение МКТ:
p=nkT
Отсюда температура газа равна:
T=pnk
Но температура прямо пропорциональна средней кинетической энергии молекул газа:
T=2−Ek3k
Следовательно:
pnk=2−Ek3k
−Ek=3p2n
E=N−Ek=N3p2n
Но концентрация определяется отношением количества молекул к объему. Следовательно:
E=N3pV2N=3pV2
А произведение давления на объем можно выразить через уравнение Менделеева — Клапейрона. Следовательно:
E=32νRT
Вторая цифра ответа будет «3».
Ответ: 13
pазбирался: Алиса Никитина | обсудить разбор
Задание EF22795
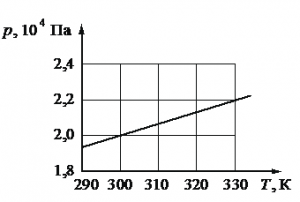 На рисунке показан график зависимости давления газа в запаянном сосуде от его температуры. Объём сосуда равен 0,25 м3. Какое приблизительно количество газообразного вещества содержится в этом сосуде? Ответ округлите до целых.
На рисунке показан график зависимости давления газа в запаянном сосуде от его температуры. Объём сосуда равен 0,25 м3. Какое приблизительно количество газообразного вещества содержится в этом сосуде? Ответ округлите до целых.
Алгоритм решения
1.Записать исходные данные.
2.Выбрать любую точку графика и извлечь из нее дополнительные данные.
3.Записать уравнение состояния идеального газа.
4.Выполнить решение задачи в общем виде.
5.Подставить известные данные и вычислить искомую величину.
Решение
Запишем исходные данные. Объем сосуда равен: V = 0,25 м3. На графике выберем точку, соответствующую температуре T = 300 К. Ей соответствует давление p = 2∙104 Па.
Запишем уравнение состояния идеального газа:
pV=νRT
Отсюда количества вещества равно:
ν=pVRT=2·104·0,258,31·300≈2 (моль)
Ответ: 2
pазбирался: Алиса Никитина | обсудить разбор
Задание EF17664
Зависимость объёма идеального газа от температуры показана на VТ-диаграмме (см. рисунок). В какой из точек давление газа максимально? Масса газа постоянна.
Ответ:
A
B
C
D
Алгоритм решения
1.Записать уравнение состояния идеального газа.
2.Установить, как зависит давление от объема и температуры газа.
3.На основании графика, отображающего изменение температуры и объема газа, установить, в какой точке давление газа максимально.
Решение
Запишем уравнение состояния идеального газа:
pV=νRT
Отсюда видно, что давление прямо пропорционально температуре. Это значит, что с ростом температуры давление увеличивается.
Также видно, что давление обратно пропорционально объему. Следовательно, давление увеличивается с уменьшением объема.
Отсюда следует, что давление будет максимальным в той точке, в которой температура максимальна, а объем минимален. Такой точкой является точка D.
Ответ: D
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18093
В камере, заполненной азотом, при температуре К находится открытый цилиндрический сосуд (см. рис. 1). Высота сосуда
см. Сосуд плотно закрывают цилиндрической пробкой и охлаждают до температуры
К. В результате расстояние от дна сосуда до низа пробки становится равным h (см. рис. 2). Затем сосуд нагревают до первоначальной температуры T0. Расстояние от дна сосуда до низа пробки при этой температуре становится равным
см (см. рис. 3). Чему равно h? Величину силы трения между пробкой и стенками сосуда считать одинаковой при движении пробки вниз и вверх. Массой пробки пренебречь.

Алгоритм решения
1.Записать исходные данные и перевести единицы измерения физических величин в СИ.
2.Записать уравнение Менделеева — Клапейрона и применить его ко всем состояниям газа.
3.Определить условие равновесия пробки.
4.Выполнить решение задачи в общем виде.
5.Вычислить искомую величину.
Решение
Запишем исходные данные:
• Начальная температура азота: T0 = 300 К.
• Высота сосуда: L = 50 см.
• Температура азота после охлаждения: T1 = 240 К.
• Высота столба азота после нагревания: H = 46 см.
50 см = 0,5 м
46 см = 0,46 м
Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Так как количество азота не меняется, можем принять, что:
pVT=const
Применим уравнение Менделеева — Клапейрона для всех трех состояний азота. Учтем, что
p0V0T0=p1V1T1=p2V2T2
Пусть S — площадь поперечного сечения сосуда. Тогда объемы столба азота для каждого из состояний будут равны:
V0=SL
V1=Sh
V2=SH
Известно, что в состоянии 3 температура азота поднимается до первоначальной. Поэтому уравнение Менделеева — Клапейрона примет вид:
p0SLT0=p1ShT1=p2SHT0
p0LT0=p1hT1=p2HT0
Неизвестными остались только давления. Их можно определить, записав условие равновесия пробки.
В состоянии 1 сила давления азота на пробку определяется формулой:
p0S=pатмS
В состоянии 2 на пробку действует сила давления со стороны азота и атмосферного давления, я а также сила трения, направленная вверх. Следовательно:
p1S=pатмS−Fтр=p0S−Fтр
В состоянии 3 на пробку действуют те же силы, но сила трения теперь действует не вверх, а вниз. Поэтому:
p2S=pатмS+Fтр=p0S+Fтр
Выразим из этих уравнений силу трения:
Fтр=p0S−p1S
Fтр=p2S−p0S
Приравняем правые части и получим:
p0S−p1S=p2S−p0S
Отсюда:
p0−p1=p2−p0
2p0=p2+p1
p0=p2+p12
Подставим это значение в уравнение Менделеева — Клапейрона и получим:
p2+p12LT0=p1hT1=p2HT0
Отсюда:
p2+p12L=p2H
p2L+p1L=2p2H
p1L=2p2H−p2L=p2(2H−L)
p1=p2(2H−L)L
Отсюда:
p2(2H−L)LhT1=p2HT0
Давление слева и справа взаимоуничтожается. Остается:
T0(2H−L)Lh=HT1
Отсюда выразим h:
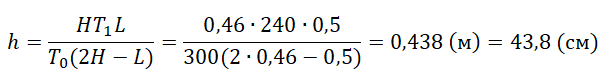
pазбирался: Алиса Никитина | обсудить разбор
Задание EF18873
 В сосуде неизменного объёма при комнатной температуре находилась смесь неона и аргона, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль аргона. Как изменились в результате парциальное давление неона и давление смеси газов, если температура газов в сосуде поддерживалась неизменной?
В сосуде неизменного объёма при комнатной температуре находилась смесь неона и аргона, по 1 моль каждого. Половину содержимого сосуда выпустили, а затем добавили в сосуд 1 моль аргона. Как изменились в результате парциальное давление неона и давление смеси газов, если температура газов в сосуде поддерживалась неизменной?
Для каждой величины определите соответствующий характер изменения:
- увеличилась
- уменьшилась
- не изменилась
Запишите в таблицу выбранные цифры для каждой физической величины. Цифры в ответе могут повторяться.
Алгоритм решения
1.Записать исходные данные.
2.Установить характер изменения парциального давления неона.
3.Применить закон Менделеева — Клапейрона, чтобы установить характер изменения общего давления смеси газов.
Решение
Исходные данные:
• Количество неона: ν1 = 1 моль.
• Количество аргона: ν2 = 1 моль.
• Количество впущенного аргона: ν4 = 1 моль.
Сначала парциальное давление неона и аргона равно. Это объясняется тем, что давление газов при неизменном количестве вещества зависит только от объема и температуры. Эти величины постоянны.
Когда из сосуда выпустили половину газовой смеси, в нем оказалось по половине моля каждого из газов. Затем в сосуд впустили 1 моль аргона. Следовательно, в сосуде стало содержаться 0,5 моль неона и 1,5 моль аргона. Запишем уравнение Менделеева — Клапейрона:
pV=νRT
Из уравнения видно, что давление и количество вещества — прямо пропорциональные величины. Следовательно, если количество неона уменьшилось, то его парциальное давление тоже уменьшилось.
Общая сумма количества вещества равна сумме количеств вещества 1 (неона) и 2 (аргона): 0,5 + 1,5 = 2 (моль). Изначально в сосуде тоже содержалось 2 моль газа. Так как количество вещества, температура и объем сохранились, давление тоже осталось неизменным.
Ответ: 23
pазбирался: Алиса Никитина | обсудить разбор
Алиса Никитина | Просмотров: 6.4k




