Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.

Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:

Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О = (МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:

2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:

По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз.
Тренировочные тесты по теме «Гидролиз»( с ответами)
233
Создан на
16 января, 2022 От Admin

Тренажер задания 21
Тренажер задания 21 ЕГЭ по химии
1 / 10
Для веществ, приведённых в. перечне, определите характер среды их водных растворов.
1) H2S
2) NaNO2
3) Ca(NO3)2
4) НВr
Запишите номера веществ в порядке возрастания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
2 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) бромид хрома(III)
2) ацетат калия
3) иодоводород
4) нитрат лития
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
3 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) CH3COOK
2) SrCl2
3) FeCl2
4) HNO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
4 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HNO2
2) C2H5COOK
3) H2CrO4
4) Ca(OH)2
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
5 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2SO4
2) Fe(NO3)2
3) K2SO3
4) HCIO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
6 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) CH3COOH
2) К3РО4
3) НNO3
4) LiOH
Запишите номера веществ в порядке убывания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
7 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) KCI
2) CrCl2
3) HI
4) K2S
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
8 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) (НСOO)2Са
2) KClO4
3) Sr(OH)2
4) HCOOH
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
9 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) NaHSO4
2) KClO4
3) CH3COOH
4) KHCO3
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
10 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) KOH
2) NaHCO3
3) H3PO4
4) НCl
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
Ваша оценка
The average score is 32%
Правила составления уравнений гидролиза солей
Алгоритм написания уравнений гидролиза
Гидролиз по катиону
1. Определяем тип гидролиза. Необходимо написать уравнение диссоциации соли.
Гидролиз сульфата меди(II): CuSO4 = Cu 2+ + SO4 2–
Соль образована катионом слабого основания и анионом сильной кислоты. Гидролиз по катиону.
2. Записываем ионное уравнение гидролиза, определяем среду:
Cu 2+ + HOH CuOH + + H + ;
образуется катион гидроксомеди(II) и ион водорода, среда кислая
3. Составляем молекулярное уравнение. Из положительных и отрицательных частиц находящихся в растворе, записываются нейтральные частицы, существующие только на бумаге. В данном случае из CuOH + SO4 2– составляем (CuOH)2SO4. Для уравнивания числа ионов меди необходимо перед сульфатом меди поставить коэффициент два. Получаем:
Продукт реакции относится к группе основных солей: сульфат гидроксомеди(II).
Гидролиз
Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н + и ОН — ионами воды малодиссоциированные электролиты.
Гидролиз солей может протекать:
→ обратимо : только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо : практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой , гидролизуются ПО АНИОНУ .
CH3COONa + HOH ↔ CH3COOH + NaOH
CH3COO — + Na + + HOH ↔ CH3COOH + Na + + OH —
сокращенное ионное уравнение:
CH3COO — + HOH ↔ CH3COOH + OH —
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH — . Водородный показатель такого раствора рН>7 .
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO3 2- + HOH ↔ HCO3 2- + OH —
или в молекулярной форме:
или в молекулярной форме:
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой , гидролизуются ПО КАТИОНУ . Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
или в молекулярной форме:
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н + . Водородный показатель такого раствора рН .
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
Fe 3+ + HOH ↔ FeOH 2+ + H +
FeCl3 + HOH ↔ FeOHCl2 + H Cl
FeOH 2+ + HOH ↔ Fe(OH)2 + + H +
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
Fe(OH)2 + + HOH ↔ Fe(OH)3 + H +
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой , гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ .
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7 . Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой , в водных растворах НЕ ИДЕТ .
Сведем вышеописанную информацию в общую таблицу:
Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be 2+ , Co 2+ , Ni 2+ , Zn 2+ , Pb 2+ , Cu 2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
! Исключения: (соли Ca, Sr, Ba и Fe 2+ ) – в этом случае получим обычный обменный процесс:
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз , протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз). Соли металлов со степенью окисления +3 (Al 3+ , Cr 3+ ) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
Соли Fe 3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H + OH — ) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
- Некоторые соли необратимо гидролизуются с образованием оксосолей :
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза .
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример : изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:
2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример : изменение степени гидролиза Na2CO3 в зависимости от температуры:
По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Гидролиз солей
Гидролиз (от греч. – вода и – разложение) – это разложение водой. Гидролиз солей – это взаимодействие ионов соли с водой с образованием малодиссоциирующих частиц. Давая такое определение реакции гидролиза, мы подчеркиваем, что соли в растворе находятся в виде ионов и движущей силой реакции является образование малодиссоциирующих частиц (общее правило для многих реакций в растворах).
Всегда ли ионы способны образовывать с водой малодиссоциирующие частицы? Разбирая этот вопрос с учениками, отмечаем, что катионы сильного основания и анионы сильной кислоты таких частиц образовать не могут и, следовательно, в реакцию гидролиза не вступают.
Какие типы гидролиза возможны? Поскольку соль состоит из катиона и аниона, то возможны три типа гидролиза:
• гидролиз по катиону (в реакцию с водой вступает только катион);
• гидролиз по аниону (в реакцию с водой вступает только анион);
• совместный гидролиз (в реакцию с водой вступает и катион, и анион).
Гидролиз по катиону. Как катион может взаимодействовать с водой? Учитель сам должен решить, рассматривать ли ему этот вопрос в общем виде или (в менее сильном классе) на конкретном примере. Отмечаем, что катион – это положительно заряженная частица, а молекула воды полярна, условно можно представить ее состоящей из положительно заряженного атома водорода и отрицательно заряженной гидроксильной группы. Какую же часть молекулы воды оторвет и присоединит к себе катион? Ученики с удовольствием отвечают: «Гидроксильную группу!» Ответ подтверждаем записью уравнения, отмечая обратимость реакции:
M n+ + H–OH MOH (n–1)+ + H + .
Написав формулу образовавшейся частицы, тут же обсуждаем, что это за частица, будет ли она иметь заряд и какой, приходим к выводу, что, как правило, это гидроксокатион. А что останется от молекулы воды? Какую реакцию водного раствора обусловливает избыток этих частиц? Какова будет реакция индикатора? А теперь проверим нашу гипотезу (следует демонстрация опыта).
После этого школьники могут самостоятельно сделать вывод: гидролиз по катиону приводит к образованию гидроксокатионов и кислой среды раствора.
Отмечаем, что иногда (при n = 1) вместо гидроксокатионов получаем молекулы слабого основания. А может ли гидроксокатион вступить в реакцию со следующей молекулой воды? Сообщаем, что это будет вторая ступень гидролиза, что каждая следующая ступень протекает в тысячи раз слабее, чем предыдущая, что даже первая ступень протекает обычно на доли процента. Поэтому, как правило, рассматривается только первая ступень гидролиза.
Гидролиз по аниону разбираем аналогично, записывая уравнение:
An n– + H–OH HAn (n–1)– + OH – .
Подводим учеников к выводу: гидролиз по аниону приводит к образованию гидроанионов и щелочной среды раствора.
Совместный гидролиз. Из самого названия следует, что в этом случае в растворе протекают две выше рассмотренные реакции. Предлагаем школьникам проанализировать их и сделать вывод о реакции среды. Опровергаем (можно экспериментом) представление о том, что среда будет нейтральной. Одинаковое число ионов водорода и гидроксид-ионов существует только на бумаге. На самом деле здесь протекают две независимые обратимые реакции, и каких ионов в растворе окажется больше – зависит от степени протекания каждой реакции. А это, в свою очередь, зависит от того, что слабее – кислота или основание. Если слабее основание, то в большей степени будет протекать гидролиз по катиону и среда раствора будет кислой. Если слабее кислота – наоборот. Как исключение возможен случай, когда среда будет почти нейтральной, но это только исключение.
Одновременно обращаем внимание учащихся на то, что связывание гидроксид-ионов и ионов водорода в воду приводит к уменьшению их концентрации в растворе. Предлагаем вспомнить принцип Ле Шателье и подумать, как это повлияет на равновесие. Подводим их к выводу, что при совместном гидролизе степень его протекания будет значительно выше и в отдельных случаях это может привести к полному гидролизу.
Полный гидролиз. Для полного протекания гидролиза нужно, чтобы соль была образована очень слабой кислотой и очень слабым основанием. Кроме того, желательно, чтобы один из продуктов гидролиза уходил из сферы реакции в виде газа. (Малорастворимые вещества, остающиеся в контакте с раствором, вообще говоря, не уходят из сферы реакции, поскольку все равно в какой-то степени растворимы.) Поэтому полному гидролизу подвергаются обычно соли газообразных или неустойчивых кислот: сероводородной, угольной, отчасти сернистой. К ним примыкают вещества, которые в обычном понимании уже не являются солями: нитриды, фосфиды, карбиды, ацетилениды, бориды. Полностью гидролизуются также алкоголяты.
Если вернуться к обычным солям, то полностью гидролизующиеся соли (карбонаты, сульфиды алюминия, хрома(III), железа(III)) нельзя получить реакциями обмена в водных растворах. Вместо ожидаемых продуктов в результате реакции мы получим продукты гидролиза. Гидролиз осложняет протекание многих других реакций обмена. Так, при взаимодействии карбоната натрия с сульфатом меди в осадок обычно выпадает основный карбонат меди (CuOH)2CO3.
В таблице растворимости для полностью гидролизующихся солей стоит прочерк. Однако прочерк может стоять по другим причинам: вещество не изучено, разлагается в ходе окислительно-восстановительной реакции и т.п. Некоторые прочерки, иногда встречающиеся в таблице растворимости, вызывают удивление. Так, сульфид бария хорошо известен и растворим, как и сульфиды других щелочно-земельных металлов. Гидролиз этих солей протекает только по аниону.
Алгоритм написания уравнений гидролиза
Когда школьники поняли суть реакции гидролиза, даем (а лучше составляем вместе с ними) алгоритм написания уравнений гидролиза. Рассмотрим его на конкретных примерах.
Пример 1. Гидролиз сульфата меди(II)
1. Определяем тип гидролиза. На этом этапе школьники могут написать уравнение диссоциации соли:
CuSO4 = Cu 2+ + .
Можно дать им «правило цепочки»: цепочка рвется по слабому звену, гидролиз идет по иону слабого электролита.
Соль образована катионом слабого основания (подчеркиваем) и анионом сильной кислоты. Идет гидролиз по катиону.
2. Пишем ионное уравнение гидролиза, определяем среду:
Cu 2+ + H–OH CuOH + + H + .
Образуется катион гидроксомеди(II) и ион водорода, среда – кислая.
3. Составляем молекулярное уравнение. Надо учитывать, что составление такого уравнения есть некоторая формальная задача. Из положительных и отрицательных частиц, находящихся в растворе, мы составляем нейтральные частицы, существующие только на бумаге. В данном случае мы можем составить формулу (CuOH)2SO4, но для этого наше ионное уравнение мы должны мысленно умножить на два. Получаем:
2CuSO4 + 2H2O (CuOH)2SO4 + H2SO4.
Обращаем внимание, что продукт реакции относится к группе основных солей. Названия основных солей, как и названия средних, следует составлять из названий аниона и катиона, в данном случае соль назовем «сульфат гидроксомеди(II)». (Не надо приставки «ди», не говорим же мы «сульфат динатрия».) Назвать эту соль «гидроксосульфат меди», на наш взгляд, значит нарушить всю логику номенклатуры солей. Разве есть в растворе или в узлах кристаллической решетки частица «гидроксосульфат»? Нет! А катион гидроксомеди есть. В дальнейшем этот подход распространяется на номенклатуру комплексных солей.
Пример 2. Гидролиз ортофосфата рубидия
1. Определяем тип гидролиза:
Рубидий – щелочной металл, его гидроксид – сильное основание, фосфорная кислота, особенно по своей третьей стадии диссоциации, отвечающей образованию фосфатов, – слабая кислота. Идет гидролиз по аниону.
2. Пишем ионное уравнение гидролиза, определяем среду:
+ H–OH + OH – .
Продукты – гидрофосфат- и гидроксид-ионы, среда – щелочная.
3. Составляем молекулярное уравнение:
Rb3PO4 + H2O Rb2HPO4 + RbOH.
Получили кислую соль – гидрофосфат рубидия.
Пример 3. Гидролиз ацетата алюминия
1. Определяем тип гидролиза:
Соль образована катионом слабого основания и анионами слабой кислоты. Идет совместный гидролиз.
2. Пишем ионные уравнения гидролиза, определяем среду:
Al 3+ + H–OH AlOH 2+ + H + ,
CH3COO – + H–OH CH3COOH + OH – .
Учитывая, что гидроксид алюминия очень слабое основание, предположим, что гидролиз по катиону будет протекать в большей степени, чем по аниону. Следовательно, в растворе будет избыток ионов водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное уравнение реакции. Обе реакции обратимы, никак друг с другом не связаны, и такое суммирование бессмысленно.
3. Составляем молекулярное уравнение:
Al(CH3COO)3 + H2O AlOH(CH3COO)2 + CH3COOH.
Это тоже формальное упражнение, для тренировки в составлении формул солей и их номенклатуре. Полученную соль назовем ацетат гидроксоалюминия.
Факторы, влияющие на степень гидролиза
Поскольку гидролиз – обратимая реакция, то на состояние равновесия гидролиза влияют температура, концентрации участников реакции, добавки посторонних веществ. Если в реакции не участвуют газообразные вещества, то давление практически не влияет. Исключается из рассмотрения вода, т.к. ее концентрация в водных растворах практически постоянна
(
55 моль/л). Так, для примеров 1 и 2 выражения констант равновесия (констант гидролиза) имеют вид:
Температура. Поскольку реакция гидролиза эндотермическая, повышение температуры смещает равновесие в системе вправо, степень гидролиза возрастает.
Концентрация продуктов гидролиза. В соответствии с принципом Ле Шателье повышение концентрации ионов водорода для реакции, рассмотренной в примере 1, приведет к смещению равновесия влево, т.е. степень гидролиза будет уменьшаться. Также будет влиять увеличение концентрации гидроксид-ионов для реакции, рассмотренной в примере 2.
Концентрация соли. Рассмотрение этого фактора приводит к парадоксальному выводу: равновесие в системе смещается вправо (в соответствии с принципом Ле Шателье), но степень гидролиза уменьшается.
Понять это помогает константа равновесия. При добавлении соли, т.е. фосфат-ионов в примере 2, равновесие будет смещаться вправо, концентрации гидрофосфат- и гидроксид-ионов будут возрастать. Но из рассмотрения константы равновесия этой реакции ясно, что, для того чтобы увеличить концентрацию гидроксид-ионов вдвое, нам надо концентрацию фосфат-ионов увеличить в 4 раза! Ведь значение константы должно быть неизменным. А это значит, что степень гидролиза, под которой можно понимать отношение [OH – ]/[], уменьшится вдвое.
Разбавление. Этот фактор означает одновременное уменьшение концентрации всех частиц в растворе (не считая воды). В соответствии с принципом Ле Шателье такое воздействие приводит к смещению равновесия в сторону реакции, идущей с увеличением числа частиц. Реакция гидролиза протекает (без учета воды!) с увеличением числа частиц. Следовательно, при разбавлении равновесие смещается в сторону протекания этой реакции, т.е. вправо, степень гидролиза возрастает. К этому же выводу приведет рассмотрение константы гидролиза.
Добавки посторонних веществ могут влиять на положение равновесия в том случае, когда эти вещества реагируют с одним из участников реакции. Так, при добавлении к раствору сульфата меди в примере 1 раствора гидроксида натрия содержащиеся в нем гидроксид-ионы будут взаимодействовать с ионами водорода. В результате их концентрация уменьшится, и по принципу Ле Шателье равновесие в системе сместится вправо, степень гидролиза возрастет. Если к тому же раствору добавить раствор сульфида натрия, то равновесие сместится не вправо, как можно было бы ожидать (взаимное усиление гидролиза), а влево из-за связывания ионов меди в практически нерастворимый сульфид меди.
Практическое применение
На практике с гидролизом учителю приходится сталкиваться, например, при приготовлении растворов гидролизующихся солей, в частности ацетата свинца. Обычная методика: в колбу наливаем воду, засыпаем соль, взбалтываем. Остается белый осадок. Добавляем еще воды, взбалтываем – осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше…
Причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим, – это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия – разбавление, нагревание – только усиливают степень гидролиза.
Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов и, поскольку главным образом мешает гидролиз по катиону, добавить кислоты, лучше соответствующей, т.е. уксусной.
В других случаях степень гидролиза желательно увеличить. Например, чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающийся гидролизу. В результате происходит полный гидролиз, и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются, и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
Гидролиз в заданиях ЕГЭ по химии
ВОПРОС А26 (2003 г.). Фенолфталеин можно использовать для обнаружения в водном растворе соли:
1) ацетата алюминия; 2) нитрата калия; 3) сульфата алюминия; 4) силиката натрия.
Фенолфталеин – индикатор на щелочную среду, в которой он принимает малиновую окраску (возможно, для многих камнем преткновения в этом вопросе стало незнание окрасок индикаторов: фенолфталеина, лакмуса, метилоранжа). В растворе соли щелочная среда может возникнуть при гидролизе по аниону.
1) ацетат алюминия рассмотрен выше, идет совместный гидролиз, среда получается слабокислая;
2) нитрат калия образован сильными кислотой и основанием, гидролиз не идет, среда нейтральная;
3) сульфат алюминия образован сильной кислотой и слабым основанием, гидролиз идет по катиону, среда получается кислая;
4) силикат натрия образован слабой кислотой и сильным основанием, гидролиз идет по аниону, среда получается щелочная:
+ H2O H + OH – .
Ответ. 4.
ВОПРОС A29 (демонстрационный вариант, 2005 г.). Среда раствора карбоната калия:
1) щелочная; 2) кислая; 3) нейтральная; 4) слабокислая.
Рассмотрение аналогичное.
Ответ. 1.
ВОПРОС B5 (демонстрационный вариант, 2005 г.). Установите соответствие между формулой соли и ионным уравнением гидролиза этой соли.
| Формула соли: | CCCCC | Ионное уравнение: |
| 1) CuSO4; | а) CH3COO – + H2O CH3COOH + OH – ; | |
| 2) K2CO3; | б) + H2O NH3•H2O + H + ; | |
| 3) CH3COONa; | в) Сu 2+ + H2O Cu(OH) + + H + ; | |
| 4) (NH4)2SO4. | г) + H2O H + OH – ; | |
| д) Сu 2+ + 2H2O Cu(OH)2 +2H + . |
Пример не слишком удачного вопроса. С одной стороны, трудно на него не ответить, исходя из простого сопоставления формул в левой и правой колонках (про гидролиз можно при этом ничего не знать). С другой стороны, оба ионных уравнения для катиона меди можно считать правильными, но уравнение д) мы бы назвали суммарным для двух стадий гидролиза и отметили бы, что степень протекания реакции по нему чрезвычайно мала. Только на основе этого мы выберем уравнение в).
Ответ. 1 – в; 2 – г; 3 – а; 4 – б.
ВОПРОС В3 (2004 г.). Установите соответствие между условиями и состоянием химического равновесия процесса гидролиза солей.
Условия смещения равновесия:
1) нагревание раствора;
2) добавление продуктов гидролиза;
3) охлаждение раствора;
4) разбавление раствора.
а) смещается влево;
б) смещается вправо;
в) не смещается.
Используем установленные выше закономерности.
Ответ. 1 – б; 2 – а; 3 – а; 4 – б.
ВОПРОС С1 (2004 г.). Как скажется на состоянии химического равновесия в системе
Zn 2+ + H2O ZnOH + + H + – Q:
2) добавление KOH;
3) нагревание раствора?
При ответе на этот вопрос надо учитывать, что добавляемые вещества – электролиты. Поставляемые ими ионы могут как непосредственно влиять на равновесие, так и взаимодействовать с одним из ионов, участвующих в обратимой реакции:
H2SO4 = 2H + + ,
повышение концентрации ионов водорода приводит по принципу Ле Шателье к смещению равновесия в системе влево;
2) добавление KOH:
гидроксид-ионы связывают ионы водорода в малодиссоциирующее вещество – воду
(H + + OH – = H2O); снижение концентрации ионов водорода приводит по принципу Ле Шателье к смещению равновесия в системе вправо;
3) нагревание раствора по принципу Ле Шателье приводит к смещению равновесия в сторону протекания эндотермической реакции, т.е. вправо.
Ответ на все три элемента вопроса оценивался в 3 балла.
Попробуйте самостоятельно ответить на следующие вопросы.
ВОПРОС А26 (2003 г.). Между собой водные растворы сульфата и фосфата натрия можно различить с помощью:
1) гидроксида натрия;
2) серной кислоты;
3) фенолфталеина;
4) фосфорной кислоты.
ВОПРОС В3 (2003 г.). Установите соответствие между названиями солей и средой их растворов.
1) нитрит калия;
2) сульфат железа(II);
3) карбонат калия;
4) хлорид алюминия.
а) кислая;
б) нейтральная;
в) щелочная.
ВОПРОС В3 (2004 г.). Установите соответствие между формулой соли и способностью этой соли к гидролизу.
Способность к гидролизу:
а) гидролиз по катиону;
б) гидролиз по аниону;
в) гидролиз по катиону и аниону;
г) гидролизу не подвергается.
ВОПРОС С1 (2003 г.). Сульфид-ион – типичный протолит. Напишите уравнение протолиза (гидролиза) сульфид-иона в водном растворе по первой ступени. Укажите среду этого раствора. Как скажется добавление гидроксида натрия на степень протолиза сульфид-ионов?
Подводя итог, отметим, что в рамках школьного курса в реакциях гидролиза солей нет ничего чрезмерно сложного для понимания школьника. Здесь используются общие правила написания ионных уравнений, общие представления о смещении химического равновесия, общий подход к номенклатуре солей, краткий и удобный алгоритм написания уравнений. Хочется надеяться, что изложенный материал поможет вам и вашим ученикам.
[spoiler title=”источники:”]
http://chemege.ru/gidroliz/
http://him.1sept.ru/article.php?ID=200501003
[/spoiler]
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН < 7), раствор карбоната калия K2СО3 — щелочную среду (pН > 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н+ или гидроксид-ионы ОН—, которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН— или ионами водорода Н+ из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н+ или ОН—, и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н+ молекулы воды, образуя слабый электролит (кислоту).
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
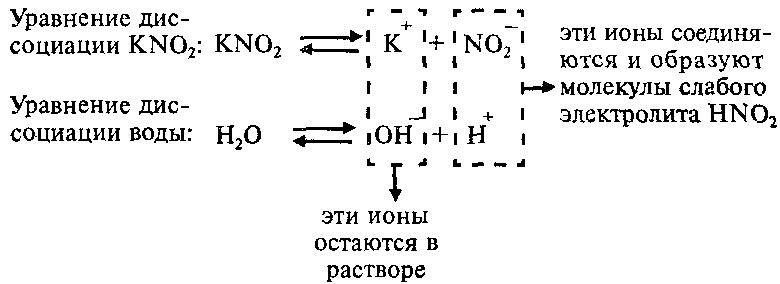
Так как ионы Н+ соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН—. Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН— воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4+ связываются с гидроксид-ионами ОН— воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н+. Среда раствора соли NH4I – кислая, рН<7.
Вывод: Соли, образованные сильной кислотой и слабым основанием, при гидролизе показывают кислую реакцию среды, рН < 7.
III. Соли, образованные слабым основанием и слабой кислотой, гидролизуются одновременно и по катиону, и по аниону. Эти соли образованы катионом слабого основания, который связывает ионы ОН— из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н+ из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH: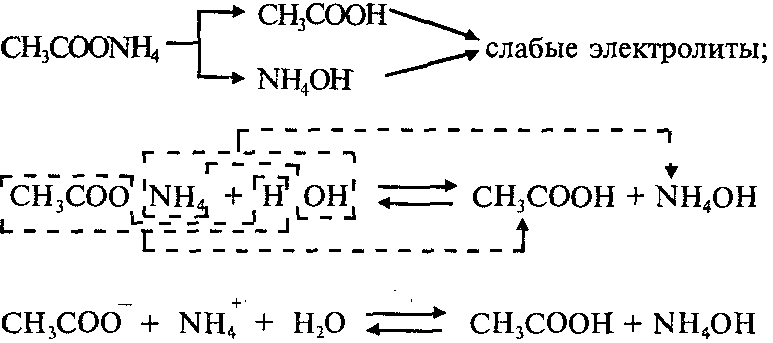
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:


Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S↑
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
3K2S + 2FeBr3 = Fe2S3 + 6KBr;
Fe2S3 + 6H2O = 2Fe(OH)3↓ + 3H2S↑
Суммируя эти уравнения, получаем:
3K2S + 2FeBr3 + 6Н2O = 2Fe(OH)3↓ + 3H2S↑ + 6KBr
или в ионном виде:
3S2- + 2Fe3+ + 6Н2O = 2Fe(OH)3↓ + 3H2S↑
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н+ или ОН— воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н+ и ОН— в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Первая ступень:
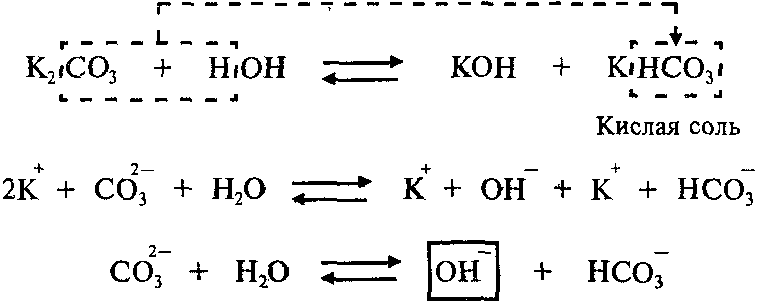
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН—.
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni2+ связывает гидроксид-ионы ОН— воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Первая ступень:

Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН < 7, потому что в растворе увеличивается концентрация ионов Н+.
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
Гидролиз солей
Общие понятия
Гидролиз (от греч. ![]() – вода и
– вода и ![]() – разложение) – это разложение водой.
– разложение) – это разложение водой.
Гидролиз солей – это взаимодействие ионов соли с
водой с образованием малодиссоциирующих частиц.
Давая такое определение реакции гидролиза, мы
подчеркиваем, что соли в растворе находятся в
виде ионов и движущей силой реакции является
образование малодиссоциирующих частиц (общее
правило для многих реакций в растворах).
Всегда ли ионы способны образовывать с водой
малодиссоциирующие частицы? Разбирая этот
вопрос с учениками, отмечаем, что катионы
сильного основания и анионы сильной кислоты
таких частиц образовать не могут и,
следовательно, в реакцию гидролиза не вступают.
Какие типы гидролиза возможны? Поскольку соль
состоит из катиона и аниона, то возможны три типа
гидролиза:
• гидролиз по катиону (в реакцию с водой
вступает только катион);
• гидролиз по аниону (в реакцию с водой вступает
только анион);
• совместный гидролиз (в реакцию с водой
вступает и катион, и анион).
Гидролиз по катиону. Как катион может
взаимодействовать с водой? Учитель сам должен
решить, рассматривать ли ему этот вопрос в общем
виде или (в менее сильном классе) на конкретном
примере. Отмечаем, что катион – это положительно
заряженная частица, а молекула воды полярна,
условно можно представить ее состоящей из
положительно заряженного атома водорода и
отрицательно заряженной гидроксильной группы.
Какую же часть молекулы воды оторвет и
присоединит к себе катион? Ученики с
удовольствием отвечают: «Гидроксильную группу!»
Ответ подтверждаем записью уравнения, отмечая
обратимость реакции:
Mn+ + H–OH ![]() MOH(n–1)+ + H+.
MOH(n–1)+ + H+.
Написав формулу образовавшейся частицы, тут же
обсуждаем, что это за частица, будет ли она иметь
заряд и какой, приходим к выводу, что, как правило,
это гидроксокатион. А что останется от молекулы
воды? Какую реакцию водного раствора
обусловливает избыток этих частиц? Какова будет
реакция индикатора? А теперь проверим нашу
гипотезу (следует демонстрация опыта).
После этого школьники могут самостоятельно
сделать вывод: гидролиз по катиону приводит к
образованию гидроксокатионов и кислой среды
раствора.
Отмечаем, что иногда (при n = 1) вместо
гидроксокатионов получаем молекулы слабого
основания. А может ли гидроксокатион вступить в
реакцию со следующей молекулой воды? Сообщаем,
что это будет вторая ступень гидролиза, что
каждая следующая ступень протекает в тысячи раз
слабее, чем предыдущая, что даже первая ступень
протекает обычно на доли процента. Поэтому, как
правило, рассматривается только первая ступень
гидролиза.
Гидролиз по аниону разбираем
аналогично, записывая уравнение:
Ann– + H–OH ![]() HAn(n–1)– + OH–.
HAn(n–1)– + OH–.
Подводим учеников к выводу: гидролиз по
аниону приводит к образованию гидроанионов и
щелочной среды раствора.
Совместный гидролиз. Из самого
названия следует, что в этом случае в растворе
протекают две выше рассмотренные реакции.
Предлагаем школьникам проанализировать их и
сделать вывод о реакции среды. Опровергаем (можно
экспериментом) представление о том, что среда
будет нейтральной. Одинаковое число ионов
водорода и гидроксид-ионов существует только на
бумаге. На самом деле здесь протекают две
независимые обратимые реакции, и каких ионов в
растворе окажется больше – зависит от степени
протекания каждой реакции. А это, в свою очередь,
зависит от того, что слабее – кислота или
основание. Если слабее основание, то в большей
степени будет протекать гидролиз по катиону и
среда раствора будет кислой. Если слабее кислота
– наоборот. Как исключение возможен случай,
когда среда будет почти нейтральной, но это
только исключение.
Одновременно обращаем внимание учащихся на то,
что связывание гидроксид-ионов и ионов водорода
в воду приводит к уменьшению их концентрации в
растворе. Предлагаем вспомнить принцип Ле
Шателье и подумать, как это повлияет на
равновесие. Подводим их к выводу, что при
совместном гидролизе степень его протекания
будет значительно выше и в отдельных случаях это
может привести к полному гидролизу.
Полный гидролиз. Для полного
протекания гидролиза нужно, чтобы соль была
образована очень слабой кислотой и очень слабым
основанием. Кроме того, желательно, чтобы один из
продуктов гидролиза уходил из сферы реакции в
виде газа. (Малорастворимые вещества, остающиеся
в контакте с раствором, вообще говоря, не уходят
из сферы реакции, поскольку все равно в какой-то
степени растворимы.) Поэтому полному гидролизу
подвергаются обычно соли газообразных или
неустойчивых кислот: сероводородной, угольной,
отчасти сернистой. К ним примыкают вещества,
которые в обычном понимании уже не являются
солями: нитриды, фосфиды, карбиды, ацетилениды,
бориды. Полностью гидролизуются также
алкоголяты.
Если вернуться к обычным солям, то полностью
гидролизующиеся соли (карбонаты, сульфиды
алюминия, хрома(III), железа(III)) нельзя получить
реакциями обмена в водных растворах. Вместо
ожидаемых продуктов в результате реакции мы
получим продукты гидролиза. Гидролиз осложняет
протекание многих других реакций обмена. Так, при
взаимодействии карбоната натрия с сульфатом
меди в осадок обычно выпадает основный карбонат
меди (CuOH)2CO3.
В таблице растворимости для полностью
гидролизующихся солей стоит прочерк. Однако
прочерк может стоять по другим причинам:
вещество не изучено, разлагается в ходе
окислительно-восстановительной реакции и т.п.
Некоторые прочерки, иногда встречающиеся в
таблице растворимости, вызывают удивление. Так,
сульфид бария хорошо известен и растворим, как и
сульфиды других щелочно-земельных металлов.
Гидролиз этих солей протекает только по аниону.
Алгоритм написания уравнений гидролиза
Когда школьники поняли суть реакции гидролиза,
даем (а лучше составляем вместе с ними) алгоритм
написания уравнений гидролиза. Рассмотрим его на
конкретных примерах.
![]() Пример 1. Гидролиз
Пример 1. Гидролиз
сульфата меди(II)
1. Определяем тип гидролиза. На
этом этапе школьники могут написать уравнение
диссоциации соли:
CuSO4 = Cu2+ + ![]() .
.
Можно дать им «правило цепочки»: цепочка рвется
по слабому звену, гидролиз идет по иону слабого
электролита.
Соль образована катионом слабого основания
(подчеркиваем) и анионом сильной кислоты. Идет
гидролиз по катиону.
2. Пишем ионное уравнение гидролиза,
определяем среду:
Cu2+ + H–OH ![]()
CuOH+ + H+.
Образуется катион гидроксомеди(II) и ион
водорода, среда – кислая.
3. Составляем молекулярное
уравнение. Надо учитывать, что составление
такого уравнения есть некоторая формальная
задача. Из положительных и отрицательных частиц,
находящихся в растворе, мы составляем
нейтральные частицы, существующие только на
бумаге. В данном случае мы можем составить
формулу (CuOH)2SO4, но для этого наше
ионное уравнение мы должны мысленно умножить на
два. Получаем:
2CuSO4 + 2H2O ![]() (CuOH)2SO4 + H2SO4.
(CuOH)2SO4 + H2SO4.
Обращаем внимание, что продукт реакции
относится к группе основных солей. Названия
основных солей, как и названия средних, следует
составлять из названий аниона и катиона, в данном
случае соль назовем «сульфат гидроксомеди(II)».
(Не надо приставки «ди», не говорим же мы «сульфат
динатрия».) Назвать эту соль «гидроксосульфат
меди», на наш взгляд, значит нарушить всю логику
номенклатуры солей. Разве есть в растворе или в
узлах кристаллической решетки частица
«гидроксосульфат»? Нет! А катион гидроксомеди
есть. В дальнейшем этот подход распространяется
на номенклатуру комплексных солей.
![]() Пример 2. Гидролиз
Пример 2. Гидролиз
ортофосфата рубидия
1. Определяем тип гидролиза:
Rb3PO4 = 3Rb+ + PO43–.
Рубидий – щелочной металл, его гидроксид –
сильное основание, фосфорная кислота, особенно
по своей третьей стадии диссоциации, отвечающей
образованию фосфатов, – слабая кислота. Идет
гидролиз по аниону.
2. Пишем ионное уравнение гидролиза,
определяем среду:
![]() + H–OH
+ H–OH ![]()
![]() + OH–.
+ OH–.
Продукты – гидрофосфат- и гидроксид-ионы, среда
– щелочная.
3. Составляем молекулярное
уравнение:
Rb3PO4 + H2O ![]() Rb2HPO4 + RbOH.
Rb2HPO4 + RbOH.
Получили кислую соль – гидрофосфат рубидия.
![]() Пример 3. Гидролиз
Пример 3. Гидролиз
ацетата алюминия
1. Определяем тип гидролиза:
Al(CH3COO)3 = Al3+ + 3CH3COO–.
Соль образована катионом слабого основания и
анионами слабой кислоты. Идет совместный
гидролиз.
2. Пишем ионные уравнения гидролиза,
определяем среду:
Al3+ + H–OH ![]()
AlOH2+ + H+,
CH3COO– + H–OH ![]() CH3COOH + OH–.
CH3COOH + OH–.
Учитывая, что гидроксид алюминия очень слабое
основание, предположим, что гидролиз по катиону
будет протекать в большей степени, чем по аниону.
Следовательно, в растворе будет избыток ионов
водорода, и среда будет кислая.
Не стоит пытаться составлять здесь суммарное
уравнение реакции. Обе реакции обратимы, никак
друг с другом не связаны, и такое суммирование
бессмысленно.
3. Составляем молекулярное
уравнение:
Al(CH3COO)3 + H2O ![]() AlOH(CH3COO)2 + CH3COOH.
AlOH(CH3COO)2 + CH3COOH.
Это тоже формальное упражнение, для тренировки
в составлении формул солей и их номенклатуре.
Полученную соль назовем ацетат
гидроксоалюминия.
Факторы, влияющие на степень гидролиза
Поскольку гидролиз – обратимая реакция, то на
состояние равновесия гидролиза влияют
температура, концентрации участников реакции,
добавки посторонних веществ. Если в реакции не
участвуют газообразные вещества, то давление
практически не влияет. Исключается из
рассмотрения вода, т.к. ее концентрация в водных
растворах практически постоянна
(~55 моль/л). Так, для примеров 1 и 2 выражения
констант равновесия (констант гидролиза) имеют
вид:
![]()
Температура. Поскольку реакция
гидролиза эндотермическая, повышение
температуры смещает равновесие в системе вправо,
степень гидролиза возрастает.
Концентрация продуктов гидролиза. В
соответствии с принципом Ле Шателье повышение
концентрации ионов водорода для реакции,
рассмотренной в примере 1, приведет к смещению
равновесия влево, т.е. степень гидролиза будет
уменьшаться. Также будет влиять увеличение
концентрации гидроксид-ионов для реакции,
рассмотренной в примере 2.
Концентрация соли. Рассмотрение этого
фактора приводит к парадоксальному выводу:
равновесие в системе смещается вправо (в
соответствии с принципом Ле Шателье), но степень
гидролиза уменьшается.
Понять это помогает константа равновесия. При
добавлении соли, т.е. фосфат-ионов в примере 2,
равновесие будет смещаться вправо, концентрации
гидрофосфат- и гидроксид-ионов будут возрастать.
Но из рассмотрения константы равновесия этой
реакции ясно, что, для того чтобы увеличить
концентрацию гидроксид-ионов вдвое, нам надо
концентрацию фосфат-ионов увеличить в 4 раза!
Ведь значение константы должно быть неизменным.
А это значит, что степень гидролиза, под которой
можно понимать отношение [OH–]/[![]() ], уменьшится вдвое.
], уменьшится вдвое.
Разбавление. Этот фактор означает
одновременное уменьшение концентрации всех
частиц в растворе (не считая воды). В соответствии
с принципом Ле Шателье такое воздействие
приводит к смещению равновесия в сторону
реакции, идущей с увеличением числа частиц.
Реакция гидролиза протекает (без учета воды!) с
увеличением числа частиц. Следовательно, при
разбавлении равновесие смещается в сторону
протекания этой реакции, т.е. вправо, степень
гидролиза возрастает. К этому же выводу приведет
рассмотрение константы гидролиза.
Добавки посторонних веществ могут
влиять на положение равновесия в том случае,
когда эти вещества реагируют с одним из
участников реакции. Так, при добавлении к
раствору сульфата меди в примере 1 раствора
гидроксида натрия содержащиеся в нем
гидроксид-ионы будут взаимодействовать с ионами
водорода. В результате их концентрация
уменьшится, и по принципу Ле Шателье равновесие в
системе сместится вправо, степень гидролиза
возрастет. Если к тому же раствору добавить
раствор сульфида натрия, то равновесие сместится
не вправо, как можно было бы ожидать (взаимное
усиление гидролиза), а влево из-за связывания
ионов меди в практически нерастворимый сульфид
меди.
Практическое применение
На практике с гидролизом учителю приходится
сталкиваться, например, при приготовлении
растворов гидролизующихся солей, в частности
ацетата свинца. Обычная методика: в колбу
наливаем воду, засыпаем соль, взбалтываем.
Остается белый осадок. Добавляем еще воды,
взбалтываем – осадок не исчезает. Добавляем из
чайника горячей воды – осадка кажется еще
больше…
Причина в том, что одновременно с растворением
идет гидролиз соли, и белый осадок, который мы
видим, – это уже продукты гидролиза –
малорастворимые основные соли. Все наши
дальнейшие действия – разбавление, нагревание –
только усиливают степень гидролиза.
Как же подавить гидролиз? Не нагревать, не
готовить слишком разбавленных растворов и,
поскольку главным образом мешает гидролиз по
катиону, добавить кислоты, лучше
соответствующей, т.е. уксусной.
В других случаях степень гидролиза желательно
увеличить. Например, чтобы сделать щелочной
моющий раствор бельевой соды более активным, мы
его нагреваем – степень гидролиза карбоната
натрия при этом возрастает.
Важную роль играет гидролиз в процессе
обезжелезивания воды методом аэрации. При
насыщении воды кислородом содержащийся в ней
гидрокарбонат железа(II) окисляется до соли
железа(III), значительно сильнее подвергающийся
гидролизу. В результате происходит полный
гидролиз, и железо отделяется в виде осадка
гидроксида железа(III).
На этом же основано применение солей алюминия в
качестве коагулянтов в процессах очистки воды.
Добавляемые в воду соли алюминия в присутствии
гидрокарбонат-ионов полностью гидролизуются, и
объемистый гидроксид алюминия коагулирует,
увлекая с собой в осадок различные примеси.
Гидролиз в заданиях ЕГЭ по химии
ВОПРОС А26 (2003 г.). Фенолфталеин
можно использовать для обнаружения в водном
растворе соли:
1) ацетата алюминия; 2) нитрата калия; 3) сульфата
алюминия; 4) силиката натрия.
![]() Фенолфталеин
Фенолфталеин
– индикатор на щелочную среду, в которой он
принимает малиновую окраску (возможно, для
многих камнем преткновения в этом вопросе стало
незнание окрасок индикаторов: фенолфталеина,
лакмуса, метилоранжа). В растворе соли щелочная
среда может возникнуть при гидролизе по аниону.
Анализируем:
1) ацетат алюминия рассмотрен выше, идет
совместный гидролиз, среда получается
слабокислая;
2) нитрат калия образован сильными кислотой и
основанием, гидролиз не идет, среда нейтральная;
3) сульфат алюминия образован сильной кислотой
и слабым основанием, гидролиз идет по катиону,
среда получается кислая;
4) силикат натрия образован слабой кислотой и
сильным основанием, гидролиз идет по аниону,
среда получается щелочная:
![]() + H2O
+ H2O
![]() H
H![]() + OH–.
+ OH–.
Ответ. 4.
ВОПРОС A29 (демонстрационный
вариант, 2005 г.). Среда раствора карбоната калия:
1) щелочная; 2) кислая; 3) нейтральная; 4)
слабокислая.
![]() Рассмотрение
Рассмотрение
аналогичное.
Ответ. 1.
ВОПРОС B5 (демонстрационный
вариант, 2005 г.). Установите соответствие между
формулой соли и ионным уравнением гидролиза этой
соли.
![]() Пример не
Пример не
слишком удачного вопроса. С одной стороны, трудно
на него не ответить, исходя из простого
сопоставления формул в левой и правой колонках
(про гидролиз можно при этом ничего не знать). С
другой стороны, оба ионных уравнения для катиона
меди можно считать правильными, но уравнение д)
мы бы назвали суммарным для двух стадий
гидролиза и отметили бы, что степень протекания
реакции по нему чрезвычайно мала. Только на
основе этого мы выберем уравнение в).
Ответ. 1 – в; 2 – г; 3 – а; 4 – б.
ВОПРОС В3 (2004 г.). Установите
соответствие между условиями и состоянием
химического равновесия процесса гидролиза
солей.
Условия смещения равновесия:
1) нагревание раствора;
2) добавление продуктов гидролиза;
3) охлаждение раствора;
4) разбавление раствора.
Химическое равновесие:
а) смещается влево;
б) смещается вправо;
в) не смещается.
![]() Используем
Используем
установленные выше закономерности.
Ответ. 1 – б; 2 – а; 3 – а; 4 – б.
ВОПРОС С1 (2004 г.). Как скажется на
состоянии химического равновесия в системе
Zn2+ + H2O ![]() ZnOH+ + H+ – Q:
ZnOH+ + H+ – Q:
1) добавление H2SO4;
2) добавление KOH;
3) нагревание раствора?
Ответ обоснуйте.
![]() При ответе на
При ответе на
этот вопрос надо учитывать, что добавляемые
вещества – электролиты. Поставляемые ими ионы
могут как непосредственно влиять на равновесие,
так и взаимодействовать с одним из ионов,
участвующих в обратимой реакции:
1) добавление H2SO4:
H2SO4 = 2H+ + ![]() ,
,
повышение концентрации ионов водорода
приводит по принципу Ле Шателье к смещению
равновесия в системе влево;
2) добавление KOH:
KOH = K+ + OH–,
гидроксид-ионы связывают ионы водорода в
малодиссоциирующее вещество – воду
(H+ + OH– = H2O); снижение
концентрации ионов водорода приводит по
принципу Ле Шателье к смещению равновесия в
системе вправо;
3) нагревание раствора по принципу Ле Шателье
приводит к смещению равновесия в сторону
протекания эндотермической реакции, т.е. вправо.
Ответ на все три элемента вопроса
оценивался в 3 балла.
Попробуйте самостоятельно ответить на
следующие вопросы.
ВОПРОС А26 (2003 г.). Между собой
водные растворы сульфата и фосфата натрия можно
различить с помощью:
1) гидроксида натрия;
2) серной кислоты;
3) фенолфталеина;
4) фосфорной кислоты.
ВОПРОС В3 (2003 г.). Установите
соответствие между названиями солей и средой их
растворов.
Название соли:
1) нитрит калия;
2) сульфат железа(II);
3) карбонат калия;
4) хлорид алюминия.
Среда раствора:
а) кислая;
б) нейтральная;
в) щелочная.
ВОПРОС В3 (2004 г.). Установите
соответствие между формулой соли и способностью
этой соли к гидролизу.
Формула соли:
1) Zn(CH3COO)2;
2) NaBr;
3) Li2S;
4) (NH4)2SO4.
Способность к гидролизу:
а) гидролиз по катиону;
б) гидролиз по аниону;
в) гидролиз по катиону и аниону;
г) гидролизу не подвергается.
ВОПРОС С1 (2003 г.). Сульфид-ион –
типичный протолит. Напишите уравнение протолиза
(гидролиза) сульфид-иона в водном растворе по
первой ступени. Укажите среду этого раствора. Как
скажется добавление гидроксида натрия на
степень протолиза сульфид-ионов?
* * *
Подводя итог, отметим, что в рамках школьного
курса в реакциях гидролиза солей нет ничего
чрезмерно сложного для понимания школьника.
Здесь используются общие правила написания
ионных уравнений, общие представления о смещении
химического равновесия, общий подход к
номенклатуре солей, краткий и удобный алгоритм
написания уравнений. Хочется надеяться, что
изложенный материал поможет вам и вашим
ученикам.
Автор будет благодарен за возможные замечания
и ответит на возникшие вопросы, с которыми можно
обратиться к нему по адресу: kontren@narod.ru.
Г.М.МОЖАЕВ,
старший преподаватель
химического факультета
Тюменского государственного университета
3.1. Теоретическая часть
Гидролиз
солей
– взаимодействие ионов соли с водой,
приводящее к образованию слабого
электролита.
В результате гидролиза происходит
смещение равновесия диссоциации воды
вследствие образования малодиссоцирующих
соединений, малорастворимьх и летучих
веществ. Поэтому гидролизуютcя только
катионы слабых оснований и анионы слабых
кислот, то есть три типа солей:
1) соли,
образованные слабыми основаниями и
сильными кислотами (гидролиз по
катиону), например, NН4CI,
Mg(NO3)2,
FeС13;
2) соли,
образованные сильными основаниями и
слабыми кислотами (гидролиз по аниону),
например, СН3СООNa,
Na2CO3,
Na2SO3;
3) соли,
образованные слабыми основаниями и
слабыми кислотами (гидролиз по катиону
и аниону), например, CH3COONН4,
Аl2S3,
(NH4)2S.
Формулы
сильных и слабых кислот и оснований
приведены в табл. 2.1 и 2.2.
3.2. Примеры решения индивидуального задания
Пример
№1.
Условие
задания: Написать
уравнение ступенчатого гидролиза соли
Na2CO3.
Указать реакцию среды и константу
равновесия для каждой стадии.
Решение
Гидролиз
соли Na2CO3,
образованной сильным основанием NaОН и
слабой двухосновной кислотой H2CO3,
протекает ступенчато в 2 стадии:
I
ступень:
Na2CO3
+ HOH ⇄
NaHCO3
+ NaOH
Na+
+ СО32-
+ HOH ⇄
Na+
+ HCO3–
+ Na+
+ OH–
СО32-
+ HOH ⇄
HCO3–
+ OH–
(среда
щелочная, рН > 7)
Константа равновесия
I ступени:

II
ступень:
NaНCO3
+ HOH ⇄
H2CO3
+ NaOH
Na+
+
НCO3–
+ HOH ⇄
Н2CO3
+ Na+
+ OH–
НCO3–
+ HOH ⇄
Н2CO3
+ OH–
(среда
щелочная, рН > 7)
Константа равновесия
II ступени:

Пример
№ 2.
Условие
задания: Написать
уравнение ступенчатого гидролиза соли
FeCl2.
Указать реакцию среды и константу
равновесия для каждой стадии.
Решение
Гидролиз
соли FeCl2,
образованной слабым многокислотным
основанием Fe(OH)2
и сильной кислотой HCl, протекает
ступенчато в 2 стадии:
I
ступень:
FeCl2
+ HOH ⇄
Fe(OH)Cl
+ HCl
Fe2+
+ 2 Cl–
+ HOH ⇄
FeOH+
+ Cl–
+
H+
+ Cl–
Fe2+
+ HOH ⇄
FeOH+
+ H+
(среда
кислая,
рН
< 7)
Константа равновесия
I ступени:

II
ступень:
Fe(OH)Cl
+ HOH ⇄
Fe(OH)2+
HCl
FeOH+
+ Cl–
+
HOH ⇄
Fe(OH)2
+ H+
+
Cl–
FeOH+
+ HOH ⇄
Fe(OH)2
+ H+
(среда
кислая,
рН
< 7)
Константа равновесия
II ступени:

Пример
№ 3.
Условие
задания: Написать
уравнение гидролиза соли
KCN.
Вычислить константу гидролиза Кг,
концентрацию
ионов водорода [H+]
и рН раствора соли, если известно, что
концентрация соли 0,1М, а константа
диссоциации синильной кислоты Кд(HCN)
= 7,2 • 10-10
(табл.2.2).
Решение
1.
Уравнение реакции гидролиза соли KCN,
которая образована сильным основанием
KOH и слабой кислотой HCN имеет вид:
KCN
+ НОН ⇄
КОН + НCN
K+
+ CN–
+ НОН ⇄
К+
+ ОН–
+ НCN
CN–
+ НОН ⇄
ОН–
+ НCN
2.
Константа гидролиза Кг для соли, которая
образована сильным
основанием
и слабой
кислотой,
рассчитывается по формуле:

Тогда:

3.
Концентрация ионов водорода равна:
![]() г-ион/дм3
г-ион/дм3
4.
Рассчитываем рН раствора соли:
pH
= – lg 8,5 • 10-13
=
12,07
Пример
№ 4.
Условие
задания: Написать
уравнение гидролиза соли
NH4Cl.
Вычислить константу гидролиза Кг,
концентрацию
ионов водорода [H+]
и рН раствора соли, если известно, что
концентрация соли 0,1М, а константа
диссоциации гидроксида аммония Кд(NH4OH)
= 1,79 •10-5
(табл.
2.2).
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
10.02.20161.72 Mб14referat_turbaza.docx
- #
- #
- #
- #
- #
- #
