Темы кодификатора ЕГЭ: Гидролиз солей. Среда водных растворов: кислая, основная и щелочная.
Гидролиз – взаимодействие веществ с водой. Гидролизу подвергаются разные классы неорганических и органических веществ: соли, бинарные соединения, углеводы, жиры, белки, эфиры и другие вещества. Гидролиз солей происходит, когда ионы соли способны образовывать с Н+ и ОН— ионами воды малодиссоциированные электролиты.

Гидролиз солей может протекать:
→ обратимо: только небольшая часть частиц исходного вещества гидролизуется.
→ необратимо: практически все частицы исходного вещества гидролизуются.
Для оценки типа гидролиза необходимо рассмотреть соль, как продукт взаимодействия основания и кислоты. Любая соль состоит из металла и кислотного остатка. Металлы соответствует основание или амфотерный гидроксид (с той же степенью окисления, что и в соли), а кислотному остатку — кислота. Например, карбонату натрия Na2CO3 соответствует основание — щелочь NaOH и угольная кислота H2CO3.
Обратимый гидролиз солей
Механизм обратимого гидролиза будет зависеть от состава исходной соли. Можно выделить 4 основных варианта, которые мы рассмотрим на примерах:
1. Соли, образованные сильным основанием и слабой кислотой, гидролизуются ПО АНИОНУ.
Примеры таких солей — CH3COONa, Na2CO3, Na2S, KCN.
Реакция гидролиза:
CH3COONa + HOH ↔ CH3COOH + NaOH
в ионной форме:
CH3COO— + Na+ + HOH ↔ CH3COOH + Na+ + OH—
сокращенное ионное уравнение:
CH3COO— + HOH ↔ CH3COOH + OH—
Таким образом, при гидролизе таких солей в растворе образуется небольшой избыток гидроксид-ионов OH—. Водородный показатель такого раствора рН>7.
Гидролиз солей многоосновных кислот (H2CO3, H3PO4 и т.п.) протекает ступенчато, с образованием кислых солей:
CO32- + HOH ↔ HCO32- + OH—
или в молекулярной форме:
Na2CO3 + HOH ↔ NaHCO3 + NaOH
2 ступень:
HCO3— + HOH ↔ H2CO3 + OH—
или в молекулярной форме:
NaHCO3 + HOH ↔ H2CO3 + NaOH
Продукты гидролиза по первой ступени подавляют вторую ступень гидролиза, в результате вторая ступень гидролиза протекает незначительно.
2. Соли, образованные слабым основанием и сильной кислотой, гидролизуются ПО КАТИОНУ. Пример такой соли: NH4Cl, FeCl3, Al2(SO4)3 Уравнение гидролиза:
NH4+ + HOH ↔ NH3·H2O + H+
или в молекулярной форме:
NH4Cl + HOH ↔ NH3·H2O + HCl
При этом катион слабого основания притягивает гидроксид-ионы из воды, а в растворе возникает избыток ионов Н+. Водородный показатель такого раствора рН<7.
Соли, образованные многокислотными основаниями, гидролизуются ступенчато, образуя катионы основных солей. Например:
I ступень:
Fe3+ + HOH ↔ FeOH2+ + H+
FeCl3 + HOH ↔ FeOHCl2 + HCl
II ступень:
FeOH2+ + HOH ↔ Fe(OH)2+ + H+
FeOHCl2 + HOH ↔ Fe(OH)2Cl+ HCl
III ступень:
Fe(OH)2+ + HOH ↔ Fe(OH)3 + H+
Fe(OH)2Cl + HOH ↔ Fe(OH)3 + HCl
Гидролиз по второй и, в особенности, по третьей ступени практически не протекает при комнатной температуре.
3. Соли, образованные слабым основанием и слабой кислотой, гидролизуются И ПО КАТИОНУ, И ПО АНИОНУ.
Примеры таких солей: CH3COONH4, (NH4)2CO3, HCOONH4,
Уравнение гидролиза:
CH3COO— + NH4+ + HOH ↔ CH3COOH + NH3·H2O
CH3COONH4 + HOH ↔ CH3COOH + NH3·H2O
В этом случае реакция раствора зависит от соотношения констант диссоциации образующихся кислот и оснований. В большинстве случаев реакция раствора будет примерно нейтральной, рН ≅ 7. Точное значение рН зависит от относительной силы основания и кислоты.
4. Гидролиз солей, образованных сильным основанием и сильной кислотой, в водных растворах НЕ ИДЕТ.
Сведем вышеописанную информацию в общую таблицу:

Необратимый гидролиз
Необратимый гидролиз происходит, если при гидролизе выделяется газ, осадок или вода, т.е. вещества, которые при данных условиях не могут взаимодействовать между собой. Необратимый гидролиз является химической реакцией, т.к. реагирующие вещества взаимодействуют практически полностью.
Варианты необратимого гидролиза:
- Гидролиз, в который вступают растворимые соли 2х-валентных металлов (Be2+, Co2+, Ni2+, Zn2+, Pb2+, Cu2+ и др.) с сильным ионизирующим полем (слабые основания) и растворимые карбонаты/гидрокарбонаты. При этом образуются нерастворимые основные соли (гидроксокарбонаты):
2MgCl2 + 2Na2CO3 + H2O = Mg2(OH)2CO3 + 4NaCl + CO2
2МеCl2 + 2Na2CO3 + Н2О = (МеОН)2CO3 + 4NaCl + СО2 (МеII, кроме Fe, Ca,Sr,Ba).
! Исключения: (соли Ca, Sr, Ba и Fe2+) – в этом случае получим обычный обменный процесс:
CaCl2 + Na2CO3 = CaCO3 + 2NaCl,
МеCl2 + Na2CO3 = МеCO3 + 2NaCl (Ме – Fe, Ca, Sr, Ba).
- Взаимный гидролиз, протекающий при смешивании двух солей, гидролизованных по катиону и по аниону. Продукты гидролиза по второй ступени усиливают гидролиз по первой ступени и наоборот. Поэтому в таких процессах образуются не просто продукты обменной реакции, а продукты гидролиза (совместный или взаимный гидролиз).Соли металлов со степенью окисления +3 (Al3+, Cr3+) и соли летучих кислот (карбонаты, сульфиды, сульфиты) при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ (H2S, SO2, CO2):
2AlCl3 + 3K2S +6H2O = 2Al(OH)3 + 3H2S↑ + 6KCl,
2CrCl3 + 3K2CO3 + 3H2O = 2Сr(ОН)3 + 3СO2 + 6KCl,
2МеCl3 + 3Na2CO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3СО2 (МеIII),
2МеCl3 + 3Na2SO3 + 3Н2О=2Ме(ОН)3 + 6NaCl + 3SО2 (МеIII),
2МеCl3 + 3Na2S + 3Н2О=2Ме(ОН)3 + 6NaCl + 3H2S (МеIII).
Соли Fe3+ при взаимодействии с карбонатами также при смешивании в растворе (взаимном гидролизе) образуют осадок гидроксида и газ:
2FeCl3 + 3K2CO3 + 3H2O = 2Fe(ОН)3 + 3СO2 + 6KCl
! Исключения: при взаимодействии солей трехвалентного железа с сульфидами реализуется окислительно-восстановительная реакция:
2FeCl3 + 3K2S(изб) = 2FeS + S↓ + 6KCl (при избытке сульфида калия)
При взаимодействии солей трехвалентного железа с сульфитами также реализуется окислительно-восстановительная реакция.
Полные уравнения таких реакций выглядят довольно сложно. Поначалу я рекомендую составлять такие уравнения в 2 этапа: сначала составляем обменную реацию без участия воды, затем разлагаем полученный продукт обменной реакции водой. Сложив эти две реакции и сократив одинаковые вещества, мы получаем полное уравнение необратимого гидролиза.
3. Гидролиз галогенангидридов и тиоангидридов происходит также необратимо. Галогенангидриды разлагаются водой по схеме ионного обмена (H+OH—) до соответствующих кислот (в случае водного гидролиза) и солей (в случае щелочного гидролиза). Степень окисления центрального элемента и остальных при этом не изменяется!
SO2Cl2 + 2 H2O = H2SO4 + 2 HCl,
SOCl2 + 2 H2O = H2SO3 + 2HCl,
PCl5 + 4 H2O = H3PO4 + 5HCl,
CrO2Cl2 + 2H2O = H2CrO4 + 2HCl,
PCl5 + 8NaOH = Na3PO4 + 5NaCl + 4H2O,
Галогенангидрид – это соединение, которое получается, если в кислоте ОН-группу заменить на галоген. При гидролизе галогенангидридов кислот образуются соответствующие данным элементам и степеням окисления кислоты и галогеноводородные кислоты.
POCl3 + 3H2O = H3PO4 + 3HCl
Галогенангидриды некоторых кислот:
| Кислота | Галогенангидриды |
| H2SO4 | SO2Cl2 |
| H2SO3 | SOCl2 |
| H2CO3 | COCl2 |
| H3PO4 | POCl3, PCl5 |
Тиоангидриды (сульфангидриды) — так называются, по аналогии с безводными окислами (ангидридами), сернистые соединения элементов (например, Sb2S3, As2S5, SnS2, CS2 и т. п.).
- Необратимый гидролиз бинарных соединений, образованных металлом и неметаллом:
- сульфиды трехвалентных металлов вводе необратимо гидролизуются до сероводорода и и гидроксида металла:
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S
при этом возможен кислотный гидролиз, в таком случае образуются соль металла и сероводород:
Al2S3 + 6HCl = 2AlCl3 + 3H2S
- гидролиз карбидов приводит к образованию гидроксида металла в водной среде, соли металла в кислой де и соответствующего углеводорода — метана, ацетилена или пропина:
Ca+2C-12 + H2O = Ca+2(OH)2 + C-12H2
Al+34C-43 + 12H2O = 4Al+3(OH)3 + 3C-4H4,
Ca3N2 + H2O =
Ca3P2 + H2O =
Mg2Si + H2O =
- Некоторые соли необратимо гидролизуются с образованием оксосолей:
BiCl3 + H2O = BiOCl + 2HCl,
SbCl3 + H2O = SbOCl + 2HCl.
Алюмокалиевые квасцы:
KAl(SO4)2 + K2S + H2O =
MgCl2 + NaНCO3 + H2O =
ZnSO4 + CsНCO3 + H2O =
CdSO4 + RbНCO3 + H2O =
CaSO4 + Rb2CO3 + H2O =
FeCl2 + Rb2CO3 + H2O =
Количественно гидролиз характеризуется величиной, называемой степенью гидролиза.
Степень гидролиза (α) — отношение количества (концентрации) соли, подвергающейся гидролизу, к общему количеству (концентрации) растворенной соли. В случае необратимого гидролиза α≅1.
Факторы, влияющие на степень гидролиза:
1. Температура
Гидролиз — эндотермическая реакция! Нагревание раствора приводит к интенсификации процесса.
Пример: изменение степени гидролиза 0,01 М CrCl3 в зависимости от температуры:

2. Концентрация соли
Чем меньше концентрация соли, тем выше степень ее гидролиза.
Пример: изменение степени гидролиза Na2CO3 в зависимости от температуры:

По этой причине для предотвращения нежелательного гидролиза хранить соли рекомендуется в концентрированном виде.
3. Добавление к реакционной смеси кислоты или щелочи
Изменяя концентрация одного из продуктов, можно смещать равновесие реакции гидролиза в ту или иную сторону.
Пройти тест по теме Гидролиз:
Здесь вы можете потренироваться в решении тестовых заданий в формате ЕГЭ по теме Гидролиз.
Тренировочные тесты по теме «Гидролиз»( с ответами)
221
Создан на
16 января, 2022 От Admin

Тренажер задания 21
Тренажер задания 21 ЕГЭ по химии
1 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) ацетат кальция
2) перхлорат калия
3) гидроксид стронция
4) метановая кислота
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
2 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2CO3
2) BaBr2
3) KOH
4) FeCl3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
3 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HF
2) HI
3) CaCrO4
4) Cs3PO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
4 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) Na2SO4
2) Fe(NO3)2
3) K2SO3
4) HCIO3
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
5 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) HI
2) H2S
3) Na2Cr2O7
4) KNO2
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
6 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) сероводород
2) аммиак
3) бромоводород
4) нитрат бария
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
7 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) KOH
2) NaHCO3
3) H3PO4
4) НCl
Запишите номера веществ в порядке уменьшения значения pH их водных растворов.
8 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов, имеющих одинаковую концентрацию (моль/л).
1) K2CO3
2) Cu(NO3)2
3) Li2SO4
4) НClO4
Запишите номера веществ в порядке возрастания значения pH их водных растворов.
9 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) FeCl2
2) HNO3
3) K3PO4
4) LiOH
Запишите номера веществ в порядке возрастания значения рН их водных растворов, учитывая, что концентрация (моль/л) всех растворов одинаковая.
10 / 10
Для веществ, приведённых в перечне, определите характер среды их водных растворов.
1) H2S
2) Na3PO4
3) HNO3
4) LiCl
Запишите номера веществ в порядке возрастания значения pН их водных растворов, учитывая, что концентрация всех растворов (моль/л) одинаковая.
Ваша оценка
The average score is 31%
Гидролиз (греч. hydor – вода и lysis – разрушение) – процесс расщепления молекул сложных химических веществ за счет
реакции с молекулами воды.
В химии, как и в жизни, разрушается чаще всего нестойкое и слабое (стойкое и сильное выдерживает удар). Запомните, что гидролиз
(вода) разрушает “слабое” – это правило вам очень пригодится.

Любая соль состоит из остатка основания и кислоты. Абсолютно любая:
- NaCl – производное основания NaOH и кислоты HCl
- KNO3 – производное основания KOH и кислоты HNO3
- CuSO4 – производное основания Cu(OH)2 и кислоты H2SO4
- Al3PO4 – производное основания Al(OH)3 и кислоты H3PO4
- Ca(NO2)2 – производное основания Ca(OH)2 и кислоты HNO2
Чтобы успешно решать задания по теме гидролиза и писать реакции, вам следует запомнить, какие основания и кислоты являются
слабыми, а какие – сильными.
При изучении гидролиза я рекомендую ученикам сохранить на гаджет схему, которую вы видите ниже. Для того, чтобы приобрести
нужный опыт – она незаменима. Пользуйтесь ей как можно чаще, подглядывайте в нее и она незаметно окажется в вашем
интеллектуальном составляющем 😉

По катиону, по аниону или нет гидролиза?
Итак, если в состав соли входит остаток сильного основания и остаток сильной кислоты – гидролиза не происходит. Примеры: NaCl, KBr,
CaSO4. Также гидролиза не происходит, если соль нерастворима (вне зависимости от того, чем она образована): AlPO4,
FeSO3, CaSO3.
Если в состав соли входит остаток слабого основания и остаток сильной кислоты, то гидролиз идет по катиону. Помните, что гидролиз
разрушает слабое, в данном случае – катион. Примеры: AlCl3, MgBr2, Cr2SO4, NH4NO3.
Катион NH4+ и его основание NH4OH , несмотря на растворимость, является слабым, поэтому гидролиз будет идти
по катиону в соли NH4Cl. Замечу также, что Ca(OH)2 считается растворимым основанием, поэтому гидролиза соли CaCl2
не происходит.
Если в состав соли входит остаток сильного основания и остаток слабой кислоты, то гидролиз идет по аниону. Примеры: K3PO4,
NaNO2, Ca(OCl)2, Ba(CH3COO)2, K2SiO3.
Если соль образована остатком слабого основания и слабой кислоты, то гидролиз идет и по катиону, и по аниону. Примеры: Mg(NO2)2,
Al2S3, Cr2(SO3)3, CH3COONH4.

Самостоятельно определите тип гидролиза для CaI2, Li2SiO3, Ba(NO2)2, CuBr2, Zn(H2PO4)2.
Ниже вы найдете решение.

Среда раствора
Среда раствора может быть нейтральной, кислой или щелочной. Определяется типом гидролиза. Некоторые задания могут быть построены так, что, увидев соль,
вы должны будете определить ее тип раствора.
Обрадую вас: если вы усвоили тему гидролиза, сделать это проще простого. В случае, когда гидролиз не идет или идет и по катиону, и по аниону среда
раствора – нейтральная.
Если гидролиз идет по катиону (разрушается остаток основания) среда – кислая, если гидролиз идет по аниону (разрушается остаток кислоты), то среда
раствора будет щелочная. Изучите примеры.
Однако замечу, что в дигидрофосфатах, гидросульфитах и гидросульфатах среда всегда кислая из-за особенностей диссоциации. Примеры:
NH4H2PO4, LiHSO4. В гидрофосфатах среда щелочная из-за того, что константа диссоциации по третьей ступени меньше, чем константа гидролиза. Примеры: K2HPO4, Na2HPO4.

Попробуйте определить среду раствора для соединений из самостоятельного задания, которое вы только что решили.
Ниже будет располагаться решение.

С целью запутать в заданиях часто бывают даны синонимы. Так “среду раствора” могут заменить водородным показателем pH.
Запомните, что кислая среда характеризуется pH < 7. В нейтральной pH = 7. В щелочной pH > 7.

Например, в соли CaCl2 среда раствора будет нейтральной (pH=7), а в растворе AlCl3 – кислой (pH < 7).
Индикаторы (лат. indicator – указатель)
Индикатор – вещество, используемое в химии для определения среды раствора. В зависимости от среды раствора индикатор способен
менять его цвет, что наглядно отражает характер среды в определенный момент времени.
Наиболее известные и широко применяемые индикаторы: лакмус, фенолфталеиновый и метиловый оранжевый. В зависимости от среды
раствора их окраска меняется, что отражает приведенная ниже таблица.

Для тех, кто обладает хорошей зрительной памятью, будет несложно запомнить эту схему. Но что делать аудиалам и кинестетикам? 🙂
От волнения на экзамене такая таблица легко может раствориться и перепутаться в океане мыслей, поэтому своим ученикам я рекомендую
запомнить индикаторы по стихам.
Только представьте, как приятно будет прочитать стих на экзамене, и убедиться в его безошибочности. Это придаст уверенности и поднимет
настроение 😉
Лакмус
Индикатор лакмус красный
Кислоту укажет ясно.
Индикатор лакмус синий –
Щелочь здесь, не будь разиней!
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеин
Фенолфталеиновый
В щелочах малиновый
Несмотря на это –
В кислотах он без цвета.
Метиловый оранжевый
От щелочи я желт как в лихорадке
Я розовею от кислот, как от стыда
И я бросаюсь в воду без оглядки –
Здесь я оранжевый практически всегда!

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Гидролизом
солей называют реакции обмена между
водой и растворенными в ней солями.
Гидролиз – частный случай сольволиза
– реакции обмена между растворителем
и растворенным веществом, разновидность
реакций ионного обмена. В результате
протекания гидролиза:
-
происходит
изменение pH
среды; -
образуются
малодиссоциирующие соединения.
Механизм
гидролиза. Для
разных типов соединений он различен.
Так, гидролиз
солей можно рассматривать:
во-первых,
как процесс,
обратный реакциям нейтрализации;
реакция нейтрализации между различными
по силе кислотами и основаниями не
всегда протекает до конца вследствие
протекания обратного процесса –
гидролиза образующейся соли, например:
НСN
+ КОН
КСN + НОН;
во-вторых,
как результат
поляризационного взаимодействия ионов
соли с их гидратной оболочкой (все ионы
в растворе гидратированы); чем значительнее
это взаимодействие, тем интенсивнее
протекает гидролиз.
Рассмотрим
возможные случаи поляризующего действия
ионов на гидратную оболочку:
-
Катионы.
В
водном растворе катионы существуют в
виде катионных аквакомплексов, которые
образуются в результате донорно-акцепторного
взаимодействия К – ОН2
([Cu(H2O)4]2+,
[Zn(H2O)4]2+,
[Al(H2O)6]3+
и т.д.). Аквакомплексы, в свою очередь,
гидратированы посредством водородных
связей. Можно считать, что чем выше заряд
и меньше размеры катиона, тем сильнее
его акцепторная способность (прочнее
связь К – ОН2),
тем сильнее поляризуется связь О–Н
координированной молекулы воды и тем
сильнее водородная связь между
координированной молекулой Н2О
в комплексе и молекулами воды гидратной
оболочки комплекса. Все это может
привести к разрыву связи О–Н в
координированной молекуле Н2О,
к превращению водородной связи Н…ОН2
в ковалентную с образованием ОН и гидроксоаквакомплекса по схеме:
и гидроксоаквакомплекса по схеме:
В
соответствии с последовательным
усилением акцепторной способности
катионов (увеличением их заряда и
уменьшением размеров) возможны два
случая: 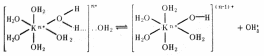
1)
отсутствие заметного разложения молекул
воды:
Na+
+ HOH
реакция практически не идет
Подобным
образом ведут себя слабые акцепторы
электронных пар – катионы щелочных и
щелочно-земельных металлов (Na+,
K+,
Сs+,
Rb+,
Fr+,
Ca2+,
Ba2+,
Sr2+),
т.е. катионы, образующие сильные основания
– щелочи;
2)
обратимое разложение молекул воды с
образованием гидроксоаквакомплексов:
[Al(OH2)6]3+
+ HOH
[Al(OH2)5(OH)]2+
+ OH3+
или
упрощенно:
Al3+
+ HOH
AlOH2+
+ H+.
Избыток
ионов Н+
обусловливает кислую среду раствора.
Этот случай характерен для двух- и
трехзарядных катионов (Cu2+,
Fe2+,
Fe3+,
Cr3+
и т.д.), т.е. катионов, образующих слабые
основания. Чем слабее основание, тем
интенсивнее протекает гидролиз.
-
Анионы.
Их
гидратация осуществляется за счет
водородной связи, которая может перейти
в ковалентную в результате поляризационного
взаимодействия между анионом и молекулами
воды: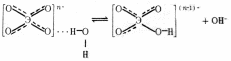
Чем
больше отрицательный заряд и меньше
размер аниона, тем он более сильный
донор электронных пар и тем легче
отрывает протон от молекулы воды.
Например, прочность водородной связи
возрастает в ряду анионов, образованных
p-элементами
III
периода:
ClO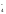 <
<
SO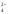 <
<
PO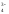 <
<
SiO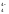 .
.
В
зависимости от электродонорной активности
анионов возможны два случая:
1)
отсутствие заметного разложения молекул
воды:
Cl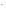
+ HOH
реакция практически не идет;
NO
+ HOH
реакция практически не идет;
подобным
образом ведут себя слабые доноры
электронных пар – однозарядные анионы
(Cl
ˉ, Brˉ,
I
ˉ, NO ,
,
ClO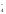 ),
),
анионы SO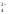 ,
,
SiF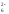
и другие кислотные остатки сильных
кислот;
2)
обратимое разложение молекул воды:
CO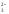
+ HOH
HCO

+ OH
ˉ.
Избыток
ОНˉ– ионов обусловливает щелочную
реакцию среды. Этот случай характерен
для одно- двух- и многозарядных анионов
(СNˉ,
CO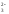 ,
,
SO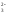 ,
,
S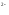 ,
,
PO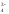
и т.д.), т.е. кислотных остатков слабых
кислот и кислот средней силы. Чем слабее
кислота, тем интенсивнее протекает
гидролиз.
Суммарный
эффект гидролиза определяется природой
находящихся в растворе катионов и
анионов.
Различают
следующие варианты взаимодействия
солей с молекулами воды:
I.
Соли сильных
оснований и слабых кислот
(KCN,
CH3COONa,
Na2CO3,
Na2S,
K2S
и т.д.).
При
диссоциации данных солей в растворе
образуется катионы, слабо поляризующие
гидратную оболочку, т.е. практически не
взаимодействующие с водой, и анионы,
поляризующие гидратную оболочку, т.е.
обратимо взаимодействующие с водой. В
этом случае гидролиз идет по аниону,
при этом образуется щелочная среда (рН
> 7).
Пример
1: процесс
гидролиза цианида калия, КСN – соль,
образована сильным основанием КОН и
слабой кислотой НСN.
Уравнение
электролитической диссоциации соли:
КCN
= K
+ CN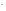 .
.
Ионно-молекулярные
уравнения гидролиза:
К+
+ НОН
реакция практически не идет,
СN¯
+ НОН
НСN + ОН¯.
Молекулярное
уравнение гидролиза: КСN + НОН
НСN + КОН.
Пример
2: гидролиз
сульфида натрия,
Nа2S
– соль образована слабой многоосновной
кислотой Н2S
и сильным основанием NаОН. Так как
диссоциация многоосновных кислот
протекает ступенчато, то и гидролиз их
солей будет также протекать ступенчато.
Уравнение
электролитической диссоциации соли:
Na2S
= 2Na
+ S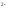 ,
,
I
ступень:
Na+
+ HOH
реакция практически не идет,
S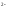
+ HOH
НS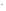
+ ОН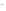
или
в молекулярной форме
Nа2S
+ НОН
NаНS
+ NаОН.
II
ступень:
НS–
+ НОН
Н2S
+ ОН–
х.р.
или
в молекулярной форме
NаНS
+ НОН
Н2S
+ NаОН.
х.р.
Гидролиз
по первой ступени всегда протекает в
большей степени, чем по второй. Это
обусловлено уменьшением константы
диссоциации при переходе от Кд1
к Кд2
(для Н2S
Кд1>Кд2):
поскольку ион НS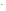 диссоциирует слабее, чем Н2S,
диссоциирует слабее, чем Н2S,
то он и образуется в первую очередь при
гидролизе Nа2S.
Кроме
того, ионы ОН–,
образующиеся при гидролизе по первой
ступени, способствуют смещению равновесия
второй ступени влево, т.е. также подавляют
гидролиз по второй ступени.
Вывод:
если соль
образована сильным основанием и слабой
кислотой, то происходит обратимый
гидролиз по аниону. Растворы таких солей
имеют щелочную среду. В обычных условиях
гидролиз по многозарядному аниону
протекает по первой ступени с образованием
кислых солей, т.к. последующие ступени
подавлены из-за накопления в растворе
ионов ОН–.
II.
Соли слабых
оснований и сильных кислот
(NH4Cl,
CuCl2,
CuSO4,
ZnCl2,
AgNO3
и т.д.).
При
диссоциации данных солей образуются
катионы, поляризующие гидратную оболочку,
т.е. обратимо взаимодействующие с водой,
и анионы, слабополяризующие гидратную
оболочку, т.е. практически не
взаимодействующие с водой. В этом случае
гидролиз протекает по катиону, при этом
образуется кислая среда (рН<7). Примером
служит процесс гидролиза СuСl2,
соли, образованной слабым двукислотным
основанием Сu(ОН)2
и сильной
кислотой НСl:
СuСl2
= Сu2+
+ Сl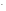 ,
,
Сu2+
+ НОН
СuОН+
+ Н+,
Сl–
+ НОН
реакция практически не идет
или
в молекулярной форме
СuСl2
+ НОН
СuОНСl
+ НСl.
Так
как диссоциация многокислотных оснований
протекает ступенчато, то и гидролиз их
солей будет протекать также ступенчато,
но константа диссоциации Сu(ОН)2
по первой ступени Кд1
больше константы диссоциации по второй
ступени Кд2
(Кд1
> Кд2).
Т.е. ион СuОН+
диссоциирует слабее, чем Сu(ОН)2,
то он и образуется в первую очередь при
гидролизе. Кроме того, ионы Н+,
образующиеся при гидролизе по первой
ступени, способствуют смещению равновесия
второй ступени влево, т.е. подавляют
гидролиз по второй ступени, он происходит
в ничтожно малой степени и его не
учитывают.
Вывод:
если соль
образована слабым основанием и сильной
кислотой, то происходит обратимый
гидролиз по катиону. Растворы таких
солей имеют кислую среду. В обычных
условиях гидролиз по многозарядному
катиону протекает по первой ступени с
образованием основных солей, т.к.
последующие ступени подавлены из-за
накопления в растворе ионов Н+.
III.
Соли слабых
оснований и слабых кислот
(Fe2(CO3)3,
Al2S3,
(NH4)3PO4
и т.д.).
При
диссоциации данных солей в растворе
образуются катионы и анионы, поляризующие
гидратную оболочку, т.е. взаимодействующие
с водой. В этом случае гидролиз протекает
и по катиону, и по аниону. Примером может
служить процесс гидролиза СН3СООNН4
– соли, образованной слабой уксусной
кислотой СН3СООН
и слабым основанием NН4ОН.
Запишем ионно-молекулярные уравнения
отдельно для процессов гидролиза катиона
и аниона, протекающих одновременно:
СН3СООNН4
= СН3СОО–
+ NН4+,
СН3СОО–
+ НОН
СН3СООН
+ ОН–,
х.р.
NН4+
+ НОН
NН4ОН
+ Н+.
х.р.
Итак,
при гидролизе аниона образуются ионы
ОН–,
а при гидролизе катиона – ионы Н+.
Эти ионы не могут в значительных
концентрациях сосуществовать одновременно;
они соединяются, образуя молекулы
слабого электролита – воды. Это приводит
к смещению обоих равновесий вправо.
Иначе говоря, в этом случае гидролиз
катиона и гидролиз аниона взаимно
усиливают друг друга, и в совокупности
процесс протекает практически необратимо.
Суммарное
ионно-молекулярное уравнение:
СН3СОО–
+ NН4+
+ Н2О
= СН3СООН
+ NН4ОН.
Молекулярное
уравнение:
СН3СООNН4
+ Н2О
= NН4ОН
+ СН3СООН.
Реакция
растворов солей, образованных слабой
кислотой и слабым основанием, определяется
относительной силой образовавшихся
кислоты и основания, зависит от соотношения
их констант диссоциации. Если константа
диссоциации кислоты больше константы
диссоциации основания, то раствор имеет
слабокислую реакцию, при обратном
соотношении констант диссоциации –
слабощелочную, т.е. рН близко к семи (рН
≈ 7).
Второй
пример:
Аl2S3
– соль
образована слабым основанием Аl(ОН)3
и слабой кислотой Н2S.
Ионы, образовавшиеся в растворе при
диссоциации данной соли, будут одновременно
подвергаться гидролизу. При этом будет
происходить взаимное усиление гидролиза
каждого из ионов (смещение химического
равновесия вправо) из-за связывания
ионов Н+
и ОНˉ в молекулы слабого электролита
Н2О.
Поэтому гидролиз каждого из ионов будет
идти по всем ступеням, до конца с
образованием Аl(ОН)3
и Н2S:
Аl2S3
= 2Аl3+
+ 3 S2–
I
ступень:
Аl3+
+ НОН
АlОН2+
+ Н+,
х.р.
S2–
+ НОН
НS–
+ ОНˉ;
х.р.
II
ступень:
АlОН2+
+ НОН
Аl(ОН)2+
+ Н+,
х.р.
НS–
+ НОН Н2S
+ ОНˉ;
х.р.
III
ступень:
Аl(ОН)2+
+ НОН = Аl(ОН)3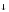
+ Н+.
Суммарное
ионно-молекулярное уравнение:
2Аl3+
+ 3S2–
+ 6Н2О
= 2Аl(ОН)3
+ 3Н2S.
Молекулярное
уравнение:
Аl2S3
+ 6Н2О
= 2Аl(ОН)3
+ 3Н2S.
Вывод:
если соль образована слабым основанием
и слабой кислотой, то гидролиз происходит
и по катиону, и по аниону, взаимно
усиливающий друг друга, протекающий
практически необратимо с образованием
слабого основания и слабой кислоты.
Характер среды близок к нейтральному.
IV.
Соли сильных
оснований и сильных кислот
(NаСl, К2SО4,
NаNО3
и т.д.).
В
этом случае поляризующее влияние
катионов и анионов на молекулы воды
невелико. Гидролиз практически не
происходит, поэтому растворы таких
солей практически нейтральны (рН ≈ 7).
Например:
NaCl
= Na +
+
Cl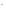 ,
,
Nа+
+ НОН
реакция практически не идет,
Сl–
+ НОН
реакция практически не идет,
NаСl
+ НОН
реакция практически не идет.
Вывод:
если соль
образована сильным основанием и сильной
кислотой, то гидролиз не происходит;
растворы таких солей практически
нейтральны (рН ≈ 7).
V.
Совместный гидролиз двух солей.
Рассмотрим, что произойдет при сливании
растворов двух солей, одна из которых
образована слабым основанием и сильной
кислотой, а другая сильным основанием
и слабой кислотой. Например, при сливании
растворов FeCl3
и Na2CО3:
2FеСl3
+ 3Nа2СО3
+ 6Н2О
= 2Fе(ОН)3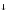
+ 3Н2СО3
+ 6NаСl
I
ступень:
Fе3+
+ НОН
FеОН2+
+ Н+,
х.р.
СО32–
+ НОН
НСО3–
+ ОН–
х.р.
и
т.д. по ступеням, как в случае соли,
образованной слабой многоосновной
кислотой и слабым многокислотным
основанием.
Образующиеся
ионы Н+
и ОН–
будут нейтрализовать друг друга на
каждой ступени гидролиза, связываясь
в молекулы слабого электролита воды,
гидролиз обоих ионов усиливается, что
приводит к протеканию всех ступеней
гидролиза и образованию конечных
продуктов Fе(ОН)3
и Н2СО3.
Суммарное ионно-молекулярное уравнение:
2Fе3+
+ 3СО32–
+ 6Н2О
= 2Fе(ОН)3↓
+ 3Н2СО3.
С
учетом разложения Н2СО3
на Н2О
и СО2,
окончательные уравнения (суммарное
ионно-молекулярное и молекулярное)
будут иметь вид:
2Fе3+
+ 3СО32–
+ 3Н2О
= 2Fе(ОН)3↓
+ 3СО2↑.
2FеСl3
+ 3Nа2СО3
+ 3Н2О
= 2Fе(ОН)3↓
+ 3СО2↑
+ 6NаСl.
В
подобных случаях в осадок выпадает
наименее растворимый из возможных
продуктов гидролиза. Так, растворимость
карбоната гидроксомеди (СuОН)2СО3
меньше, чем гидроксида меди Сu(ОН)2.
Поэтому при сливании растворов СuSО4
и Nа2СО3
конечным продуктом гидролиза является
именно (СuОН)2СО3:
2СuSО4
+ 2Nа2СО3
+ Н2О
= (СuОН)2СО3↓
+ СО2↑
+ 2Nа2SО4,
2Сu2+
+ 2СО32–
+ Н2О
= (СuОН)2СО3↓
+ СО2↑.
Вывод:
если в растворе присутствуют две соли,
одна из которых гидролизуется по аниону,
другая по катиону, то гидролиз обеих
солей усиливается, протекает необратимо
с образованием конечных продуктов
(слабого основания и слабой кислоты).
Растворы таких солей имеют среду, близкую
к нейтральной (рН ≈ 7).
VI.
Существенно отличен характер гидролиза
ковалентных соединений. Большинство
соединений неметаллов с неметаллами в
воде претерпевает необратимое
гидролитическое разложение, с образованием
соответствующих кислот, например:
SiCl4
+ 3HOH = H2SiO3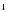 +
+
4HCl,
SiS2
+ 3HOH = H2SiO3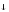 +
+
2H2S.
Количественные
характеристики процесса гидролиза.
Количественно
гидролиз характеризуется степенью
гидролиза h и константой гидролиза Кг.
Степень
гидролиза представляет собой отношение
числа молекул Nг,
подвергшихся гидролизу, к общему числу
растворенных молекул Nо,
которое определяется концентрацией
вещества:
![]() .
.
Степень
гидролиза соли,
как правило, невелика, зависит
от константы гидролиза и концентрации
соли и
выражается в процентах или долях единицы.
Так,
в 0,1 м СН3СООNа
и NН4Сl
при 298 К она составляет примерно 10–4,
т.е. в этих растворах гидролизована лишь
одна из 10 000 молекул. Причина столь низкой
степени гидролиза кроется в том, что
один из участников реакции – вода
является очень слабым электролитом.
Поэтому положение равновесия реакции
гидролиза сильно смещено в сторону
исходных веществ.
Более
конкретной характеристикой является
константа гидролиза. Запишем уравнение
гидролиза соли КА (здесь К+
– катион металла, А–
– анион кислотного остатка) в общем виде:
КА
+ НОН
НА + КОН.
Этому
равновесию отвечает константа равновесия:
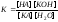 .
.
Концентрация
воды в разбавленных растворах представляет
собою практически постоянную величину.
Обозначая К[Н2О]=Кг,
получим:
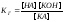 .
.
Величина
Кг
называется константой гидролиза соли.
Ее значение характеризует способность
данной соли подвергаться гидролизу;
чем больше Кг,
тем в большей степени (при
одинаковых температуре и концентрации
соли) протекает
гидролиз.
Например,
для реакции гидролиза цианида калия
КСN
+ Н2О
КОН + НСN
или
в ионно-молекулярном виде
CN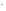
+ HOH
HCN
+OHˉ,
выражение
для константы гидролиза будет иметь
вид
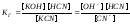 .
.
Выразим
из выражения для ионного произведения
воды Кв
концентрацию гидроксид-ионов: [ОНˉ] =
Кв/
[H+].
Подставим это соотношение в предыдущее
выражение для КГ:
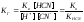 .
.
По
этой формуле мы можем вычислить Кг
цианида калия, воспользовавшись значением
константы диссоциации синильной кислоты:
 .
.
Таким
образом,
если соль образована слабой кислотой
и сильным основанием, константа гидролиза
связана с константой диссоциации кислоты
Кдкисл
зависимостью
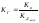 ,
,
где Кв –
ионное произведение воды.
Это
уравнение показывает, что Кг
тем больше, чем меньше Кдкисл.
Иными словами, чем
слабее кислота, тем в большей степени
подвергаются гидролизу ее соли.
Для
солей, образованных слабым основанием
и сильной кислотой, аналогичное
соотношение связывает константу
гидролиза с константой диссоциации
основания Кдосн:
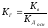 .
.
Поэтому
чем слабее
основание, тем в большей степени
подвергаются гидролизу образованные
им соли.
Для
солей, образованных слабой кислотой и
слабым основанием, константа гидролиза
связана с константами диссоциации
кислоты и основания следующим соотношением:
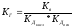 .
.
Эти
уравнения служат количественным
подтверждением вывода: чем слабее
кислота (основание), соль которой
(которого) подвергается гидролизу, тем
полнее он протекает.
Константа
гидролиза связана со степенью гидролиза
h уравнением, аналогичным закону
разбавления Оствальда для диссоциации
слабого электролита:
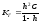 ,
,
где
С – молярная концентрация соли в
растворе.
Чаще
всего гидролизованная часть соли очень
мала, а концентрация продуктов гидролиза
незначительна. В подобных случаях h <<
1, и в знаменателе последней формулы
этой величиной можно пренебречь. Тогда
связь между Кг
и h выразится более простыми соотношениями:
Кг
= h2C
или
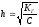 .
.
Из
последнего уравнения следует, что
степень
гидролиза данной соли тем больше, чем
меньше ее концентрация;
иначе говоря, при
разбавлении раствора гидролизующейся
соли степень ее гидролиза возрастает.
Влияние
различных факторов на глубину процесса
гидролиза.
На глубину гидролиза, как на обратимый
процесс, влияют следующие факторы:
1.
Природа соли.
Природа
соли проявляется в величине константы
гидролиза.
2.
Концентрация раствора.
Из
последнего уравнения следует, что
степень гидролиза данной соли тем
больше, чем меньше ее концентрация;
иначе говоря, при разбавлении раствора
гидролизующейся соли степень ее гидролиза
возрастает. Например, уменьшение
концентрации раствора Nа2СО3
от 0,1 до 0,001 моль/л при 298 К приводит к
увеличению степени гидролиза от 0,029 до
0,34.
Рассмотрим
влияние концентрации раствора на глубину
гидролиза ацетата натрия. В растворе
гидролизующейся соли устанавливается
равновесие:
СН3СООNа
+ Н2О
СН3СООН
+ NаОН,
которому
отвечает константа гидролиза:
![]()
При
разбавлении раствора и увеличении в
нем относительной концентрации воды в
соответствии с принципом Ле Шателье
происходит смещения равновесия в сторону
прямой реакции, т.е. гидролиз усиливается
(увеличивается степень гидролиза соли
– h).
Разбавим
раствор в 10 раз. В первый момент
концентрации всех веществ – СН3СООNа,
СН3СООН
и NаОН – уменьшаются в 10 раз. Вследствие
этого числитель правой части уравнения
константы гидролиза уменьшится в 100
раз, а знаменатель – в 10 раз. Но Кг,
как всякая константа равновесия, не
зависит от концентрации веществ. Поэтому
равновесие нарушится. Для того чтобы
оно установилось, числитель дроби должен
возрасти, а знаменатель – уменьшиться,
т.е. некоторое количество соли должно
дополнительно гидролизоваться. В
результате этого концентрации СН3СООН
и NаОН возрастут, а концентрация СН3СООNа
– уменьшится. Таким образом, степень
гидролиза h увеличится.
3.
Температура раствора.
Поскольку
обратный гидролизу процесс – реакция
нейтрализации протекает с выделением
теплоты, то реакция гидролиза представляет
собой эндотермический процесс (∆Н >
0). Согласно принципу Ле Шателье, повышение
температуры ведет к усилению гидролиза,
а понижение температуры – к его
ослаблению.
4.
Введение в раствор кислоты или основания.
Подавлению
гидролиза способствует введение в
раствор одного из продуктов гидролиза
(кислоты или основания). Для усиления
гидролиза надо сделать все наоборот.
Итак,
максимальная степень гидролиза
достигается при высоких температурах
и в разбавленных растворах.
Напротив,
для уменьшения степени гидролиза
необходимо использовать возможно более
концентрированные растворы солей при
низких температурах, а также добавлять
к раствору один из продуктов гидролиза:
кислоту или щелочь.
В ходе урока мы изучим тему «Гидролиз. Среда водных растворов. Водородный показатель». Вы узнаете о гидролизе – обменной реакции вещества с водой, приводящей к разложению химического вещества. Кроме того, будет введено определение водородному показателю – так называемому РН.
I. Механизм гидролиза
Гидролиз – это обменная реакция вещества с водой, приводящая к его разложению.
Попробуем разобраться в причине данного явления.
Электролиты делятся на сильные электролиты и слабые. См. Табл. 1.
Табл. 1
Вода относится к слабым электролитам и поэтому диссоциирует на ионы лишь в незначительной степени
Ионы веществ, попадающие в раствор, гидратируются молекулами воды. Но при этом может происходить и другой процесс. Например, анионы соли, которые образуются при её диссоциации, могут взаимодействовать с катионами водорода, которые, пусть и в незначительной степени, но все-таки образуются при диссоциации воды. При этом может происходить смещение равновесия диссоциации воды. Обозначим анион кислоты Х-.
Предположим, что кислота сильная. Тогда она по определению практически полностью распадается на ионы. Если кислота слабая, то она диссоциирует неполностью. Она будет образовываться при прибавлении в воду из анионов соли и ионов водорода, получающихся при диссоциации воды. За счет её образования, в растворе будут связываться ионы водорода, и их концентрация будет уменьшаться. Н++ Х–↔ НХ
Но, по правилу Ле Шателье, при уменьшении концентрации ионов водорода равновесие смещается в первой реакции в сторону их образования, т. е. вправо. Ионы водорода будут связываться с ионами водорода воды, а гидроксид ионы – нет, и их станет больше, чем было в воде до прибавления соли. Значит, среда раствора будет щелочная. Индикатор фенолфталеин станет малиновым.
Аналогично можно рассмотреть взаимодействие катионов с водой. Не повторяя всю цепочку рассуждений, подытоживаем, что если основание слабое, то в растворе будут накапливаться ионы водорода, и среда будет кислая.
II. Классификация катионов и анионов
III. Отношение к гидролизу солей разных типов
Поскольку и катионы и анионы, согласно данной классификации, бывают двух типов, то всего существует 4 разнообразных комбинации при образовании их солей. Рассмотрим, как относится к гидролизу каждый из классов этих солей.
1. Гидролиз не возможен (гидролиз соли, образованной сильным основанием и сильной кислотой)
Соль, образованная сильным основанием и сильной кислотой (KBr, NaCl, NaNO3), гидролизу подвергаться не будет, так как в этом случае слабый электролит не образуется.
рН таких растворов = 7. Реакция среды остается нейтральной.
2. Гидролиз по катиону (в реакцию с водой вступает только катион, т.е. это гидролиз соли, образованной слабым основанием и сильной кислотой)
Видео – Эксперимент: “Гидролиз солей, образованных слабым основанием и сильной кислотой”
В соли, образованной слабым основанием и сильной кислотой (FeCl2, NH4Cl, Al2(SO4)3,MgSO4) гидролизу подвергается катион:
FeCl2 + HOH <=>Fe(OH)Cl + HCl
Fe2+ + 2Cl– + H+ + OH– <=> FeOH+ + 2Cl– + Н+
В результате гидролиза образуется слабый электролит, ион H+ и другие ионы.
рН раствора < 7 (раствор приобретает кислую реакцию).
Подведем итог тому, что вы узнали о гидролизе по катиону:
1) по катиону соли, как правило, гидролизуются обратимо;
2) химическое равновесие реакций сильно смещено влево;
3) реакция среды в растворах таких солей кислотная (рН < 7);
4) при гидролизе солей, образованных слабыми многокислотными основаниями, получаются основные соли.
3. Гидролиз по аниону (в реакцию с водой вступает только анион, т.е. это гидролиз соли, образованной сильным основанием и слабой кислотой)
Видео – Эксперимент: “Гидролиз солей, образованных сильным основанием и слабой кислотой”
Соль, образованная сильным основанием и слабой кислотой (КClO, K2SiO3, Na2CO3,CH3COONa) подвергается гидролизу по аниону, в результате чего образуется слабый электролит, гидроксид-ион ОН– и другие ионы.
K2SiO3 + НОH <=>KHSiO3 + KОН
2K+ +SiO32- + Н+ + ОH–<=> НSiO3– + 2K+ + ОН–
рН таких растворов > 7 (раствор приобретает щелочную реакцию).
Подведем итог тому, что вы узнали о гидролизе по аниону:
1) по аниону соли, как правило, гидролизуются обратимо;
2) химическое равновесие в таких реакциях сильно смещено влево;
3) реакция среды в растворах подобных солей щелочная (рН > 7);
4) при гидролизе солей, образованных слабыми многоосновными кислотами, получаются кислые соли.
4. Совместный гидролиз: и по катиону, и по аниону (в реакцию с водой вступает и катион и анион, т.е. это гидролиз соли, образованной слабым основанием и слабой кислотой)
Соль, образованная слабым основанием и слабой кислотой (СН3СООNН4, (NН4)2СО3,Al2S3), гидролизуется и по катиону, и по аниону. В результате образуются малодиссоциирующие основание и кислота. рН растворов таких солей зависит от относительной силы кислоты и основания. Мерой силы кислоты и основания является константа диссоциации соответствующего реактива.
Реакция среды этих растворов может быть нейтральной, слабокислой или слабощелочной:
Al2S3 + 6H2O =>2Al(OH)3↓+ 3H2S↑
 Гидролиз – процесс обратимый.
Гидролиз – процесс обратимый.
Гидролиз протекает необратимо, если в результате реакции образуется нерастворимое основание и (или) летучая кислота
Видео – Эксперимент: “Гидролиз солей”
Видео – Эксперимент: “Гидролиз солей, образованных слабым основанием и слабой кислотой”
IV. Алгоритм составления уравнений гидролиза солей
|
Ход рассуждений |
Пример |
||||
|
1. Определяем силу электролита – основания и кислоты, которыми образована рассматриваемая соль. Помните! Гидролиз всегда протекает по слабому электролиту, сильный электролит находится в растворе в виде ионов, которые не связываются водой.
|
Na2CO3 – карбонат натрия, соль образованная сильным основанием (NaOH) и слабой кислотой (H2CO3) |
||||
|
2. Записываем диссоциацию соли в водном растворе, определяем ион слабого электролита, входящий в состав соли |
2Na+ + CO32- + H+OH– ↔ Это гидролиз по аниону От слабого электролита в соли присутствует анион CO32- , он будет связываться молекулами воды в слабый электролит – происходит гидролиз по аниону. |
||||
|
3. Записываем полное ионное уравнение гидролиза – ион слабого электролита связывается молекулами воды |
2Na+ + CO32- + H+OH– ↔ (HCO3)– + 2Na+ + OH– В продуктах реакции присутствуют ионы ОН–, следовательно, среда щелочная pH>7 |
||||
|
4. Записываем молекулярное гидролиза |
Na2CO3 + HOH ↔ NaHCO3 + NaOH |
V. Практическое применение гидролиза
На практике с гидролизом учителю приходится сталкиваться, например при приготовлении растворов гидролизующихся солей (ацетат свинца, например). Обычная “методика”: в колбу наливается вода, засыпается соль, взбалтывается. Остается белый осадок. Добавляем еще воды, взбалтываем, осадок не исчезает. Добавляем из чайника горячей воды – осадка кажется еще больше… А причина в том, что одновременно с растворением идет гидролиз соли, и белый осадок, который мы видим это уже продукты гидролиза – малорастворимые основные соли. Все наши дальнейшие действия, разбавление, нагревание, только усиливают степень гидролиза. Как же подавить гидролиз? Не нагревать, не готовить слишком разбавленных растворов, и поскольку главным образом мешает гидролиз по катиону – добавить кислоты. Лучше соответствующей, то есть уксусной.
В других случаях степень гидролиза желательно увеличить, и чтобы сделать щелочной моющий раствор бельевой соды более активным, мы его нагреваем – степень гидролиза карбоната натрия при этом возрастает.
Важную роль играет гидролиз в процессе обезжелезивания воды методом аэрации. При насыщении воды кислородом, содержащийся в ней гидрокарбонат железа(II) окисляется до соли железа(III), значительно сильнее подвергающегося гидролизу. В результате происходит полный гидролиз и железо отделяется в виде осадка гидроксида железа(III).
На этом же основано применение солей алюминия в качестве коагулянтов в процессах очистки воды. Добавляемые в воду соли алюминия в присутствии гидрокарбонат-ионов полностью гидролизуются и объемистый гидроксид алюминия коагулирует, увлекая с собой в осадок различные примеси.
VI. Задания для закрепления
Задание №1. Запишите уравнения гидролиза солей и определите среду водных растворов (рН) и тип гидролиза:
Na2SiO3 , AlCl3, K2S.
Задание №2. Составьте уравнения гидролиза солей, определите тип гидролиза и среду раствора:
Сульфита калия, хлорида натрия, бромида железа (III)
Задание №3. Составьте уравнения гидролиза, определите тип гидролиза и среду водного раствора соли для следующих веществ:
сульфид калия – K2S, бромид алюминия – AlBr3, хлорид лития – LiCl, фосфат натрия – Na3PO4, сульфат калия – K2SO4, хлорид цинка – ZnCl2, сульфит натрия – Na2SO3, сульфат аммония – (NH4)2SO4, бромид бария – BaBr2
ЦОРы
Видео – Эксперимент: “Гидролиз солей”
Видео – Эксперимент: “Гидролиз солей, образованных сильным основанием и слабой кислотой”
Видео – Эксперимент: “Гидролиз солей, образованных слабым основанием и сильной кислотой”
Видео – Эксперимент: “Гидролиз солей, образованных слабым основанием и слабой кислотой”
Видео – Эксперимент: “Усиление гидролиза солей при нагревании”
