2.7. Характерные химические свойства солей: средних, кислых, основных, комплексных (на примере соединений алюминия и цинка).
Химические свойства средних солей
Взаимодействие средних солей с металлами
Реакция соли с металлом протекает в том случае, если исходный свободный металл более активен, чем тот, который входит в состав исходной соли. Узнать о том, какой металл более активен, можно, воспользовавшись электрохимическим рядом напряжений металлов.
Так, например, железо взаимодействует с сульфатом меди в водном растворе, поскольку является более активным, чем медь (левее в ряду активности):
В то же время железо не реагирует с раствором хлорида цинка, поскольку оно менее активно, чем цинк:
Следует отметить, что такие активные металлы, как щелочные и щелочноземельные, при их добавлении к водным растворам солей будут прежде всего реагировать не с солью, а входящей в состав растворов водой.
Взаимодействие средних солей с гидроксидами металлов
Оговоримся, что под гидроксидами металлов в данном случае понимаются соединения вида Me(OH)x.
Для того чтобы средняя соль реагировала с гидроксидом металла, должны одновременно (!) выполняться два требования:
- в предполагаемых продуктах должен быть обнаружен осадок или газ;
- исходная соль и исходный гидроксид металла должны быть растворимы.
Рассмотрим пару случаев, для того чтобы усвоить данное правило.
Определим, какие из реакций ниже протекают, и напишем уравнения протекающих реакций:
- 1) PbS + KOH
- 2) FeCl3 + NaOH
Рассмотрим первое взаимодействие сульфида свинца и гидроксида калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», обозначив таким образом, что пока не известно, протекает ли реакция на самом деле:
В предполагаемых продуктах мы видим гидроксид свинца (II), который, судя по таблице растворимости, нерастворим и должен выпадать в осадок. Однако, вывод о том, что реакция протекает, пока сделать нельзя, так как мы не проверили удовлетворение еще одного обязательного требования – растворимости исходных соли и гидроксида. Сульфид свинца – нерастворимая соль, а значит реакция не протекает, так как не выполняется одно из обязательных требований для протекания реакции между солью и гидроксидом металла. Т.е.:
Рассмотрим второе предполагаемое взаимодействие между хлоридом железа (III) и гидроксидом калия. Запишем предполагаемую реакцию ионного обмена и пометим ее слева и справа «шторками», как и в первом случае:
В предполагаемых продуктах мы видим гидроксид железа (III), который нерастворим и должен выпадать в осадок. Однако сделать вывод о протекании реакции пока еще нельзя. Для этого надо еще убедиться в растворимости исходных соли и гидроксида. Оба исходных вещества растворимы, значит мы можем сделать вывод о том, что реакция протекает. Запишем ее уравнение:
Реакции средних солей с кислотами
Средняя соль реагирует с кислотой в том случае, если образуется осадок или слабая кислота.
Распознать осадок среди предполагаемых продуктов практически всегда можно по таблице растворимости. Так, например, серная кислота реагирует с нитратом бария, поскольку в осадок выпадает нерастворимый сульфат бария:
Распознать слабую кислоту по таблице растворимости нельзя, поскольку многие слабые кислоты растворимы в воде. Поэтому список слабых кислот следует выучить. К слабым кислотам относят H2S, H2CO3, H2SO3, HF, HNO2, H2SiO3 и все органические кислоты.
Так, например, соляная кислота реагирует с ацетатом натрия, поскольку образуется слабая органическая кислота (уксусная):
Следует отметить, что сероводород H2S является не только слабой кислотой, но и плохо растворим в воде, в связи с чем выделяется из нее в виде газа (с запахом тухлых яиц):
Кроме того, обязательно следует запомнить, что слабые кислоты — угольная и сернистая — являются неустойчивыми и практически сразу же после образования разлагаются на соответствующий кислотный оксид и воду:
Выше было сказано, что реакция соли с кислотой идет в том случае, если образуется осадок или слабая кислота. Т.е. если нет осадка и в предполагаемых продуктах присутствует сильная кислота, то реакция не пойдет. Однако есть случай, формально не попадающий под это правило, когда концентрированная серная кислота вытесняет хлороводород при действии на твердые хлориды:
Однако, если брать не концентрированную серную кислоту и твердый хлорид натрия, а растворы этих веществ, то реакция действительно не пойдет:
Реакции средних солей с другими средними солями
Реакция между средними солями протекает в том случае, если одновременно (!) выполняются два требования:
- исходные соли растворимы;
- в предполагаемых продуктах есть осадок или газ.
Например, сульфат бария не реагирует с карбонатом калия, поскольку несмотря на то что в предполагаемых продуктах есть осадок (карбонат бария), не выполняется требование растворимости исходных солей.
В то же время хлорид бария реагирует с карбонатом калия в растворе, поскольку обе исходные соли растворимы, а в продуктах есть осадок:
Газ при взаимодействии солей образуется в единственном случае – если смешивать при нагревании раствор любого нитрита с раствором любой соли аммония:
Причина образования газа (азота) заключается в том, что в растворе одновременно находятся катионы NH4+ и анионы NO2— , образующие термически неустойчивый нитрит аммония, разлагающийся в соответствии с уравнением:
Реакции термического разложения солей
Разложение карбонатов
Все нерастворимые карбонаты, а также карбонаты лития и аммония термически неустойчивы и разлагаются при нагревании. Карбонаты металлов разлагаются до оксида металла и углекислого газа:
а карбонат аммония дает три продукта – аммиак, углекислый газ и воду:
Разложение нитратов
Абсолютно все нитраты разлагаются при нагревании, при этом тип разложения зависит от положения металла в ряду активности. Схема разложения нитратов металлов представлена на следующей иллюстрации:
Так, например, в соответствии с этой схемой уравнения разложения нитрата натрия, нитрата алюминия и нитрата ртути записываются следующим образом:
Также следует отметить специфику разложения нитрата аммония и нитрата железа (II):
Реакция разложения нитрата железа (II) снова стала встречаться в ЕГЭ по химии. В заданиях фигурирует формулировка о его разложении в токе воздуха, однако, что в токе воздуха, что без него, уравнение будет одинаковым. Писать оксид FeO при разложении нитрата железа (II) будет ошибкой.
Разложение солей аммония
Термическое разложение солей аммония чаще всего сопровождается образованием аммиака:
В случае, если кислотный остаток обладает окислительными свойствами, вместо аммиака образуется какой-либо продукт его окисления, например, молекулярный азот N2 или оксид азота (I):
Разложение хлората калия
Реакция разложения хлората калия может протекать по-разному. В присутствии катализатора (как правило MnO2), реакция приводит к образованию хлорида калия и кислорода:
Без катализатора, реакция будет протекать по типу диспропорционирования:
Химические свойства кислых солей
Отношение кислых солей к щелочам и кислотам
Кислые соли реагируют с щелочами. При этом, если щелочь содержит тот же металл, что и кислая соль, то образуются средние соли:
Также, если в кислотном остатке кислой соли осталось два или более подвижных атомов водорода, как, например, в дигидрофосфате натрия, то возможно образование как средней:
так и другой кислой соли с меньшим числом атомов водорода в кислотном остатке:
Важно отметить, что кислые соли реагируют с любыми щелочами, в том числе и теми, которые образованы другим металлом. Например:
Кислые соли, образованные слабыми кислотами, реагируют с сильными кислотами аналогично соответствующим средним солям:
Более подробно, с разбором алгоритмов составления уравнений, взаимодействие кислых солей (в частности, гидрокарбонатов, дигидрофосфатов и гидрофосфатов) со щелочами рассмотрено в данной публикации.
Термическое разложение кислых солей
Все кислые соли при нагревании разлагаются. В рамках программы ЕГЭ по химии из реакций разложения кислых солей следует усвоить, как разлагаются гидрокарбонаты. Гидрокарбонаты металлов разлагаются уже при температуре более 60 оС. При этом образуются карбонат металла, углекислый газ и вода:
Последние две реакции являются основной причиной образования накипи на поверхности водонагревательных элементов в электрических чайниках, стиральных машинах и т.д.
Гидрокарбонат аммония разлагается без твердого остатка с образованием двух газов и паров воды:
Химические свойства основных солей
Основные соли всегда реагируют со всеми сильными кислотами. При этом могут образоваться средние соли, если использовались кислота с тем же кислотным остатком, что и в основной соли, или смешанные соли, если кислотный остаток в основной соли отличается от кислотного остатка реагирующей с ней кислоты:
Также для основных солей характерны реакции разложения при нагревании, например:
Химические свойства комплексных солей (на примере соединений алюминия и цинка)
В рамках программы ЕГЭ по химии следует усвоить химические свойства таких комплексных соединений алюминия и цинка, как тетрагидроксоалюминаты и третрагидроксоцинкаты.
Тетрагидроксоалюминатами и тетрагидроксоцинкатами называют соли, анионы которых имеют формулы [Al(OH)4]— и [Zn(OH)4]2- соответственно. Рассмотрим химические свойства таких соединений на примере солей натрия:
Данные соединения, как и другие растворимые комплексные, хорошо диссоциируют, при этом практически все комплексные ионы (в квадратных скобках) остаются целыми и не диссоциируют дальше:
Действие избытка сильной кислоты на данные соединения приводит к образованию двух солей:
При действии же на них недостатка сильных кислот в новую соль переходит только активный металл. Алюминий и цинк в составе гидроксидов выпадают в осадок:
Осаждение гидроксидов алюминия и цинка сильными кислотами не является удачным выбором, поскольку сложно добавить строго необходимое для этого количество сильной кислоты, не растворив при этом часть осадка. По этой причине для этого используют углекислый газ, обладающий очень слабыми кислотными свойствами и благодаря этому не способный растворить осадок гидроксида:
В случае тетрагидроксоалюмината осаждение гидроксида также можно проводить, используя диоксид серы и сероводород:
В случае тетрагидроксоцинката осаждение сероводородом невозможно, поскольку в осадок вместо гидроксида цинка выпадает его сульфид:
При упаривании растворов тетрагидроксоцинката и тетрагидроксоалюмината с последующим прокаливанием данные соединения переходят соответственно в цинкат и алюминат:
ЭКЗАМЕНЫ НЕ ЗА ГОРАМИ
Подготовка к ЕГЭ по химии
Кислые соли
Задания на применение знаний о кислых
солях встречаются в вариантах работ ЕГЭ
на разных уровнях сложности (А, В и С). Поэтому при
подготовке учащихся к сдаче ЕГЭ
нужно рассмотреть следующие вопросы.
1. Определение и номенклатура.
Кислые соли – это продукты неполного
замещения атомов водорода многоосновных кислот
на металл. Номенклатура кислых солей отличается
от средних только добавлением приставки
«гидро…» или «дигидро…» к названию соли,
например: NaHCO3 – гидрокарбонат
натрия, Са(Н2РО4)2 – дигидрофосфат
кальция.
2. Получение.
Кислые соли получаются при взаимодействии
кислот с металлами, оксидами металлов,
гидроксидами металлов, солями, аммиаком, если
кислота в избытке.
Например:
Zn + 2H2SO4 = H2 + Zn(HSO4)2,
CaO + H3PO4 = CaHPO4 + H2O,
NaOH + H2SO4 = H2O + NaHSO4,
Na2S + HCl = NaHS + NaCl,
NH3 + H3PO4 = NH4H2PO4,
2NH3 + H3PO4 = (NH4)2HPO4.
Также кислые соли получаются при
взаимодействии кислотных оксидов со щелочами,
если оксид в избытке. Например:
CO2 + NaOH = NaHCO3,
2SO2 + Ca(OH)2 = Ca(HSO3)2.
3. Взаимопревращения.
Средняя соль ![]() кислая
кислая
соль; например:
K2СО3 ![]() KНСО3.
KНСО3.
Чтобы из средней соли получить кислую, нужно
добавить избыток кислоты или соответствующего
оксида и воды:
K2СО3 + Н2О + СО2 =
2KНСО3.
Чтобы из кислой соли получить среднюю, нужно
добавить избыток щелочи:
KНСО3 + KОН = K2СО3 + Н2О.
Гидрокарбонаты разлагаются с образованием
карбонатов при кипячении:
2KНСО3 ![]() K2СО3
K2СО3
+ Н2О + СО2.
4. Свойства.
Кислые соли проявляют свойства кислот,
взаимодействуют с металлами, оксидами металлов,
гидроксидами металлов, солями.
Например:
2KНSO4 + Mg = H2![]() + MgSO4 + K2SO4,
+ MgSO4 + K2SO4,
2KHSO4 + MgO = H2O + MgSO4 + K2SO4,
2KHSO4 + 2NaOH = 2H2O + K2SO4
+ Na2SO4,
2KHSO4 + Cu(OH)2 = 2H2O + K2SO4
+ CuSO4,
2KHSO4 + MgCO3 = H2O + CO2![]() + K2SO4 + MgSO4,
+ K2SO4 + MgSO4,
2KHSO4 + BaCl2 = BaSO4![]() + K2SO4 + 2HCl.
+ K2SO4 + 2HCl.
5. Задачи на кислые соли. Образование одной
соли.
При решении задач на избыток и недостаток нужно
помнить о возможности образования кислых солей,
поэтому сначала составляют уравнения всех
возможных реакций. После нахождения количеств
реагирующих веществ делают вывод о том, какая
соль получится, и решают задачу по
соответствующему уравнению.
З а д а ч а 1. Через раствор, содержащий 60 г NaOH,
пропустили 44,8 л СО2. Найти массу
образовавшейся соли.
| Дано: | Найти: m(соли). |
| m(NaOH) = 60 г, | |
| V(CO2) = 44,8 л. |
Р е ш е н и е
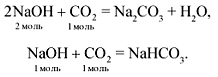
![]() (NaOH) = m/M =
(NaOH) = m/M =
60 (г)/40 (г/моль) = 1,5 моль;
![]() (СО2) = V/Vm
(СО2) = V/Vm
= 44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку ![]() (NaOH) :
(NaOH) : ![]() (CO2) = 1,5 : 2 = 0,75 : 1,
(CO2) = 1,5 : 2 = 0,75 : 1,
то делаем вывод, что СО2 в избытке,
следовательно, получится кислая соль:
NaOH + CO2 = NaHCO3.
Количество вещества образовавшейся соли равно
количеству вещества прореагировавшего
гидроксида натрия:
![]() (NaHCO3)
(NaHCO3)
= 1,5 моль.
m(NaHCO3) = M •![]() = 84 (г/моль)•1,5 (моль) = 126 г.
= 84 (г/моль)•1,5 (моль) = 126 г.
Ответ: m(NaHCO3) = 126 г.
З а д а ч а 2. Оксид фосфора(V) массой 2,84 г
растворили в 120 г 9%-й ортофосфорной кислоты.
Полученный раствор прокипятили, затем к нему
добавили 6 г гидроксида натрия. Найти массу
полученной соли.
| Дано: | Найти: m(соли). |
| m(P2O5) = 2,84 г, | |
| m(р-ра)(H3PO4) = 120 г, |
|
| m(NaOH) = 6 г. |
Р е ш е н и е
![]()
![]() (P2O5)
(P2O5)
= m/M = 2,84 (г)/142 (г/моль) = 0,02 моль,
следовательно, ![]() 1(H3PO4
1(H3PO4
получ.) = 0,04 моль.
m(H3PO4) = m(р-ра)•![]() = 120 (г)•0,09 = 10,8 г.
= 120 (г)•0,09 = 10,8 г.
![]() 2(H3PO4)
2(H3PO4)
= m/M = 10,8 (г)/98 (г/моль) = 0,11 моль,
![]() (H3PO4)
(H3PO4)
= ![]() 1 +
1 + ![]() 2 = 0,11 + 0,04 = 0,15
2 = 0,11 + 0,04 = 0,15
моль.
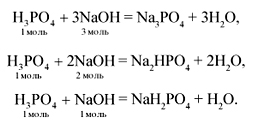
![]() (NaOH) = m/M
(NaOH) = m/M
= 6 (г)/40 (г/моль) = 0,15 моль.
Поскольку
![]() (H3PO4)
(H3PO4)
: ![]() (NaOH) = 0,15 : 0,15 = 1 : 1,
(NaOH) = 0,15 : 0,15 = 1 : 1,
то получится дигидрофосфат натрия:
![]()
![]() (NaH2PO4)
(NaH2PO4)
= 0,15 моль,
m(NaH2PO4) = M•![]() = 120 (г/моль)•0,15 (моль) = 18 г.
= 120 (г/моль)•0,15 (моль) = 18 г.
Ответ: m(NaH2PO4) = 18 г.
З а д а ч а 3. Сероводород объемом 8,96 л пропустили
через 340 г 2%-го раствора аммиака. Назовите соль,
получившуюся в результате реакции, и определите
ее массу.
Ответ: гидросульфид аммония,
m(NH4HS) = 20,4 г.
З а д а ч а 4. Газ, полученный при сжигании 3,36 л
пропана, прореагировал с 400 мл 6%-го раствора
гидроксида калия (![]()
= 1,05 г/мл). Найти состав полученного раствора и
массовую долю соли в полученном растворе.
Ответ: ![]() (KНСО3) = 10,23 %.
(KНСО3) = 10,23 %.
З а д а ч а 5. Весь углекислый газ, полученный при
сжигании 9,6 кг угля, пропустили через раствор,
содержащий 29,6 кг гидроксида кальция. Найти массу
полученной соли.
Ответ: m(Ca(HCO3)2) = 64,8 кг.
З а д а ч а 6. В 9,8 кг 20%-го раствора серной кислоты
растворили 1,3 кг цинка. Найти массу полученной
соли.
Ответ: m(ZnSO4) = 3,22 кг.
6. Задачи на кислые соли. Образование смеси
двух солей.
Это более сложный вариант задач на кислые соли.
В зависимости от количества реагирующих веществ
возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора(V)
щелочью в зависимости от молярного соотношения
реагентов могут образоваться следующие
продукты:
P2O5 + 6NaOH = 2Na3PO4 + 3H2O,
![]() (P2O5):
(P2O5):![]() (NaOH) = 1:6;
(NaOH) = 1:6;
P2O5 + 4NaOH = 2Na2HPO4 + H2O,
![]() (P2O5):
(P2O5):![]() (NaOH) = 1:4;
(NaOH) = 1:4;
P2O5 + 2NaOH + H2O = 2NaH2PO4,
![]() (P2O5):
(P2O5):![]() (NaOH) = 1:2.
(NaOH) = 1:2.
Следует помнить, что при неполной
нейтрализации возможно образование смеси двух
соединений. При взаимодействии 0,2 моль Р2О5
с раствором щелочи, содержащим 0,9 моль NaOH,
молярное соотношение находится между 1:4 и 1:6. В
этом случае образуется смесь двух солей: фосфата
натрия и гидрофосфата натрия.
Если раствор щелочи будет содержать 0,6 моль NaOH,
то молярное соотношение будет другим: 0,2:0,6 = 1:3,
оно находится между 1:2 и 1:4, поэтому получится
смесь двух других солей: дигидрофосфата и
гидрофосфата натрия.
Эти задачи можно решать разными способами. Мы
будем исходить из предположения, что
одновременно происходят две реакции.
А л г о р и т м р е ш е н и я
1. Составить уравнения всех возможных
реакций.
2. Найти количества реагирующих веществ и по
их соотношению определить уравнения двух
реакций, которые происходят одновременно.
3. Обозначить количество одного из
реагирующих веществ в первом уравнении как х
моль, во втором – у моль.
4. Выразить через х и у количества
другого реагирующего вещества согласно молярным
соотношениям по уравнениям.
5. Составить систему уравнений с двумя
неизвестными.
З а д а ч а 1. Оксид фосфора(V), полученный при
сжигании 6,2 г фосфора, пропустили через 200 г 8,4%-го
раствора гидроксида калия. Какие вещества и в
каких количествах получаются?
Р е ш е н и е
![]()
![]() (P) = m/M
(P) = m/M
= 6,2 (г)/31 (г/моль) = 0,2 моль,
следовательно, ![]() (P2O5)
(P2O5)
= 0,1 моль.
m(KOH) = ![]() •m(р-ра)
•m(р-ра)
= 0,084•200 (г) = 16,8 г,
![]() (KOH) = m/M
(KOH) = m/M
= 16,8 (г)/56 (г/моль) = 0,3 моль.
Уравнения возможных реакций:
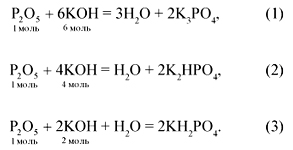
![]() (Р2О5):
(Р2О5):![]() (KОН) = 0,1:0,3 = 1:3,
(KОН) = 0,1:0,3 = 1:3,
следовательно, получится смесь двух солей –
гидрофосфата и дигидрофосфата калия (уравнения 2
и 3).
Обозначим ![]() (Р2О5)
(Р2О5)
в уравнении (2) как х моль, а ![]() (Р2О5) в уравнении (3)
(Р2О5) в уравнении (3)
как у моль, тогда потребуется: ![]() (KОН) = 4х + 2у.
(KОН) = 4х + 2у.
Составим систему уравнений:
![]()
х = 0,1 – у,
4(0,1 – у) + 2у = 0,3,
0,4 – 4у + 2у = 0,3,
2у = 0,1, у = 0,05,
х = 0,1 – 0,05 = 0,05.
Поскольку количество вещества образующейся
соли вдвое больше количества вещества
вступившего в реакцию оксида фосфора(V), то
получится по 0,1 моль гидро- и дигидрофосфата
калия:
![]() (P2O5)2
(P2O5)2
= 0,05 моль —> ![]() (K2НРО4)
(K2НРО4)
= 0,1 моль,
![]() (Р2О5)3
(Р2О5)3
= 0,05 моль —> ![]() (KН2РО4)
(KН2РО4)
= 0,1 моль.
Ответ: ![]() (K2НРО4) = 0,1 моль,
(K2НРО4) = 0,1 моль,
![]() ( KН2РО4)
( KН2РО4)
= 0,1 моль.
З а д а ч а 2. Найти массы и массовые доли солей,
полученных при растворении 22,4 л углекислого газа
в 480 г 10%-го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2 г, ![]() (Na2CO3) = 4,05%
(Na2CO3) = 4,05%
m(NaHCO3) = 67,2 г, ![]() (NaHCO3) = 12,82 %.
(NaHCO3) = 12,82 %.
З а д а ч а 3. Найти массовые доли солей в
растворе, полученном при пропускании 100 м3 аммиака
через 500 кг 50%-го раствора фосфорной кислоты.
Ответ. ![]() ((NH4)2HPO4) = 43,8 %,
((NH4)2HPO4) = 43,8 %,
![]() (NH4H2PO4)
(NH4H2PO4)
= 12,8 %.
З а д а ч а 4. К 50 г раствора ортофосфорной
кислоты с массовой долей 11,76 % прибавили 150 г
раствора гидроксида калия с массовой долей
5,6 %. Найти состав остатка, полученного при
выпаривании раствора.
Ответ: m(K3PO4) = 6,36 г,
m(K2HPO4) = 5,22 г.
З а д а ч а 5. Сожгли 5,6 л бутана (н.у.) и
образовавшийся углекислый газ пропустили через
раствор, содержащий 102,6 г гидроксида бария. Найти
массы полученных солей.
Ответ: m(BaCO3) = 39,4 г,
m(Ba(HCO3)2) = 103,6 г.
Г.С.ОСНОВСКАЯ,
учитель химии средней школы № 7
(г. Великие Луки, Псковская обл.)
Кислые соли
Задания на применение знаний о кислых солях встречаются в вариантах работ ЕГЭ
на разных уровнях сложности (А, В и С). Поэтому при подготовке учащихся к сдаче ЕГЭ
нужно рассмотреть следующие вопросы.
1. Определение и номенклатура.
Кислые соли – это продукты неполного замещения атомов водорода многоосновных кислот на металл. Номенклатура кислых солей отличается от средних только добавлением приставки «гидро…» или «дигидро…» к названию соли, например: NaHCO3 – гидрокарбонат натрия, Са(Н2РО4)2 – дигидрофосфат кальция.
Кислые соли получаются при взаимодействии кислот с металлами, оксидами металлов, гидроксидами металлов, солями, аммиаком, если кислота в избытке.
Na2S + HCl = NaHS + NaCl,
Также кислые соли получаются при взаимодействии кислотных оксидов со щелочами, если оксид в избытке. Например:
Средняя соль кислая соль; например:
K2СО3 KНСО3.
Чтобы из средней соли получить кислую, нужно добавить избыток кислоты или соответствующего оксида и воды:
Чтобы из кислой соли получить среднюю, нужно добавить избыток щелочи:
Гидрокарбонаты разлагаются с образованием карбонатов при кипячении:
2KНСО3 K2СО3 + Н2О + СО2.
Кислые соли проявляют свойства кислот, взаимодействуют с металлами, оксидами металлов, гидроксидами металлов, солями.
2KНSO4 + Mg = H2 + MgSO4 + K2SO4,
2KHSO4 + MgCO3 = H2O + CO2 + K2SO4 + MgSO4,
2KHSO4 + BaCl2 = BaSO4 + K2SO4 + 2HCl.
5. Задачи на кислые соли. Образование одной соли.
При решении задач на избыток и недостаток нужно помнить о возможности образования кислых солей, поэтому сначала составляют уравнения всех возможных реакций. После нахождения количеств реагирующих веществ делают вывод о том, какая соль получится, и решают задачу по соответствующему уравнению.
З а д а ч а 1. Через раствор, содержащий 60 г NaOH, пропустили 44,8 л СО2. Найти массу образовавшейся соли.
| Дано: | Найти: m(соли). |
| m(NaOH) = 60 г, | |
| V(CO2) = 44,8 л. |
(NaOH) = m/M = 60 (г)/40 (г/моль) = 1,5 моль;
(СО2) = V/Vm = 44,8 (л)/22,4 (л/моль) = 2 моль.
Поскольку (NaOH) : (CO2) = 1,5 : 2 = 0,75 : 1, то делаем вывод, что СО2 в избытке, следовательно, получится кислая соль:
Количество вещества образовавшейся соли равно количеству вещества прореагировавшего гидроксида натрия:
(NaHCO3) = 1,5 моль.
m(NaHCO3) = M • = 84 (г/моль)•1,5 (моль) = 126 г.
З а д а ч а 2. Оксид фосфора(V) массой 2,84 г растворили в 120 г 9%-й ортофосфорной кислоты. Полученный раствор прокипятили, затем к нему добавили 6 г гидроксида натрия. Найти массу полученной соли.
| Дано: | Найти: m(соли). |
| m(P2O5) = 2,84 г, | |
| m(р-ра)(H3PO4) = 120 г, | |
| (H3PO4) = 9 %, | |
| m(NaOH) = 6 г. |
(P2O5) = m/M = 2,84 (г)/142 (г/моль) = 0,02 моль,
следовательно, 1(H3PO4 получ.) = 0,04 моль.
m(H3PO4) = m(р-ра)• = 120 (г)•0,09 = 10,8 г.
2(H3PO4) = m/M = 10,8 (г)/98 (г/моль) = 0,11 моль,
(H3PO4) = 1 + 2 = 0,11 + 0,04 = 0,15 моль.
(NaOH) = m/M = 6 (г)/40 (г/моль) = 0,15 моль.
(H3PO4) : (NaOH) = 0,15 : 0,15 = 1 : 1,
то получится дигидрофосфат натрия:
(NaH2PO4) = 0,15 моль,
m(NaH2PO4) = M• = 120 (г/моль)•0,15 (моль) = 18 г.
З а д а ч а 3. Сероводород объемом 8,96 л пропустили через 340 г 2%-го раствора аммиака. Назовите соль, получившуюся в результате реакции, и определите ее массу.
Ответ: гидросульфид аммония,
m(NH4HS) = 20,4 г.
З а д а ч а 4. Газ, полученный при сжигании 3,36 л пропана, прореагировал с 400 мл 6%-го раствора гидроксида калия ( = 1,05 г/мл). Найти состав полученного раствора и массовую долю соли в полученном растворе.
Ответ: (KНСО3) = 10,23 %.
З а д а ч а 5. Весь углекислый газ, полученный при сжигании 9,6 кг угля, пропустили через раствор, содержащий 29,6 кг гидроксида кальция. Найти массу полученной соли.
З а д а ч а 6. В 9,8 кг 20%-го раствора серной кислоты растворили 1,3 кг цинка. Найти массу полученной соли.
6. Задачи на кислые соли. Образование смеси двух солей.
Это более сложный вариант задач на кислые соли. В зависимости от количества реагирующих веществ возможно образование смеси двух солей.
Например, при нейтрализации оксида фосфора(V) щелочью в зависимости от молярного соотношения реагентов могут образоваться следующие продукты:
(P2O5):(NaOH) = 1:6;
(P2O5):(NaOH) = 1:4;
(P2O5):(NaOH) = 1:2.
Следует помнить, что при неполной нейтрализации возможно образование смеси двух соединений. При взаимодействии 0,2 моль Р2О5 с раствором щелочи, содержащим 0,9 моль NaOH, молярное соотношение находится между 1:4 и 1:6. В этом случае образуется смесь двух солей: фосфата натрия и гидрофосфата натрия.
Если раствор щелочи будет содержать 0,6 моль NaOH, то молярное соотношение будет другим: 0,2:0,6 = 1:3, оно находится между 1:2 и 1:4, поэтому получится смесь двух других солей: дигидрофосфата и гидрофосфата натрия.
Эти задачи можно решать разными способами. Мы будем исходить из предположения, что одновременно происходят две реакции.
А л г о р и т м р е ш е н и я
1. Составить уравнения всех возможных реакций.
2. Найти количества реагирующих веществ и по их соотношению определить уравнения двух реакций, которые происходят одновременно.
3. Обозначить количество одного из реагирующих веществ в первом уравнении как х моль, во втором – у моль.
4. Выразить через х и у количества другого реагирующего вещества согласно молярным соотношениям по уравнениям.
5. Составить систему уравнений с двумя неизвестными.
З а д а ч а 1. Оксид фосфора(V), полученный при сжигании 6,2 г фосфора, пропустили через 200 г 8,4%-го раствора гидроксида калия. Какие вещества и в каких количествах получаются?
| Дано: | Найти: 1; 2. |
| m(P) = 6,2 г, | |
| m(р-ра KОН) = 200 г, | |
| (KОН) = 8,4 %. |
(P) = m/M = 6,2 (г)/31 (г/моль) = 0,2 моль,
следовательно, (P2O5) = 0,1 моль.
m(KOH) = •m(р-ра) = 0,084•200 (г) = 16,8 г,
(KOH) = m/M = 16,8 (г)/56 (г/моль) = 0,3 моль.
Уравнения возможных реакций:
(Р2О5):(KОН) = 0,1:0,3 = 1:3, следовательно, получится смесь двух солей – гидрофосфата и дигидрофосфата калия (уравнения 2 и 3).
Обозначим (Р2О5) в уравнении (2) как х моль, а (Р2О5) в уравнении (3) как у моль, тогда потребуется: (KОН) = 4х + 2у.
Составим систему уравнений:
х = 0,1 – 0,05 = 0,05.
Поскольку количество вещества образующейся соли вдвое больше количества вещества вступившего в реакцию оксида фосфора(V), то получится по 0,1 моль гидро- и дигидрофосфата калия:
(P2O5)2 = 0,05 моль —> (K2НРО4) = 0,1 моль,
(Р2О5)3 = 0,05 моль —> (KН2РО4) = 0,1 моль.
Ответ: (K2НРО4) = 0,1 моль,
( KН2РО4) = 0,1 моль.
З а д а ч а 2. Найти массы и массовые доли солей, полученных при растворении 22,4 л углекислого газа в 480 г 10%-го раствора гидроксида натрия.
Ответ: m(Na2CO3) = 21,2 г, (Na2CO3) = 4,05%
m(NaHCO3) = 67,2 г, (NaHCO3) = 12,82 %.
З а д а ч а 3. Найти массовые доли солей в растворе, полученном при пропускании 100 м 3 аммиака через 500 кг 50%-го раствора фосфорной кислоты.
Ответ. ((NH4)2HPO4) = 43,8 %,
(NH4H2PO4) = 12,8 %.
З а д а ч а 4. К 50 г раствора ортофосфорной кислоты с массовой долей 11,76 % прибавили 150 г раствора гидроксида калия с массовой долей 5,6 %. Найти состав остатка, полученного при выпаривании раствора.
З а д а ч а 5. Сожгли 5,6 л бутана (н.у.) и образовавшийся углекислый газ пропустили через раствор, содержащий 102,6 г гидроксида бария. Найти массы полученных солей.
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например , оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например , гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например , гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например , гидроксид меди (II) реагирует с серной кислотой:
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например , гидроксид цинка (II) реагирует с соляной кислотой:
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например , аммиак реагирует с соляной кислотой:
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например , соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например , гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например , при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например , гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например , кислород окисляет сульфит натрия до сульфата натрия:
7. Еще один способ получения солей — взаимодействие металлов с неметаллами . Таким способом можно получить только соли бескислородных кислот.
Например , сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах . Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например , железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например , железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например , хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например , в растворе:
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
2F2 0 + 4NaO -2 H = O2 0 + 4NaF — + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например , хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например , хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например , гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
Например , гидроксокарбонат меди (II) диссоциирует в две ступени:
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Например , сульфат алюминия-калия диссоциирует в одну ступень:
Смешанные соли диссоциируют также одноступенчато.
Например , хлорид-гипохлорид кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например , тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
2. Соли взаимодействуют с кислотными и амфотерными оксидами . При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например , карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например , сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например , гидрокарбонат калия взаимодействует с гидроксидом калия:
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например , сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например , гидрокарбонат калия взаимодействует с гидросульфатом калия:
Некоторые кислые соли могут реагировать со своими средними солями.
Например , фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например , железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например , при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например , нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
- Галогениды серебра (кроме AgF):
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
7. Соли проявляют восстановительные свойства . Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например , йодид калия окисляется хлоридом меди (II):
8. Соли проявляют и окислительные свойства . Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Все химические реакции, которые необходимы для успешной сдачи ОГЭ
Правило 12.1 Взаимодействие растворов солей с металлами
Более активные металлы вытесняют из солей менее активные металлы:
Fe + CuSO4 → Cu + FeSO4
Железо является более активным металлом, чем медь, так как стоит левее в ряду активностей металлов, следовательно вытесняет медь из ее соли. Такие реакции протекают в растворах, следовательно, соли должны быть растворимыми.
Ag + CuSO4 → реакция не идет, так как серебро стоит правее меди в ряду активностей металлов и, следовательно, является более слабым металлом.
Правило 12.2. Соли вступают в реакции ионного обмена с щелочами:
Условия: 1) оба реагента должны быть растворимыми; 2) должен выпадать осадок или выделяться газ.
2NaOH + ZnCl2 → Zn(OH)2  + 2NaCl
+ 2NaCl
NaOH + NH4NO3 → NH3  + NaNO3 + H2O
+ NaNO3 + H2O
Cu(OH)2 + NaNO3 → реакция не идет, так как гидроксид меди (II) нерастворим.
Правило 12.3. Соли вступают в реакции ионного обмена с кислотами:
Условие: должен выделяться газ, выпадать осадок или образовываться более слабая кислота:
CaCO3 + 2HCl → CaCl2 + CO2  + H2O
+ H2O
AgNO3 + HCl → AgCl  + HNO3
+ HNO3
K3PO4 + HCl → NaCl + H3PO4 (слабая кислота)
Правило 12.4. Получение кислых солей
1. Кислые соли образуются в реакциях металлов, основных оксидов или щелочей с кислотами при условии избытка кислоты:
CaO + H3PO4 = CaHPO4 + H2O
NaOH + H2SO4 = NaHSO4 + H2O
2. Либо при условии избытка кислотного оксида:
NaOH + CO2 → NaHCO3
Ca(OH)2 + 2SO2 → Ca(HSO3)2
3. Также кислые соли образуются в реакциях карбонатов с раствором, содержащим CO2:
K2СO3 + H2О + СO2 → 2KНСO3
CaСO3 + H2О + СO2 → Ca(НСO3)2
Правило 12.5. Свойства кислых солей
Кислые соли реагируют как с кислотами, так и с щелочами, образуя среднии соли:
[spoiler title=”источники:”]
http://chemege.ru/salts/
http://chemrise.ru/theory/inorganic_9/rules_acid_salts_9
[/spoiler]
Перед изучением этого раздела рекомендую прочитать следующую статью:
Классификация неорганических веществ
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей

Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
Например, оксид серы (VI) реагирует с оксидом натрия с образованием сульфата натрия:
SO3 + Na2O → Na2SO4
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
Например, гидроксид натрия реагирует с соляной кислотой:
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Например, гидроксид калия взаимодействует с избытком фосфорной кислоты с образованием гидрофосфата калия или дигидрофосфата калия:
H3PO4 + KOH → KH2PO4 + H2O
H3PO4 + 2KOH → K2HPO4 + 2H2O
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Например, гидроксид меди (II) реагирует с серной кислотой:
H2SO4 + Cu(OH)2 → CuSO4 + 2H2O
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Например, гидроксид цинка (II) реагирует с соляной кислотой:
2HCl + Zn(OH)2 → ZnCl2 + 2H2O
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
Например, аммиак реагирует с соляной кислотой:
NH3 + HCl → NH4Cl


3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
Например, соляная кислота реагирует с оксидом меди (II):
2HCl + CuO → CuCl2 + H2O

4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
Например, гидроксид натрия взаимодействует с углекислым газом с образованием карбоната натрия:
2NaOH + CO2 → Na2CO3 + H2O
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
Например, при взаимодействии гидроксида натрия с избытком углекислого газа образуется гидрокарбонат натрия:
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
Например, гидроксид меди (II) взаимодействует с оксидом серы (VI), но не вступает в реакцию с углекислым газом:
Cu(OH)2 + CO2 ≠
Cu(OH)2 + SO3 → CuSO4 + H2O


5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
CaCO3 + H2SO4 → CaSO4 + 2H2O + CO2
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
Na2SiO3 + 2HCl → H2SiO3↓ + 2NaCl

6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Например, кислород окисляет сульфит натрия до сульфата натрия:
2Na2SO3 + O2 → 2Na2SO4
7. Еще один способ получения солей — взаимодействие металлов с неметаллами. Таким способом можно получить только соли бескислородных кислот.
Например, сера взаимодействует с кальцием с образованием сульфида кальция:
Ca + S → CaS
8. Соли образуются при растворении металлов в кислотах. Минеральные кислоты и кислоты-окислители (азотная кислота, серная концентрированная кислота) реагируют с металлами по-разному.
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Например, железо растворяется в соляной кислоте с образованием хлорида железа (II):
Fe + 2HCl → FeCl2 + H2

9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
Например, железо не реагирует с раствором щёлочи, оксид железа (II) — основный. А алюминий растворяется в водном растворе щелочи, оксид алюминия — амфотерный:
2Al + 2NaOH + 6H2+O = 2Na[Al+3(OH)4] + 3H20

10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
Например, хлор при взаимодействии с холодной щелочью переходит в степени окисления -1 и +1:
2NaOH + Cl20 = NaCl— + NaOCl+ + H2O
Хлор при взаимодействии с горячей щелочью переходит в степени окисления -1 и +5:
6NaOH + Cl20 = 5NaCl— + NaCl+5O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
Например, в растворе:
2NaOH + Si0 + H2+O= Na2Si+4O3 + 2H20
Фтор окисляет щёлочи:
2F20 + 4NaO-2H = O20 + 4NaF— + 2H2O
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
Например, хлор взаимодействует с бромидом калия:
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме+ и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
Например, хлорид кальция диссоциирует почти полностью:
CaCl2 → Ca2+ + 2Cl–
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
Например, гидрокарбонат натрия диссоциирует в две ступени:
NaHCO3 → Na+ + HCO3–
HCO3– → H+ + CO32–
Основные соли также диссоциируют ступенчато.
Например, гидроксокарбонат меди (II) диссоциирует в две ступени:
(CuOH)2CO3 → 2CuOH+ + CO32–
CuOH+ → Cu2+ + OH–
Двойные соли диссоциируют в одну ступень.
Например, сульфат алюминия-калия диссоциирует в одну ступень:
KAl(SO4)2 → K+ + Al3+ + 2SO42–
Смешанные соли диссоциируют также одноступенчато.
Например, хлорид-гипохлорит кальция диссоциирует в одну ступень:
CaCl(OCl) → Ca2+ + Cl— + ClO–
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
Например, тетрагидроксоалюминат калия распадается на ионы калия и тетрагидроксоалюминат-ион:
K[Al(OH)4] → K+ + [Al(OH)4]–

2. Соли взаимодействуют с кислотными и амфотерными оксидами. При этом менее летучие оксиды вытесняют более летучие при сплавлении.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Например, карбонат калия взаимодействует с оксидом кремния (IV) с образованием силиката калия и углекислого газа:
K2CO3 + SiO2 → K2SiO3 + CO2↑
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
K2CO3 + Al2O3 → 2KAlO2 + CO2↑
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Например, сульфат меди (II) взаимодействует с гидроксидом калия, т.к. образуется осадок гидроксида меди (II):
CuSO4 + 2KOH → Cu(OH)2 + K2SO4
Хлорид аммония взаимодействует с гидроксидом натрия:
(NH4)2SO4 + 2KOH → 2NH3↑ + 2H2O + K2SO4
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
Например, гидрокарбонат калия взаимодействует с гидроксидом калия:
KHCO3 + KOH → K2CO3 + H2O

5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Например, сульфат меди (II) взаимодействует с хлоридом бария, т.к. образуется осадок сульфата бария:
CuSO4 + BaCl2 → BaSO4↓+ CuCl2
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Например, гидрокарбонат калия взаимодействует с гидросульфатом калия:
KHSO4 + KHCO3 = H2O + CO2↑ + K2SO4
Некоторые кислые соли могут реагировать со своими средними солями.
Например, фосфат калия взаимодействует с дигидрофосфатом калия с образованием гидрофосфата калия:
K3PO4 + KH2PO4 = 2K2HPO4

6. Cоли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
Например, железо вытесняет медь из раствора сульфата меди (II):
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Соль1 + металл1 = соль2 + металл2
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
Например, при добавлении натрия в раствор хлорида цинка натрий будет взаимодействовать с водой:
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Например, нитрат меди (II) в расплаве не реагирует с железом, так как при нагревании нитрат меди разлагается:
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
Cu(NO3)2, (расплав) + Fe ≠

При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
Pb(NO3)2 + Zn = Pb + Zn (NO3)2
7. Некоторые соли при нагревании разлагаются.
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
- Нитрат, дихромат, нитрит аммония:
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
(NH4)2Cr2O7 → N2 + 4H2O + Cr2O3
- Все нитраты:
2AgNO3 → 2Ag +2NO2 + O2
- Галогениды серебра (кроме AgF):
2AgCl → 2Ag + Cl2
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся:
- Карбонаты и гидрокарбонаты:
MgСO3 → MgO + СО2
2NaНСО3 → Na2СО3 + СО2 + Н2О
- Карбонат, сульфат, сульфит, сульфид, хлорид, фосфат аммония:
NH4Cl → NH3 + HCl
(NH4)2CO3 → 2NH3 + CO2 + H2O
(NH4)2SO4 → NH4HSO4 + NH3

7. Соли проявляют восстановительные свойства. Как правило, восстановительные свойства проявляют либо соли, содержащие неметаллы с низшей степенью окисления, либо соли, содержащие неметаллы или металлы с промежуточной степенью окисления.
Например, йодид калия окисляется хлоридом меди (II):
4KI— + 2Cu+2 Cl2 → 4KCl + 2Cu+l + I20

8. Соли проявляют и окислительные свойства. Как правило, окислительные свойства проявляют соли, содержащие атомы металлов или неметаллов с высшей или промежуточной степенью окисления. Окислительные свойства некоторых солей рассмотрены в статье Окислительно-восстановительные реакции.
Правила
составления формул кислых солей по
названию.
Чтобы
научиться составлять формулы кислых
солей необходимо уметь составлять
формулы средних солей по кислотным
остаткам соответствующих кислот (см. §
1).
Пример
1:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:




гидрофосфат
калия
KHPO4
Приставка
ГИДРО означает, что соль кислая,
поэтому, в составе кислотного остатка
1 атом Н (атом водорода).Название
ФОСФАТ означает, что это соль фосфорнойкислоты,
поэтому, в составе кислотного остатка
группаPO4
2)
Проставьте валентность над символами
металла и кислотного остатка, например,
для указанных выше веществ:
-
Название
вещества:
Выполненное
действие:
Пояснения:






гидрофосфат
калия
I
IIKHPO4
Валентность
калия равна I , так как калий элементI
группы главной подгруппы.Валентность
кислотного остатка HPO4
определяетсяпо
разности атомов водорода в кислоте
и кислотномостатке:
H3PO4
HPO43
-1 = II
3)
Найдите наименьшее общее кратное (НОК)
– самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:




НОК
= 2I
IIK2HPO4
2
: I = 2 2 : II = 1единицу не
пишутСамое
маленькое число, делящаеся на обе
валентностит.е.
на II и на I это 2.Разделив
2 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элементаи
кислотного остатка.
¾
10 ¾
Пример
2:
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:





дигидрофосфат
кальция
СаH2PO4
Приставка
ДИГИДРО означает, что соль кислая и
имеетв
составе кислотного остатка 2 атома Н“ДИ”
означает ДВА (атома водорода)Название
ФОСФАТ означает, что это соль фосфорнойкислоты,
поэтому, в составе кислотного остатка
группаPO4
2)
Проставьте валентность над символами
металла и кислотного остатка, например,
для указанных выше веществ:
-
Название
вещества:
Выполненное
действие:
Пояснения:




дигидрофосфат
калия
II
IСаH2PO4
Валентность
кальция равна II , так как кальций
элементII
группы главной подгруппы.Валентность
кислотного остатка H2PO4
определяетсяпо
разности атомов водорода в кислоте
и кислотномостатке:
H3PO4
H2PO43
-2 = I
3)
Найдите наименьшее общее кратное (НОК)
– самое маленькое число, которое можно
разделить на обе валентности и получить
целые числа. Наименьшее общее кратное
(НОК) разделите на каждую из валентностей
и проставьте ИНДЕКСЫ ( цифры внизу справа
у символа элемента) в формулу.
-
Выполненное
действие:Пояснения:





НОК
= 2II
IСа(H2PO4)2
2
: II = 1 2 : I = 2кислотный
остатокнадо
взять в скобки, т.к.результат
делениябольше
1Самое
маленькое число, делящаеся на обе
валентности,т.е.
на II и на I это 2.Разделив
2 на обе валентности, получаем индексы,которые
записываем справа внизу от знака
элементаи
кислотного остатка.
¾
11 ¾
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
