При решении задач
этого раздела см. табл.
8.
Коррозией
называют
самопроизвольное
разрушение металлических материалов
под действием
окружающей
среды. Как любой самопроизвольный
процесс, коррозия сопровождается
уменьшением энергии Гиббса (∆G
< 0).
По механизму
протекания различают химическую и
электрохимическую коррозию. Химическая
коррозия – окисление металлов и сплавов
агрессивными веществами при отсутствии
электролита, обычно при высоких
температурах. Намного чаще приходится
сталкиваться с электрохимической
коррозией, протекающей
в атмосферных условиях в присутствии
электролита.
Разрушение металла
при электрохимической коррозии происходит
в результате работы огромного количества
микрогальванических элементов, которые
образуются на поверхности металла
вследствие его энергетической
неоднородности. Участки металла, имеющие
более отрицательные значения потенциала,
становятся анодами коррозионных
микрогальванических элементов. Именно
на этих участках протекает анодное
окисление металла и происходит
коррозионное разрушение.
Запись схемы
электрохимической коррозии:
_
![]()
![]()



А (-) Анод│коррозионная
среда (деполяризатор)│ Катод (+) К![]()
Таким образом, при
электрохимической коррозии на поверхности
металла одновременно протекают два
процесса:
анодный
— окисление
металла
A:
(-) Me
– ne
= Men+;
катодный
– восстановление окислителя, находящегося
в окружающей среде,
K: (+) Ox + ne = Red.
Ионы или молекулы,
которые восстанавливаются на катоде,
называют деполяризаторами. При атмосферной
коррозии
— коррозии
во влажном воздухе —
деполяризатором
является кислород. В этом случае процесс
называют коррозией с кислородной
деполяризацией:
A: (-) Me –
ne = Men+;
(1)
К: (+) О2
+ 2 Н2О
+ 4е = 4 ОН![]() (рН ≥ 7); φ0
(рН ≥ 7); φ0
= 1,23 В; (2)
О2
+4 Н+
+ 4е = 2 Н2О (рН
< 7). φ0
= 0,40 В. (3)
В водных растворах
кислот в роли окислителя выступают ионы
водорода Н+.
Процесс называют коррозией с водородной
деполяризацией:
A: (-) Me
– ne = Men+;
К: (+) 2 Н+
+ 2е = Н2 (рН
<< 7) φ0
= 0,00 В. (4)
Встречаются также
процессы коррозии со смешанной
кислородно-водородной деполяризацией,
когда окислителями являются одновременно
кислород О2
и ионы
водорода Н+.
Появившиеся на
анодных участках электроны по поверхности
металла перетекают к катодным участкам,
где принимаются окислителем
(деполяризатором). Возникает коррозионный
электрический ток. Поскольку анодные
и катодные участки являются
короткозамкнутыми, то для работы таких
микрогальванопар достаточно тончайшей
пленки влаги, конденсирующейся на
поверхности металла в атмосферных
условиях.
Особенно часто
электрохимическая коррозия возникает
при непосредственном контакте двух
различных металлов (контактная коррозия),
при частичном погружении в водный
раствор (коррозия по ватерлинии), при
использовании неудачных конструкций
(щелевая коррозия).
Термодинамическая
возможность коррозии определяется из
условия
∆G
< 0. Так как ∆G
= — nFE
и Е = φК
– φА,
то коррозия возможна, если
φА
< φK,
т.е. если электродный потенциал металла
меньше электродного потенциала
деполяризатора (см. уравнения (2) – (4)).
Пример 1.
Как происходит коррозия цинка, находящегося
в контакте с кадмием, в нейтральном и
кислом растворах. Составьте электронные
уравнения анодного и катодного процессов.
Каков состав продуктов коррозии?
Решение.
Цинк имеет более отрицательный потенциал
(-0,763 В), чем
кадмий
(-0,403 В),
поэтому он является анодом, а кадмий
катодом.
Схема коррозионного
процесса:
а) в кислой среде
б) в нейтральной среде
![]()
![]()
![]()






А (-) Zn│ Н+ │
Cd
(+) К
![]()
А (-) Zn│H2O;
O2│
Cd
(+) К
Анодный процесс
протекает на поверхности цинка
А (-): Zn°-2e=Zn2+;
катодный процесс
протекает на поверхности кадмия.
К (+): в кислой среде
2Н+
+ 2е
=
H2;
в нейтральной
среде
![]() О2
О2
+ Н2О
+ 2e
= 2ОH![]() .
.
Так как ионы Zn2+
с
гидроксильной группой образуют
нерастворимый гидроксид, то продуктом
коррозии будет Zn(OH)2
Zn2+
+ 2ОH![]() = Zn(OH)2.
= Zn(OH)2.
Пример 2.
Составьте уравнения процессов, протекающих
при коррозии стали, во влажной среде,
содержащей кислород, при рН = 5. Как
изменяются процессы в случае применения
протекторной защиты?
Решение.
Составим схему коррозионного процесса.
![]()
![]()



А (-) Fe│ O2;
Н+
│ Fe
(+) К
На анодных участках
поверхности стали происходит окисление:
А (-): Fe°-2e
= Fe2+. φ0
= – 0,440 В.
На
катодных участках при рН = 5 возможно
протекание процессов:
К (+): О2
+4 Н+
+ 4е = 2 Н2О; (1)
2
Н+
+ 2е = Н2. (2)
При рН = 5 вычислим
электродные потенциалы катодных
процессов:
для процесса восстановления
кислорода (1)
φ1
= φ0
– 0,059 рН = 0,40 – 0,059 ∙ 5 = 0,105 В;
для процесса
восстановления ионов Н+
(2)
φ2
= φ0
= 0,000 — 0,059 ∙ 5 = – 0,295 В.
Так как φ1
> φ2,
протекает коррозия с кислородной
деполяризацией (1).
Для протекторной
защиты необходимо выбрать металл,
потенциал которого более отрицательный,
чем потенциал железа (табл. 8), например,
магний. В этом случае анодом станет
магний.
Анодный процесс
А (-): Mg°-2e
= Mg2+.
Катодный
процесс не изменится.
К (+): О2
+4 Н+
+ 4е = 2 Н2О.
Пример 3. При
атмосферной коррозии железного изделия
после удаления слоя ржавчины было
установлено, что потеря массы металла
за 3 месяца работы составила 0,112 г.
Вычислите объем кислорода, израсходованного
на коррозию и величину коррозионного
тока.
Решение.
Составим схему коррозионного процесса.
![]()
![]()


А (-) Fe│ O2;
Н2О
│ Fe
(+) К
![]()
Запишем уравнения
анодного и катодного процессов коррозии:
А (-): Fe°-2e
= Fe2+
К (+):
![]() О2
О2
+ Н2О
+ 2e
= 2ОH![]()
Fe2+
+ 2ОH![]() = Fe(OH)2
= Fe(OH)2
Fe(OH)2
+
![]() О2
О2
+ Н2О
= Fe(OH)3.
Рассчитаем э
число молярных масс эквивалента (число
моль-экв.) железа, растворившегося в
результате процесса анодного окисления:
э
=
![]() 0,004
0,004
моль.
Согласно второму
закону Фарадея, столько же эквивалентов
кислорода должно быть израсходовано в
катодном процессе. Следовательно, объем
кислорода, израсходованного на коррозию:
![]() 0,0224
0,0224
л = 22,4 мл.
Величину коррозионного
тока определяем по закону Фарадея:
![]()
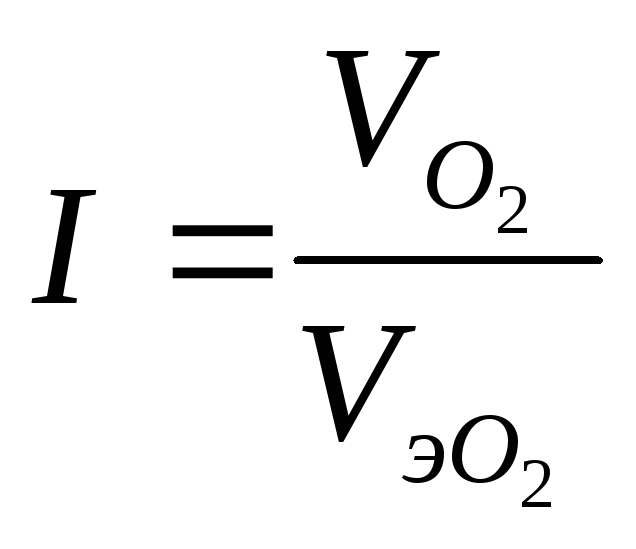
![]() 4,96∙10-5
4,96∙10-5
А.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Процессы коррозии различных металлов. Интенсивность коррозии
Решение задач по химии на коррозию металлов
Задание 296
Цинковую и железную пластинки опустили в раствор сульфата меди. Составьте электронные и ионно-молекулярные уравнения реакций, происходящих на каждой из этих пластинок. Какие процессы будут проходить на пластинках, если наружные концы их соединить проводником?
Решение:
Если цинковую или медную пластинки опустить в раствор сульфата меди, то в обоих случаях будет наблюдаться выпадение осадка меди. Происходит вытеснение меди цинком и железом, потому что стандартные электродные потенциалы цинка (-0,763 В) и железа (-0,44 В) значительно электроотрицательнее, чем потенциал меди (+0,34 В). Поэтому цинк и железо будут окисляться, а ионы меди Cu 2+ – восстанавливаться до металлической меди:
а) Электрохимические процессы при реакции цинка и сульфата меди
Zn 0 + Сu 2+ = Zn 2+ + Cu 0
б) Электрохимические процессы при реакции железа и сульфата меди
Fe 0 + Сu 2+ = Fe 2+ + Cu 0
Если соединить цинковую и железную пластинки, опущенные в раствор сульфата меди (II) проводником, то будет наблюдаться растворение цинковой пластинки и осаждение меди на железной пластинке. Объясняется это тем, что цинк имеет более электроотрицательный стандартный электродный потенциал, чем железо, поэтому цинк будет окисляться. На железной пластинке будут восстанавливаться ионы меди, так как стандартный электродный потенциал меди имеет большее численное значение, чем потенциал железа.
Анодный процесс: Zn 0 -2 = Zn 2+
Катодный процесс: Cu 2+ + 2 = Cu 0
Задание 297
Как влияет рН среды на скорость коррозии железа и цинка? Почему? Составьте электронные уравнения анодного и катодного процессов атмосферной коррозии этих металлов.
Решение:
Стандартные электродные потенциалы железа и цинка равны соответственно -0,44 В и -0,763 В. Потенциал, отвечающий электродному процесс:
2Н + + 2 = Н2↑
В нейтральной среде, равен приблизительно -0,41 В. Следовательно, ионы водорода, находящиеся в воде и в нейтральных водных средах, могут окислять только те металлы, потенциал которых меньше, чем -0,41 В, – это могут быть железо и цинк. Однако, эти металлы в нейтральных растворах, содержащих растворённый кислород, образуют защитную оксидную плёнку, препятствующую дальнейшему разрушению металла. Поэтому железо и цинк не могут быть окислены ионами водорода в нейтральных средах. Атмосферная коррозия – коррозия во влажном воздухе при комнатной температуре. Поверхность металла, находящегося во влажном воздухе, бывает покрыта плёнкой воды, содержащей различные газы, и в первую очередь – кислород. Скорость атмосферной коррозии зависит от рН среды. При понижении рН среды концентрация ионов водорода Н+ возрастает, что приводит к увеличению скорости коррозии металла, увеличивается восстановительный процесс на аноде:
2Н + + 2 = Н2↑
При повышении рН раствора уменьшается концентрация ионов водорода Н + и, соответственно, увеличивается концентрация ионов ОН-, что, согласно принципу Ле Шателье, смещает равновесие в системах: 2Н + + 2 = Н2 ↑ и 1/2O2 + H2O + 2 = 2OH – влево, т. е. в сторону увеличения концентрации ионов Н + и уменьшения концентрации ионов ОН – .
Электрохимические процессы, протекающие при контакте железа и цинка при контакте с водой с поглощением кислорода (атмосферная коррозия):
Анод: Zn 0 -2 = Zn 2+
Катод: 1/2O2 + H2O + 2 = 2OH –
Анод: Zn 0 -2 = Zn 2+
Катод: 1/2O2 + H2O + 2 = 2OH –
Задание 298
В раствор электролита, содержащего растворенный кислород, опустили цинковую пластинку и цинковую пластинку, частично покрытую медью. В каком случае процесс коррозии цинка проходит интенсивнее? Составьте электронные уравнения анодного и катодного процессов.
Решение:
а) Если цинковую пластинку опустить в раствор электролита, содержащего растворенный кислород, то будет наблюдаться коррозия цинка, характеризующаяся окислением его до ионов Zn 2+ :
Zn 0 -2 = Zn 2+
Чрез некоторое время скорость реакции заметно замедляется, потому что чистый цинк окисляется кислородом, растворённым в воде, с образованием оксидной плёнки, которая, покрывая пластинку тонким слоем, пассивирует её. При этом протекает реакция:
Zn + 1/2 O2 = Zn 0
б) Если в раствор электролита опустить цинковую пластинку частично покрытую медью, процесс коррозии будет происходить значительно интенсивнее, так как образуется гальваническая пара Zn — Cu. Цинк имеет более электроотрицательный электродный потенциал (-0,763 В), чем медь (0,34 В), поэтому цинк является анодом, а медь – катодом.
Анодный процесс: Zn 0 -2 = Zn 2+
Катодный процесс: в кислой среде: 2Н + + 2 = Н2 0 ; в нейтральной или щелочной среде: 1/2O2 + H2O + 2 = 2OH –
В нейтральной среде или в щелочной ионы цинка Zn 2+ с гидроксид-ионами ОН- образуют нерастворимое основание, то продуктом коррозии будет Zn(OH)2. В кислой среде ионы цинка Zn 2+ с ионами кислотного остатка будут образовывать соль и при этом выделяется газообразный водород. Происходит интенсивное разрушение цинковой пластинки частично покрытой медью.
Коррозия металлов. Виды коррозии металлов
Определение коррозии
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H + +2e — = H2 разряд водородных ионов
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H + +4e — = H2O восстановление растворенного кислорода
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е 0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е 0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е 0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e — = Fe 2+
K: O2 + 4H + + 4e — = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Коррозия металлов и способы защиты от нее
Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе.
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой.
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов.
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H + + 2e → H2
O2 + 2H2O + 4e → 4OH –
Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: 2H + + 2e → H2
Суммарная реакция: Fe + 2H + → H2 + Fe 2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH –
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
[spoiler title=”источники:”]
http://zadachi-po-khimii.ru/obshaya-himiya/korroziya-metallov.html
http://chemege.ru/korroziya/
[/spoiler]
…
Определение коррозии
Материалы из металлов под химическим или электрохимическим воздействием окружающей среды подвергаются разрушению, которое называется коррозией.
Коррозия металлов вызывается окислительно-восстановительными реакциями, в результате которых металлы переходят в окисленную форму и теряют свои свойства, что приводит в негодность металлические материалы.
Можно выделить 3 признака, характеризующих коррозию:
- Коррозия – это с химической точки зрения процесс окислительно-восстановительный.
- Коррозия – это самопроизвольный процесс, возникающий по причине неустойчивости термодинамической системы металл – компоненты окружающей среды.
- Коррозия – это процесс, который развивается в основном на поверхности металла. Однако, не исключено, что коррозия может проникнуть и вглубь металла.
Виды коррозии металлов
Наиболее часто встречаются следующие виды коррозии металлов:
- Равномерная – охватывает всю поверхность равномерно
- Неравномерная
- Избирательная
- Местная пятнами – корродируют отдельные участки поверхности
- Язвенная (или питтинг)
- Точечная
- Межкристаллитная – распространяется вдоль границ кристалла металла
- Растрескивающая
- Подповерхностная
С точки зрения механизма коррозионного процесса можно выделить два основных типа коррозии: химическую и электрохимическую.
Химическая коррозия металлов
Химическая коррозия металлов — это результат протекания таких химических реакций, в которых после разрушения металлической связи, атомы металла и атомы, входящие в состав окислителей, образуют химическую связь.
Электрический ток между отдельными участками поверхности металла в этом случае не возникает. Такой тип коррозии присущ средам, которые не способны проводить электрический ток – это газы, жидкие неэлектролиты.
Виды химической коррозии
Химическая коррозия металлов бывает газовой и жидкостной.
Газовая коррозия металлов – это результат действия агрессивных газовых или паровых сред на металл при высоких температурах, при отсутствии конденсации влаги на поверхности металла. Это, например, кислород, диоксид серы, сероводород, пары воды, галогены. Такая коррозия в одних случаях может привести к полному разрушению металла (если металл активный), а в других случаях на его поверхности может образоваться защитная пленка (например, алюминий, хром, цирконий).
Жидкостная коррозия металлов– может протекать в таких неэлектролитах, как нефть, смазочные масла, керосин и др. Этот тип коррозии при наличии даже небольшого количества влаги, может легко приобрести электрохимический характер.
При химической коррозии скорость разрушения металла пропорциональна скорости химической реакции и той скорости с которой окислитель проникает сквозь пленку оксида металла, покрывающую его поверхность. Оксидные пленки металлов могут проявлять или не проявлять защитные свойства, что определяется сплошностью.
Фактор Пиллинга-Бэдворса
Сплошность такой пленки оценивают величине фактора Пиллинга—Бэдвордса: (α = Vок/VМе) по отношению объема образовавшегося оксида или другого какого-либо соединения к объему израсходованного на образование этого оксида металла
α = Vок/VМе = Мок·ρМе/(n·AMe·ρок),
где Vок — объем образовавшегося оксида
VМе — объем металла, израсходованный на образование оксида
Мок – молярная масса образовавшегося оксида
ρМе – плотность металла
n – число атомов металла
AMe — атомная масса металла
ρок — плотность образовавшегося оксида
Оксидные пленки, у которых α < 1, не являются сплошными и сквозь них кислород легко проникает к поверхности металла. Такие пленки не защищают металл от коррозии. Они образуются при окислении кислородом щелочных и щелочно-земельных металлов (исключая бериллий).
Оксидные пленки, у которых 1 < α < 2,5 являются сплошными и способны защитить металл от коррозии.
При значениях α > 2,5 условие сплошности уже не соблюдается, вследствие чего такие пленки не защищают металл от разрушения.
Ниже представлены значения сплошности α для некоторых оксидов металлов
| Металл | Оксид | α | Металл | Оксид | α |
| K | K2O | 0,45 | Zn | ZnO | 1,55 |
| Na | Na2O | 0,55 | Ag | Ag2O | 1,58 |
| Li | Li2O | 0,59 | Zr | ZrO2 | 1.60 |
| Ca | CaO | 0,63 | Ni | NiO | 1,65 |
| Sr | SrO | 0,66 | Be | BeO | 1,67 |
| Ba | BaO | 0,73 | Cu | Cu2O | 1,67 |
| Mg | MgO | 0,79 | Cu | CuO | 1,74 |
| Pb | PbO | 1,15 | Ti | Ti2O3 | 1,76 |
| Cd | CdO | 1,21 | Cr | Cr2O3 | 2,07 |
| Al | Al2O2 | 1,28 | Fe | Fe2O3 | 2,14 |
| Sn | SnO2 | 1,33 | W | WO3 | 3,35 |
| Ni | NiO | 1,52 |
Электрохимическая коррозия металлов
Электрохимическая коррозия металлов – это процесс разрушения металлов в среде различных электролитов, который сопровождается возникновением внутри системы электрического тока.
При таком типе коррозии атом удаляется из кристаллической решетки результате двух сопряженных процессов:
- Анодного – металл в виде ионов переходит в раствор.
- Катодного – образовавшиеся при анодном процессе электроны, связываются деполяризатором (вещество — окислитель).
Сам процесс отвода электронов с катодных участков называется деполяризацией, а вещества способствующие отводу – деполяризаторами.
Наибольшее распространение имеет коррозия металлов с водородной и кислородной деполяризацией.
Водородная деполяризация
Водородная деполяризация осуществляется на катоде при электрохимической коррозии в кислой среде:
2H++2e— = H2 разряд водородных ионов
2H3O++2e— = H2 + 2H2O
Кислородная деполяризация
Кислородная деполяризация осуществляется на катоде при электрохимической коррозии в нейтральной среде:
O2 + 4H++4e— = H2O восстановление растворенного кислорода
O2 + 2H2O + 4e— = 4OH—
Все металлы, по их отношению к электрохимической коррозии, можно разбить на 4 группы, которые определяются величинами их стандартных электродных потенциалов:
- Активные металлы (высокая термодинамическая нестабильность) – это все металлы, находящиеся в интервале щелочные металлы — кадмий (Е0 = -0,4 В). Их коррозия возможна даже в нейтральных водных средах, в которых отсутствуют кислород или другие окислители.
- Металлы средней активности (термодинамическая нестабильность) – располагаются между кадмием и водородом (Е0 = 0,0 В). В нейтральных средах, в отсутствии кислорода, не корродируют, но подвергаются коррозии в кислых средах.
- Малоактивные металлы (промежуточная термодинамическая стабильность) – находятся между водородом и родием (Е0 = +0,8 В). Они устойчивы к коррозии в нейтральных и кислых средах, в которых отсутствует кислород или другие окислители.
- Благородные металлы (высокая термодинамическая стабильность) – золото, платина, иридий, палладий. Могут подвергаться коррозии лишь в кислых средах при наличии в них сильных окислителей.
Виды электрохимической коррозии
Электрохимическая коррозия может протекать в различных средах. В зависимости от характера среды выделяют следующие виды электрохимической коррозии:
- Коррозия в растворах электролитов — в растворах кислот, оснований, солей, в природной воде.
- Атмосферная коррозия – в атмосферных условиях и в среде любого влажного газа. Это самый распространенный вид коррозии.
Например, при взаимодействии железа с компонентами окружающей среды, некоторые его участки служат анодом, где происходит окисление железа, а другие – катодом, где происходит восстановление кислорода:
А: Fe – 2e— = Fe2+
K: O2 + 4H+ + 4e— = 2H2O
Катодом является та поверхность, где больше приток кислорода.
- Почвенная коррозия – в зависимости от состава почв, а также ее аэрации, коррозия может протекать более или менее интенсивно. Кислые почвы наиболее агрессивны, а песчаные – наименее.
- Аэрационная коррозия — возникает при неравномерном доступе воздуха к различным частям материала.
- Морская коррозия – протекает в морской воде, в связи с наличием в ней растворенных солей, газов и органических веществ.
- Биокоррозия – возникает в результате жизнедеятельности бактерий и других организмов, вырабатывающих такие газы как CO2, H2S и др., способствующие коррозии металла.
- Электрокоррозия – происходит под действием блуждающих токов на подземных сооружениях, в результате работ электрических железных дорог, трамвайных линий и других агрегатов.
Методы защиты от коррозии металла
Основной способ защиты от коррозии металла – это создание защитных покрытий – металлических, неметаллических или химических.
Металлические покрытия
Металлическое покрытие наносится на металл, который нужно защитить от коррозии, слоем другого металла, устойчивого к коррозии в тех же условиях. Если металлическое покрытие изготовлено из металла с более отрицательным потенциалом (более активный) , чем защищаемый, то оно называется анодным покрытием. Если металлическое покрытие изготовлено из металла с более положительным потенциалом (менее активный), чем защищаемый, то оно называется катодным покрытием.
Например, при нанесении слоя цинка на железо, при нарушении целостности покрытия, цинк выступает в качестве анода и будет разрушаться, а железо защищено до тех пор, пока не израсходуется весь цинк. Цинковое покрытие является в данном случае анодным.
Катодным покрытием для защиты железа, может, например, быть медь или никель. При нарушении целостности такого покрытия, разрушается защищаемый металл.
Неметаллические покрытия
Такие покрытия могут быть неорганические (цементный раствор, стекловидная масса) и органические (высокомолекулярные соединения, лаки, краски, битум).
Химические покрытия
В этом случае защищаемый металл подвергают химической обработке с целью образования на поверхности пленки его соединения, устойчивой к коррозии. Сюда относятся:
оксидирование – получение устойчивых оксидных пленок (Al2O3, ZnO и др.);
фосфатирование – получение защитной пленки фосфатов (Fe3(PO4)2, Mn3(PO4)2);
азотирование – поверхность металла (стали) насыщают азотом;
воронение стали – поверхность металла взаимодействует с органическими веществами;
цементация – получение на поверхности металла его соединения с углеродом.
Изменение состава технического металла и коррозионной среды
Изменение состава технического металла также способствует повышению стойкости металла к коррозии. В этом случае в металл вводят такие соединения, которые увеличивают его коррозионную стойкость.
Изменение состава коррозионной среды (введение ингибиторов коррозии или удаление примесей из окружающей среды) тоже является средством защиты металла от коррозии.
Электрохимическая защита
Электрохимическая защита основывается на присоединении защищаемого сооружения катоду внешнего источника постоянного тока, в результате чего оно становится катодом. Анодом служит металлический лом, который разрушаясь, защищает сооружение от коррозии.
Протекторная защита – один из видов электрохимической защиты – заключается в следующем.
К защищаемому сооружению присоединяют пластины более активного металла, который называется протектором. Протектор – металл с более отрицательным потенциалом – является анодом, а защищаемое сооружение – катодом. Соединение протектора и защищаемого сооружения проводником тока, приводит к разрушению протектора.
Примеры задач с решениями на определение защитных свойств оксидных пленок, определение коррозионной стойкости металлов, а также уравнения реакций, протекающих при электрохимической коррозии металлов приведены в разделе Задачи к разделу Коррозия металлов
Железное изделие покрыли никелем. Какое это покрытие анодное или катодное? Почему? Составьте электрические уравнения анодного и катодного процессов коррозии этого изделия при нарушении покрытия во влажном воздухе и в соляной кислоте (HCl). Какие продукты реакции получатся в первом и втором случае?
Решение задачи
1.Изделие находится во влажном воздухе, который является электропроводящей средой, следовательно, будет протекать электрохимическая коррозия.
При нарушении покрытия образуется гальванический элемент. Составим схему коррозионного гальванического элемента:
Fe │ H2O, O2 │ Ni
Вода – это нейтральная среда, поэтому окислителем (деполяризатором) является кислород – О2 воздуха. Следовательно, в этой схеме будет протекать электрохимическая коррозия с кислородной деполяризацией.
Никель имеет больший (-0,23 B) потенциал, чем железо (-0,44 B) (смотри таблицу электрохимических потенциалов металлов), поэтому в гальваническом элементе никель будет катодом (окислителем), железо – анодом (восстановителем).
(-) Fe │ H2O, O2 │ Ni (+)
Электроны двигаются от железа к никелю.
Запишем электронные уравнения процессов коррозии, протекающих на электродах, и составим суммарное уравнение процессов коррозии.
![]()
![]()
![]()
Составим молекулярное уравнение процесса коррозии окислительно-восстановительной реакции, протекающей при коррозии:
![]()
Вывод: коррозировать будет железо. Продуктом его коррозии является основание – гидроксид железа (II).
Ответ:
продукт процесса коррозии гидроксид железа (II).
2.Металлы находятся в кислой среде – растворе соляной кислоты (HCl). Раствор HCl – электролит, то есть электропроводящая среда, следовательно, будет протекать электрохимическая коррозия.
В данном случае среда кислая, поэтому окислителем (деполяризатором) является ион водорода (H+). Следовательно, в этой схеме будет протекать электрохимическая коррозия с водородной деполяризацией.
(-) Fe │ HCl │ Ni (+)
Электроны двигаются от железа к никелю.
Запишем электронные уравнения процессов коррозии, протекающих на электродах, и составим суммарное уравнение процессов коррозии.
![]()
![]()
![]()
Составим молекулярное уравнение процессов коррозии окислительно-восстановительной реакции, протекающей при коррозии:
![]()
Запишем вывод: при коррозии железа, находящегося в контакте с никелем, окисляется железо. Продуктом его коррозии является соль – хлорид железа (II). На никелевом электроде выделяется водород.
Ответ:
продукты процессов коррозии хлорид железа (II), водород.
Коррозия – это процесс разрушения металлов и металлических конструкций под воздействием различных факторов окружающей среды – кислорода, влаги, вредных примесей в воздухе.
Коррозионная стойкость металла зависит от его природы, характера среды и температуры.
- Благородные металлы не подвергаются коррозии из-за химической инертности.
- Металлы Al, Ti, Zn, Cr, Ni имеют плотные газонепроницаемые оксидные плёнки, которые препятствуют коррозии.
- Металлы с рыхлой оксидной плёнкой – Fe, Cu и другие – коррозионно неустойчивы. Особенно сильно ржавеет железо.
Различают химическую и электрохимическую коррозию.
Химическая коррозия сопровождается химическими реакциями. Как правило, химическая коррозия металлов происходит при действии на металл сухих газов, её также называют газовой.
3Fe + 2O2 = Fe3O4
При химической коррозии также возможны процессы:
Fe + 2HCl → FeCl2 + H2
2Fe + 3Cl2 → 2FeCl3
Как правило, такие процессы протекают в аппаратах химических производств.
Электрохимическая коррозия – это процесс разрушения металла, который сопровождается электрохимическими процессами. Как правило, электрохимическая коррозия протекает в присутствии воды и кислорода, либо в растворах электролитов.
В таких растворах на поверхности металла возникают процессы переноса электронов от металла к окислителю, которым является либо кислород, либо кислота, содержащаяся в растворе.
При этом электродами являются сам металл (например, железо) и содержащиеся в нем примеси (обычно менее активные металлы, например, олово).
В таком загрязнённом металле идёт перенос электронов от железа к олову, при этом железо (анод) растворяется, т.е. подвергается коррозии:
Fe –2e = Fe 2+
На поверхности олова (катод) идёт процесс восстановления водорода из воды или растворённого кислорода:
2H+ + 2e → H2
O2 + 2H2O + 4e → 4OH–
Например, при контакте железа с оловом в растворе соляной кислоты происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: 2H+ + 2e → H2
Суммарная реакция: Fe + 2H+ → H2 + Fe2+
Если реакция проходит в атмосферных условиях в воде, в ней участвует кислород и происходят процессы:
Анод: Fe –2e → Fe 2+
Катод: O2 + 2H2O + 4e → 4OH–
Суммарная реакция:
Fe 2+ + 2OH – → Fe(OH)2
4Fe(OH)2 + O2+ 2H2O → 4Fe(OH)3
При этом образуется ржавчина.
Методы защиты от коррозии
Защитные покрытия
Защитные покрытия предотвращают контакт поверхности металла с окислителями.
- Катодное покрытие – покрытие менее активным металлом (защищает металл только неповреждённое покрытие).
- Покрытие краской, лаками, смазками.
- Создание на поверхности некоторых металлов прочной оксидной плёнки химическим путём (анодирование алюминия, кипячение железа в фосфорной кислоте).
Создание сплавов, стойких к коррозии
Физические свойства сплавов могут существенно отличаться от свойств чистых металлов. Добавление некоторых металлов может приводить к повышению коррозионной стойкости сплава. Например, нержавеющая сталь, новые сплавы с большой коррозионной устойчивостью.
Изменение состава среды
Коррозия замедляется при добавлении в среду, окружающую металлическую конструкцию, ингибиторов коррозии. Ингибиторы коррозии — это вещества, подавляющие процессы коррозии.
Электрохимические методы защиты
Протекторная защита: при присоединении к металлической конструкции пластинок из более активного металла – протектора. В результате идёт разрушение протектора, а металлическая конструкция при этом не разрушается.
