- Учебники
- 8 класс
- Химия 👍
- Габриелян
- №4

авторы: Габриелян, Сладков, Остроумов.
издательство: “Просвещение”
Раздел:
- ГЛАВА 1. Первоначальные химические понятия
- ГЛАВА 2. Важнейшие представители неорганических веществ. Количественные отношения в химии
- §13. Кислород
- Часть II
Запишите уравнения реакций горения сложных веществв:
а) сероводорода $H_{2}S$
б) серокглерода $CS_{2}$
в) этана $C_{2}H_{6}$
г) ацетилена $C_{2}H_{2}$

reshalka.com
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §13. Часть II. Номер №4
Решение а
$2H_{2}S + 2O_{2} = SO_{2} + 2H_{2}O$
Решение б
$CS_{2} + 3O_{2} = 2SO_{2} + CO_{2}$
Решение в
$2C_{2}H_{6} + 7O_{2} = 4CO_{2} + 6H_{2}O$
Решение г
$2C_{2}H_{2} + 5O_{2} = 4CO_{2} + 2H_{2}O$
- Предыдущее
- Следующее
![]()
Нашли ошибку?
Если Вы нашли ошибку, неточность или просто не согласны с ответом, пожалуйста сообщите нам об этом

Химия, опубликовано 2018-08-22 14:27:55 by Гость
Составьте уравнения окислительно-восстановительных реакций полного и неполного сгорания сероводорода. Укажите окислитель и восстановитель.

Ответ оставил Гость
Полное сгорание сероводорода:
2H₂S + 3O₂ = 2H₂O + 2SO₂
S⁻² -6e⁻ —> S⁺⁴ |2 (S⁻² – восстановитель)
O₂⁰ +4e⁻ —> 2O⁻² |3 (O₂⁰ – окислитель)
Неполное сгорание сероводорода:
2H₂S+O₂=2S+2H₂O
S⁻² -2e⁻ —> S⁰ |2 (S⁻² – восстановитель)
O₂⁰ +4e⁻ —> 2O⁻² |1 (O₂⁰ – окислитель)

Не нашли ответа?
Если вы не нашли ответа на свой вопрос, или сомневаетесь в его правильности, то можете воспользоваться формой ниже и уточнить решение. Или воспользуйтесь формой поиска и найдите похожие ответы по предмету Химия.
Составьте уравнения реакций горения сложных веществ : а) сероводорода H2S ; б) сульфида цинка ZnS ; в) метана CH4 ; г) ацетилена C2H2 ; д) сероуглерода CS2 ; е) бензола C6H6.
На этой странице сайта вы найдете ответы на вопрос Составьте уравнения реакций горения сложных веществ : а) сероводорода H2S ; б) сульфида цинка ZnS ; в) метана CH4 ; г) ацетилена C2H2 ; д) сероуглерода CS2 ; е) бензола C6H6?,
относящийся к категории Химия. Сложность вопроса соответствует базовым
знаниям учеников 5 – 9 классов. Для получения дополнительной информации
найдите другие вопросы, относящимися к данной тематике, с помощью поисковой
системы. Или сформулируйте новый вопрос: нажмите кнопку вверху страницы, и
задайте нужный запрос с помощью ключевых слов, отвечающих вашим критериям.
Общайтесь с посетителями страницы, обсуждайте тему. Возможно, их ответы
помогут найти нужную информацию.
Масса кислорода
Найти массу кислорода (O2), необходимого для полного сжигания 67,2 литров (нормальные условия) сероводорода (H2S) до сернистого газа (SO2).
Решение задачи
Запишем уравнение реакции горения сероводорода (H2S):
![]()
Отмечу то, что если сжигаемое вещество содержит серу, то при горении, независимо от количества кислорода, образуется сернистый газ (SO2).
Учитывая, что сероводорода (H2S) – бесцветный газ с характерным запахом, вычислим химическое количество сероводорода (H2S) по формуле, устанавливающей связь между химическим количеством вещества и объемом:
![]()
Получаем:
n (H2S) = 67,2 / 22,4 = 3 (моль).
По уравнению реакции рассчитаем химическое количество кислорода (O2), необходимого для полного сжигания 67,2 литров сероводорода (H2S):
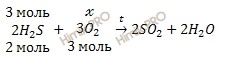
х моль O2 необходимо для полного сжигания 3 моль H2S
3 моль O2 необходимо для полного сжигания 2 моль H2S
Откуда:
![]()
Учитывая, что молярная масса кислорода (O2) равна 32 г/моль, найдем массу кислорода (O2) по формуле, устанавливающей связь между массой и химическим количеством вещества:
![]()
Получаем:
m (O2) = 4,5 ∙ 32 = 144 (г).
Ответ:
масса кислорода (O2) равна 144 грамма.
