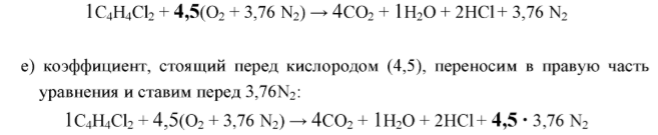Процесс горения отлично знаком человеку. Помните, как первобытные люди дорожили огнём? Да и сегодня огню приписывается символическое значение: олимпийский огонь, который зажигают в преддверии игр, или вечный огонь, горящий в память о погибших. Но нас сейчас будет интересовать не история огня, а сам процесс горения с химической точки зрения и уравнения химических реакций.
Итак,
горение – это взаимодействие веществ с кислородом.
Если мы сжигаем какое-то вещество в воздухе, а потом его же сожжём в чистом кислороде, то во втором случае процесс будет куда интенсивнее. Всё дело в том, что в воздухе кислорода содержится всего 21 процент, то есть концентрация его меньше, чем в собственно чистом кислороде. Поэтому и горение на воздухе менее интенсивное, чем в чистом кислороде. И это первое, что нужно запомнить.
Все видели, как что-то горит, и все знают, что при этом появляется свет и выделяется тепло. Это тоже особенность процесса горения – он, как правило, протекает с выделением энергии (тепловой и световой). Но иногда для запуска горения требуется нагреть компоненты. Например, бумага воспламенится и при обычной температуре, а вот чтобы поджечь металлическую проволоку или стеклянный стакан, понадобится их сильно нагреть.
Ну а теперь мы перейдём непосредственно к химическим уравнениям и рассмотрим подробно горение простых и сложных веществ.
Горение простых веществ
При сгорании простого вещества всегда образуется его оксид.
Например:
С + О2 = СО2
4Р + 5О2 = 2Р2О5
2Сu + O2 = 2CuO
Напомню, что, как правило, эти реакции протекают с выделением тепла.
Горение сложных веществ
При сгорании сложного вещества почти всегда образуются оксиды входящих в него элементов.
Например:
СН4 + О2 = СО2 + 2Н2О
2Н2S + 3O2 = 2Н2О + 2SO2
2ZnS + 3O2 = 2SO2 + 2ZnO
Но тут нужно помнить, что при недостатке кислорода может образоваться оксид только одно элемента. Так, аммиак при недостатке кислорода сгорает по такой схеме:
4NH3 + 3O2 = 6H2O + 2N2
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Правило № 1.
В левой части уравнения записываем горючее вещество и воздух в виде:
Правило № 2.
В правой части уравнения записываем продукты реакции горения, учитывая, что:
Правило № 3.
Уравниваем реакцию горения для того, чтобы в исходных веществах и получившихся из них продуктах реакции содержалось одинаковое количество одинаковых атомов. При этом коэффициенты и индексы перемножаются:
Правило № 4.
Кислород, входящий в состав горючего вещества, например,
участвует в реакции горения, как и кислород воздуха, в качестве окислителя.
При решении практически всех задач по
дисциплине “Теория горения и взрыва”
необходимо составить уравнение реакции
горения. Поэтому очень важно научиться
делать это правильно. Изучите изложенные
ниже правила составления уравнений
реакции горения, разберите примеры.
Правило № 1. В левой части уравнения
записываем горючее вещество и окислитель
[воздух в виде (O2 + 3,76N2)].
Правило № 2. В правой части уравнения
записываем продукты реакции горения,
учитывая, что:
углерод (С), содержащийся в горючем
веществе, превращается в CO2,
сера (S), содержащаяся
в горючем веществе, превращается в SO2,
фосфор (Р), содержащийся в горючем
веществе, превращается в P2O5,
водород (Н), содержащийся в горючем
веществе, превращается в H2O,
хлор (Cl), содержащийся
в горючем веществе, превращается в HCl,
фтор (F), содержащийся
в горючем веществе, превращается в HF,
бром (Br), содержащийся
в горючем веществе, превращается в HBr,
йод (I), содержащийся
в горючем веществе, превращается в HI,
кислород (О), содержащийся в горючем
веществе, входит в состав образующихся
оксидов (CO2,
SO2,
H2O)
как и кислород воздуха.
азот (N), при температуре
горения ниже 2000 оС не вступает в
реакцию. Поскольку, в условиях реального
пожара температура не превышает значения
1500 – 1600 оС, то принимают, что азот
выделяется в свободном виде (N2).
Следовательно 3,76 молей N2
из воздуха переходят в неизменном виде
в продукты горения.
Если горючее вещество содержит другие
элементы, то они переходят в высшие
оксиды, как указанные выше углерод,
водород и фосфор.
Правило
№ 3. Атомы
кислорода, входящие в состав молекул
горючего вещества (например, C2H6OS
– 2-тиолэтанол), участвуют в реакции
горения в качестве окислителя, как
кислород воздуха.
Правило № 4. Уравниваем реакцию
горения для того, чтобы в исходных
веществах (левая часть уравнения) и
получившихся из них продуктах реакции
(правая часть уравнения) содержалось
одинаковое количество атомов данного
вида. При подсчете количества атомов
данного вида стехиометрические
коэффициенты и индексы, указывающие
количество атомов в молекуле, перемножаются.
Рекомендуется придерживаться следующей
последовательности действий.
Перед формулой горючего вещества всегда
ставится коэффициент 1, так как все
расчеты ведут на 1 моль горючего вещества;
Перед формулой углекислого газа ставится
коэффициент равный количеству атомов
углерода в молекуле горючего вещества.
Уравниваются атомы элементов, входящих
в состав молекул горючего вещества, за
исключением Н, О и N.
Уравниваются атомы водорода, учитывая
их содержание в молекулах галогеноуглеводородов
и воды.
Уравниваются атомы кислорода, рассчитав
их количество в правой части уравнения
и учитывая атомы кислорода, содержащиеся
в молекуле горючего вещества.
Коэффициент, поставленный перед молекулой
кислорода, переносим в правую часть
уравнения и ставим перед 3,76N2.
Уравниваем атомы азота, содержащиеся
в молекуле горючего вещества.
Рассмотрим несколько примеров составления
реакций горения веществ в воздухе, в
которых использованы описанные выше
правила.
Пример
1. Составить
уравнение реакции горения С6Н4N2О4
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С6Н4N2О4
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С6Н4N2О4
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ N2
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, кислород
вошел в состав воды и углекислого газа,
азот выделился в свободном виде – N2.
Азот, содержащийся в воздухе, также не
участвует в реакции горения и выделяется
в неизменном виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ N2
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 6, равный количеству
атомов углерода в молекуле горючего
вещества:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ N2
+ 3,76 N2
в) Уравниваем элементы, входящие в состав
молекулы горючего вещества, за исключением
Н и О. В данном случае уравниваем атомы
азота. В состав горючего вещества входят
два атома азота. В составе выделившейся
молекулы азота тоже два атома, поэтому
перед молекулой азота в продуктах
реакции ставим коэффициент 1:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ 1N2
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества четыре атома
водорода. В состав молекулы воды входит
только два атома. Следовательно, перед
формулой воды ставим коэффициент 2:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе шести молекул углекислого
газа: 6 ∙ 2 = 12;
в составе двух молекул воды: 2 ∙ 1 = 2;
итого: 12 + 2 = 14 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества имеется 4 атома
кислорода. Вычитаем это число из
количества атомов кислорода в правой
части уравнения (14 – 4 = 10). Затем делим
полученное число на 2 (количество атомов
водорода в Н2О) (10/2 = 5) и ставим
полученный коэффициент перед воздухом:
1С6Н4N2О4
+ 5(О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 3,76 N2
е) коэффициент 5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1С6Н4N2О4
+ 5(О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 5
∙ 3,76
N2
Чтобы
убедиться в правильности составленного
уравнения реакции горения, рассчитаем
количество одинаковых атомов в его
правой и левой частях:
С
– слева 6, справа 6 ∙
1 = 6;
Н
– слева 4, справа 2 ∙ 2 = 4;
N
– слева: в горючем веществе 2, в воздухе
5∙ 3,76 = 18,8, итого 20,8;
справа
2 + 5∙ 3,76 = 20,8;
О
– слева: в горючем веществе 4, в воздухе
5 ∙ 2 = 10, итого 14;
справа:
в углекислом газе 6 ∙ 2 = 12, в воде 2 ∙ 1 =
2, итого 14.
Вывод:
уравнение реакции горения составлено
верно.
Пример
2. Составить
уравнение реакции горения пара-дихлорбензола
С4Н4Сl2
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С4Н4Сl2
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С4Н4Сl2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ HCl
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, хлор
превратился в хлороводород. Азот,
содержащийся в воздухе, не участвует в
реакции горения и выделяется в неизменном
виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
С4Н4Сl2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ HCl
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 4, равный количеству
атомов углерода в молекуле горючего
вещества:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ Н2О
+ HCl
+ 3,76 N2
в) Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае уравниваем атомы
хлора. В состав горючего вещества входят
два атома хлора. В составе выделившейся
молекулы хлороводорода один атом Cl,
поэтому перед молекулой хлороводорода
в продуктах реакции ставим коэффициент
2:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ Н2О
+ 2HCl
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества четыре атома
водорода. Из них два атома водорода уже
вошли в состав двух молекул хлороводорода.
Оставшиеся два атома Н перейдут в состав
молекулы Н2О. Следовательно, перед
молекулой воды ставим коэффициент 1:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе четыре молекул углекислого
газа: 4 ∙ 2 = 8;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 8 + 1 = 9 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества нет атомов кислорода.
Следовательно, делим количество атомов
кислорода в правой части уравнения на
2 (9 /2 = 4,5) и ставим полученный коэффициент
перед воздухом:
1С4Н4Сl2
+ 4,5(О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 3,76 N2
е) коэффициент 4,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1С4Н4Сl2
+ 4,5(О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 4,5
∙ 3,76 N2
Пример
3. Составить
уравнение реакции горения ацетилена
С2Н2
в
воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С2Н2
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С2Н2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду. Азот,
содержащийся в воздухе, не участвует в
реакции горения и выделяется в неизменном
виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
С2Н2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 2, равный количеству
атомов углерода в молекуле ацетилена:
1
С2Н2
+ (О2
+ 3,76 N2)
→ 2СО2
+ Н2О
+ 3,76 N2
в)
Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае таких элементов нет.
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества – два атома
водорода. В состав молекулы воды входит
также два атома водорода. Следовательно,
перед молекулой воды ставим коэффициент
1:
1
С2Н2
+ (О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+
3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе двух молекул углекислого
газа: 2 ∙ 2 = 4;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 4 + 1 = 5 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества нет атомов кислорода,
следовательно, делим количество атомов
кислорода в правой части уравнения на
2 (5/2 = 2,5) и ставим данный коэффициент
перед воздухом:
1
С2Н2
+ 2,5(О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+ 3,76 N2
е) коэффициент 2,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1
С2Н2
+ 2,5(О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+ 2,5
∙ 3,76 N2
Пример
4. Составить
уравнение реакции горения C6Н8SО3
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
C6Н8SО3
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
C6Н8SО3
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ SO2
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, кислород
вошел в состав воды и углекислого газа,
сера образовала оксид SO2.
Азот воздуха не участвует в реакции
горения и выделяется в неизменном виде
– 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ SO2
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 6, равный количеству
атомов углерода в молекуле горючего
вещества:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ SO2
+ 3,76 N2
в)
Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае уравниваем атомы
серы. В состав молекулы горючего вещества
входит один атом серы. В составе
выделившейся молекулы SO2
тоже один
атом, поэтому перед молекулой SO2
в продуктах реакции ставим коэффициент
1:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ 1SO2
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества восемь
атомов водорода, а в состав молекулы
воды входит только два атома. Следовательно,
перед молекулой воды ставим коэффициент
4:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе шести молекул углекислого
газа: 6 ∙ 2 = 12;
в составе четырех молекул воды: 4 ∙ 1 =
4;
в составе одной молекулы оксида серы:
1∙ 2 = 2
итого: 12 + 4 + 2 = 18 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества имеется 3 атома
кислорода. Вычитаем это число из
количества атомов кислорода в правой
части уравнения (18 – 3 = 15). Делим полученное
число на 2 (15 /2 = 7,5) и ставим данный
коэффициент перед воздухом:
1
C6Н8SО3
+ 7,5(О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+ 3,76 N2
е) коэффициент 7,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1
C6Н8SО3
+ 7,5(О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+7,5
∙ 3,76 N2.
Многообразие реакций горения не
исчерпывается рассмотренными в данном
разделе примерами. Однако, используя
описанные правила, можно самостоятельно
составить реакцию горения многих других
горючих веществ. Написание уравнений
реакций горения является важной составной
частью при решении многих задач в курсе
«Теория горения и взрыва».
- Учебники
- 8 класс
- Химия 👍
- Габриелян
- №4
авторы: Габриелян, Сладков, Остроумов.
издательство: “Просвещение”
Раздел:
- ГЛАВА 1. Первоначальные химические понятия
- ГЛАВА 2. Важнейшие представители неорганических веществ. Количественные отношения в химии
- §13. Кислород
- Часть II
Запишите уравнения реакций горения сложных веществв:
а) сероводорода $H_{2}S$
б) серокглерода $CS_{2}$
в) этана $C_{2}H_{6}$
г) ацетилена $C_{2}H_{2}$
reshalka.com
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §13. Часть II. Номер №4
Решение а
$2H_{2}S + 2O_{2} = SO_{2} + 2H_{2}O$
Решение б
$CS_{2} + 3O_{2} = 2SO_{2} + CO_{2}$
Решение в
$2C_{2}H_{6} + 7O_{2} = 4CO_{2} + 6H_{2}O$
Решение г
$2C_{2}H_{2} + 5O_{2} = 4CO_{2} + 2H_{2}O$
- Предыдущее
- Следующее
Нашли ошибку?
Если Вы нашли ошибку, неточность или просто не согласны с ответом, пожалуйста сообщите нам об этом

Химия, опубликовано 2018-08-22 03:45:12 by Гость
Составьте уравнения реакций горения сложных веществ: а) сероводорода H2S; б) сульфида цинка ZnS; в) метана CH4; г) ацетилена C2H2; д) сероуглерода CS2; е) бензола C6H6.

Ответ оставил Гость
1)2H₂S+ O₂->2H₂O+2S
2)2ZnS+3O₂->2ZnO+2SO₂
3)CH₄+2O₂-> CO₂+2H₂O
4)2C₂H₂+5O₂->4CO₂+2H₂O
5) CS₂+3O₂->CO₂+2SO₂
6)2C₆H₆+ 15O₂-> 12CO₂+6H₂O

Не нашли ответа?
Если вы не нашли ответа на свой вопрос, или сомневаетесь в его правильности, то можете воспользоваться формой ниже и уточнить решение. Или воспользуйтесь формой поиска и найдите похожие ответы по предмету Химия.