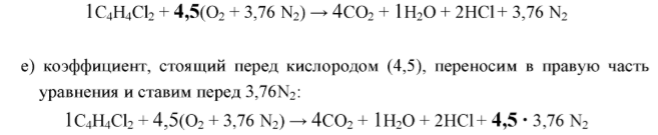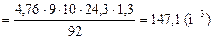При решении практически всех задач по
дисциплине “Теория горения и взрыва”
необходимо составить уравнение реакции
горения. Поэтому очень важно научиться
делать это правильно. Изучите изложенные
ниже правила составления уравнений
реакции горения, разберите примеры.
Правило № 1. В левой части уравнения
записываем горючее вещество и окислитель
[воздух в виде (O2 + 3,76N2)].
Правило № 2. В правой части уравнения
записываем продукты реакции горения,
учитывая, что:
углерод (С), содержащийся в горючем
веществе, превращается в CO2,
сера (S), содержащаяся
в горючем веществе, превращается в SO2,
фосфор (Р), содержащийся в горючем
веществе, превращается в P2O5,
водород (Н), содержащийся в горючем
веществе, превращается в H2O,
хлор (Cl), содержащийся
в горючем веществе, превращается в HCl,
фтор (F), содержащийся
в горючем веществе, превращается в HF,
бром (Br), содержащийся
в горючем веществе, превращается в HBr,
йод (I), содержащийся
в горючем веществе, превращается в HI,
кислород (О), содержащийся в горючем
веществе, входит в состав образующихся
оксидов (CO2,
SO2,
H2O)
как и кислород воздуха.
азот (N), при температуре
горения ниже 2000 оС не вступает в
реакцию. Поскольку, в условиях реального
пожара температура не превышает значения
1500 – 1600 оС, то принимают, что азот
выделяется в свободном виде (N2).
Следовательно 3,76 молей N2
из воздуха переходят в неизменном виде
в продукты горения.
Если горючее вещество содержит другие
элементы, то они переходят в высшие
оксиды, как указанные выше углерод,
водород и фосфор.
Правило
№ 3. Атомы
кислорода, входящие в состав молекул
горючего вещества (например, C2H6OS
– 2-тиолэтанол), участвуют в реакции
горения в качестве окислителя, как
кислород воздуха.
Правило № 4. Уравниваем реакцию
горения для того, чтобы в исходных
веществах (левая часть уравнения) и
получившихся из них продуктах реакции
(правая часть уравнения) содержалось
одинаковое количество атомов данного
вида. При подсчете количества атомов
данного вида стехиометрические
коэффициенты и индексы, указывающие
количество атомов в молекуле, перемножаются.
Рекомендуется придерживаться следующей
последовательности действий.
Перед формулой горючего вещества всегда
ставится коэффициент 1, так как все
расчеты ведут на 1 моль горючего вещества;
Перед формулой углекислого газа ставится
коэффициент равный количеству атомов
углерода в молекуле горючего вещества.
Уравниваются атомы элементов, входящих
в состав молекул горючего вещества, за
исключением Н, О и N.
Уравниваются атомы водорода, учитывая
их содержание в молекулах галогеноуглеводородов
и воды.
Уравниваются атомы кислорода, рассчитав
их количество в правой части уравнения
и учитывая атомы кислорода, содержащиеся
в молекуле горючего вещества.
Коэффициент, поставленный перед молекулой
кислорода, переносим в правую часть
уравнения и ставим перед 3,76N2.
Уравниваем атомы азота, содержащиеся
в молекуле горючего вещества.
Рассмотрим несколько примеров составления
реакций горения веществ в воздухе, в
которых использованы описанные выше
правила.
Пример
1. Составить
уравнение реакции горения С6Н4N2О4
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С6Н4N2О4
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С6Н4N2О4
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ N2
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, кислород
вошел в состав воды и углекислого газа,
азот выделился в свободном виде – N2.
Азот, содержащийся в воздухе, также не
участвует в реакции горения и выделяется
в неизменном виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ N2
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 6, равный количеству
атомов углерода в молекуле горючего
вещества:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ N2
+ 3,76 N2
в) Уравниваем элементы, входящие в состав
молекулы горючего вещества, за исключением
Н и О. В данном случае уравниваем атомы
азота. В состав горючего вещества входят
два атома азота. В составе выделившейся
молекулы азота тоже два атома, поэтому
перед молекулой азота в продуктах
реакции ставим коэффициент 1:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ 1N2
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества четыре атома
водорода. В состав молекулы воды входит
только два атома. Следовательно, перед
формулой воды ставим коэффициент 2:
1С6Н4N2О4
+ (О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе шести молекул углекислого
газа: 6 ∙ 2 = 12;
в составе двух молекул воды: 2 ∙ 1 = 2;
итого: 12 + 2 = 14 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества имеется 4 атома
кислорода. Вычитаем это число из
количества атомов кислорода в правой
части уравнения (14 – 4 = 10). Затем делим
полученное число на 2 (количество атомов
водорода в Н2О) (10/2 = 5) и ставим
полученный коэффициент перед воздухом:
1С6Н4N2О4
+ 5(О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 3,76 N2
е) коэффициент 5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1С6Н4N2О4
+ 5(О2
+ 3,76 N2)
→ 6СО2
+ 2Н2О
+ 1N2
+ 5
∙ 3,76
N2
Чтобы
убедиться в правильности составленного
уравнения реакции горения, рассчитаем
количество одинаковых атомов в его
правой и левой частях:
С
– слева 6, справа 6 ∙
1 = 6;
Н
– слева 4, справа 2 ∙ 2 = 4;
N
– слева: в горючем веществе 2, в воздухе
5∙ 3,76 = 18,8, итого 20,8;
справа
2 + 5∙ 3,76 = 20,8;
О
– слева: в горючем веществе 4, в воздухе
5 ∙ 2 = 10, итого 14;
справа:
в углекислом газе 6 ∙ 2 = 12, в воде 2 ∙ 1 =
2, итого 14.
Вывод:
уравнение реакции горения составлено
верно.
Пример
2. Составить
уравнение реакции горения пара-дихлорбензола
С4Н4Сl2
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С4Н4Сl2
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С4Н4Сl2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ HCl
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, хлор
превратился в хлороводород. Азот,
содержащийся в воздухе, не участвует в
реакции горения и выделяется в неизменном
виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
С4Н4Сl2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ HCl
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 4, равный количеству
атомов углерода в молекуле горючего
вещества:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ Н2О
+ HCl
+ 3,76 N2
в) Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае уравниваем атомы
хлора. В состав горючего вещества входят
два атома хлора. В составе выделившейся
молекулы хлороводорода один атом Cl,
поэтому перед молекулой хлороводорода
в продуктах реакции ставим коэффициент
2:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ Н2О
+ 2HCl
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества четыре атома
водорода. Из них два атома водорода уже
вошли в состав двух молекул хлороводорода.
Оставшиеся два атома Н перейдут в состав
молекулы Н2О. Следовательно, перед
молекулой воды ставим коэффициент 1:
1С4Н4Сl2
+ (О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе четыре молекул углекислого
газа: 4 ∙ 2 = 8;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 8 + 1 = 9 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества нет атомов кислорода.
Следовательно, делим количество атомов
кислорода в правой части уравнения на
2 (9 /2 = 4,5) и ставим полученный коэффициент
перед воздухом:
1С4Н4Сl2
+ 4,5(О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 3,76 N2
е) коэффициент 4,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1С4Н4Сl2
+ 4,5(О2
+ 3,76 N2)
→ 4СО2
+ 1Н2О
+ 2HCl
+ 4,5
∙ 3,76 N2
Пример
3. Составить
уравнение реакции горения ацетилена
С2Н2
в
воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
С2Н2
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
С2Н2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду. Азот,
содержащийся в воздухе, не участвует в
реакции горения и выделяется в неизменном
виде – 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
С2Н2
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 2, равный количеству
атомов углерода в молекуле ацетилена:
1
С2Н2
+ (О2
+ 3,76 N2)
→ 2СО2
+ Н2О
+ 3,76 N2
в)
Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае таких элементов нет.
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества – два атома
водорода. В состав молекулы воды входит
также два атома водорода. Следовательно,
перед молекулой воды ставим коэффициент
1:
1
С2Н2
+ (О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+
3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе двух молекул углекислого
газа: 2 ∙ 2 = 4;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 4 + 1 = 5 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества нет атомов кислорода,
следовательно, делим количество атомов
кислорода в правой части уравнения на
2 (5/2 = 2,5) и ставим данный коэффициент
перед воздухом:
1
С2Н2
+ 2,5(О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+ 3,76 N2
е) коэффициент 2,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1
С2Н2
+ 2,5(О2
+ 3,76 N2)
→ 2СО2
+ 1Н2О
+ 2,5
∙ 3,76 N2
Пример
4. Составить
уравнение реакции горения C6Н8SО3
в воздухе.
Решение.
-
В
левой части уравнения записываем
формулу горючего вещества плюс воздух:
C6Н8SО3
+ (О2
+ 3,76 N2)
2.
В правой части уравнения записываем
продукты реакции горения, основываясь
на составе молекулы горючего вещества
(правило 2):
C6Н8SО3
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ SO2
+ 3,76 N2
Таким
образом, углерод (С), содержащийся в
горючем веществе, перешел в СО2,
водород превратился в воду, кислород
вошел в состав воды и углекислого газа,
сера образовала оксид SO2.
Азот воздуха не участвует в реакции
горения и выделяется в неизменном виде
– 3,76 N2.
3.
Уравниваем реакцию горения.
а) Перед формулой горючего вещества
всегда ставится коэффициент 1:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ СО2
+ Н2О
+ SO2
+ 3,76 N2
б) Перед формулой углекислого газа
ставим коэффициент 6, равный количеству
атомов углерода в молекуле горючего
вещества:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ SO2
+ 3,76 N2
в)
Уравниваем элементы, входящие в состав
горючего вещества, за исключением Н и
О. В данном случае уравниваем атомы
серы. В состав молекулы горючего вещества
входит один атом серы. В составе
выделившейся молекулы SO2
тоже один
атом, поэтому перед молекулой SO2
в продуктах реакции ставим коэффициент
1:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ Н2О
+ 1SO2
+ 3,76 N2
г) Уравниваем атомы водорода. В составе
молекулы горючего вещества восемь
атомов водорода, а в состав молекулы
воды входит только два атома. Следовательно,
перед молекулой воды ставим коэффициент
4:
1
C6Н8SО3
+ (О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+ 3,76 N2
д) Уравниваем атомы кислорода. Для этого
рассчитываем число атомов кислорода в
правой части уравнения:
в составе шести молекул углекислого
газа: 6 ∙ 2 = 12;
в составе четырех молекул воды: 4 ∙ 1 =
4;
в составе одной молекулы оксида серы:
1∙ 2 = 2
итого: 12 + 4 + 2 = 18 атомов кислорода.
Рассчитываем число атомов кислорода в
левой части уравнения. В составе молекулы
горючего вещества имеется 3 атома
кислорода. Вычитаем это число из
количества атомов кислорода в правой
части уравнения (18 – 3 = 15). Делим полученное
число на 2 (15 /2 = 7,5) и ставим данный
коэффициент перед воздухом:
1
C6Н8SО3
+ 7,5(О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+ 3,76 N2
е) коэффициент 7,5, поставленный перед
воздухом, ставим перед 3,76N2
в правой части уравнения:
1
C6Н8SО3
+ 7,5(О2
+ 3,76 N2)
→ 6СО2
+ 4Н2О
+ 1SO2
+7,5
∙ 3,76 N2.
Многообразие реакций горения не
исчерпывается рассмотренными в данном
разделе примерами. Однако, используя
описанные правила, можно самостоятельно
составить реакцию горения многих других
горючих веществ. Написание уравнений
реакций горения является важной составной
частью при решении многих задач в курсе
«Теория горения и взрыва».
Правило № 1.
В левой части уравнения записываем горючее вещество и воздух в виде:
Правило № 2.
В правой части уравнения записываем продукты реакции горения, учитывая, что:
Правило № 3.
Уравниваем реакцию горения для того, чтобы в исходных веществах и получившихся из них продуктах реакции содержалось одинаковое количество одинаковых атомов. При этом коэффициенты и индексы перемножаются:
Правило № 4.
Кислород, входящий в состав горючего вещества, например,
участвует в реакции горения, как и кислород воздуха, в качестве окислителя.
СОСТАВЛЕНИЕ УРАВНЕНИЙ РЕАКЦИЙ ГОРЕНИЯ ВЕЩЕСТВ В ВОЗДУХЕ
Горением называется сложный физико-химический процесс, представляющий собой окислительно-восстановительную реакцию между горючим веществом и окислителем, сопровождающийся выделением тепла и излучением света. Для горения необходимо наличие трёх составляющих: горючего вещества; окислителя (кислород воздуха, озон, перекись водорода, галогены, перманганат калия, хромовый ангидрид и т. д.) и благоприятствующего фактора (источник зажигания; физико-химический или биологический процесс, протекающий с выделением тепла, нагретая поверхность).
С точки зрения электронной теории, горение – это перераспределение валентных электронов между горючим веществом и окислителем.
Горючим веществом называется вещество, атомы (молекулы) которого способны отдавать в процессе реакции свои валентные электроны. Горючее вещество в процессе реакции окисляется, образуя продукты окисления.
Окислителем называется вещество, атомы (молекулы) которого способны присоединять валентные электроны в процессе реакции. Окислитель в ходе реакции восстанавливается.
Процесс горения как одна из форм химического взаимодействия атомов и молекул может по-настоящему понятен только на основе изучения молекулярно-кинетической теории строения материи. Необходимо представлять, что в химических процессах, прежде чем образуются новые молекулы, разрушаются старые. Энергия, необходимая для разрыва связей в молекулах горючего и окислителя, называется энергией активации. Разрушение или ослабление химических связей в молекулах происходит под действием теплового движения атомов. Чем выше температура, тем выше доля активных молекул, тем эффективнее соударения и больше их число. Для реакции горения, как и для многих других химических реакций, справедливо положение: повышение температуры на 10 о С приводит к увеличению её скорости в 2–4 раза (правило Вант-Гоффа). Кроме того, скорость реакции согласно закону действующих масс увеличивается с возрастанием концентрации реагентов. Скорость горения максимальна при стехиометрическом составе смеси – когда отношение реагентов соответствует коэффициентам в уравнении реакции.
В условиях пожара горение чаще всего протекает в среде воздуха. При составлении уравнения материального баланса процессов горения принято учитывать не только кислород, принимающий участие в реакции окисления, но и азот, входящий в состав воздуха. Воздух состоит из азота, кислорода, водорода, углекислого и инертных газов. При ведении теоретических расчётов водород, углекислый газ и инертные газы (их вместе взятых в воздухе около 1 %) причисляют к азоту, которого в воздухе 78 %. Поэтому можно принять, что воздух состоит из 21 % кислорода и 79 % азота. Не трудно установить, что на 1 объём кислорода в воздухе приходится 3,76 объёма азота (79 : 21 = 3,76) или на 1 моль кислорода приходится 3,76 моля азота и, таким образом, состав воздуха в уравнениях реакций горения – (О2 + 3,76 N2).
В реакции горения принимает участие только кислород. Азот в реакцию не вступает и выделяется из зоны горения вместе с продуктами горения. В левой части уравнения реакции горения записывают горючее вещество и воздух, в правой части – продукты горения. При уравнивании левой и правой частей уравнения реакции горения коэффициент перед горючим веществом для упрощения расчётов параметров процесса горения, как правило, не ставят, т.е. принимают равным единице, в связи с чем коэффициент перед воздухом может получаться дробным.
Для решения задач по определению основных параметров, характеризующих процесс горения, необходимо уметь составлять уравнения реакций горения горючих веществ в воздухе.
Обобщённая запись брутто-уравнения материального баланса реакции горения имеет вид:
где nг.в, nо, nпгi – стехиометрические коэффициенты при соответствующих веществах: [г.в.] – горючее вещество, [о] – окислитель, [пг] – продукты горения.
Данное уравнение является обобщённым выражением материального баланса любой химической реакции окисления. Оно не несёт информации о промежуточных стадиях процесса, которых может быть великое множество, а выражает только начальное и конечное состояние системы. Поэтому его называют также суммарным или брутто-уравнением реакции горения. Для решения многих инженерно-технических задач этого уравнения бывает достаточно.
Рассмотрим примеры составления уравнений реакций горения горючих веществ в воздухе.
ПРИМЕР: Составить уравнение реакции горения пропана (С3Н8) в воздухе.
При горении углеводородов в воздухе продуктами горения будут углекислый газ (СО2), пары воды (Н2О) и азот (N2) из воздуха:
Уравняем эту реакцию, в результате чего число атомов каждого элемента в правой части уравнения будет равно числу атомов этих элементов в левой части.
Углерода в молекуле пропана 3 атома, следовательно, в продуктах горения образуется 3 молекулы углекислого газа. Атомов водорода в молекуле пропана 8, следовательно, в продуктах горения образуется 4 молекулы воды, так как в молекуле Н2О два атома водорода (8: 2 = 4). В последнюю очередь уравнивается число атомов кислорода. Подсчитываем число атомов кислорода в правой части уравнения: число атомов кислорода в 3 молекулах СО2 равно 6 (3 * 2 =6); число атомов кислорода в 4 молекулах воды равно 4 (4 * 1 = 4). Всего в правой части получается 10 атомов кислорода (6 + 4 = 10), следовательно, в левой части перед скобкой мы должны поставить коэффициент равный 5 (10 : 2 = 5), т. к. в молекуле кислорода 2 атома. Коэффициент перед азотом в продуктах горения будет равен коэффициенту перед скобкой воздуха, умноженному на 3,76.
Окончательная запись уравнения реакции горения пропана в воздухе имеет вид:
Коэффициент, стоящий перед скобкой воздуха, называется стехиометрическим коэффициентом реакции горения и обозначается β. В нашем случае β = 8.
При горении кислородосодержащих соединений в воздухе уравнивание реакции происходит аналогично. Однако при уравнивании атомов кислорода нужно учесть количество атомов кислорода, содержащихся в горючем веществе, которые тоже участвуют в реакции.
Для этого из количества атомов кислорода в правой части уравнения реакции нужно вычесть количество атомов кислорода, содержащихся в горючем веществе, а потом уже делить на 2.
ПРИМЕР: Составить уравнение реакции горения пропилового спирта в воздухе.
Углерода в молекуле пропилового спирта 3 атома, следовательно, в продуктах горения образуется 3 молекулы углекислого газа. Атомов водорода в молекуле 8, следовательно, в продуктах горения образуется 4 молекулы воды, так как в молекуле Н2О два атома водорода (8 : 2 = 4). В последнюю очередь уравнивается число атомов кислорода. Подсчитываем число атомов кислорода в правой части уравнения: число атомов кислорода в 3 молекулах СО2 равно 6 (3 * 2 =6); число атомов кислорода в 4 молекулах воды равно 4 (4 * 1 = 4). Всего в правой части получается 10 атомов кислорода (6 + 4 = 10), следовательно, в левой части перед скобкой мы должны поставить коэффициент равный 4,5 (10 — 1 = 9; 9: 2 = 4, 5). Коэффициент перед азотом в продуктах горения будет равен коэффициенту перед скобкой воздуха, умноженному на 3, 76.
Окончательная запись уравнения реакции горения пропилового спирта в воздухе имеет вид:
Если в состав горючего вещества входит галоген и горючее вещество не содержит водород, то в продуктах горения он будет выделяться в свободном виде (Cl2, Br2 и т. д.). Если же горючее вещество содержит водород, то в продуктах горения он будет выделяться в соединении с водородом, например хлороводород (НCl).
Если в состав горючего вещества входят сера, алюминий, кремний и др., то в продуктах горения будут выделяться оксиды этих элементов (SO2, Al2O3, SiO2). При горении веществ, содержащих азот, он выделяется в виде чистого газа азота (N2) и записывается отдельно от азота, содержащегося в воздухе.
ЗАДАЧИ ДЛЯ САМОСТОЯТЕЛЬНОГО РЕШЕНИЯ
1.Написать структурные формулы,составить уравнения реакций горения горючих веществ в воздухе и рассчитать стехиометрические коэффициенты.
1.1.амилбензол, абиетиновая кислота, аллиламин;
1.2.амилдифенил, адипиновая кислота, аллилизотиоцианат;
1.3.амилен, акриловая кислота, альнафт;
1.4.амилнафталин, аллилацетат, альтакс;
1.5.амилтолуол,аллилидендиацетат,амиламин;
1.6.антрацен, аллилкапроат, амилнитрат;
1.7.аценафтен, аллиловьiй спирт, амилнитрит;
1.8.ацетилен, амилацетат, амилсульфид;
1.9.бензол,амилбутират,амилтрихлорсилан;
1.10.бутилбензол, амилксилиловый эфир, амилхлорнафталин;
1.11.бутилциклогексан, амиллаурат, аминалон;
1.12.бутилциклопетан, амилметилкетон, аминоазокраситель;
1.13.гексадекан, амилолеат, аминокапроновая кислота;
1.14.гексан, амилсалицилат, аминопеларгоновая кислота;
1.15.гексилциклопентан, амилстеарат, аминоциклогексан;
1.16.гептадекан, амилфенилметиловый эфир, ампициллин;
1.17.гептан, амнлфениловый эфир, ангинин;
1.18.декан, амилформиат, анилин;
1.19.диамилбензол, анизол, антримид;
1.20.диамилнафталин, ацеталь, атофан;
1.21.дивинилацетилен, ацетальдегид, ацеклидин;
1.22.дигидроциклопентадиен, ацетилацетон, ацетанилид;
1.23.диизобутилен, ацетисалициловая кислота, ацетилхлорид;
1.24.диизопропилбензол, ацетилтрибутилцитрат, ацетоацетанилид;
1.25.диметиленциклобутан, ацетометоксан, ацетонитрил;
1.26.дитолилметан, ацетон, ацетоксим;
1.27.дифенил, ацетонилацетон, ацетоэтиламид;
1.28.дифенилметан, ацетопропиловый спирт, бензамид;
1.29.диэтилциклогексан, ацетоуксусный эфир, бензилдиэтиламин;
1.30.додекан, ацетофенон, бензилтиол;
1.31.изобутилбензол, бензальдегид, бензилхлорид;
1.32.изобутилциклогексан, бензантрон, бензилцианид;
1.33.изооктан, бензгидрол, бензимидазол;
1.34.изопентан, бензилацетат, бензоат натрия;
1.35.изопрен, бензилбензоат, бензоилхлорид;
1.36.изопропенилбензол, бензилсалицилат, бензоксазолон;
1.37.изопропилацетилен, бензилцеллозольв, бензолсульфазид;
1.38.метилциклогексан, бензилэтиловый эфир, бензолсульфамид;
1.39.метилциклопентан, бензилянтарная кислота, бензолсульфокислота;
1.40.октилтолуол, метоксибутилацетат, бензонитрил.
2.Написать структурные формулы и определить при сгорании какого горючего вещества выделится большее число молей продуктов горения?
2.1.бензофенон и бензофенонтетракарбоновая кислота;
2.2.борнеол и бутаналь;
2.3.бутановая кислота и бутилацетат;
2.4.бутилацетилрицинолеат и бутилацетоацетат
2.5.бутилбензилсебацинат и бутилбензоат;
2.6.бутилбутират и бутилвиниловый эфир;
2.7.бутилгликоль и бутилгликольацетат;
2.8.бутилглицидный эфир и бутилдиэтиладипинат;
2.9.бутилизовалериат и бутилкапронат;
2.10.бутилкарбитол и бутиллактат;
2.11.бутиллаурат и бутилметакрилат;
2.12.бутилметилкетон и бутилолеат;
2.13.бутилпропионат и бутилрициноолеат;
2.14.бутилстеарат и бутилфениловый эфир;
2.15.бутилформиат и бутилэтилацетальдегид;
2.16.бутилэтилкетон и бутилэтиловый эфир;
2.17.валериановая кислота и валериановый альдегид;
2.18.ванилин и ветиверилацетат;
2.19.ветиверовый спирт и ветинилацетат;
2.20.ветинон и винилаллиловый эфир;
2.21.винилацетат и винилбутират;
2.22.винилизобутиловый эфир и винилизооктиловый эфир;
2.23.винилизопропиловый эфир и винилкротонат;
2.24.винилметилкетон и винилоксиэтилметакрилат;
2.25.винилоктадециловый эфир и винилпропионат;
2.26.винилтриметилнониловый эфир и винилэтиловый эфир;
2.27.винилэтиловый эфир и винная кислота;
2.28.витамин А (ацетат) и витамин С;
2.29.галловая кислота и гексаналь;
2.30.гексановая кислота и гексилацетат;
2.31.гексилбутират и гексилдиэтилгексагидрофталат;
2.32.гексилметакрилат и гексилметилкетон;
2.33.гексиловый спирт и гексилпропионат;
2.34.гексилформиат и гексилцеллозольв;
2.35.гелиотропин и гептадециловый спирт;
2.36.гептаналь и гептилацетат;
2.37.гептилбутират и гептилдифенилкетон;
2.38.гептилизобутилкетон и гептилметилкетон;
2.39.гептиловый спирт и гептилпропионат;
2.40.гептилформиат и гидрохинон.
Правила составления уравнения реакции горения
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ИВАНОВСКИЙ ИНСТИТУТ ГОСУДАРСТВЕННОЙ ПРОТИВОПОЖАРНОЙ СЛУЖБЫ МИНИСТЕРСТВА РОССИЙСКОЙ ФЕДЕРАЦИИ ПО ДЕЛАМ ГРАЖДАНСКОЙ ОБОРОНЫ, ЧРЕЗВЫЧАЙНЫМ СИТУАЦИЯМ И ЛИКВИДАЦИИ ПОСЛЕДСТВИЙ СТИХИЙНЫХ БЕДСТВИЙ»
Кафедра химии, теории горения и взрыва
Т.А Мочалова, Д.В. Батов, А.В. Петров
Теория горения и взрыва
Задания и методические указания по выполнению
Расчетно-графической работы
Иваново
Мочалова Т.А, Батов Д.В., Петров А.В. Теория горения и взрыва. Задания и методические рекомендации по выполнению расчетно-графической работы. Учебное пособие. Иваново: ООНИ ИвИ ГПС МЧС России, 2012.- 38 с.
Учебное пособие предназначено для обучающихся по специальности 280705 Пожарная безопасность и направлению подготовки 280700 Техносферная безопасность. Учебное пособие охватывает основные темы дисциплины «Теория горения и взрыва» и рассчитано на более глубокое ее усвоение. Пособие содержит варианты контрольных заданий и методические рекомендации по выполнению расчетно-графической работы по дисциплине «Теория горения и взрыва».
Печатается по решению Редакционно-издательского совета института
Рассмотрено и рекомендовано к публикации кафедрой химии, теории горения и взрыва, протокол № 7 от 22 декабря 2011 года.
Ведущий научный сотрудник ФГБУН
Институт химии растворов им. Г.А.Крестова РАН
доктор химических наук П.Р.Смирнов
кафедры физики и теплотехники
Ивановского института ГПС МЧС России
кандидат химических наук О.Е.Сторонкина
© Ивановский институт ГПС МЧС России, 2012
| Стр. |
| Список используемых сокращений |
| ВВЕДЕНИЕ |
| Общие указания по выполнению расчетно-графической работы |
| Правила составления уравнения реакции горения |
| Пример решения задач |
| Задачи для самостоятельного решения |
| Список рекомендуемой литературы |
| Приложения |
Список используемых сокращений
КПР – концентрационные пределы распространения пламени
НКПР – нижний концентрационный предел распространения пламени
ВКПР — верхний концентрационный предел распространения пламени
ТПР – температурные пределы распространения пламени
ПГ – продукты горения
ГВ – горючее вещество
Введение
В результате изучения дисциплины «Теория горения и взрыва» у обучающихся формируется теоретический фундамент для глубокого осмысления всей системы показателей пожарной опасности веществ и материалов как совокупности предельных условий и параметров возникновения и прекращения горения.
Овладение методами расчета показателей пожарной опасности веществ необходимо, прежде всего, для будущей практической деятельности: для решения вопросов обеспечения безопасности технологических процессов, зданий и сооружений, а также обеспечения пожарной безопасности людей во время пожаров.
Использование знаний о механизмах протекания горения дает возможность управлять горением на пожаре, организовывать профилактические меры против возникновения самовоспламенения, самовозгорания, воспламенения, меры по снижению интенсивности горения на пожаре, его локализации и тушению.
1. Общие указания по выполнению расчетно-графической работы
В соответствие с учебным планом обучающиеся по дисциплине «Теория горения и взрыва» обязаны выполнить расчетно-графическую работу. Расчетно-графическая работа выполняется по индивидуальному заданию.
Вариант задания выбирается по двум последним цифрам номера зачётной книжки (Приложение 1).
При необходимости преподаватель имеет право изменить вариант расчетно-графической работы обучающегося.
Расчетно-графические работы могут быть оформлены как в ученических тетрадях в объеме не более 18 листов рукописного текста, так и на листах формата А-4, в объеме не более 15 листов, компьютерным набором, ориентация книжная.
При выполнении расчетно-графической работы в ученической тетради с полями, содержащей не менее 18 листов, на титульном листе тетради должны быть указаны звание, фамилия, имя, отчество, номер зачётной книжки и номер учебной группы обучающегося. Работа выполняется аккуратно, разборчивым почерком через строчку, графики вычерчиваются при помощи линейки и карандаша. В задании должны быть представлены номер и полный текст задачи.
При выполнении расчетно-графической работы на компьютере необходимо учитывать следующие требования:
— ориентация страниц – книжная;
— на титульном листе указывается министерство, название кафедры, фамилия, инициалы обучающегося, номер учебной группы, номер варианта, должность, фамилия, инициалы преподавателя (приложение 3);
— поля: верхнее – 1 см, левое – 2 см, нижнее – 1 см, правое – 1 см;
— интервал между строками- одинарный;
— красная строка 1,5 см от левой границы текста;
— нумерация по центру листа внизу;
— шрифт Times New Roman, размер шрифта 14;
— работа скрепляется в папку-скоросшиватель.
Задание должно быть оформлено в соответствии со следующей схемой: формулировка задачи, дано, найти, решение, ответ.
При решении задач даются ссылки на использованные справочные данные и соответствующий литературный источник. Литература, используемая в процессе выполнения задания, приводится в конце работы. Список литературы составляется с учетом правил оформления библиографии (Приложение 1).
Выполненная и правильно оформленная расчетно-графическая работа сдается преподавателю. Работа, выполненная не по своему варианту, к зачету не принимается. Такая работа должна быть выполнена повторно.
Правила составления уравнения реакции горения
При решении практически всех задач по дисциплине «Теория горения и взрыва» необходимо составить уравнение реакции горения. Поэтому очень важно научиться делать это правильно. Изучите изложенные ниже правила составления уравнений реакции горения, разберите примеры.
Правило № 1. В левой части уравнения записываем горючее вещество и окислитель [воздух в виде(O2 + 3,76N2)].
Правило № 2.В правой части уравнения записываем продукты реакции горения, учитывая, что:
углерод (С), содержащийся в горючем веществе, превращается в CO2,
сера (S), содержащаяся в горючем веществе, превращается в SO2,
фосфор (Р), содержащийся в горючем веществе, превращается в P2O5,
водород (Н), содержащийся в горючем веществе, превращается в H2O,
хлор (Cl), содержащийся в горючем веществе, превращается в HCl,
фтор (F), содержащийся в горючем веществе, превращается в HF,
бром (Br), содержащийся в горючем веществе, превращается в HBr,
йод (I), содержащийся в горючем веществе, превращается в HI,
кислород (О), содержащийся в горючем веществе, входит в состав образующихся оксидов (CO2, SO2, H2O) как и кислород воздуха.
азот (N), при температуре горения ниже 2000 о С не вступает в реакцию. Поскольку, в условиях реального пожара температура не превышает значения 1500 – 1600 о С, то принимают, что азот выделяется в свободном виде (N2). Следовательно, 3,76 молей N2 из воздуха переходят в неизменном виде в продукты горения.
Если горючее вещество содержит другие элементы, то они переходят в высшие оксиды.
Правило № 3. Атомы кислорода, входящие в состав молекул горючего вещества (например, C2H6OS — 2-тиолэтанол), участвуют в реакции горения в качестве окислителя, как кислород воздуха.
Правило № 4.Расставляем коэффициенты в схеме реакции горения для того, чтобы в исходных веществах (левая часть уравнения) и получившихся из них продуктах реакции (правая часть уравнения) содержалось одинаковое количество атомов данного вида. При подсчете количества атомов данного вида стехиометрические коэффициенты и индексы, указывающие количество атомов в молекуле, перемножаются.
Рекомендуется придерживаться следующей последовательности действий.
Перед формулой горючего вещества всегда ставится коэффициент 1, так как все расчеты ведут на 1 моль горючего вещества.
Перед формулой углекислого газа ставится коэффициент равный количеству атомов углерода в молекуле горючего вещества.
Уравниваем число атомов элементов, входящих в состав молекул горючего вещества, за исключением Н, О и N.
Уравниваем число атомов водорода, учитывая их содержание в молекулах галогеноуглеводородов и воды.
Уравниваем число атомов кислорода, рассчитав их количество в правой части уравнения и учитывая атомы кислорода, содержащиеся в молекуле горючего вещества.
Коэффициент, поставленный перед молекулой кислорода, переносим в правую часть уравнения и ставим перед 3,76N2. Уравниваем число атомов азота, содержащиеся в молекуле горючего вещества.
Рассмотрим несколько примеров составления реакций горения веществ в воздухе, в которых использованы описанные выше правила.
Пример 1. Составить уравнение реакции горения С6Н4N2О4 в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, кислород вошел в состав воды и углекислого газа, азот выделился в свободном виде — N2. Азот, содержащийся в воздухе, также не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 6, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав молекулы горючего вещества, за исключением Н и О. В данном случае уравниваем число атомов азота. В состав горючего вещества входят два атома азота. В составе выделившейся молекулы азота тоже два атома, поэтому перед молекулой азота в продуктах реакции ставим коэффициент 1:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества четыре атома водорода. В состав молекулы воды входит только два атома. Следовательно, перед формулой воды ставим коэффициент 2:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе шести молекул углекислого газа: 6 ∙ 2 = 12;
в составе двух молекул воды: 2 ∙ 1 = 2;
итого: 12 + 2 = 14 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества имеется 4 атома кислорода. Вычитаем это число из количества атомов кислорода в правой части уравнения (14 – 4 = 10). Затем делим полученное число на 2 (количество атомов водорода в Н2О) (10/2 = 5) и ставим полученный коэффициент перед воздухом:
е) коэффициент 5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Чтобы убедиться в правильности составленного уравнения реакции горения, рассчитаем количество атомов одних и тех же элементов в его правой и левой частях:
С – слева 6, справа 6 ∙ 1 = 6;
Н – слева 4, справа 2 ∙ 2 = 4;
N – слева: в горючем веществе 2, в воздухе 5∙ 3,76 = 18,8, итого 20,8;
справа 2 + 5∙ 3,76 = 20,8;
О — слева: в горючем веществе 4, в воздухе 5 ∙ 2 = 10, итого 14;
справа: в углекислом газе 6 ∙ 2 = 12, в воде 2 ∙ 1 = 2, итого 14.
Вывод: уравнение реакции горения составлено верно.
Пример 2. Составить уравнение реакции горения п-дихлорбензола (С4Н4Сl2) в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, хлор превратился в хлороводород. Азот, содержащийся в воздухе, не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 4, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О, N. В данном случае уравниваем число атомов хлора. В состав горючего вещества входят два атома хлора. В составе выделившейся молекулы хлороводорода один атом Cl, поэтому перед молекулой хлороводорода в продуктах реакции ставим коэффициент 2:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества четыре атома водорода. Из них два атома водорода уже вошли в состав двух молекул хлороводорода. Оставшиеся два атома водорода перейдут в состав молекулы Н2О. Следовательно, перед молекулой воды ставим коэффициент 1:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе четырех молекул углекислого газа: 4 ∙ 2 = 8;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 8 + 1 = 9 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества нет атомов кислорода. Следовательно, делим количество атомов кислорода в правой части уравнения на 2 (9 /2 = 4,5) и ставим полученный коэффициент перед воздухом:
е) коэффициент 4,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Пример 3. Составить уравнение реакции горения ацетилена (С2Н2) в воздухе.
1. В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду. Азот, содержащийся в воздухе, не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 2, равный количеству атомов углерода в молекуле ацетилена:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О и N. В данном случае таких элементов нет.
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества — два атома водорода. В состав молекулы воды входит также два атома водорода. Следовательно, перед молекулой воды ставим коэффициент 1:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе двух молекул углекислого газа: 2 ∙ 2 = 4;
в составе одной молекулы воды: 1 ∙ 1 = 1;
итого: 4 + 1 = 5 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества нет атомов кислорода, следовательно, делим количество атомов кислорода в правой части уравнения на 2 (5/2 = 2,5) и ставим данный коэффициент перед воздухом:
е) коэффициент 2,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Пример 4. Составить уравнение реакции горения C6Н8SО3 в воздухе.
1.В левой части уравнения записываем формулу горючего вещества плюс воздух:
2. В правой части уравнения записываем продукты реакции горения, основываясь на составе молекулы горючего вещества (правило 2):
Таким образом, углерод (С), содержащийся в горючем веществе, перешел в СО2, водород превратился в воду, кислород вошел в состав воды и углекислого газа, сера образовала оксид SO2. Азот воздуха не участвует в реакции горения и выделяется в неизменном виде – 3,76 N2.
3. Расставляем коэффициенты в схеме реакции горения.
а) Перед формулой горючего вещества всегда ставится коэффициент 1:
б) Перед формулой углекислого газа ставим коэффициент 6, равный количеству атомов углерода в молекуле горючего вещества:
в) Уравниваем число атомов элементов, входящих в состав горючего вещества, за исключением Н, О и N. В данном случае уравниваем число атомов серы. В состав молекулы горючего вещества входит один атом серы. В составе выделившейся молекулы SO2 тоже один атом, поэтому перед молекулой SO2 в продуктах реакции ставим коэффициент 1:
г) Уравниваем число атомов водорода. В составе молекулы горючего вещества восемь атомов водорода, а в состав молекулы воды входит только два атома. Следовательно, перед молекулой воды ставим коэффициент 4:
д) Уравниваем число атомов кислорода. Для этого рассчитываем число атомов кислорода в правой части уравнения:
в составе шести молекул углекислого газа: 6 ∙ 2 = 12;
в составе четырех молекул воды: 4 ∙ 1 = 4;
в составе одной молекулы оксида серы: 1∙ 2 = 2
итого: 12 + 4 + 2 = 18 атомов кислорода.
Рассчитываем число атомов кислорода в левой части уравнения. В составе молекулы горючего вещества имеется 3 атома кислорода. Вычитаем это число из количества атомов кислорода в правой части уравнения (18 – 3 = 15). Делим полученное число на 2 (15 /2 = 7,5) и ставим данный коэффициент перед воздухом:
е) коэффициент 7,5, поставленный перед воздухом, ставим перед 3,76N2 в правой части уравнения:
Многообразие реакций горения не исчерпывается рассмотренными в данном разделе примерами. Однако, используя описанные правила, можно самостоятельно составить реакцию горения многих других горючих веществ. Написание уравнений реакций горения является важной составной частью при решении многих задач в курсе «Теория горения и взрыва».
Пример решения задач
Задача. Используя данные таблицы, определить показатели пожарной опасности толуола: группу горючести, температуру вспышки; концентрационные пределы распространения пламени (в % и г/м 3 ) при t = 25, 45 и 65 o C, построить график зависимости КПР от температуры; температурные пределы распространения пламени, низшую теплоту сгорания по следствию из закона Гесса; максимальное давление взрыва, тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании. Рассчитать объем воздуха, объем и процентный состав компонентов продуктов горения.
| Начальное давление, Па | Начальная температура, 0 С | Температура взрыва, 0 С. | Масса вещества, кг | Коэффициент избытка воздуха |
| 101 300 | 1,3 |
1. Составляем уравнение реакции горения толуола в воздухе (см. правила составления уравнения реакции горения) и определяем стехиометрический коэффициент β (коэффициент перед кислородом):
2. Рассчитываем объём, занимаемый 1 кмоль воздуха при заданных условиях.
3. Рассчитываем молярную массу толуола.
М (C7H8) = 12 × 7 + 1 × 8 = 92 (кг/кмоль)
4. Рассчитываем объём воздуха, необходимого для полного сгорания заданной массы толуола.

5. Определяем избыточное количество вещества кислорода и азота.




6. Рассчитываем общее количество вещества продуктов горения.
ånпг = 
ånпг = 7 + 4 + 33,84 + 2,7 + 10,2 = 57,74 (кмоль)
7. Определяем общий объём образующихся продуктов горения.

8. Определяем мольный процентный состав компонентов продуктов горения. Принимаем общее количество вещества продуктов горения за 100%, а количество вещества конкретного продукта реакции за 
Для СО2 получаем следующую пропорцию.
ånпг = 57,74 кмоль – 100%


отсюда
Аналогично находим процентное содержание оставшихся продуктов горения:
При расчете процентного содержания азота суммируем его количество перешедшее в продукты горения в результате реакции и из избытка воздуха.
9. Определяем группу горючести толуола. Для этого рассчитываем его коэффициент горючести по формуле:
где: nC, nS, nH, nN, nO, nCl, nF, nBr— соответственно число атомов углерода, серы, водорода, азота, кислорода, хлора, фтора, брома в молекуле вещества.
Если расчётное значение К £ 0 – вещество негорючее, 0 2 – вещество является горючим.
Записываем количество атомов составляющих толуол (С7Н8): nC= 7; nH= 8;
Рассчитываем коэффициент горючести:
Вывод: К > 2, следовательно, толуол – горючее вещество.
10. Определяем температуру вспышки. Для этого по справочнику [4] находим температуру кипения толуола:
Определяем температуру вспышки по формуле Элея:

Справочное значение 7 0 С [4].
11. Рассчитываем нижний и верхний концентрационный пределы распространения пламени толуола при стандартных условиях по формуле:


b — число молекул кислорода, необходимое для полного окисления молекулы горючего;
a и b — константы определяемые по табл. 2 приложения 2.
Концентрационные пределы распространения пламени при заданных условиях рассчитываются по формулам:




1550 К и 1110 К — температура горения соответственно на нижнем и верхнем концентрационных пределах распространения пламени.
Рассчитываем КПР при температуре 298 К.
Для расчета 
Для расчета 
Рассчитываем КПР при температуре Т = 273,15 + 45 = 318,15 К.
Рассчитываем КПР при температуре Т = 273,15 + 65 = 338,15 К.
Строим графики зависимостей КПР от температуры.
Из графика делаем вывод, что с увеличением температуры НКПР толуола незначительно уменьшается, ВКПР – сильно возрастает. Изменение ВКПР приблизительно в 10 раз превышает изменение НКПР. Таким образом, с ростом температуры область воспламенения паров толуола расширяется.
12. Рассчитываем концентрационные пределы распространения пламени толуола в граммах на кубометр (j / н или j / в):

Vt – объем занимаемый 1 кмоль газа при заданной температуре и давлении, м 3 /кмоль;
М – молярная масса, кг/кмоль.
Определяем мольный объем паров толуола при заданных температурах:
При Т = 298.15 К
При Т = 318.15 К
При Т = 338.15 К
Рассчитываем КПР паров толуола при заданных температурах:
При Т = 298.15 К 

При Т = 318.15 К 

При Т = 338.15 К 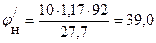

13. Определяем температурные пределы распространения пламени по уравнению Антуана:

tН(В) – нижний (верхний) температурные пределы распространения пламени;

А, В, С – константы, определяемые по таблице 10 Приложения 2.
Определяем давление насыщенного пара на нижнем и верхнем температурных пределах распространения пламени по формуле:
Из табл. 10 приложения 2 находим значения констант А, В и С для толуола:
А = 6,95508, В = 1345,087, С = 219,516
Подставляем значения в уравнение Антуана и определяем температурные пределы распространения пламени:
Справочные значения tн = 6 о С, tв = 37 о С [4].
14. Рассчитываем низшую теплоту сгорания толуола, используя следствие из закона Гесса.
Qн = [S(ni× 

Здесь ni×и 

По уравнению реакции находим, что при сгорании 1 моль толуола выделяется 7 моль углекислого газа и 4 моль воды:


Определяем по табл. 3 приложения 2 значения стандартных теплот образования горючего вещества и продуктов горения, учитывая при этом, что теплоты образования простых веществ (О2, N2) равны нулю.
Df 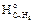
Df 
Df 
Следует иметь в виду, что существует две шкалы тепловых эффектов. В термодинамической шкале экзотермическому процессу соответствует знак минус, эндотермическому – знак плюс. В термохимической шкале знаки изменяются на противоположные. В справочной литературе используется в основном термодинамическая шкала. Однако для расчетов в курсе «Теории горения и взрыва» применяют термохимическую шкалу. Поэтому значения стандартных энтальпий образования веществ нужно подставлять в уравнение с обратным знаком.
Qн = 
15. Рассчитываем максимальное давление взрыва паров толуола при заданных условиях по формуле:
Рн – давление паровоздушной смеси до взрыва, Па;
ТВЗР – температура взрыва, К;
Тн — температура паровоздушной смеси до взрыва, К;
Snпг — число моль продуктов горения, моль;
Sncм — число моль исходной газовоздушной смеси, моль.
По уравнению реакции горения определяем число моль газов в горючей смеси до взрыва и число моль продуктов горения.
Sncм = 
ånп.г= 
Переводим начальную температуру и температуру взрыва из шкалы Цельсия в шкалу Кельвина:
Тн = 273 + 23 = 296 К
ТВЗР = 273 + 2678 = 2951 К
Рассчитываем давление взрыва паров толуола при заданных условиях.
16. Рассчитываем тротиловый эквивалент возможного аварийного взрыва паров толуола при взрыве в технологическом оборудовании по формуле:
QН — низшая теплота сгорания взрывчатого вещества, Дж/кг;
mВВ – масса горючего вещества в смеси, кг;
4520×10 3 – низшая теплота сгорания тринитротолуола (ТНТ, тротил), Дж/кг.
Согласно расчету, проведенному в п.14, низшая теплота сгорания толуола равна Qн = 3773,21 кДж/моль. Переводим ее в кДж/кг, разделив на молярную массу (92∙10 -3 кг/моль):
Рассчитываем тротиловый эквивалент возможного аварийного взрыва при взрыве в технологическом оборудовании:

8.1. Реакции горения
Реакции горения описываются т.н. стехиометрическими уравнениями, характеризующими качественно и количественно вступающие в реакцию и образующиеся в результате ее вещества. Общее уравнение реакции горения любого углеводорода
Q — тепловой эффект реакции, или теплота сгорания.
Реакции горения некоторых газов приведены в табл. 8.1. Эти уравнения являются балансовыми, и по ним нельзя судить ни о скорости реакций, ни о механизме химических превращений.
Тепловой эффект (теплотой сгорания) Q — количество теплоты, выделяющееся при полном сгорании 1 кмоля, 1 кг или 1 м3 газа при нормальных физических условиях. Различают высшую Qв и низшую Qн теплоту сгорания: высшая теплота сгорания включает в себя теплоту конденсации водяных паров в процессе горения (в реальности при сжигании газа водяные пары не конденсируются, а удаляются вместе с другими продуктами сгорания). Обычно технические расчеты обычно ведут по низшей теплоте сгорания, без учета теплоты конденсации водяных паров (около 2400 кДж/кг).
КПД, рассчитанный по низшей теплоте сгорания, формально выше, но теплота конденсации водяных паров достаточно велика, и ее использование более чем целесообразно. Подтверждение этому — активное применение в отопительной технике контактных теплообменников, весьма разнообразных по конструкции.
Для смеси горючих газов высшая (и низшая) теплота сгорания газов определяется по соотношению
где r1, r2, …, rn — объемные (молярные, массовые) доли компонентов, входящих в смесь;
Q1, Q2, …, Qn — теплота сгорания компонентов
Воспользовавшись табл. 8.1, высшую и низшую теплоту сгорания, кДж/м3, сложного газа можно определять по следующим формулам:
где H2, CO, CH4 и т. д. — содержание отдельных составляющих в газовом топливе, об. %.
Интенсивность тепловыделения и рост температуры приводят к увеличению в реагирующей системе активных частиц. Такая взаимосвязь цепного реагирования и температуры, свойственная практически всем процессам горения, привела к введению понятия цепочечно-теплового взрыва — сами химические реакции горения имеют цепной характер, а их ускорение происходит за счет выделения теплоты и роста температуры в реагирующей системе.
Скорость химической реакции в однородной смеси пропорциональна произведению концентраций реагирующих веществ:
где С1 и С2 — концентрации реагирующих компонентов, кмоль/м3;
k —константа скорости реакции, зависящая от природы реагирующих веществ и температуры.
При сжигании газа концентрации реагирующих веществ можно условно считать неизменными, так как в зоне горения происходит непрерывный приток свежих компонентов однозначного состава.
Константа скорости реакции (по уравнению Аррениуса):
где К0 — предэкспоненциальный множитель, принимаемый для биометрических гомогенных смесей, ≈1,0;
Е — энергия активации, кДж/кмоль;
R— универсальная газовая постоянная, Дж/(кг•К);
Т — абсолютная температура, К (°С);
е — основание натуральных логарифмов.
Уравнение (8.6) показывает, что скорость химических реакций резко возрастает с увеличением температуры: например, повышение температуры с 500 до 1000 К влечет повышение скорости реакции горения в 2•104÷5•108 раз (в зависимости от энергии активации).
На скорость реакций горения влияет их цепной характер. Первоначально генерируемый реакцией атомы и радикалы вступают в соединения с исходными веществами и между собой, образуя конечные продукты и новые частицы, повторяющие ту же цепь реакций. Нарастающее генерирование таких частиц приводит к «разгону» химических реакций — фактически взрыву всей смеси.
Высокотемпературное горение углеводородов имеет весьма сложный характер и связано с образованием активных частиц в виде атомов и радикалов, а также промежуточных молекулярных соединений. В качестве примера приводятся реакции горения простейшего углеводорода — метана:
источники:
http://megaobuchalka.ru/7/36497.html
http://www.fas-him.ru/info/spravochnik/gl-8/gl-8_100.html