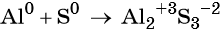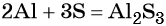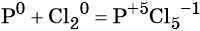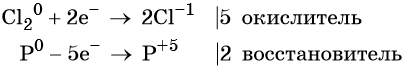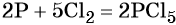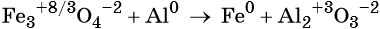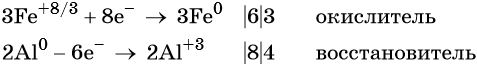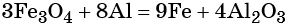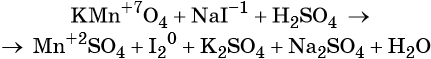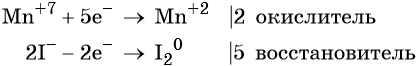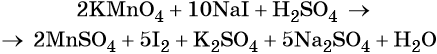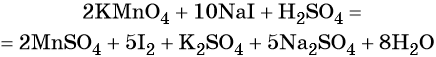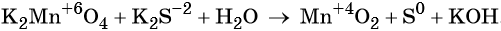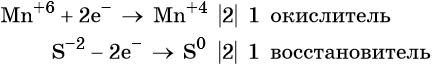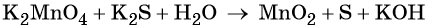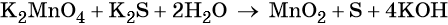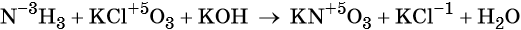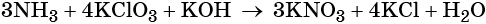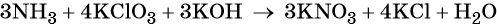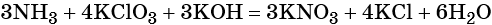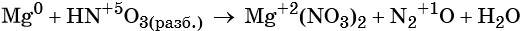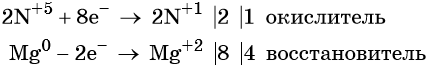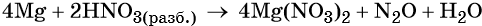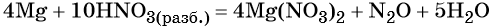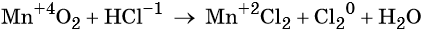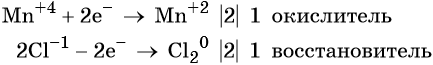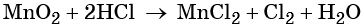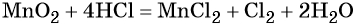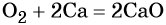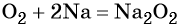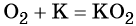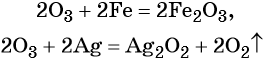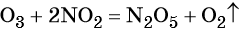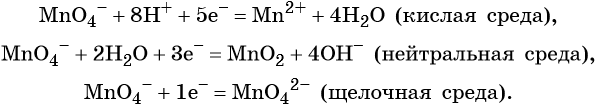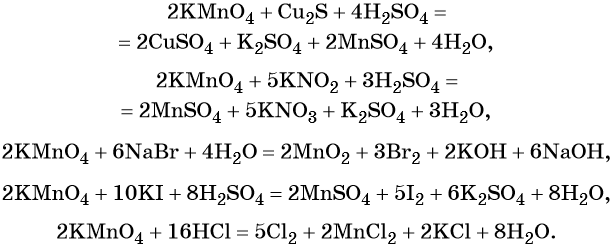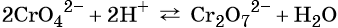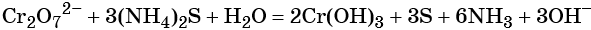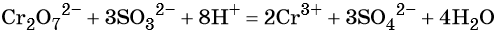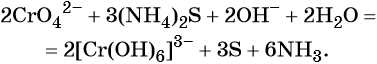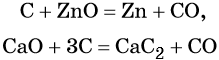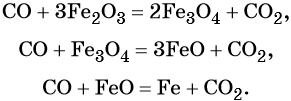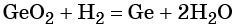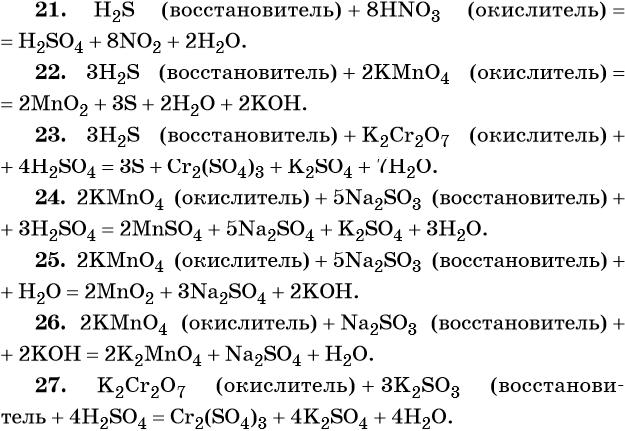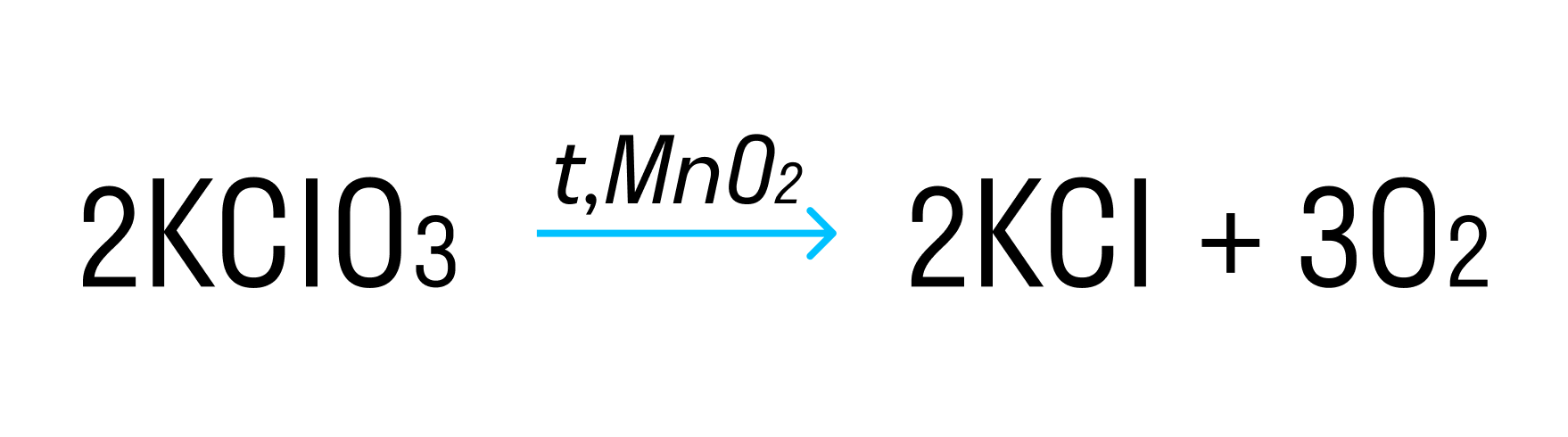Окислительно-восстановительные реакции. Окислитель и восстановитель
Окислительно-восстановительными называют реакции, которые сопровождаются изменением степеней окисления химических элементов, входящих в состав реагентов.
Окислением называют процесс отдачи электронов атомом, молекулой или ионом, который сопровождается повышением степени окисления.
Восстановлением называют процесс присоединения электронов атомом, молекулой или ионом, который сопровождается понижением степени окисления.
Окислителем называют реагент, который принимает электроны в ходе окислительно-восстановительной реакции. (Легко запомнить: окислитель — грабитель.)
Восстановителем называют реагент, который отдаёт электроны в ходе окислительно-восстановительной реакции.
Окислительно-восстановительные реакции делят на реакции межмолекулярного окисления-восстановления, реакции внутримолекулярного окисления-восстановления, реакции диспропорционирования и реакции конмутации.
Для составления окислительно-восстановительных реакций используют метод электронного баланса.
Составление уравнения окислительно-восстановительной реакции осуществляют в несколько стадий.
- Записывают схему уравнения с указанием в левой и правой частях степеней окисления атомов элементов, участвующих в процессах окисления и восстановления.
- Определяют число электронов, приобретаемых или отдаваемых атомами или ионами.
- Уравнивают число присоединённых и отданных электронов введением множителей, исходя из наименьшего кратного для коэффициентов в процессах окисления и восстановления.
- Найденные коэффициенты (их называют основными) подставляют в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Пример 1. Реакция алюминия с серой. Записываем схему реакции и указываем изменение степеней окисления:
Атом серы присоединяет два электрона, изменяя свою степень окисления от 0 до –2. Он является окислителем. Атом алюминия отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 2. Окисление фосфора хлором. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления хлора изменяется от 0 до –1, при этом молекула хлора присоединяет два электрона. Хлор является окислителем.
Атом фосфора отдаёт пять электронов, изменяя свою степень окисления от 0 до +5. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Электронное уравнение для хлора записывают именно так, поскольку окислителем является молекула хлора, состоящая из двух атомов, и каждый из этих атомов изменяет свою степень окисления от 0 до –1. Коэффициент 5 относится к молекуле хлора в левой части уравнения, а количество атомов хлора в правой части уравнения 5 × 2 = 10.
Подставляем найденные коэффициенты в уравнение реакции и окончательно получаем:
Пример 3. Восстановление оксида железа (II, III) алюминием. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления железа изменяется от +8/3 до 0, при этом три иона железа (поскольку в исходном оксиде их содержится именно три) присоединяют восемь электронов (3 × 8/3 = 8). Железо является окислителем.
Алюминий отдаёт три электрона, изменяя свою степень окисления от 0 до +3. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединенных и отданных электронов:
Электронное уравнение для алюминия записывают именно так, поскольку в состав оксида алюминия входят два атома алюминия. Таким образом, в левой части уравнения основной коэффициент перед оксидом железа (II, III) будет равен 3, а перед алюминием 4 × 2 = 8.
Количество атомов железа в правой части уравнения реакции составит 3 × 3 = 9. Количество молекул оксида алюминия будет равно 8/2 = 4. Окончательно получаем:
Проверяем баланс по кислороду. В левой части уравнения 3 × 4 = 12. В правой части уравнения 4 × 3 = 12. Таким образом, число атомов каждого элемента в отдельности в левой и в правой части химического уравнения равны между собой, и реакция уравнена правильно.
Этот пример наглядно показывает, что дробная степень окисления хотя и не имеет физического смысла, но позволяет правильно уравнять окислительно-восстановительную реакцию.
Очень часто окислительно-восстановительные реакции проходят в растворах в нейтральной, кислой или щелочной среде. В этом случае химические элементы, входящие в состав вещества, образующего среду реакции, свою степень окисления не меняют.
Пример 4. Окисление йодида натрия перманганатом калия в среде серной кислоты. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Атом марганца принимает пять электронов, изменяя свою степень окисления от +7 до +2. Перманганат калия является окислителем.
Два йодид-иона отдают два электрона, образуя молекулу I20. Йодид натрия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Найденные коэффициенты подставим в уравнение реакции перед соответствующими формулами веществ в левой и правой частях.
Серная кислота является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет, но сульфат-анион связывает выделяющиеся в результате реакции катионы калия, натрия и марганца. Подсчитаем число сульфат-ионов в правой части. Оно равно 2 + 1 + 5 = 8. Следовательно, перед серной кислотой следует поставить коэффициент 8. Число атомов водорода в левой части уравнения равно 8 × 2 = 16. Отсюда вычисляем коэффициент для воды: 16/2 = 8.
Таким образом, уравнение реакции будет иметь вид:
Правильность баланса проверяем по кислороду. В левой части его 2 × 4 = 8 (перманганат калия); в правой — 8 × 1 = 8 (вода). Следовательно, уравнение составлено правильно.
Пример 5. Окисление сульфида калия манганатом калия в водной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Ион марганца принимает два электрона, изменяя свою степень окисления от +6 до +4. Манганат калия является окислителем.
Сульфид-ион отдаёт два электрона, образуя молекулу S0. Сульфид калия является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов введением множителей:
Основные коэффициенты в уравнении реакции равны единице:
Вода является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Гидроксид-ионы связывают выделяющиеся в результате реакции катионы калия. Таких катионов четыре (2 × 2), число атомов водорода также 4 (4 × 1), поэтому перед молекулой воды ставим коэффициент два (4/2 = 2):
Пример 6. Окисление аммиака хлоратом калия в щелочной среде. Записываем схему реакции, указываем степени окисления элементов, участвующих в процессах окисления и восстановления:
Хлор принимает шесть электронов, изменяя свою степень окисления от +5 до –1. Хлорат калия является окислителем.
Азот отдаёт восемь электронов, изменяя свою степень окисления от –3 до +5. Аммиак является восстановителем.
Составляем уравнение электронного баланса, уравниваем число присоединённых и отданных электронов введением множителей, сокращаем кратные коэффициенты:
Проставляем найденные основные коэффициенты в уравнение реакции:
Гидроксид калия является средой реакции. Ни один из элементов, входящих в состав этого соединения, свою степень окисления не меняет.
Катионы калия связывают выделяющиеся в результате реакции нитрат-ионы. Таких анионов три. Следовательно, перед гидроксидом калия ставим коэффициент три:
Число атомов водорода в левой части уравнения равно девяти в аммиаке (3 × 3) = 9 и трём в гидроксиде калия (3 × 1), а их общее число 9 + 3 = 12. Следовательно, перед водой ставим коэффициент (12/2) = 6. Окончательно уравнение реакции будет иметь вид:
Убеждаемся ещё раз в правильности расстановки коэффициентов, сравнивая число атомов кислорода в левой и правой его частях. Оно равно 15.
Довольно часто одно и то же вещество одновременно является окислителем и создаёт среду реакции. Такие реакции характерны для концентрированной серной кислоты и азотной кислоты в любой концентрации. Кроме того, в подобные реакции, но в качестве восстановителя, вступают галогенводородные кислоты с сильными окислителями.
Пример 7. Окисление магния разбавленной азотной кислотой. Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления азота изменяется от +5 до +1, при этом два атома азота присоединяют восемь электронов. Азотная кислота является окислителем.
Магний отдаёт два электрона, изменяя свою степень окисления от 0 до +2. Он является восстановителем.
Составляем уравнение электронного баланса и уравниваем число присоединённых и отданных электронов:
Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 4 × 2 = 8 нитрат-ионов, не изменивших свою степень окисления. Очевидно, что для этого в правую часть уравнения реакции следует добавить ещё 8 молекул HNO3. Тогда общее количество молекул азотной кислоты в правой части уравнения составит 2 + 8 = 10.
В этих молекулах содержатся 10 × 1 = 10 атомов водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Следовательно, перед молекулой воды следует подставить коэффициент 10/2 = 5, и уравнение окончательно будет иметь вид:
Окончательно проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части 10 × 3 = 30. В правой части (2 × 3) × 4 = 24 в нитрате магния, 1 в оксиде азота (I) и 5 × 1 = 5 в молекуле воды. Итого 24 + 1 + 5 = 30. Таким образом, реакция полностью уравнена.
Пример 8. Взаимодействие соляной кислоты с оксидом марганца (IV). Записываем схему реакции и указываем изменение степеней окисления:
Степень окисления марганца изменяется от +4 до +2, при этом марганец присоединяет два электрона. Оксид марганца (IV) является окислителем.
Два хлорид-иона отдают два электрона, образуя молекулу Cl20, хлористый водород является восстановителем.
Составляем электронное уравнение и уравниваем число присоединённых и отданных электронов, сокращаем кратные коэффициенты:
При этом коэффициент 1 изначально относится к двум хлорид-ионам и к одной молекуле Cl2. Подставляем найденные коэффициенты перед окислителем и восстановителем в левой части уравнения реакции и перед продуктами окисления и восстановления в правой части уравнения реакции:
При этом в правой части уравнения реакции имеется 1 × 2 = 2 хлорид-иона, не изменивших свою степень окисления. Эти хлорид-ионы в окислительно-восстановительной реакции не участвовали. Очевидно, что для этого в правую часть уравнения реакции следует добавить 2 молекулы HCl. Тогда общее количество молекул HCl в правой части уравнения составит 2 + 2 = 4. В этих молекулах будет содержаться 4 × 1 = 4 атома водорода. Такое же количество атомов водорода должно быть и в правой части уравнения. Тогда перед молекулой воды следует подставить коэффициент 4/2 = 2, и уравнение в окончательном виде будет иметь вид:
Проверяем правильность баланса, подсчитывая число атомов кислорода в левой и правой частях уравнения. В левой части оно составляет 1 × 2 = 2 в оксиде марганца (IV), а в правой части 2 × 1 = 2 в молекуле воды. Таким образом, реакция полностью уравнена.
В качестве окислителя могут выступать нейтральные атомы и молекулы, положительно заряженные ионы металлов, сложные ионы и молекулы, содержащие атомы металлов и неметаллов в состоянии положительной степени окисления и др.
Ниже приведены сведения о некоторых наиболее распространенных окислителях, имеющих важное практическое значение.
Кислород. Сильный окислитель, окислительная способность значительно возрастает при нагревании. Кислород взаимодействует непосредственно с большинством простых веществ, кроме галогенов, благородных металлов Ag, Au, Pt и благородных газов, с образованием оксидов:
Взаимодействие натрия с кислородом приводит к пероксиду натрия:
Более активные щелочные металлы (K, Rb, Cs) при взаимодействии с кислородом дают надпероксиды типа ЭО2:
В своих соединениях кислород, как правило, проявляет степень окисления –2. Применяется кислород в химической промышленности, в различных производственных процессах в металлургической промышленности, для получения высоких температур. С участием кислорода идут многочисленные чрезвычайно важные жизненные процессы: дыхание, окисление аминокислот, жиров, углеводов. Только немногие живые организмы, называемые анаэробными, могут обходиться без кислорода.
Реакции, иллюстрирующие окислительные свойства кислорода при его взаимодействии с различными неорганическими веществами, приведены в уроке 14.
Озон. Обладает ещё большей по сравнению с кислородом окислительной способностью. Озон окисляет все металлы, за исключением золота, платины и некоторых других, при этом, как правило, образуются соответствующие высшие оксиды элементов, реже — пероксиды и озониды, например:
Озон окисляет оксиды элементов с промежуточной степенью окисления в высшие оксиды.
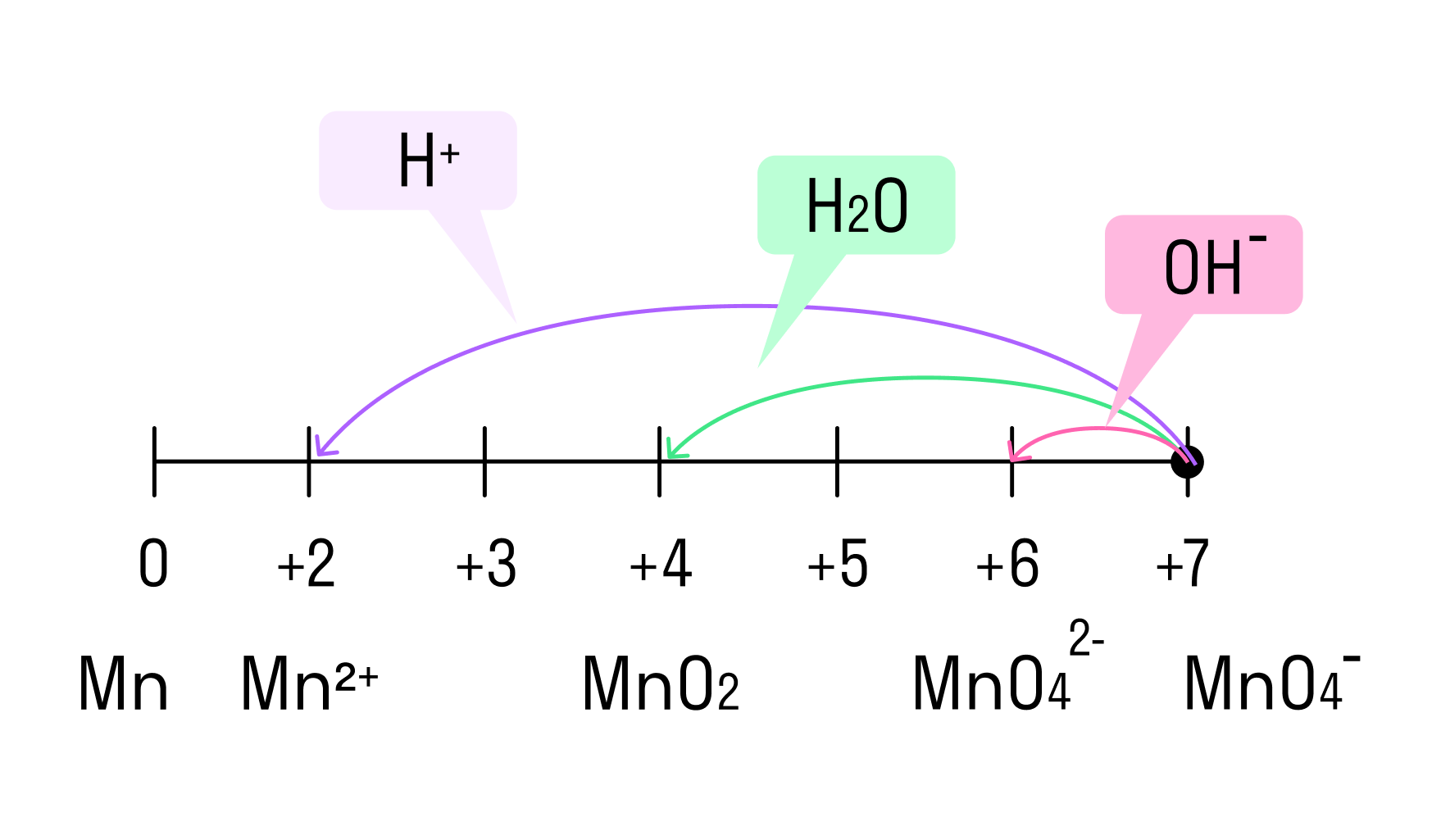
Перманганат калия. Является сильным окислителем, широко применяется в лабораторной практике. Характер восстановления перманганата калия зависит от среды, в которой протекает реакция. В кислой среде перманганат калия восстанавливается до солей Mn2+, в нейтральной или слабощелочной — до MnO2, а в сильнощелочной он переходит в манганат-ион MnO42–. Данные переходы описываются следующими уравнениями
Перманганат калия способен окислять сульфиды в сульфаты, нитриты в нитраты, бромиды и йодиды — до брома и йода, соляную кислоту до хлора и т. д.:
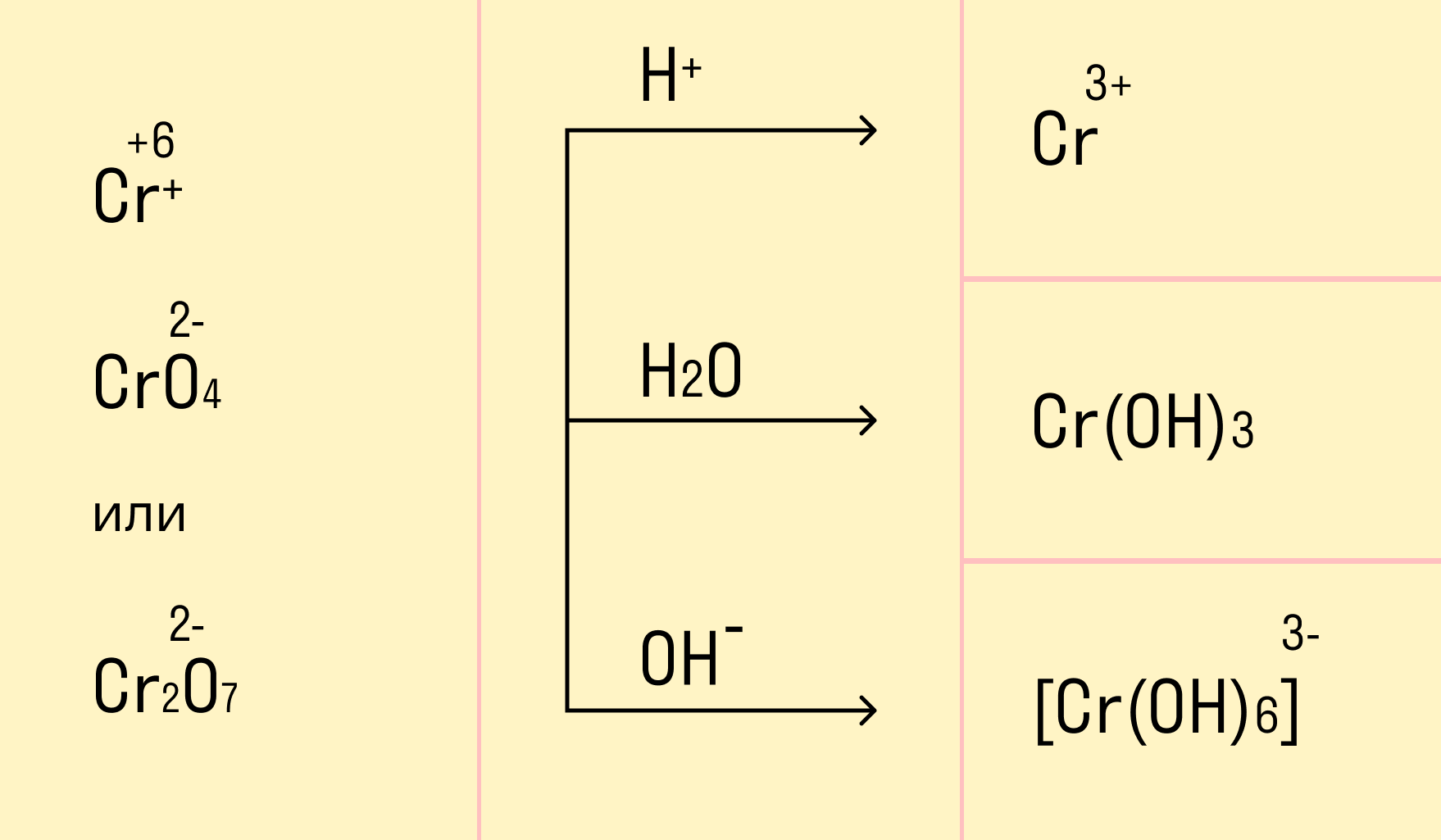
Хромат и бихромат калия. Эти соединения широко применяют в качестве окислителей в неорганических и органических синтезах. Взаимные переходы хромат- и бихромат-ионов очень легко протекают в растворах, что можно описать следующим уравнением обратимой реакции:
Соединения хрома (VI) — сильные окислители. В окислительно-восстановительных процессах они переходят в производные Cr (III). В нейтральной среде образуется гидроксид хрома (III), например:
В кислой среде образуются ионы Cr3+:
В щелочной — производные анионного комплекса [Cr(OH)6]3–:
В качестве восстановителя могут выступать нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления, электрический ток на катоде и др.
Ниже приведены сведения о некоторых наиболее распространённых восстановителях, имеющих важное практическое значение.
Углерод. Углерод широко применяют в качестве восстановителя в неорганических синтезах. При этом в качестве продуктов окисления может образовываться углекислый газ, или оксид углерода (II). При восстановлении оксидов металлов могут образовываться свободные металлы, реже — карбиды металлов.
Восстановительные свойства углерод проявляет также в реакции получения водяного газа:
Полученную смесь водорода и оксида углерода (II) широко применяют для синтеза органических соединений.
Оксид углерода (II). Широко применяют в металлургии при восстановлении металлов из их оксидов, например:
Водород. Широко применяют в качестве восстановителя в неорганических синтезах (водородотермия) для получения чистого вольфрама, молибдена, галлия, германия и т. д.:
Тренировочные задания
Используя метод электронного баланса, расставьте коэффициенты, определите окислитель и восстановитель в уравнении реакции, схема которой:
1. Al + H2O + KNO3 + KOH → K[Al(OH)4] + NH3↑.
2. KNO3 + Al → KAlO2 + Al2O3 + N2.
3. Na2O2 + H2SO4 + KMnO4 → O2↑ + MnSO4 + Na2SO4 + K2SO4 + H2O.
4. NaCl + H2SO4 + MnO2 → Cl2 + MnSO4 + Na2SO4 + H2O.
5. NaCl + H2SO4 + KMnO4 → Cl2 + MnSO4 + Na2SO4 + K2SO4 + H2O.
6. KNO2 + H2SO4 + MnO2 → MnSO4 + KNO + H2O.
7. KI + H2SO4 + KMnO4 → I2 + MnSO4 + K2SO4 + H2O.
8. KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O.
9. C + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O.
10. PbO2 + HNO3 + KI → Pb(NO3)2 + I2 + KNO3 + H2O.
11. PbO2 + HNO3 + Mn(NO3)2 → Pb(NO3)2 + HMnO4 + H2O.
12. NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + H2O.
13. KNO2 + KMnO4 + H2SO4 → KNO3 + MnSO4 + K2SO4 + H2O.
14. KNO2 + K2Cr2O7 + H2SO4 → KNO3 + Cr2(SO4)3 + K2SO4 + H2O.
15. KNO2 + KI + H2SO4 → NO + I2 + K2SO4 + H2O.
16. KNO2 + FeSO4 + H2SO4 → NO + Fe2(SO4)3 + K2SO4 + H2O.
17. Ca3(PO4)2 + C + SiO2 → CaSiO3 + P + CO.
18. Sb + HNO3 → Sb2O5 + NO2 + H2O.
19. H2O2 + H2SO4 + KMnO4 → MnSO4 + O2 + H2O + K2SO4.
20. S + HNO3 → H2SO4 + NO2 + H2O.
21. H2S + HNO3 → H2SO4 + NO2 + H2O.
22. H2S + KMnO4 → MnO2 + S + H2O + KOH.
23. H2S + K2Cr2O7 + H2SO4 → S + Cr2(SO4)3 + K2SO4 + H2O.
24. KMnO4 + Na2SO3 + H2SO4 → MnSO4 + Na2SO4 + K2SO4 + H2O.
25. KMnO4 + Na2SO3 + H2O → MnO2 + Na2SO4 + KOH.
26. KMnO4 + Na2SO3 + KOH → K2MnO4 + Na2SO4 + H2O.
27. K2Cr2O7 + K2SO3 + H2SO4 → Cr2(SO4)3 + K2SO4 + H2O.
28. H2SO4 + C → SO2 + CO2 + H2O.
29. H2SO4 + Zn → ZnSO4 + H2S + H2O.
30. H2SO4 + KBr → SO2 + Br2 + KHSO4 + H2O.
31. H2SO4 + KI → H2S + I2 + K2SO4 + H2O.
32. PbO2 + HCl → PbCl2 + Cl2 + H2O.
33. K2Cr2O7 + HCl → CrCl3 + Cl2 + KCl + H2O.
34. KMnO4 + HCl → MnCl2 + Cl2 + KCl + H2O.
35. KClO3 + HCl → KCl + Cl2 + H2O.
36. HClO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + HCl + H2O.
37. NaBrO3 + NaBr + H2SO4 → Br2 + Na2SO4 + H2O.
38. HNO3 + I2 → HIO3 + NO2 + H2O.
39. HNO3 + I2 → HIO3 + NO + H2O.
40. H2SO4 + HI → I2 + H2S + S + H2O.
41. Fe2(SO4)3 + HI → FeSO4 + I2 + H2SO4.
42. HIO3 + FeSO4 + H2SO4 → Fe2(SO4)3 + I2 + H2O.
43. NaIO3 + NaI + H2SO4 → I2 + Na2SO4 + H2O.
44. KMnO4 + Cu2O + H2SO4 → MnSO4 + CuSO4 + K2SO4 + H2O.
45. HNO3 + Cu2S → CuSO4 + Cu(NO3)2 + NO2 + H2O.
46. H2SO4 + Cu2S → CuSO4 + SO2 + H2O.
47. Ag + HNO3 → AgNO3 + NO + H2O.
48. Zn + HNO3 → Zn(NO3)2 + N2O + H2O.
49. PH3 + KMnO4 + H2SO4 → H3PO4 + MnSO4 + K2SO4 + H2O.
50. FeSO4 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O.
51. H2S + KMnO4 + H2SO4 → S + MnSO4 + K2SO4 + H2O.
52. Ca3P2 + KMnO4 + H2SO4 → CaSO4 + H3PO4 + MnSO4 + K2SO4 + H2O.
Ответы
1. Как определить окислительно-восстановительную реакцию?
Существуют различные классификации химических реакций. К одной из них относится такие, при которых вещества, вступающие во взаимодействие друг с другом (или само вещество) меняют степени окисления элементов.
В качестве примера рассмотрим две реакции:
Zn0 + 2Н+1С1-1 = Zn+2Cl2-1 + Н20 (1)
Н+1Cl-1 + К+1О-2Н+1 = К+1Cl-1 + H2+1O-2 (2)
В реакции (1) участвуют цинк и соляная кислота. Цинк и водород меняют свои степени окисления, хлор оставляет свою степень окисления неизменной:
Zn0 – 2е = Zn2+
2Н+1 + 2е = H20
2Сl-1 = 2 Сl-1
А в реакции (2), (реакция нейтрализации), хлор, водород, калий, и кислород не меняют свои степени окисления: Сl-1 = Cl-1, H+1 = H+1, К+1 = К+1, O-2 = O-2; Реакция (1) относится к окислительно-восстановительной, а реакция (2) принадлежит к другому типу.
Химические реакции, которые осуществляются с изменением степени окисления элементов, называются окислительно-восстановительными.
Для того чтобы определить окислительно-восстановительную реакцию необходимо установить степени окисления элементов в левой и в правой части уравнения. Для этого требуется знать, как определить степень окисления того или иного элемента.
В случае реакции (1) элементы Zn и Н меняют свои состояния, теряя или приобретая электроны. Цинк, отдавая 2 электрона, переходит в ионное состояние – становится катионом Zn2+. В данном случае происходит процесс восстановления и цинк окисляется. Водород приобретает 2 электрона, проявляет окислительные свойства, сам в процессе реакции восстанавливается.
2. Определение степени окисления элементов.
Степень окисления элементов в его соединениях определяется, исходя из положения, что общий суммарный заряд степеней окисления всех элементов данного соединения равен нулю. Например, в соединении Н3РО4 степени окисления у водорода +1, у фосфора +5, у кислорода -2; Составив математическое уравнение определим, что в сумме число частиц (атомов или ионов) составят заряд равный нулю: (+1)x3+(+5)+(-2)х4 = 0
Но в данном примере уже заданы степени окисления элементов. Каким же образом можно определить степень окисления cеры, например, в соединении тиосульфат натрия Na2S2O3, или марганца в соединении перманганат калия – КMnO4? Для этого необходимо знать постоянные степени окисления ряда элементов. Они имеют следующие значения:
1) Элементы I группы периодической системы (в том числе водород в соединении с неметаллами) +1;
2) Элементы II группы периодической системы +2;
3) Элементы III группы периодической системы +3;
4) Кислород (кроме в соединении со фтором или в перекисных соединениях) -2;
Исходя из этих постоянных значений степеней окисления (для натрия и кислорода) определим степень окисления серы в соединении Na2S2O3. Поскольку суммарный заряд всех степеней окисления элементов, состав которых отражает данная формула соединения, равен нулю, то обозначив неизвестный заряд у серы «2Х» (поскольку в формуле два атома серы), составим следующее математическое равенство:
(+1) х 2 + 2Х + (-2) х 3 = 0
Решая это уравнение относительно 2 х, получим
2Х= (-1) х 2 + (+2) х 3
или
Х = [(-2) + (+6)] : 2 = +2;
Следовательно, степень окисления серы в соединении Na2S2O3 равна (+2). Но неужели всегда будет необходимо пользоваться таким неудобным методом для определения степеней окисления тех или иных элементов в соединениях? Конечно же не всегда. К примеру, для бинарных соединений: оксидов, сульфидов, нитридов и т.д., можно пользоваться для определения степеней окисления так называемым методом «крест-на-крест». Допустим, дана формула соединения: оксид титана – Ti2O3. Используя простой математический анализ, исходя из того, что степень окисления кислорода нам известна и равна (-2): Ti2O3, нетрудно установить, что степень окисления у титана будет равна (+3). Или, к примеру, в соединении метан СН4 известно, что степень окисления водорода равна (+1), тогда не составляет труда определить степень окисления углерода. Она будет соответствовать в формуле этого соединения (-4). Так же, пользуясь методом «крест-на-крест», не сложно установить, что если дана следующая формула соединения Cr4Si3, то степень окисления хрома в неё равна (+3), а кремния (-4).
Для солей так же это не предоставляется затруднительным. Причём не имеет значения, дана или средняя соль или кислая соль. В данных случаях необходимо исходить из солеобразующей кислоты. К примеру, дана соль нитрат натрия (NaNO3). Известно, что она является производной азотной кислоты (НNO3), а в этом соединении степень окисления азота равна (+5), следовательно, и в её соли – нитрате натрия, степень окисления азота так же равна (+5). Гидрокарбонат натрия (NaHCO3) является кислой солью угольной кислоты (H2CO3). Так же, как и в кислоте, степень окисления углерода в этой соли будет равна (+4).
Следует отметить то обстоятельство, что степени окисления в соединениях: металлах и неметаллах (при составлении уравнения электронного баланса) равны нулю: К0, Са0, Аl0 , Н20, Cl20,N20В качестве примера приведём степени окисления наиболее типичных элементов:
Только окислителями являются вещества, имеющие максимальную, как правило положительную, степень окисления, например: КCl+7O4, H2S+6O4, K2Cr+6O4, HN+5O3, KMn+7O4. Это легко доказать. Если бы данные соединения могли быть восстановителями, то в данных состояниях они должны были бы отдавать электроны:
Cl+7– е = Cl+8
S+6 – е = S+7
Но элементы хлор и сера не могут существовать с такими степенями окисления. Аналогичным образом, только восстановителями являются вещества, имеющие минимальную, как правило, отрицательную степень окисления, например: H2S-2, HJ–, N-3H3. В процессе окислительно-восстановительных реакций такие соединения не могут быть окислителями, поскольку им пришлось бы присоединять электроны:
S-2 + е = S-3
J– + е = J-2
Но для серы и йода ионы с такими степенями окисления не характерны. Элементы с промежуточными степенями окисления, например N+1, N+4, S+4, Сl+3, С+2 могут проявлять как окислительные, так и восстановительные свойства.
3. Типы окислительно-восстановительных реакций.
Существует четыре типа окислительно-восстановительных реакций.
1) Межмолекулярные окислительно-восстановительные реакции.
Наиболее часто встречающийся тип реакций. При данных реакциях изменяются степени окисления элементов в разных молекулах, например:
2Bi+3Сl3 + 3Sn+2Cl2 = 2Bi0 + 3Sn+4Cl4
Bi+3 – 3е = Bi0
Sn+2 + 2е = Sn+4
2) Разновидностью межмолекулярных окислительно-восстановительных реакций является реакция конпропорционирования, в которой окислителем и восстановителем являются атомы одного и того же элемента: в данной реакции два атома одного элемента различными степенями окисления образуют один атом с иной степенью окисления:
SO2+4 + 2H2S-2 = 3S0 + 2Н2O
S-2 – 2е = S0
S+4 + 4е = S0
3) Реакции диспропорционирования осуществляются в случае, если окислителем и восстановителем являются атомы одного и того же элемента, или один атом элемента с одной степенью окисления образует соединение с двумя степенями окисления:
N+4O2 + NaOH = NaN+5O3+ NaN+3O2 + H2O
N+4 – е = N+5
N+4 + е = N+3
4) Внутримолекулярные окислительно-восстановительные реакции происходят в случаях, когда атом-окислитель и атом – восстановитель находятся в составе одного вещества, например:
N-3H4N+5O3 = N+12O + 2H2O
2N-3 – 8е =2N+1
2N+5 + 8е = 2N+1
4. Механизм окислительно-восстановительных реакций.
Окислительно-восстановительные реакции осуществляются за счет перехода электронов от атомов одного элемента к другому. Если атом или молекула теряет электроны, то такой процесс называется окислением, а данный атом является восстановителем, например:
Al0 – 3e = Al 3+
2Cl– – 2e = Cl20
Fe2+ – e = Fe3+
В данных примерах Al0, Cl–, Fe2+ являются восстановителями, а процессы их превращения в соединения Аl3+, Сl20, Fe3+ называются окислительными. Если атом или молекула приобретают электроны, то такой процесс называется восстановлением, а данный атом является окислителем, например:
Ca2++ 2e = Ca0
Cl20 + 2e = 2Cl–
Fe3+ + e = Fe2+
Окислителями, как правило, являются неметаллы (S, Cl2 ,F2, О2) или соединения металлов, имеющих максимальную степень окисления (Mn+7, Cr+6, Fe+3). Восстановителями являются металлы (К, Са, Аl) или соединения неметаллов, имеющих минимальную степень окисления (S-2, Сl-1 , N-3, P-3);
H2SO4 (конц.) + HJ → H2S + J2 + H2O
Прежде всего, установим, что степень окисления йода в йодистом водороде равна (-1), а серы в серной кислоте: (+6). В процессе реакции йод (-1) будет окисляться до молекулярного состояния, а сера (+6) восстанавливаться до степени окисления (-2) – сероводорода:
J–→ J02
S+6→ S-2
Чтобы составить уравнение электронного баланса необходимо учесть, что количество частиц атомов в левой и в правой частях полуреакций должно быть одинаковой
2J–→ J20
S+6 → S-2
Далее необходимо определить количество электронов, принявших участие в реакции:
2J– – 2e → J02
S+6 + 8e → S-2
Установив вертикальную черту, справа данной схемы полуреакции, определим коэффициенты реакции:
2J– – 2e → J02 |8
S+6 + 8e → S-2 |2
Сократив на «2», получим окончательные значения коэффициентов:
2J– – 2e → J02 |4
S+6 + 8e → S-2 |1
Подведем под данной схемой полуреакции горизонтальную черту и суммируем участвующее в реакции количество частиц атомов:
2J– – 2e → J02 |4
S+6 + 8e → S-2 |1
____________________
8J– + S+6 → 4 J02 + S-2
После этого необходимо расставить коэффициенты в уравнении реакции. Подставив полученные значения коэффициентов в молекулярное уравнение, приведем его к данному виду:
8HJ + H2SO4 = 4J2 + H2S + Н2O
Подсчитав количество атомов водорода в левой и правой частях уравнения, убедимся в необходимости коррекции коэффициента « 4 » перед водой, получим полное уравнение:
8HJ + H2SO4 = 4J2 + H2S + 4Н2O
Данное уравнение можно составить, используя метод электронно-ионного баланса. В этом случае отпадает необходимость в коррекции коэффициента перед молекулами воды. Уравнение составляется на основе диссоциации ионов соединений, участвующих в реакции: Например, диссоциация серной кислоты приводит к тому, что образуются два протона водорода и сульфат-анион:
H2SO4 ↔ 2H+ + SO42-
Аналогичным образом можно записать диссоциацию иодистого водорода и сероводорода:
HJ ↔ Н+ + J–
H2S ↔ 2Н+ + S2-
J2 не диссоциирует. Так же практически не диссоциирует Н2О. Составление уравнения методом полуреакции по йоду остается такой же:
2J– – 2e → J02
Полуреакция по атомам серы приобретет следующую форму:
SO4-2 → S-2
Поскольку в правой части полуреакции недостает четыре атома кислорода, то это количество необходимо сбалансировать за счет воды:
SO4-2 → S-2 + 4H2О
Тогда в левой части полуреакции необходимо компенсировать атомы водорода за счет протонов (т.к. реакция среды кислая):
SO42- + 8Н+ → S-2 + 4H2О
Подсчитав количество переходящих электронов, получим полную запись уравнения по методу полуреакций:
SO42- + 8Н+ + 8е → S-2 + 4H2О
Суммируя обе полуреакции, получим уравнение электронного баланса:
2J– – 2e → J02 |8 4
SO42- + 8Н+ + 8е → S-2 + 4H2О |2 1
_____________________________________
8J– + SO42- +8Н+ → 4J20 + S0 + 4H2O
Из данной записи следует, что метод электронно-ионного уравнения дает более полную картину окислительно-восстановительной реакции, чем метод электронного баланса.Количество электронов, участвующих в процессе, совпадает при обоих методах баланса, но в последнем случае как бы «автоматически» устанавливается количество протонов и молекул воды, участвующих в окислительно-восстановительном процессе.
Разберем несколько конкретных случаев окислительно-восстанови-тельных реакций, которые можно составить методом электронно-ионного баланса. Некоторые окислительно-восстановительные процессы осу-ществляются при участии щелочной среды, например:
KCrO2 + Br2 + KOH → KBr + K2CrO4 +H2O
В данной реакции восстановителем является хромит-ион (CrО2–), который окисляется до хромат-иона (CrO-24). Окислитель – бром (Br02) восстанавливается до бромид-иона (Br–):
СrO2– → CrO42-
Br02 → 2 Br–
Поскольку реакция происходит в щелочной среде, то первую полуреакцию необходимо составить с учетом гидроксид-ионов (OH–):
CrO2– + 4OH– – 3e = CrO2-4 + 2H2O
Вторую полуреакцию составляем уже известным способом:
CrO2– + 4OH– -3е = CrO42–+ 2H2O |2
Br02 + 2e = Br– |3
__________________________________________
2CrO2– + 3Br20 + 8OH– = 2CrO2-4 + 6Br– + 4H2O
После этого необходимо окончательно расставить коэффициенты в уравнении реакции и полностью молекулярное уравнение данного окислительно-восстановительного процесса примет вид:
2KCrO2 + 3Br2 + 8KOH = 2K2CrO4 + 6KBr + 4H2O.
В ряде случаев в окислительно-восстановительной реакции участвуют одновременно и недиссоциируемые вещества. Например:
AsH3 + HNO3 = H3AsO4 + NO2 + 4H2O
Тогда метод полуреакций составляется с учетом данного процесса:
AsH3 + 4H2O – 8e = AsO43- + 11H+ |1
NО3 + 2H+ + e = NO2 + H2O |8
________________________________________________
AsH3 + 8NО3 + 4H2O + 2H+ = AsO43- + 8NO2 + 11H+O
Молекулярное уравнение примет вид:
AsH3 + 8HNO3 = H3AsO4 + 8NO2 + 4H2O.
Окислительно-восстановительные реакции иногда сопровождаются одновременным процессом окисления-восстановления нескольких веществ. Например, в реакции с сульфидом меди взаимодействует концентрированная азотная кислота:
Cu2S + HNO3 = Cu(NO3)2 + H2SO4 + NO + H2O
D окислительно-восстановительном процессе участвуют атомы меди, серы и азота. При составлении уравнения методом полуреакций необходимо учитывать стадии данного процесса:
Cu+ → Cu2+
S2- → S+6
N5+ → N+2
В данной ситуации необходимо объединить в одну стадию окислительные и восстановительные процессы:
2Cu+ – 2e → 2Cu2+ |10e
S2- – 8e → S6+
_______________________
N5+ + 3e → N2+ |3e
При котором окислительно-восстановительная полуреакция примет вид:
2Cu+ – 2e → 2Cu2+
S2- – 8e → S6+ 3 (процессы восстановления)
_______________________
N5+ + 3e → N2+ 10 (процесс окисления)
_____________________________________
6Cu+ + 3S2- + 10N5+ → 6Cu2+ + 3S6+ + 10N2+
В итоге молекулярное уравнение реакции примет вид:
3Cu2S + 22HNO3 = 6Cu(NO3)2 + 3H2SO4 + 10NO + 8H2O.
Особое внимание следует уделить окислительно-восстановительным реакциям с участием органических веществ. Например, при окислении глюкозы перманганатом калия в кислой среде происходит следующая реакция:
C6H12O6 +KMnO4 + H2SO4 > CO2 + MnSO4 + K2SO4 + H2O
При составлении баланса методом полуреакции превращения глюкозы учитывается отсутствие её диссоциации, но коррекцию количества атомов водорода осуществляется за счет протонов и молекул воды:
C6H12O6 + 6H2O – 24e = 6CO2 + 24H+
Полуреакция с участием перманганата калия примет вид:
MnO4–+ 8H+ + 5e = Mn2+ +4H2O
В итоге получим следующую схему окислительно-восствновительного процесса:
C6H12O6 + 6H2O – 24e = 6CO2 + 24H+ |5
MnО4– +8H+ + 5e = Mn+2 + 4H2O |24
___________________________________________________
5C6H12O6 + 30H2O + 24MnО4– + 192H+ = 30CO2 + 120H+ + 24Mn2+ + 96H2O
Сократив количества протонов и молекул воды в левой и правой части полуреакции, получим итоговое молекулярное уравнение:
5C6H12O6 + 24KMnO4 + 36H2SO4 = 30CO2 + 24MnSO4 + 12K2SO4 + 66H2O
5. Влияние среды на характер протекания окислительно-восстановительных реакций.
В зависимости от среды (избыток H+, нейтральной, избыток OH–) может изменяться характер протекания реакции между одними и теми же веществами. Для создания кислой среды обычно используется серная кислота (H2SO4), азотная кислота (HNO3), соляная кислота (HCl), в качестве среды OH– применяют гидроксид натрия (NaOH) или гидроксид калия (KOH). Например покажем, как среда влияет на переманганат калия (КMnO4). и продукты его реакции:
Для примера возьмём в качестве восстановителя Na2SO3, в качестве окислителя KMnO4
В кислой среде:
5Na2SO3 + 2KMnO4 + 3H2SO4 → 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
SO32- + H2O – 2e → SO42- + 2H+ |5
MnO4–+ 8H+ + 5e → Mn2+ + 4H2O |2
________________________________________________
5SO32- + 2MnO4– + 6H+ → 5SO42- + 2Mn2+ + 3H2O
В нейтральной (или слабощелочной):
3Na2SO3 + 2KMnO4 + H2O → 3Na2SO4 + 2MnO2 + 2KOH
SO32- + H2O – 2e→ SO42- + 2H+ |3
MnO4– + 2H2O + 3e→ MnO2 + 4OН |2
_____________________________________
3SO32- + 2 MnO4– + H2O → 3SO42- + 2MnO2 + 2OН
В сильно щелочной среде:
Na2SO3 + 2KMnO4 + 2NaOH → Na2SO4 + K2MnO4 + Na2MnO + H2O
SO32- + 2 OН– – 2e → SO42- + H2O |1
MnO4– + e → MnO42 |2
____________________________________
SO32- + 2 MnO4– + 2OH → SO42- + 2MnO42- + H2O
Пероксид водорода (Н2О2) в зависимости от среды восстанавливается согласно схеме:
1) Кислая среда (H+) H2O2 + 2H+ + 2е → 2H2O
2) Нейтральная среда (Н2О) H2O2 + 2е → 2ОН
3) Щелочная среда (ОН–) H2O2 + 2е→ 2ОН
Пероксид водорода (Н2О2) выступает как окислитель:
2FeSO4 + H2O2 + H2SO4 → Fe2(SO4)3 + 2H2O
Fe2+ – е = Fe3+ |2
H2O2 + 2H+ + 2е = 2Н2О |1
________________________________
2Fe2+ + H2O2 + 2H+ → 2Fe3+ + 2 Н2О
Однако, встречаясь с очень сильными окислителями (KMnO4) Пероксид водорода (Н2О2) выступает как восстановитель:
5H2O2 + 2KMnO4 + 3H2SO4 → 5O2 + 2MnSO4 + K2SO4 + 8H2O
H2O2 – 2e → O2 + 2H+ |5
MnO4–+ 8H+ + 5e → Mn2+ + 4H2O |2
_________________________________
5H2O + 2 MnO4– + 6H+→ 5O2 + 2Mn2+ + 8H2O
6. Определение продуктов окислительно-восстановительных реакций.
В практической части данной темы рассматриваются окислительно-восстановительные процессы с указанием только исходных реагентов. Продукты реакций, как правило, необходимо определить. Например, в реакции участвуют хлорид железа (FeCl3) и иодид калия (KJ):
FeCl3 + KJ = A + B + C
требуется установить формулы соединений A, B, C, образующиеся в результате окислительно-восстановительного процесса.
Исходные степени окисления реагентов следующие: Fe3+, Cl–, K+, J–. Нетрудно предположить, что Fe3+, являясь окислителем (имеет максимальную степень окисления), может только снизить свою степень окисления до Fe2+:
Fe3+ + e = Fe2+
Хлорид-ион и ион калия в реакции не изменяют свою степень окисления, а иодид-ион может только повысить свою степень окисления, т.е. перейти в состояние J20:
2J– – 2e= J20
В результате реакции, помимо окислительно-восстановительного процесса, произойдет реакция обмена между FeCl3 и KJ, но с учетом изменения степеней окисления реакция определяется не по данной схеме:
FeCl3 + KJ = FeJ3 + KCl,
а примет вид
FeCl3 + KJ = FeJ2 + KCl,
где в качестве продукта C обозначается соединение J20:
FeCl3 + 6KJ = 2FeJ2 + 6KJ + J2
Fe3+ + e ═> Fe2+ |2
2J– – 2e ═> J20 |1
________________________________
2Fe+3 + 2J– = 2Fe2+ + J20
В дальнейшем, при определении продуктов окислительно-восстановительного процесса, можно применять так называемую «систему лифта». Принцип её заключается в том, что любую окислительно-восстановительную реакцию можно представить, как движение лифтов в многоэтажном строении в двух взаимно противоположных направлениях. Причём, «этажами» будут являться степени окисления соответствующих элементов. Поскольку любая из двух полуреакций в окислительно-восстановительном процессе сопровождается либо понижением, либо повышением степени окисления того или иного элемента, то простым рассуждением можно предположить о возможных их степенях окисления в образующихся продуктах реакции.
В качестве примера приведём реакцию, в которой сера реагирует с концентрированным раствором гидроксида натрия (NaOH):
S + NaOH(конц) = (А) + (В) + H2O
Поскольку в данной реакции изменения будут происходить только со степенями окисления серы, то для наглядности составим диаграмму её возможных состояний:
Соединениями (А) и (В) не могут быть одновременно состояния серы S+4 и S+6, поскольку в данном случае процесс происходил бы только с отдачей электронов, т.е. являлся бы восстановительным:
S0 – 4е=S+4
S0– 6е =S+6
Но это противоречило бы принципу окислительно-восстановительных процессов. Тогда следует полагать, что в одном случае процесс должен проходить с отдачей электронов, а в другом двигаться в противоположном направлении, т.е. быть окислительным:
S0 – 4е =S+4
S0+ 2е =S-2
С другой стороны, насколько вероятно, что процесс восстановления будет осуществляться до состояния S+4 или до S+6? Поскольку реакция протекает в щелочной, а не в кислой среде, то окислительная возможность её значительно ниже, поэтому образование соединения S+4 в этой реакции предпочтительнее, чем S+6. Следовательно, реакция в окончательном варианте примет вид:
4S + 6NaOH(конц) = Na2SO3 + 2Na2S + 3H2O
S0 +2e = S–2 | 4 | 2
S0 + 6OH– – 4e = SO32– + 3H2O | 2 | 1
3S0 + 6OH– = 2S–2 + SO32– + 3H2O
В качестве другого примера разберём следующую реакцию между фосфином и концентрированной азотной кислотой(HNO3):
PH3 + HNO3 = (А) + (В) + H2O
В данном случае имеем изменяющиеся степени окисления у фосфора и азота. Для наглядности приведём диаграммы состояния их степеней окисления.
Фосфор в состоянии степени окисления (-3) будет проявлять только восстановительные свойства, поэтому в реакции он будет повышать свою степень окисления. Азотная кислота сама по себе является сильным окислителем и создаёт кислую среду, поэтому фосфор от состояния (-3) достигнет своей максимальной степени окисления (+5).
В противоположность этому азот будет понижать свою степень окисления. В реакциях данного типа обычно до состояния (+4).
Далее нетрудно предположить, что фосфор в состоянии (+5), являясь продуктом (А), может быть только ортофосфорной кислотой H3PO4, поскольку среда реакции сильнокислая. Азот в таких случаях, обычно принимает степень окисления (+2) или (+4), чаще (+4). Поэтом продуктом (В) будет оксид азота NO2. Остаётся только решить это уравнение методом баланса:
P–3 – 8e = P+5 | 1
N+5 + e = N+4 | 8
P–3 + 8N+5 = P+5 + 8N+4
PH3 + 8HNO3 = H3PO4 + 8NO2 + 4H2O
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Сравним
две реакции: первая реакция – взаимодействие гидроксида натрия с соляной
кислотой.
NaOH
+ HCl = NaCl
+ H2O.
Расставим
степени окисления у всех атомов. У натрия степень окисления +1, у кислорода -2,
у водорода +1, в соляной кислоте у водорода степень окисления +1, а у хлора -1.
В хлориде натрия у натрия степень окисления +1, у хлора -1, в воде у водорода
степень окисления +1, у кислорода -2. Как видно, атомы химических элементов
не изменили свои степени окисления.
Сравним вторую реакцию – взаимодействие
магния с соляной кислотой.
Mg
+ 2HCl = MgCl2
+ H2↑.
У
магния степень окисления нуль, т.к. это простое вещество, у водорода в соляной
кислоте +1, у хлора -1, в хлориде магния у магния степень окисления +2, у хлора
-1, у водорода, как простого вещества степень окисления равна нулю.
Следовательно, в данной реакции магний и водород изменили свои степени
окисления: магний с нуля до +2, а водород с +1 до нуля. Т.е. каждый атом
магния отдал два электрона, а каждый атом водорода принял по одному электрону.
Эти
химические реакции, в результате которых происходит изменение степеней
окисления атомов химических элементов или ионов, называют окислительно-восстановительными
реакциями.
Процесс
присоединения электронов атомами, ионами или молекулами
называется восстановлением. Степень окисления при этом понижается.
В нашем случае атомы водорода присоединяют электроны и понижают свою степень
окисления, т.е. этот процесс является восстановлением. Например, атомы
неметаллов могут присоединять электроны и превращаться при этом в отрицательные
ионы, т.е. они восстанавливаются. Так атом серы может присоединить два
электрона и превратиться в сульфид-ион, где степень окисления серы -2.
Электроны
могут присоединяться и к положительным ионам, которые при этом превращаются в
нейтральные атомы или положительные ионы, у которых степень окисления
понижается.
Т.е.
ион железа (III) и атом серы являются окислителями.
Т.о., атомы, ионы или молекулы, принимающие электроны, называют окислителями.
Процесс
отдачи электронов атомами, ионами или молекулами называется
окислением. При этом степень окисления повышается. Атомы
металлов отдают электроны, превращаются при этом в положительные ионы, т.е. они
окисляются. Например, атом кальция отдает два электрона и превращается в
ион кальция, со степенью окисления +2.
Отдавать
электроны могут также и отрицательные, и положительные ионы. Например, сульфид
ион отдает два электрона и превращается в атом серы, или ион железа (II)
отдает один электрон и превращается в ион железа (III).
Атомы,
ионы или молекулы, которые отдают электроны, называют восстановителями.
В нашем случае, это сульфид-ион и ион железа (II).
Все
окислительно-восстановительные реакции представляют собой единство двух
противоположных процессов – окисления и восстановления.
Рассмотрим
реакцию взаимодействия алюминия с серой. В нашем случае атом алюминий
отдает три электрона и становится ионом алюминия со степенью окисления +3.
Т.е. он является восстановителем, при этом он повышает свою степень
окисления, а сам он окисляется. Атом серы, напротив, принимает два электрона,
понижает свою степень окисления и превращается в сульфид-ион, где степень
окисления серы -2. Атом серы является окислителем, т.е. он
восстанавливается.
В
окислительно-восстановительных реакциях число электронов, отдаваемых
восстановителем, равно числу электронов, принимаемых окислителем, т.е. соблюдается
электронный баланс. Метод электронного баланса применяют для записей
электронных уравнений процессов окисления и восстановления. Например, при
записи уравнения реакции алюминия и серы над каждым атомом и ионом ставят
степени окисления.
А в электронных уравнениях
указывают число отдаваемых и принимаемых электронов, указывают восстановитель и
окислитель, процессы окисления и восстановления.
Молекулярное
уравнение этой реакции записать несложно, т.к. коэффициенты для него будут
взяты из электронных уравнений.
Так, перед алюминием
будет стоять коэффициент 2, а перед серой – 3.
Попробуем
расставить коэффициенты методом электронного баланса в более сложной
реакции. Как вы помните, азотная кислота любой концентрации и концентрированная
серная кислота реагирует с металлами иначе, чем другие кислоты. Запишем реакцию
взаимодействия серебра с разбавленной азотной кислотой. В результате
реакции образуется соль – нитрат серебра (I),
оксид азота (II) и вода. Укажем степени
окисления у атомов и ионов.
Подчеркнем знаки
химических элементов, изменивших свои степени окисления. В нашем случае – это
серебро и азот. Составим электронные уравнения, отразив процессы восстановления
и окисления.
В
реакциях между металлом и кислотой, коэффициенты ставят, как правило,
сначала перед продуктами реакции, а затем перед исходными веществами.
Значит, перед формулой нитрата серебра (I)
ставим коэффициент 3, а перед оксидом азота (II)
коэффициент 1.
Следовательно,
и перед формулой серебра в левой части уравнения нужно поставить коэффициент
3. Считаем число атомов азота после реакции, 4 атома, до реакции один атом,
значит, перед формулой азотной кислоты нужно поставить коэффициент 4. Считаем
число атомов водорода в левой части уравнения, их – 4, в правой – 2, значит,
перед формулой воды нужно поставить коэффициент 2. Считаем число атомов
кислорода: в левой части 12, в правой тоже, теперь мы можем поставить знак
равенства вместо стрелки.
Зная
степень окисления атомов химических элементов нетрудно предсказать окислителем
или восстановителем будет элемент или вещество. Например,
в азотной кислоте (HNO3)
степень окисления азота максимальная +5, следовательно, он «потерял» все
электроны, поэтому азотная кислота будет проявлять только окислительные
свойства. В аммиаке (NH3)
степень окисления азота минимальная -3, т.е. он не может больше
принимать электроны и может быть только восстановителем. В оксиде азота
(II) степень окисления азота +2,
т.е. является промежуточной, поэтому он может проявлять и восстановительные,
и окислительные свойства.
Наиболее
важными восстановителями являются активные металлы,
водород (H2),
уголь, оксид углерода (II)
– CO, сероводород – H2S,
аммиак (NH3)
и др. Наиболее важными окислителями являются: кислород (O2),
галогены, азотная кислота (HNO3),
серная кислота (H2SO4),
перманганат калия (KMnO4)
и др.
Алгоритм
составления окислительно – восстановительных реакций.
1.
Составляем уравнение химической реакции
железо
взаимодействует с сульфатом меди с образованием сульфата железа(2) и меди
Fe+
CuSO4=FeSO4
+Cu
2.
Ставим степени окисления над химическими элементами.
Fe0+ Cu+2
S+6 O4-2=Fe+2 S+6 O4-2
+Cu0
3.
Обратите внимание, что есть элементы, у которых меняется степень окисления
Fe0+
Cu+2 S+6 O4-2=Fe+2 S+6 O4-2
+Cu0
4.
Если у химических элементов меняется степень окисления, значить это
окислительно- восстановительная реакция.
5.
Сейчас нужно определить исходя из названия данного типа реакции, какой из
элементов является окислителем, а какой восстановителем.
6.
Записываем у каких элементов как меняется степень окисления.
Fe0 =
Fe+2
Cu+2 =
Cu0
7. Восстановитель – химический элемент, у которого
степень окисления по оси координат возрастает.
Окислитель-
химический
элемент, у которого степень окисления по оси координат уменьшается
8.Согласно
определения видим, что степень окисления возрастает у железа. Значить оно
является восстановителем, а у меди степень окисления уменьшается- окислитель.
Fe0 =
Fe+2 – восстановитель
Cu+2 =
Cu0 – окислитель
9.
Восстановитель всегда отдает электроны, а окислитель всегда принимает.
10.
Находим разницу между степенью окисления у железа
Fe0 =
Fe+2 – восстановитель
разница равна 2
Fe0 – 2
e = Fe+2 – восстановитель
11. Находим разницу между степенью
окисления у меди
Cu+2 =
Cu0 – окислитель
Разница между
степенью окисления у меди равна 2
Cu+2 +2e
= Cu0 –
окислитель
12.
Получили следующую запись
Fe0 – 2
e = Fe+2 – восстановитель
Cu+2 +2e
= Cu0 –
окислитель
13.
Находим наименьшее кратное отданных и принятых электронов

e = Fe+2 – восстановитель
Cu+2 +2e
= Cu0 –
окислитель
14.
Наименьшее кратное для этих двух уравнений 2
15.
Fe0 – 2 e =
Fe+2 – восстановитель
2 наименьшее
кратное
Cu+2 +2e =
Cu0 – окислитель
16.
Наименьшее кратное 2 делим на число отданных электронов железом и принятых
медью.
Fe0 – 2 e =
Fe+2 – восстановитель
2:2=1
2
Cu+2 +2e =
Cu0 – окислитель 2:2=1
17.
Получив эти числа 1 у железа и 1 у меди из данной записи следует, что мы должны
поставить коэффициент 1 у железа в левой и правой части уравнения. Так же
следует поставить 1 у меди в обоих частях уравнения.
1 Fe+
CuSO4=1FeSO4 +Cu
Fe+1 CuSO4=FeSO4
+1Cu
Как
мы знаем коэффициент 1 мы не ставим.
18.
Посчитайте количество атомов серы в левой и правой части
Fe+
CuSO4=FeSO4
+Cu
Количество атомов
серы по одному
19. Посчитайте
количество атомов кислорода в левой и правой части
Fe+
CuSO4=FeSO4 +Cu
Количество атомов
кислорода по 4.
20. Количество
атомов всех элементов одинаково. Мы с вами с помощью электронов отданных и
принятых (электронный баланс) уравняли данное химическое уравнение.
Уравнения для самостоятельной работы по данной теме по отработке
навыков составления окислительно-восстановительных реакций (ОВР). Определите
какой из элементов является окислителем и восстановителем, составьте
электронный баланс и расставьте коэффициенты.
а) СuO + NH3
= N2 + Cu + H 2O
б) NH3 + O2 = NО + H 2O
в) Li + N2 = Li 2N
Как определять степень окисления
Степень окисления — это число электронов, перешедших от одного атома — к другому. Знак «минус», стоящий перед степенью окисления, говорит о том, что атом электроны потерял; знак «плюс» — получил.
Степень окисления равна нулю:
- у свободных атомов;
- у атомов, входящих в состав неполярных молекул (например, H2, O2, N2, Cl2. );
- в сумме значений степеней окисления всех элементов, входящих в соединение.
Последний пункт дает возможность определять неизвестную степень окисления элемента, если известны степени окисления других элементов в этом соединении:
Для определения степени окисления азота составляем и решаем уравнение:
Во многих случаях степень окисления численно равна валентности.
Как составлять уравнения окислительно-восстановительных реакций
Напомним, что окислительно-восстановительными реакциями называются химические реакции, протекающие с изменением степеней окисления элементов (всех или некоторых).
Главный момент любой окислительно-восстановительной реакции, о котором всегда следует помнить — кол-во электронов, которые отдал элемент-восстановитель, всегда равно кол-ву электронов, принятых элементом-окислителем.
Уравнения окислительно-восстановительных реакций составляются при помощи метода электронного баланса, либо метода полуреакций.
Метод электронного баланса
Алгоритм составления уравнения окислительно-восстановительной реакции:
- Дана следующая схема реакции:
- В левой и правой частях уравнения рядом с элементами в формулах веществ проставляем степени их окисления:
- Внимательно смотрим, и определяем элементы с разной степенью окисления в левой и правой частях, в нашем случае — это марганец и хлор:
- Рядом запишем получившиеся атомы с «новой» степенью окисления:
- Записыаем кол-во перешедших электронов:
- Справа проводится вертикальная черта за которой записываются коэффициенты, стоящие перед электронами, при этом, верхний коэффициент записывается вниз, а нижний — вверх:
- проверяем, чтобы общая сумма электронов атома (иона элемента-окислителя) была равна общему числу электронов атома (иона элемента-восстановителя);
- Переносим коэффициенты электронных уравнений в уравнение реакции в молекулярной форме, которые следует проставить в уравнении перед соответствующими формулами, и проверяем равенстов кол-ва атомов элементов в левой и правой части уравнения:
Приведем еще один пример составления уравнения окислительно-восстановительной реакции методом электронного баланса.
- Дана следующая схема реакции:
- Записываем степени окисления всех элементов в обеих частях схемы, после чего определяем элементы, изменяющие свои степени окисления в ходе реакции:
- Пишем уравнения окисления и восстановления, поскольку продуктом окисления является двухатомная молекула брома, то и в левой части берем также два атома брома:
- Записываем множители для уравнения:
- Основное правило метода электронного баланса выполняется: 2 атома марганца принимают 10 электронов (2·5), а 10 атомов брома отдают 10 электронов (каждый атом — по одному электрону);
- Найденные множители записываются в качестве коэффициентов перед формулами веществ, содержащих элементы, участвующие в процессе окисления-восстановления:
- Осталось уравнять кол-во атомов элементов, не изменяющих степени окисления (калий, сера, водород, кислород):
- В последнюю очередь уравниваются кол-ва атомов кислорода и водорода.
Рассмотрим пример окислительно-восстановительной реакции, в которой меняют свои степени окисления сразу три элемента.
- Схема реакции:
- Определяем элементы, меняющие свои степени окисления:
- В процессе реакции окисляются фосфор и сера, а восстанавливается азот, при этом кол-во электронов, участвующих в процессах окисления, равно 22, а в процессе восстановления участвует только 1 электрон:
- Записываем найденные множители в схему реакции, как коэффициенты перед формулами соответствующих веществ:
- На последней стадии проводим уравнение кол-ва атомов кислорода и водорода:
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Окислительно-восстановительные реакции
О чем эта статья:
11 класс, ЕГЭ/ОГЭ
Что такое ОВР
Окислительно-восстановительная реакция (ОВР) — это реакция, которая протекает с изменением степеней окисления.
В такой реакции всегда участвуют вещество-окислитель и вещество-восстановитель. Другие вещества могут выступать в качестве среды, в которой протекает данная реакция.
Конечно, в каждом правиле есть исключения. Например, реакция диспропорционирования галогенов в горячем растворе щелочи выглядит так: Br2 + KOH = KBrO3 + KBr + H2O. Здесь и окислителем, и восстановителем является простое вещество бром (Br2).
Теперь посмотрим внимательнее на вещества — участники окислительно-восстановительных реакций.
Окислитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет принимать электроны, тем самым понижая свою степень окисления.
Восстановитель — вещество, в состав которого входит ион или атом, который в процессе реакции будет отдавать электроны, тем самым повышая свою степень окисления.
Из определений понятно, что реакция включает два противоположных по действиям явления: процесс окисления и процесс восстановления. Процесс восстановления — это процесс принятия электронов, а процесс окисления — процесс отдачи электронов. Оба процесса протекают одновременно: окислитель восстанавливается, а восстановитель окисляется.
Вот мы и узнали общие закономерности протекания окислительно-восстановительных реакций. Теперь давайте разберемся, какие вещества могут быть окислителями, а какие — восстановителями, и может ли одно вещество проявлять те и другие свойства.
Примеры веществ-окислителей
Только окислителями могут быть элементы в высшей своей степени окисления. Например, S +6 в серной кислоте (H2SO4), N +5 в азотной кислоте (HNO3) или солях-нитратах, Cr +6 в хроматах (CrO4 2− ) и дихроматах (Cr2O7 2− ) соответственно, а также Mn +7 (MnO 4− ).
В зависимости от среды проведения реакции Mn +7 и Cr +6 ведут себя по-разному. Рассмотрим на схемах:
И марганец, и хром в кислой среде (H + ) образуют соли той кислоты, которая образовывала среду. В нейтральной среде (H2O) марганец превращается в оксид бурого цвета, а хром — в серо-зеленый нерастворимый в воде гидроксид. В щелочной среде (OH − ) марганец превращается в манганат (MnO4 2− ), а хром — в комплексное соединение светло-зеленого цвета.
Только окислителями могут быть простые вещества-неметаллы. Например, представители VIIA группы — галогены. Проявляя окислительные свойства в кислой среде, галогены восстанавливаются до соответствующих им галогеноводородных кислот: HF, HCl, HBr, HI. В щелочной среде образуются соли галогеноводородных кислот.
Кислород превращается в анион с устойчивой степенью окисления −2. А сера ведет себя как окислитель по отношению к водороду и металлам, образуя при этом сероводород и сульфиды.
Только окислителями могут быть и протон водорода (H + ) и катионы металлов в их высших степенях окисления при нескольких возможных. Ион Н + при взаимодействии с восстановителями переходит в газообразный водород (H2), а катионы металлов — в ионы с более низкой степенью окисления: 2CuCl2 + 2KI = CuCl + 2KCl + I2.
Рассмотрим как ведут себя сильные кислоты-окислители — азотная и серная. В зависимости от их концентрации меняются и продукты реакции.
Эти кислоты проявляют окислительные способности и с некоторыми неметаллами, окисляя их до соответствующих кислот в высшей степени окисления неметалла-восстановителя.
Для удобства мы собрали цвета переходов важнейших веществ-окислителей в одном месте.
Примеры веществ-восстановителей
Типичными восстановителями могут быть щелочные (IA) и щелочноземельные (IIA) металлы, цинк и алюминий, а также катионы металлов в своих низших степенях окисления при нескольких возможных. Например:
Типичными восстановителями также могут быть бескислородные кислоты и их соли. Например, H2S + 4Cl2 + 4H2O = 8HCl + H2SO4.
Гидриды активных металлов (щелочных и щелочноземельных) тоже являются типичными восстановителями. Например, NaH + H2O = NaOH + H2.
Для удобства мы собрали цвета переходов важнейших веществ-восстановителей в одном месте.
Окислительно-восстановительная двойственность
Окислительно-восстановительная двойственность — это способность атома проявлять как свойства окислителя, так и свойства восстановителя в зависимости от условия протекания химической реакции.
Разберем вещества, атомы которых обладают окислительно-восстановительной двойственностью.
По отношению к водороду и металлам сера играет роль окислителя: S + H2 = H2S.
При взаимодействии с сильными окислителями повышает свою степень окисления до +4 или +6: S + KMnO4 = K2SO4 + MnO2.
Кислородсодержащие соединения серы в степени окисления +4
Сера в сульфитах и сернистой кислоте при взаимодействии с сильными окислителями повышает степень окисления до +6: SO2 + 2HNO3 (конц) = H2SO4 + 2NO2.
С восстановителями соединения серы проявляют окислительные свойства, восстанавливаясь до степени окисления 0 или −2: SO2 + C = CO2 + S.
Пероксид водорода
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии восстановителей может понижать степень окисления до –2: 4H2O2 + PbS = PbSO4 + 4H2O.
Атом кислорода в пероксиде водорода находится в промежуточной степени окисления –1, и в присутствии окислителей может повышать степень окисления до 0: 3H2O2 + 2KMnO4 = 3O2 + 2MnO2 + 2KOH + 2H2O.
Простое вещество йод
Окислительная способность проявляется у йода в реакции с такими восстановителями, как сероводород, фосфор и металлы: I2 + H2S = S + 2HI.
Йод при взаимодействии с более сильными окислителями играет роль восстановителя: I2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl.
Азотистая кислота и нитриты
При взаимодействии с более сильными окислителями азот повышает степень окисления до +5 и превращается либо в азотную кислоту из азотистой, либо в нитрат-анион из нитрит-аниона: 5NaNO2 + 2KMnO4 + 3H2SO4 = 5NaNO3 + 2MnSO4 + K2SO4 + 3H2O.
При взаимодействии с сильными восстановителями обычно происходит восстановление до NO (иногда до других соединений азота в более низких степенях окисления): 2HNO2 + 2HI = 2NO + I2 + 2H2O.
Для удобства мы собрали представителей типичных окислителей и восстановителей в одну схему.
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции можно поделить на четыре типа:
Рассмотрим каждую по отдельности.
Межмолекулярная ОВР — это реакция, окислитель и восстановитель которой являются различными веществами.
2KI + Br2 = 2KBr + I2, где Br2 — окислитель, а KI — восстановитель (за счёт I −1 ).
Внутримолекулярная ОВР — это реакция, в которой один атом является окислителем, а другой восстановителем в рамках одного соединения.
Пример такой окислительно-восстановительной реакции:
где Cl +5 — окислитель, а O −2 — восстановитель.
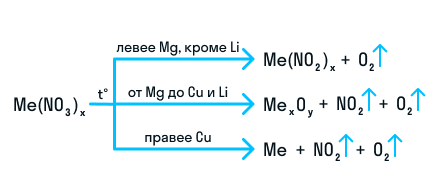
Термическое разложение нитратов — это внутримолекулярная ОВР. Вот схема разложения нитратов в зависимости от металла, входящего в состав соли.
Исключение — разложение нитрата железа (II): 4Fe(NO3)2 = 2Fe2O3 + 8NO2 + O2. Здесь железо окисляется до +3 вопреки правилам. Иначе разлагается при нагревании и нитрат аммония: NH4NO3 = N2O + 2H2O.
Окислительно-восстановительная реакция диспропорционирования — это реакция, в ходе которой один и тот же атом является и окислителем, и восстановителем. Например, 3HNO2 = HNO3 + 2NO + H2O, где N +3 переходит в N +5 , являясь восстановителем, и N +3 переходит в N +2 , являясь окислителем.
Окислительно-восстановительная реакция контрпропорционирования — это реакция, в которой атомы одного и того же химического элемента в разных степенях окисления входят в состав разных веществ, при этом образуя новые молекулы одного и того же продукта.
Основные правила составления ОВР
Подобрать среди исходных веществ окислитель и восстановитель, а также вещество, которое отвечает за среду — при необходимости. Для этого нужно расставить степени окисления элементов и сравнить их окислительно-восстановительные свойства.
Составить уравнение реакции и записать продукты реакции. Следует помнить, что в кислой среде образуются соли одно-, двух- и трехзарядных катионов, а для создания среды чаще всего используют серную кислоту. В кислой среде невозможно образование оснóвных оксидов и гидроксидов, так как они вступят в реакцию с кислотой. В щелочной среде не могут образовываться кислоты и кислотные оксиды, а образуются соли.
Уравнять методом электронного баланса или методом полуреакций.
Составим алгоритм для уравнивания окислительно-восстановительных реакций методом электронного баланса.
Главное условие протекания ОВР — общее число электронов, отданных восстановителем, должно быть равно общему числу электронов, принятых окислителем.
Определите атомы, которые меняют свои степени окисления в ходе реакции.
Выпишите, сколько электронов принял окислитель и отдал восстановитель. Если восстановителей несколько, выписываем все.
Найдите НОК для суммарно отданных/принятых электронов.
Расставьте первые полученные коэффициенты перед окислителем и одним или несколькими восстановителями.
Уравняйте все присутствующие металлы в уравнении реакции.
Уравняйте кислотные остатки.
Уравняйте водород — в обеих частях его должно быть одинаковое количество.
Проверьте себя по кислороду — если все посчитано верно, то он сойдется.
Окислительно-восстановительные реакции
Окислительно-восстановительные реакции — это химические реакции, сопровождающиеся изменением степени окисления у атомов реагирующих веществ. При этом некоторые частицы отдают электроны, а некоторые получают.
Окислители и восстановители
Окислители — это частицы (атомы, молекулы или ионы), которые принимают электроны в ходе химической реакции. При этом степень окисления окислителя понижается. Окислители при этом восстанавливаются.
Восстановители — это частицы (атомы, молекулы или ионы), которые отдают электроны в ходе химической реакции. При этом степень окисления восстановителя повышается. Восстановители при этом окисляются.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства. Некоторые вещества практически не проявляют окислительно-восстановительную активность.
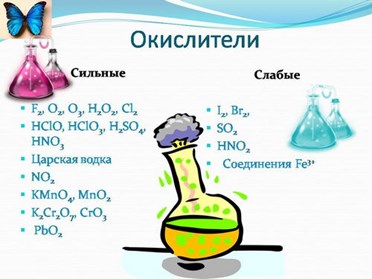
К типичным окислителям относят:
- простые вещества-неметаллы с наиболее сильными окислительными свойствами (фтор F2, кислород O2, хлор Cl2);
- сложные вещества, в составе которых есть ионыметаллов или неметаллов с высокими положительными (как правило, высшими) степенями окисления : кислоты (H N +5 O3, H Cl +7 O4), соли (K N +5 O3, K Mn +7 O4), оксиды ( S +6 O3, Cr +6 O3)
- соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb 4+ , Fe 3+ , Au 3+ и др.
Типичные восстановители – это, как правило:
- простые вещества-металлы (восстановительные способности металлов определяются рядом электрохимической активности);
- сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательной (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI);
- некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn 2+ , Fe 2+ , Cr 2+ ), которые, отдавая электроны, могут повышать свою степень окисления;
- соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S +4 O3) 2– , (НР +3 O3) 2– , в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства.
Типичные окислители и восстановители приведены в таблице.
В лабораторной практике наиболее часто используются следующие окислители :
К восстановителям , которые применяются в лабораторной практике относятся:
- магний (Mg), алюминий (Al), цинк (Zn) и другие активные металлы;
- водород (Н2) и углерод (С);
- иодид калия (KI);
- сульфид натрия (Na2S) и сероводород (H2S);
- сульфит натрия (Na2SO3);
- хлорид олова (SnCl2).
Классификация окислительно-восстановительных реакций
Окислительно-восстановительные реакции обычно разделяют на четыре типа: межмолекулярные, внутримолекулярные, реакции диспропорционирования (самоокисления-самовосстановления), и реакции контрдиспропорционирования.
Межмолекулярные реакции протекают с изменением степени окисления разных элементов из разных реагентов. При этом образуются разные продукты окисления и восстановления .
2 Al 0 + Fe +3 2O3 → Al +3 2O3 + 2 Fe 0 ,
C 0 + 4H N +5 O3(конц) = C +4 O2 ↑ + 4 N +4 O2 ↑+ 2H2O.
Внутримолекулярные реакции – это такие реакции, в которых разные элементы из одного реагента переходят в разные продукты, например:
2 Na N +5 O -2 3 → 2 Na N +3 O2 + O 0 2↑.
Реакции диспропорционирования (самоокисления-самовосстановления) – это такие реакции, в которых окислитель и восстановитель – один и тот же элемент одного реагента, который при этом переходит в разные продукты:
3Br2 + 6 KOH → 5KBr + KBrO3 + 3 H2O,
Репропорционирование (конпропорционирование, контрдиспропорционирование ) – это реакции, в которых окислитель и восстановитель – это один и тот же элемент, который из разных реагентов переходит в один продукт. Реакция, обратная диспропорционированию.
2H2 S -2 + S +4 O2 = 3 S + 2H2O
Основные правила составления окислительно-восстановительных реакций
Окислительно-восстановительные реакции сопровождаются процессами окисления и восстановления:
Окисление — это процесс отдачи электронов восстановителем.
Восстановление — это процесс присоединения электронов окислителем.
Окислитель восстанавливается , а восстановитель окисляется .
В окислительно-восстановительных реакциях соблюдается электронный баланс: количество электронов, которые отдает восстановитель, равно количеству электронов, которые получает окислитель. Если баланс составлен неверно, составить сложные ОВР у вас не получится.
Используется несколько методов составления окислительно-восстановительных реакций (ОВР): метод электронного баланса, метод электронно-ионного баланса (метод полуреакций) и другие.
Рассмотрим подробно метод электронного баланса .
«Опознать» ОВР довольно легко — достаточно расставить степени окисления во всех соединениях и определить, что атомы меняют степень окисления:
K + 2 S -2 + 2K + Mn +7 O -2 4 = 2K + 2 Mn +6 O -2 4 + S 0
Выписываем отдельно атомы элементов, меняющих степень окисления, в состоянии ДО реакции и ПОСЛЕ реакции.
Степень окисления меняют атомы марганца и серы:
S -2 -2e = S 0
Mn +7 + 1e = Mn +6
Марганец поглощает 1 электрон, сера отдает 2 электрона. При этом необходимо, чтобы соблюдался электронный баланс. Следовательно, необходимо удвоить число атомов марганца, а число атомов серы оставить без изменения. Балансовые коэффициенты указываем и перед реагентами, и перед продуктами!
Схема составления уравнений ОВР методом электронного баланса:
Внимание! В реакции может быть несколько окислителей или восстановителей. Баланс необходимо составить так, чтобы ОБЩЕЕ число отданных и полученных электронов было одинаковым.
Общие закономерности протекания окислительно-восстановительных реакций
Продукты окислительно-восстановительных реакций зачастую зависят от условий проведения процесса. Рассмотрим основные факторы, влияющие на протекание окислительно-восстановительных реакций .
Самый очевидный фактор, определяющий — среда раствора реакции — кислая, нейтральная или щелочная. Как правило (но не обязательно), вещество, определяющее среду, указано среди реагентов. Возможны такие варианты:
- окислительная активность усиливается в более кислой среде и окислитель восстанавливается глубже (например, перманганат калия, KMnO4, где Mn +7 в кислой среде восстанавливается до Mn +2 , а в щелочной — до Mn +6 );
- окислительная активность усиливается в более щелочной среде, и окислитель восстанавливается глубже (например, нитрат калия KNO3, где N +5 при взаимодействии с восстановителем в щелочной среде восстанавливается до N -3 );
- либо окислитель практически не подвержен изменениям среды.
Среда протекания реакции позволяет определить состав и форму существования остальных продуктов ОВР. Основной принцип — продукты образуются такие, которые не взаимодействуют с реагентами!
Обратите внимание! Е сли среда раствора кислая, то среди продуктов реакции не могут присутствовать основания и основные оксиды, т.к. они взаимодействуют с кислотой. И, наоборот, в щелочной среде исключено образование кислоты и кислотного оксида. Это одна из наиболее частых, и наиболее грубых ошибок.
Также на направление протекания ОВР влияет природа реагирующих веществ. Например , при взаимодействии азотной кислоты HNO3 с восстановителями наблюдается закономерность — чем больше активность восстановителя, тем больше восстанавливается азот N +5 .
При увеличении температуры большинство ОВР, как правило, проходят более интенсивно и более глубоко.
В гетерогенных реакциях на состав продуктов зачастую влияет степень измельчения твердого вещества . Например, порошковый цинк с азотной кислотой образует одни продукты, а гранулированный — совершенно другие. Чем больше степень измельчения реагента, тем больше его активность, как правило.
Рассмотрим наиболее типичные лабораторные окислители.
Основные схемы окислительно-восстановительных реакций
Схема восстановления перманганатов
В составе перманганатов есть мощный окислитель — марганец в степени окисления +7. Соли марганца +7 окрашивают раствор в фиолетовый цвет.
Перманганаты, в зависимости от среды реакционного раствора, восстанавливаются по-разному.
В кислой среде восстановление происходит более глубоко, до Mn 2+ . Оксид марганца в степени окисления +2 проявляет основные свойства, поэтому в кислой среде образуется соль. Соли марганца +2 бесцветны . В нейтральном растворе марганец восстанавливается до степени окисления +4 , с образованием амфотерного оксида MnO2 — коричневого осадка, нерастворимого в кислотах и щелочах. В щелочной среде марганец восстанавливается минимально — до ближайшей степени окисления +6 . Соединения марганца +6 проявляют кислотные свойства, в щелочной среде образуют соли — манганаты . Манганаты придают раствору зеленую окраску .
Рассмотрим взаимодействие перманганата калия KMnO4 с сульфидом калия в кислой, нейтральной и щелочной средах. В этих реакциях продуктом окисления сульфид-иона является S 0 .
3 K2S + 2 KMnO4 + 4 H2O = 2 MnO2↓ + 3 S↓ + 8 KOH,
Распространенной ошибкой в этой реакции является указание на взаимодействие серы и щелочи в продуктах реакции. Однако, сера взаимодействует с щелочью в довольно жестких условиях (повышенная температура), что не соответствует условиям этой реакции. При обычных условиях правильно будет указывать именно молекулярную серу и щелочь отдельно, а не продукты их взаимодействия.
При составлении этой реакции также возникают трудности. Дело в том, что в данном случае написание молекулы среды (КОН или другая щелочь) в реагентах не требуется для уравнивания реакции. Щелочь принимает участие в реакции, и определяет продукт восстановления перманганата калия, но реагенты и продукты уравниваются и без ее участия. Этот, казалось бы, парадокс легко разрешим, если вспомнить, что химическая реакция — это всего лишь условная запись, которая не указывает на каждый происходящий процесс, а всего лишь является отображением суммы всех процессов. Как определить это самостоятельно? Если действовать по классической схеме — баланс-балансовые коэффициенты-уравнивание металла, то вы увидите, что металлы уравниваются балансовыми коэффициентами, и наличие щелочи в левой части уравнения реакции будет лишним.
Перманганаты окисляют:
- неметаллы с отрицательной степенью окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк — до +5 ;
- неметаллы с промежуточной степенью окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
KMnO4 + неМе (низшая с.о.) = неМе 0 + другие продукты
KMnO4 + неМе (промежуточная с.о.) = неМе(высшая с.о.) + др. продукты
KMnO4 + Ме 0 = Ме (стабильная с.о.) + др. продукты
KMnO4 + P -3 , As -3 = P +5 , As +5 + др. продукты
Схема восстановления хроматов/бихроматов
Особенностью хрома с валентностью VI является то, что он образует 2 типа солей в водных растворах: хроматы и бихроматы, в зависимости от среды раствора. Хроматы активных металлов (например, K2CrO4) — это соли, которые устойчивы в щелочной среде. Дихроматы (бихроматы) активных металлов (например, K2Cr2O7) — соли, устойчивые в кислой среде .
Восстанавливаются соединения хрома (VI) до соединений хрома (III) . Соединения хрома Cr +3 — амфотерные, и в зависимости от среды раствора они существуют в растворе в различных формах: в кислой среде в виде солей (амфотерные соединения при взаимодействии с кислотами образуют соли), в нейтральной среде — нерастворимый амфотерный гидроксид хрома (III) Cr(OH)3 , и в щелочной среде соединения хрома (III) образуют комплексную соль, например, гексагидроксохромат (III) калия K3[Cr(OH)6] .
Соединения хрома VI окисляют:
- неметаллы в отрицательной степени окисления до простых веществ (со степенью окисления 0), исключения — фосфор, мышьяк – до +5 ;
- неметаллы в промежуточной степени окисления до высшей степени окисления;
- активные металлы из простых веществ (ст.окисления 0) до соединений со стабильной положительной степенью окисления металла.
Хромат/бихромат + неМе (отрицательная с.о.) = неМе 0 + другие продукты
Хромат/бихромат + неМе (промежуточная положительная с.о.) = неМе(высшая с.о.) + др. продукты
Хромат/бихромат + Ме 0 = Ме (стабильная с.о.) + др. продукты
Хромат/бихромат + P, As (отрицательная с.о.) = P, As +5 + другие продукты
Разложение нитратов
Соли-нитраты содержат азот в степени окисления +5 — сильный окислитель. Такой азот может окислять кислород (О -2 ). Это происходит при нагревании нитратов. При этом в большинстве случаев кислород окисляется до степени окисления 0, т.е. до молекулярного кислорода O2 .
В зависимости от типа металла, образующего соль, при термическом (температурном) разложении нитратов образуются различные продукты: если металл активный (в ряду электрохимической активности находятся до магния), то азот восстанавливается до степени окисления +3, и при разложении образуется соли-нитриты и молекулярный кислород .
Например:
Активные металлы в природе встречаются в виде солей (KCl, NaCl).
Если металл в ряду электрохимической активности находится правее магния и левее меди (включая магний и медь) , то при разложении образуется оксид металла в устойчивой степени окисления, оксид азота (IV) (бурый газ) и кислород . Оксид металла образует также при разложении нитрат лития .
Например , разложение нитрата цинка:
Металлы средней активности чаще всего в природе встречаются в виде оксидов (Fe2O3, Al2O3 и др.).
Ионы металлов , расположенных в ряду электрохимической активности правее меди являются сильными окислителями. При разложении нитратов они, как и N +5 , участвуют в окислении кислорода, и восстанавливаются до простых веществ, т.е. образуется металл и выделяются газы — оксид азота (IV) и кислород .
Например , разложение нитрата серебра:
Неактивные металлы в природе встречаются в виде простых веществ.
Некоторые исключения!
Разложение нитрата аммония :
В молекуле нитрата аммония есть и окислитель, и восстановитель: азот в степени окисления -3 проявляет только восстановительные свойства, азот в степени окисления +5 — только окислительные.
При нагревании нитрат аммония разлагается. При температуре до 270 о С образуется оксид азота (I) («веселящий газ») и вода:
Это пример реакции контрдиспропорционирования .
Результирующая степень окиcления азота — среднее арифметическое степени окисления атомов азота в исходной молекуле.
При более высокой температуре оксид азота (I) разлагается на простые вещества — азот и кислород :
При разложении нитрита аммония NH4NO2 также происходит контрдиспропорционирование.
Результирующая степень окисления азота также равна среднему арифметическому степеней окисления исходных атомов азота — окислителя N +3 и восстановителя N -3
Термическое разложение нитрата марганца (II) сопровождается окислением металла:
Нитрат железа (II) при низких температурах разлагается до оксида железа (II), при нагревании железо окисляется до степени окисления +3:
Нитрат никеля (II) разлагается до нитрита при нагревании до 150 о С под вакуумом и до оксида никеля при более высоких температурах (разложения нитрата никеля в ЕГЭ по химии не должно быть, но это не точно)).
Окислительные свойства азотной кислоты
Азотная кислота HNO3 при взаимодействии с металлами практически никогда не образует водород , в отличие от большинства минеральных кислот.
Это связано с тем, что в составе кислоты есть очень сильный окислитель — азот в степени окисления +5. При взаимодействии с восстановителями — металлами образуются различные продукты восстановления азота.
Азотная кислота + металл = соль металла + продукт восстановления азота + H2O
Азотная кислота при восстановлении может переходить в оксид азота (IV) NO2 (N +4 ); оксид азота (II) NO (N +2 ); оксид азота (I) N2O («веселящий газ»); молекулярный азот N2; нитрат аммония NH4NO3 . Как правило, образуется смесь продуктов с преобладанием одного из них. Азот восстанавливается при этом до степеней окисления от +4 до −3. Глубина восстановления зависит в первую очередь от природы восстановителя и от концентрации азотной кислоты . При этом работает правило: чем меньше концентрация кислоты и выше активность металла, тем больше электронов получает азот, и тем более восстановленные продукты образуются .
Некоторые закономерности позволят верно определять основной продукт восстановления металлами азотной кислоты в реакции:
- при действии очень разбавленной азотной кислоты на металлы образуется, как правило, нитрат аммония NH4NO3;
Например , взаимодействие цинка с очень разбавленной азотной кислотой:
- концентрированная азотная кислота на холоде пассивирует некоторые металлы — хром Cr, алюминий Al и железо Fe . При нагревании или разбавлении раствора реакция идет;
пассивация металлов — это перевод поверхности металла в неактивное состояние за счет образования на поверхности металла тонких слоев инертных соединений, в данном случае преимущественно оксидов металлов, которые не реагируют с концентрированной азотной кислотой
- азотная кислота не реагирует с металлами платиновой подгруппы — золотом Au, платиной Pt, и палладием Pd;
- при взаимодействии концентрированной кислоты с неактивными металлами иметаллами средней активности азотная кислота восстанавливается до оксида азота (IV)NO2 ;
Например , окисление меди концентрированной азотной кислотой:
- при взаимодействии концентрированной азотной кислоты с активными металлами образуется оксид азота(I) N2O ;
Например , окисление натрия концентрированной азотной кислотой:
- при взаимодействии разбавленной азотной кислоты с неактивными металлами (в ряду активности правее водорода) кислота восстанавливается до оксида азота (II) NO ;
- при взаимодействии разбавленной азотной кислоты с металлами средней активности образуется либо оксид азота (II) NO, либо оксид азота N2O, либо молекулярный азот N2 — в зависимости от дополнительных факторов (активность металла, степень измельчения металла, степень разбавления кислоты, температура).
- при взаимодействии разбавленной азотной кислоты с активными металлами образуется молекулярный азот N2.
Для приближенного определения продуктов восстановления азотной кислоты при взаимодействии с разными металлами я предлагаю воспользоваться принципом маятника. Основные факторы, смещающие положение маятника: концентрация кислоты и активность металла. Для упрощения используем 3 типа концентраций кислоты: концентрированная (больше 30%), разбавленная (30% или меньше), очень разбавленная (меньше 5%). Металлы по активности разделим на активные (до алюминия), средней активности (от алюминия до водорода) и неактивные (после водорода). Продукты восстановления азотной кислоты располагаем в порядке убывания степени окисления:
Чем активнее металл, тем больше мы смещаемся вправо. Чем больше концентрация или меньше степень разбавления кислоты, тем больше мы смещаемся влево.
Например , взаимодействуют концентрированная кислота и неактивный металл медь Cu. Следовательно, смещаемся в крайнее левое положение, образуется оксид азота (IV), нитрат меди и вода.
Взаимодействие металлов с серной кислотой
Разбавленная серная кислота взаимодействует с металлами, как обычная минеральная кислота. Т.е. взаимодействует с металлами, которые расположены в ряду электрохимических напряжений до водорода. Окислителем здесь выступают ионы H + , которые восстанавливаются до молекулярного водорода H2. При этом металлы окисляются, как правило, до минимальной степени окисления.
Например :
Концентрированная серная кислота взаимодействует с металлами, стоящими в ряду напряжений как до, так и после водорода.
H2SO4 (конц) + металл = соль металла + продукт восстановления серы (SO2, S, H2S) + вода
При взаимодействии концентрированной серной кислоты с металлами образуются соль металла (в устойчивой степени окисления), вода и продукт восстановления серы — сернистый газ S +4 O2, молекулярная сера S либо сероводород H2S -2 , в зависимости от степени концентрации, активности металла, степени его измельчение, температуры и т.д. При взаимодействии концентрированной серной кислоты с металлами молекулярный водород не образуется!
Основные принципы взаимодействия концентрированной серной кислоты с металлами:
1. Концентрированная серная кислота пассивирует алюминий, хром, железо при комнатной температуре, либо на холоду;
2. Концентрированная серная кислота не взаимодействует с золотом, платиной и палладием ;
3. С неактивными металлами концентрированная серная кислота восстанавливается до оксида серы (IV).
Например , медь окисляется концентрированной серной кислотой :
Cu 0 + 2H2 S +6 O4(конц) = Cu +2 SO4 + S +4 O2 + 2H2O
4. При взаимодействии с активными металлами и цинком концентрированная серная кислота образует серу S либо сероводород H2S 2- (в зависимости от температуры, степени измельчения и активности металла).
Например , взаимодействие концентрированной серной кислоты с цинком :
Пероксид водорода
Пероксид водорода H2O2 содержит кислород в степени окисления -1. Такой кислород может и повышать, и понижать степень окисления. Таким образом, пероксид водорода проявляет и окислительные, и восстановительные свойства.
При взаимодействии с восстановителями пероксид водорода проявляет свойства окислителя, и восстанавливается до степени окисления -2. Как правило, продуктом восстановления пероксида водорода является вода или гидроксид-ион, в зависимости от условий проведения реакции. Например:
При взаимодействии с окислителями перекись окисляется до молекулярного кислорода (степень окисления 0): O2. Например :
источники:
http://skysmart.ru/articles/chemistry/okislitelno-vosstanovitelnye-reakczii
http://chemege.ru/materials/ovr/