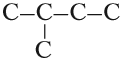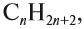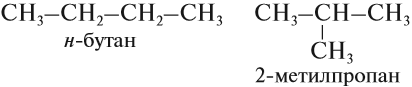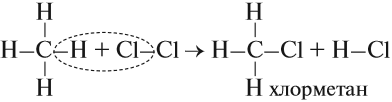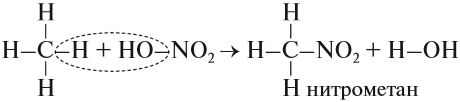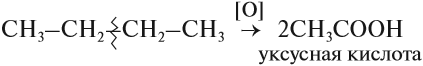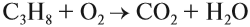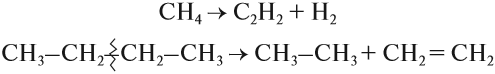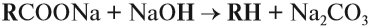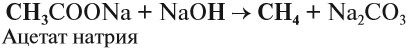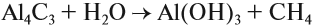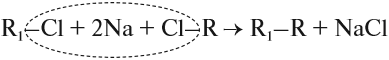Органическая химия
Мы приступаем к новому разделу – органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать
наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉

В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько
основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает
химическое строение. - Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его
свойствах. - Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы

Алканы (парафины) – насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к
алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями – содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда
– CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen – имя + calare – созывать) – совокупность названий индивидуальных химических веществ, а также правила составления
этих названий. Названия у алканов формируются путем добавления суффикса “ан”: метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos –
соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить
читателя с ними. Итак, алгоритм составления названий следующий:
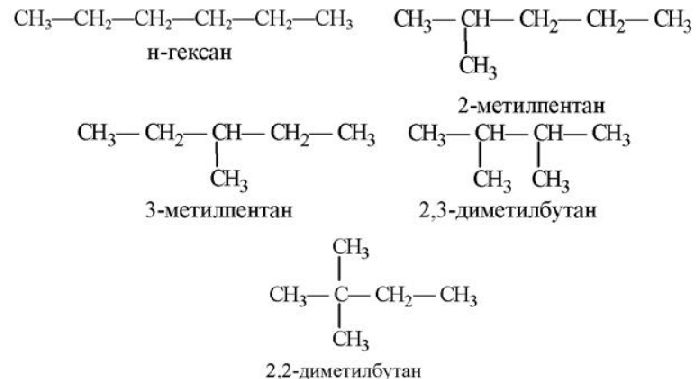
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они
связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи
и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д. - Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный
атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros – составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по
строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной
(геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана
C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
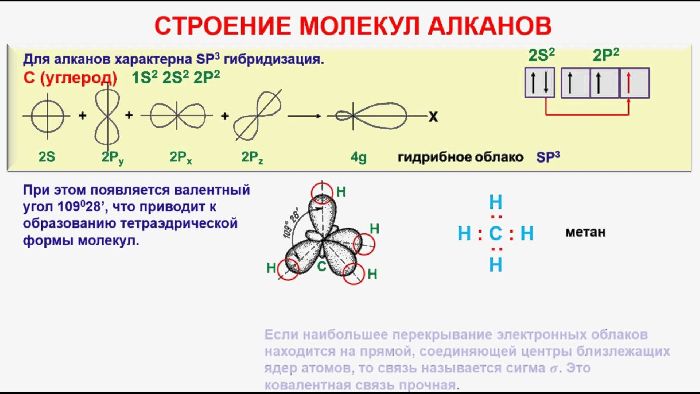
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода – sp3
- Валентный угол (между химическими связями) составляет 109°28′

Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить
одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем
крекинга из нефти получают алканы.

Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
- Гидрогенизацией угля (торфа, сланца)
- Гидрированием оксида углерода II
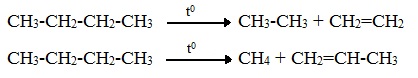
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
C + H2 → (t, p) CH4
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
- Реакция Вюрца
- Синтез Гриньяра
- Синтез Кольбе
- Разложение карбида алюминия
- Гидрированием ненасыщенных углеводородов
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного
радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).

На схеме выше мы сначала получили реактив Гриньяра, а потом
использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.

В результате электролиза солей карбоновых кислот может происходить образование алканов.

В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы – насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для
алканов характерны реакции замещения, а не присоединения.
- Галогенирование
- Нитрование (реакция Коновалова)
- Окисление
- Пиролиз
- Изомеризация
- Крекинг
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода,
чуть труднее – у вторичного и значительно труднее – у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы,
которые и осуществляют атаку на молекулу углеводорода.

Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция
идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту – HNO3 – можно представить как HO-NO2.

Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)

Пиролиз (греч. πῦρ – огонь + λύσις – разложение) – термическое разложение неорганических и органических соединений. Принципиальное
отличие пиролиза от горения – в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат.) CH2=CH2 + H2↑
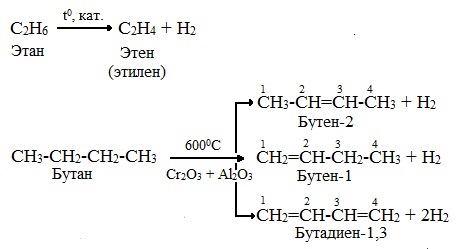
C2H6 → (t = 1200°С, кат.) CH2=CH2 + H2↑
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их
химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Алканы – это предельные углеводороды, содержащие только одинарные связи между атомами С–С в молекуле, т.е. содержащие максимальное количество водорода.
Строение алканов
Гомологический ряд
Получение алканов
Химические свойства алканов
Алканы – предельные углеводороды, поэтому они не могут вступать в реакции присоединения.
Для предельных углеводородов характерны реакции:
- разложения,
- замещения,
- окисления.
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для алканов характерны только радикальные реакции.
Алканы устойчивы к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагируют с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения.
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование.
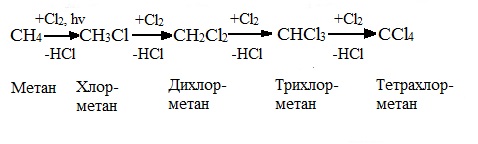
Алканы реагируют с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно.
При хлорировании алканов с углеродным скелетом, содержащим более 3 атомов углерода, образуется смесь хлорпроизводных.
Например, при хлорировании пропана образуются 1-хлорпропан и 2-хлопропан:
Бромирование протекает более медленно и избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
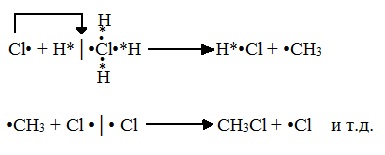
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование алканов.
Алканы взаимодействуют с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140оС и под давлением. Атом водорода в алкане замещается на нитрогруппу NO2.
При этом процесс протекает также избирательно.
С третичный–Н > С вторичный–Н > С первичный–Н
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
Уравнение дегидрирования алканов в общем виде:
CnH2n+2 → CnH2n-х + (х+1)H2
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
Например, при дегидрировании этана образуются этилен или ацетилен:
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана.
При медленном и длительном нагревании до 1500оС метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
CH4 + 2O2 → CO2 + 2H2O + Q
Уравнение сгорания алканов в общем виде:
CnH2n+2 + (3n+1)/2O2 → nCO2 + (n+1)H2O + Q
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
2C3H8 + 7O2 → 6CO + 8H2O
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
CH4 + O2 → C + 2H2O
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
2. Реакции разложения.
2.1. Дегидрирование и дегидроциклизация.
Дегидрирование – это реакция отщепления атомов водорода.
В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др.
При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
При дегидрировании бутана под действием металлических катализаторов образуется смесь продуктов. Преимущественно образуется бутен-2:
Если бутан нагревать в присутствии оксида хрома (III), преимущественно образуется бутадиен-1,3:
Алканы с более длинным углеродным скелетом, содержащие 5 и более атомов углерода в главной цепи, при дегидрировании образуют циклические соединения.
При этом протекает дегидроциклизация – процесс отщепления водорода с образованием замкнутого цикла.
Пентан и его гомологи, содержащие пять атомов углерода в главной цепи, при нагревании над платиновым катализатором образуют циклопентан и его гомологи:
Алканы с углеродной цепью, содержащей 6 и более атомов углерода в главной цепи, при дегидрировании образуют устойчивые шестиатомные циклы, т. е. циклогексан и его гомологи, которые далее превращаются в ароматические углеводороды.
Гексан при нагревании в присутствии оксида хрома (III) в зависимости от условий может образовать циклогексан и потом бензол:
Гептан при дегидрировании в присутствии катализатора образует метилциклогексан и далее толуол:
2.2. Пиролиз (дегидрирование) метана .
При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ:
Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен:
Пиролиз метана – промышленный способ получения ацетилена.
2.3. Крекинг.
Крекинг – это реакция разложения алкана с длинной углеродной цепью на алканы и алкены с более короткой углеродной цепью.
Крекинг бывает термический и каталитический.
Термический крекинг протекает при сильном нагревании без доступа воздуха.
При этом получается смесь алканов и алкенов с различной длиной углеродной цепи и различной молекулярной массой.
Каталитический крекинг проводят при более низкой температуре в присутствии катализаторов. Процесс сопровождается реакциями изомеризации и дегидрирования. Катализаторы каталитического крекинга – цеолиты (алюмосиликаты кальция, натрия).
3. Реакции окисления алканов.
Алканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.).
3.1. Полное окисление – горение.
Алканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты.
Уравнение сгорания алканов в общем виде:
При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С.
Например, горение пропана в недостатке кислорода:
Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода:
Эта реакция используется для получения сажи.
3.2. Каталитическое окисление.
- Каталитическое окисление бутана – промышленный способ получения уксусной кислоты:
- При каталитическом окислении метана кислородом возможно образование различных продуктов в зависимости от условий проведения процесса и катализатора. Возможно образование метанола, муравьиного альдегида или муравьиной кислоты:
- Важное значение в промышленности имеет паровая конверсия метана: окисление метана водяным паром при высокой температуре.
Продукт реакции – так называемый «синтез-газ».
4. Изомеризация алканов.
Под действием катализатора и при нагревании неразветвленные алканы, содержащие не менее четырех атомов углерода в основной цепи, могут превращаться в более разветвленные алканы.
Алканы
Органическая химия
Мы приступаем к новому разделу — органической химии. Совершенно необязательно (и даже преступно по отношению к собственному времени!) знать наизусть, зубрить свойства органических веществ.
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
В этой связи особый интерес представляет теория химического строения, которая была создана А.М. Бутлеровым в 1861 году. Она включает в себя несколько основных положений:
- Атомы в молекуле соединены в определенной последовательности, в соответствии с их валентностью. Порядок связи атомов отражает химическое строение.
- Зная свойства веществ, можно установить их химическое строение, и наоборот, зная строение вещества можно сделать вывод о его свойствах.
- Атомы или группы атомов оказывают взаимное влияние друг на друга непосредственно или через другие атомы
- Свойства вещества зависят от количественного и качественного состава, а также от химического строения молекулы
Алканы (парафины) — насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями — содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда — CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen — имя + calare — созывать) — совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса «ан»: метан, этан, пропан, бутан и т.д.
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos — соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерами (греч. isomeros — составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Некоторые данные, касающиеся алканов, надо выучить:
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода — sp 3
- Валентный угол (между химическими связями) составляет 109°28′
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
Гидрогенизацией угля (торфа, сланца)
Гидрированием оксида углерода II
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Гидрированием ненасыщенных углеводородов
Химические свойства алканов
Алканы — насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
- Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее — у вторичного и значительно труднее — у первичного.
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Для удобства и более глубокого понимания, азотную кислоту — HNO3 — можно представить как HO-NO2.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
Пиролиз (греч. πῦρ — огонь + λύσις — разложение) — термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения — в отсутствии кислорода.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Урок 18. Алканы
Понятие об алканах
Алканы — это углеводороды незамкнутого (нециклического) строения, в молекулах которых атомы углерода соединены только простыми связями. Например:
Задание 18.1. Допишите атомы водорода и попробуйте ответить на вопрос: существует ли углеводород, имеющий большее число атомов водорода в молекуле?
Поэтому-то алканы обычно называют предельными углеводородами, то есть содержащими максимально возможное (предельное) число атомов водорода в молекуле.
Гомологический ряд, номенклатура, изомерия
Алканы образуют гомологический ряд с общей формулой
где n — число атомов углерода в молекуле. Если
Начиная с n = 4 для алканов возможна изомерия, то есть для вещества состава C4H10 существуют два соединения различного строения, а значит, различные по свойствам:
Следующий гомолог с n = 5 имеет уже три изомера, один из них н-пентан, то есть пентан нормального (неразветвлённого) строения.
Задание 18.2. Составьте графические формулы всех изомеров пентана (их три). Назовите эти изомеры.
Строение молекул
Атомы углерода и водорода в молекулах алканов соединены только простыми связями. Это ковалентные, слабо полярные связи.
Все С–Н связи в молекуле метана равноценны и направлены в пространстве к вершинам тетраэдра. Это σ-связи (сигма-связи), очень прочные. Поэтому метан и другие алканы с трудом вступают в химические реакции (на разрыв σ-связей нужно затратить много энергии). Все химические реакции алканов идут в особых условиях (нагревание, присутствие катализатора, освещение и др.), то есть при обычных условиях реакции алканов невозможны.
Свойства алканов
Физические свойства
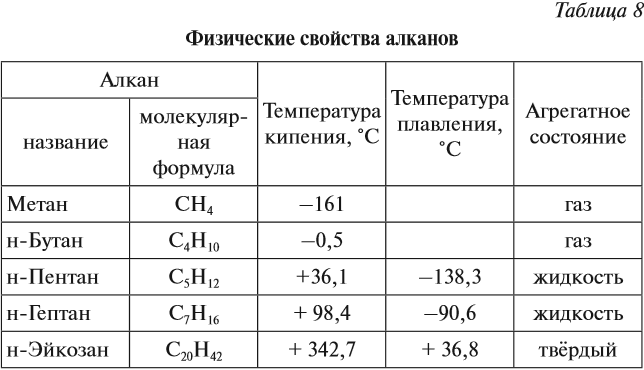
Поскольку все связи в молекулах алканов слабо полярны, то в молекулах отсутствуют какие-либо значительные заряды. Поэтому молекулы алканов слабо притягиваются друг к другу. В результате все алканы — это либо газы, либо летучие жидкости, либо твёрдые легкоплавкие вещества (табл. 8).
Смесь газообразных углеводородов образует природный газ. Начиная с n = 16, алканы являются твёрдыми веществами. Очищенные твёрдые предельные углеводороды называют парафином.
Неполярные углеводороды практически нерастворимы в полярном растворителе, например в воде, но прекрасно растворяются в неполярных растворителях. Таким растворителем является смесь жидких алканов (бензин, керосин). Природная смесь твёрдых, жидких и газообразных углеводородов называется нефтью. Нефть в основном состоит из алканов и циклоалканов. При переработке нефти получают: попутный нефтяной газ, смесь жидких алканов (бензин, керосин), твёрдых алканов (асфальт, парафин) и другие нефтепродукты. Такой способ переработки нефти называется нефтеперегонкой и осуществляется при её нагревании в специальных ректификационных колоннах.
Задание 18.3. Бензин представляет собой смесь алканов с числом атомов углерода от 5 до 9. Составьте их молекулярные формулы.
Химические свойства
Алканы, в принципе, не способны к реакциям присоединения, так как имеют максимально возможное число атомов водорода. Поэтому их называют насыщенными углеводородами.
Для алканов наиболее характерна реакция замещения. В результате такой реакции происходит замещение одного атома водорода алкана на новую группу или на атом (на каждой стадии). Характер химической связи при этом не изменяется.
К таким реакциям относятся:
- Реакция хлорирования, которая происходит под действием солнечного света:
- Реакция нитрования, которая происходит при нагревании:
Обратите внимание: молекулу азотной кислоты в органических реакциях рекомендуется записывать как НО–NO2, так как в результате реакций с ней в молекуле исходного вещества появляется нитрогруппа –NО2.
Для алканов возможны реакции окисления. В растворе они не происходят. Но в присутствии катализаторов алканы окисляются до кислот:
Обратите внимание! Знак [О] означает, что происходит неполное (мягкое) окисление. Окислителями могут быть разные вещества, не только кислород, например, перманганат калия KMnO4.
При полном окислении (горении) любой алкан (и любой углеводород!) превращается в углекислый газ и воду:
Газообразные алканы горят бесцветным пламенем, т. е. сгорают полностью! При этом выделяется много теплоты, поэтому алканы применяются в качестве топлива: природный газ, бензин, керосин, мазут и т. д.
Задание 18.4. Расставьте коэффициенты в уравнении реакции горения.
При нагревании до очень высоких температур в отсутствии кислорода происходит разрушение (крекинг) молекулы углеводорода:
При этом образуются и непредельные углеводороды.
Задание 18.5. Укажите формулы непредельных углеводородов.
Процессы крекинга используют при переработке нефти.
Задание 18.6. Напишите уравнения реакций:
- хлорирования этана;
- нитрования метана;
- горения пентана.
Получение и применение алканов
Алканы широко распространены в природе. Простейший алкан — метан — образуется в результате разложения без доступа воздуха остатков растительных и животных организмов, этот газ выделяется на болотах, поэтому он так и называется: «болотный газ». Метан накапливается в шахтах, где добывают каменный уголь, из-за этого на шахтах иногда бывают взрывы, так как смесь метана с воздухом взрывоопасна. Это следует учитывать и в быту, так как природный газ является источником тепла в газовых плитах. Метан составляет 95–97 % природного газа.
Алканы — ценное сырьё для получения смазочных масел, пластмасс, красок, стиральных порошков и т. д. Смеси алканов — бензин, керосин — топливо для автомобилей, тракторов, ракет, самолётов. Поэтому их получают в больших количествах в основном при переработке нефти и газа.
В лаборатории в небольших количествах алканы можно получить нагреванием соли карбоновой кислоты со щёлочью:
Внимание! Здесь и далее буквой R обозначается любой углеводородный радикал.
Так, метан получают нагреванием ацетата натрия в присутствии щёлочи:
Метан можно получить гидролизом карбида алюминия (см. урок 13.1):
Кроме того, в лаборатории алканы получают синтезом Вюрца из галогенпроизводных под действием натрия:
где R и R1 — предельные радикалы.
Выводы
Алканы — предельные, насыщенные углеводороды, в молекулах которых имеется максимально возможное (предельное) числа атомов углерода. Поэтому состав всех алканов СnH2n+2 и они не способны вступать в реакции присоединения. Все связи в молекулах алканов — неполярные, простые, очень прочные, поэтому алканы с трудом вступают в химические реакции. Это реакции замещения, крекинга, горения и каталитического окисления.
источники:
http://studarium.ru/article/181
http://himi4ka.ru/samouchitel-po-himii/urok-18-alkany.html
Члены гомологического ряда алканов имеют общие химические свойства. В обычных условиях алканы химически инертны. Они устойчивы к действию многих реагентов: не взаимодействуют с концентрированной серной и азотной кислотами, с концентрированными и расплавленными щелочами, не окисляются сильными окислителями – КМnО4 и т.п
Видеоопыт «Отношение метана к раствору перманганата калия и бромной воде»
Химическая устойчивость алканов объясняется высокой прочностью σ–связей С ─ С и С ─ Н, а также их неполярностью. Неполярные связи С ─ С и С ─ Н в алканах не склонны к ионному разрыву, но способны расщепляться гомолитически под действием активных свободных радикалов. Поэтому для алканов характерны радикальные реакции (реакции замещения), в результате которых получаются соединения, где атомы водорода замещены на другие атомы или группы атомов.
Алканы вступают в реакции, протекающие по свободно-радикальному (цепному) механизму и протекают обычно на свету или при нагревании. По этому механизму легче всего замещаются атомы водорода у третичных, затем вторичных и первичных атомов углерода. При хлорировании эта закономерность не соблюдается при T>400˚C.
Алканы относятся к углеводородам, в которых отсутствуют кратные связи. Из-за предельности алканов реакции присоединения для них нехарактерны.
Реакции замещения (разрыв связей С ─ Н)
1. Галогенирование (замещение атома водорода атомом галогена — F, Cl, Br с образованием галогеналкана).
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных частиц.
Теорию цепных реакций разработал советский ученый, один из основоположников химической физики, академик Н.Н. Семенов (1896—1986), за что в 1956 г. был награжден Нобелевской премией.
Скорость реакции зависит от активности галогенов, которая уменьшается с увеличением радиуса атома.
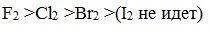
Алканы очень активно реагируют с фтором, реакция алканов с его участием сопровождается взрывом и окислением до СF4.
Реакции хлорирования и бромирования протекают под действием света (фотохимическая цепная реакция) или при 300–400оC.
Иодирование проходит обратимо, поэтому требуется окислитель для удаления НI из реакции.
Низшие алканы (СН4, С2Н6, С3Н8) можно прохлорировать полностью. В молекуле метана атомы хлора могут заместить от одного до четырех атомов водорода в зависимости от соотношения реагентов
Хлорирование метана:
(hv — формула кванта света)
Тривиальное название трихлорметана – хлороформ.
Механизм реакции
Реакция осуществляется в три стадии:
А) Инициирование (зарождение цепи) – гомолитическое расщепление молекулы Сl2 с образованием свободных радикалов хлора:

Свободные радикалы – это атомы или группы атомов с неспаренными электронами (•Сl, •Н, •СН3…)
Б) Развитие цепи (взаимодействие радикала хлора с молекулой алкана, метильного радикала с новой молекулой хлора и т.д.):
В) Обрыв цепи (происходит при соединении двух радикалов друг с другом):
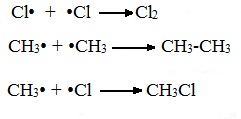
Монохлорирование метана
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:
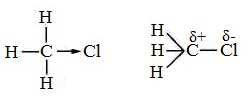
Электронная плотность связи С – Cl смещена к более электроотрицательному атому хлора, в результате этого на нем образуется частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атоме углерода в метильной группе (-СН3) создаётся недостаток электронной плотности, поэтому он оттягивает на себя электронную плотность от соседних атомов водорода, в результате этого связи С – Н становятся менее прочными и атомы водорода легче замещаются на атомы хлора.
При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайшего к заместителю:
Алканы обесцвечивают раствор брома при нагревании, вступая в реакцию радикального замещения.
Видеоопыт «Взаимодействие алканов с бромом при нагревании»
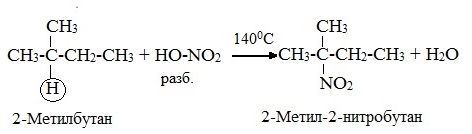
2.Нитрование (замещение атома водорода нитрогруппой – NO2 с образованием нитроалканов R-NO2). Нитрующий реагент – разбавленная азотная кислота HNO3 (НО─NО2).
Нитрование разбавленной азотной кислотой при t = 1400С и при повышенном или нормальном давлении – реакция М.И.Коновалова.
В результате реакции образуется смесь изомерных нитросоединений. Наиболее легко замещаются атомы водорода у третичного атома углерода, труднее – у вторичного, наиболее трудно – у первичного:
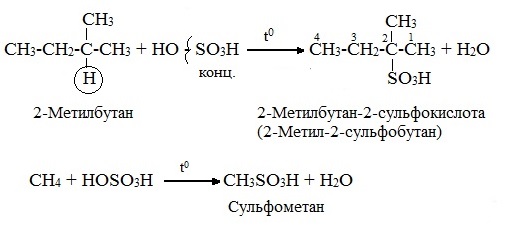
3.Сульфирование (замещение атомов водорода сульфогруппой SO3Н с образованием алкансульфокислот RSO3Н). Сульфирующий реагент – серная кислота Н2SO4 (НО─SO3Н). Сульфирование алканов происходит при действии очень концентрированной Н2SO4 при небольшом нагревании.
Наиболее легко замещается атом водорода у третичного атома углерода:
Реакции окисления
Алканы – соединения с низкими степенями окисления углерода и в зависимости от условий реакции они могут окисляться с образованием различных соединений.

При обычных условиях алканы устойчивы к действию сильных окислителей (КМnO4, К2Сr2О7).
1. Горение (окисление кислородом воздуха при высоких температурах)
А) Полное окисление (избыток О2)
При избытке кислорода происходит полное окисление алканов до СО2, где углерод имеет высшую степень окисления +4, и воды. Горение углеводородов приводит к разрыву всех связей С–С и С–Н и сопровождается выделением большого количества тепла (экзотермическая реакция).
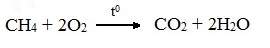
Низшие гомологи (метан, этан, пропан, бутан) образуют с воздухом взрывоопасные смеси, что необходимо учитывать при их использовании. С увеличением молекулярной массы алканы загораются труднее.
Сжиженная пропан-бутановая смесь, горение
Видеоопыт «Взрыв смеси метана с кислородом»
Видеоопыт «Горение жидких алканов»
Видеоопыт «Горение твердых углеводородов (на примере парафина)»
Процесс горения углеводородов широко используется для получения энергии (в двигателях внутреннего сгорания, в тепловых электростанциях и т.п.).
Общий вид реакции горения алканов:
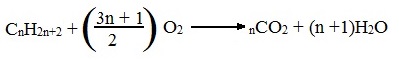
Б) Неполное окисление (недостаток О2)
При горении высших алканов ((n >>1)) при недостатке кислорода образуются продукты частичного окисления: угарный газ СО (степень окисления углерода +2), сажа (мелкодисперсный углерод, со степенью окисления 0).
Поэтому высшие алканы горят на воздухе коптящим пламенем, выделяя токсичный угарный газ, представляющий опасность для человека.
Горение метана при недостатке кислорода происходит по уравнениям:
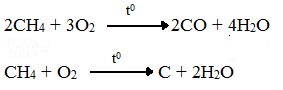
Последняя реакция используется в промышленности для получения сажи из природного газа, содержащего 80-97% метана.
2. Каталитическое окисление
Частичное окисление алканов при относительно невысокой температуре и с применением катализаторов сопровождается разрывом только части связей С–С и С–Н и используется для получения ценных продуктов: карбоновых кислот, кетонов, альдегидов, спиртов.
Например, при неполном окислении бутана происходит разрыв связи (С2–С3) и получается две молекулы уксусной кислоты:
Этим способом в промышленности получают уксусную кислоту.
При мягком окислении метана кислородом воздуха в присутствии катализаторов могут быть получены метиловый спирт, формальдегид и муравьиная кислота.
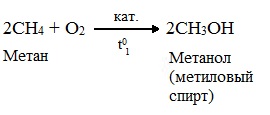
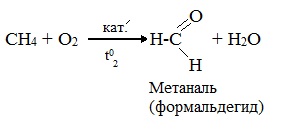
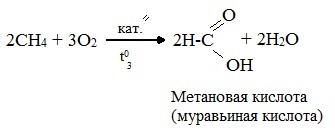
Высшие алканы (n>25) под действием кислорода воздуха в жидкой фазе в присутствии солей марганца превращаются в смесь карбоновых кислот со средней длиной цепи С12–С18, которые используются для получения моющих средств и поверхностно-активных веществ.
Учебный фильм «Каталитическое окисление высших парафиновых углеводородов»
Термические превращения алканов (реакции разложения)
1.Крекинг (анг. сracking — расщепление) алканов является основой переработки нефти с целью получения продуктов меньшей молекулярной массы, которые используются в качестве моторных топлив, смазочных масел, а также сырья для химической и нефтехимической промышленности.
Для осуществления этого процесса используют два способа: термический крекинг (при нагревании без доступа воздуха) и каталитический крекинг (более умеренное нагревание в присутствии катализатора).
Термический крекинг — это разрыв связей С ─ С в молекулах алканов с длинными углеродными цепями, в результате которого образуются алканы и алкены с меньшим числом атомов углерода.
Термический крекинг (пиролиз) осуществляется при температуре 450 – 7000С:
Крекинг н-гексана (работа Литвишко Алексея, г. Самара)
Каталитический крекинг проводят в присутствии катализаторов (обычно оксидов алюминия и кремния) при температуре 5000С и атмосферном давлении. При этом с разрывом молекул происходит реакция изомеризации и дегидрирования.
Крекинг октана (работа Литвишко Алексея, г. Самара)
2.При нагревании метана или этана до температуры 10000С начинается пиролиз – разложение на простые вещества:
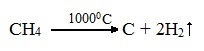
Полученный этим способом углерод является достаточно чистым, в технике называется сажей и используется, например, при производстве автомобильных покрышек.
3. Конверсия метана с образованием синтез – газа (СО + Н2)
Важное значение имеет реакция взаимодействия метана с водяным паром, в результате которой образуется смесь оксида углерода (II) с водородом – «синтез-газ» (водяной газ, генераторный газ):
Эта реакция используется для получения водорода. Синтез-газ служит сырьем для получения различных углеводородов.
Реакции отщепления
1.Дегидрирование (отщепление водорода; происходит в результате разрыва связей С ─ Н; осуществляется в присутствии катализатора при повышенных температурах).
В ходе пропускания алканов над катализатором (Pt, Pd, Ni, А1203, Сг203) при высокой температуре (400 — 600°С) происходит отщепление молекулы водорода и образование алкена:
2. Если метан нагреть до более высокой температуры (15000С) и быстро охладить, то происходит межмолекулярное дегидрирование и образуется этин (ацетилен):
3.Дегидроциклизация (ароматизация) — реакция дегидрирования, которая приводит к замыканию цепи в устойчивый цикл.
Алканы, содержащие в основной цепи больше 4-х атомов углерода, используются для получения циклических соединений.
Если основная цепь молекулы алкана содержит 5 (но не более) атомов углерода (н-пентан и его алкильные производные), то при температуре 3000С над Pt-катализатором атомы водорода отщепляются от концевых атомов углеродной цепи и образуется пятичленный цикл (циклопентан или его производные):
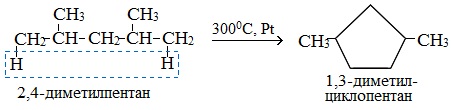
Алканы с шестью или более углеродными атомами в цепи в присутствии катализатора циклизуются с образованием бензола м его производных:
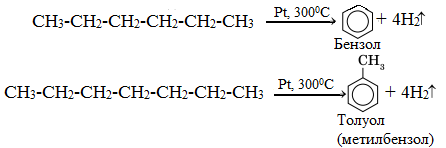
Реакции перегруппировки (изомеризация)
1.Изомеризация (превращение химического соединения в его изомер):
Нормальные алканы под влиянием катализаторов и при нагревании способны превращаться в алканы с разветвленной цепью без изменения состава молекул. В этих случаях участвуют алканы, молекулы которых содержат не менее 4-х углеродных атомов:
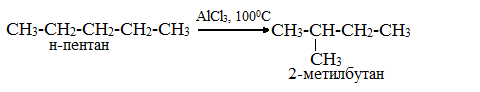
Эта реакция является важной для производства бензина, поскольку наличие в его составе разветвленных углеводородов повышает октановое число, т.е. качество топлива.
Видеоопыт “Установление качественного состава предельных углеводородов“
Алканы (предельные углеводороды)
Химические свойства алканов

4.1
Средняя оценка: 4.1
Всего получено оценок: 928.
Обновлено 30 Августа, 2021
4.1
Средняя оценка: 4.1
Всего получено оценок: 928.
Обновлено 30 Августа, 2021
Алканы – соединения гомологического ряда метана. Это насыщенные нециклические углеводороды. Химические свойства алканов зависят от строения молекулы и физического состояния веществ.
Строение алканов
Молекула алкана состоит из атомов углерода и водорода, которые образуют метиленовые (-CH2-) и метильные (-CH3) группы. Углерод может создавать четыре ковалентные неполярные связи с соседними атомами. Именно наличие прочных σ-связей -С-С- и -С-Н обуславливает инертность гомологического ряда алканов.
Соединения реагируют на свету или при нагревании. Реакции протекают по цепному (свободно-радикальному) механизму. Таким образом, связи способны расщепляться только под действием свободных радикалов. В результате замещения водорода образуются галогеналканы, соли, циклоалканы.
Алканы относятся к предельным или насыщенным углеродам. Это значит, что молекулы содержат максимальное количество атомов водорода. Из-за отсутствия свободных связей реакции присоединения для алканов не характерны.
Химические свойства
Общие свойства алканов приведены в таблице.
|
Типы химических реакций |
Описание |
Уравнение |
|
Галогенирование |
Реагируют с F2, Cl2, Br2. Реакция с йодом не идёт. Галогены замещают атом водорода. Реакция с фтором сопровождается взрывом. Хлорирование и бромирование происходит при температуре 300-400°C. В результате образуются галогеналканы |
CH4 + Cl2 → CH3Cl + HCl |
|
Нитрование (реакция Коновалова) |
Взаимодействие с разбавленной азотной кислотой при температуре 140°C. Атом водорода замещается нитрогруппой NO2. В результате образуются нитроалканы |
CH3-CH3 +HNO3 → CH3-CH2-NO2 + H2O |
|
Сульфохлорирование |
Сопровождается окислением с образованием алкансульфонилхлоридов |
R-H + SO2 + Cl2 → R-SO3Cl + HCl |
|
Сульфоокисление |
Образование алкансульфоновых кислот в избытке кислорода. Атом водорода замещается группой SO3H |
C5H12 + HOSO3H → C5H11SO3H + H2O |
|
Крекинг |
Происходит в присутствии катализатора при высоких температурах. В результате разрыва связей С-С образуются алканы и алкены |
C4H10 → C2H6 + C2H4 |
|
Горение |
В избытке кислорода происходит полное окисление до углекислого газа. При недостатке кислорода происходит неполное окисление с образованием угарного газа, сажи |
– CH4 + 2O2 → CO2 + 2H2O; – 2CH4 + 3O2 → 2CO + 4H2O |
|
Каталитическое окисление |
Происходит частичное окисление алканов при небольшой температуре и в присутствии катализаторов. Могут образовываться кетоны, альдегиды, спирты, карбоновые кислоты |
C4H10 → 2CH3COOH + H2O |
|
Дегидрирование |
Отщепление водорода в результате разрыва связей С-Н в присутствии катализатора (платины, оксида алюминия, оксида хрома) при температуре 400-600°С. Образуются алкены |
C2H6 → C2H4 + H2 |
|
Ароматизация |
Реакция дегидрирования с образованием циклоалканов |
C6H14 → C6H6 + 4H2 |
|
Изомеризация |
Образование изомеров под действием температуры и катализаторов |
C5H12 → CH3-CH(CH3)-CH2-CH3 |
Чтобы понимать, как проходит реакция и какие радикалы замещаются, рекомендуется записывать структурные формулы.
Применение
Алканы широко применяются в промышленной химии, косметологии, строительстве. Из соединений изготавливают:
- топливо (бензин, керосин);
- асфальт;
- смазочные масла;
- вазелин;
- парафин;
- мыло;
- лаки;
- краски;
- эмали;
- спирты;
- синтетические ткани;
- каучук;
- адьдегиды;
- пластмассы;
- моющие средства;
- кислоты;
- пропелленты;
- косметические средства.
Что мы узнали?
Узнали о химических свойствах и применении алканов. Из-за прочных ковалентных связей между атомами углерода, а также между атомами углерода и водорода, алканы проявляют инертность. Возможны реакции замещения и разложения в присутствии катализатора при высоких температурах. Алканы – предельные углеводороды, поэтому реакции присоединения невозможны. Алканы используются для производства материалов, моющих средств, органических соединений.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Татьяна Резун
9/10
-
Анастасия Кузина
3/10
-
Насима Давлетова
10/10
Оценка доклада
4.1
Средняя оценка: 4.1
Всего получено оценок: 928.
А какая ваша оценка?