Это значит что прежде чем писать уравнение взаимодействия веществ в водных растворах, нужно учесть, что в водных растворах сильные электролиты полностью диссоциированы, поэтому реакция фактически идёт с участием ионов, но не всех, а только некоторых.
Например, мы пишем уравнение: CaCl2 + Na2CO3 —–> CaCO3 + 2 NaCl.
Из такой записи непонятно, как же именно происходит взаимодействие.
Теперь распишем эту же реакцию с учётом того, что и CaCl2 и Na2CO3 ( а также NaCl) – сильные электролиты и полностью диссоциированы на ионы:
Ca(2+) + 2 Cl(-) + 2 Na(+) + CO3(2-) —–> CaCO3 + 2 Na(+) + Cl(-).
Теперь видим, что некоторые ионы присутствуют в обеих частях уравнения, поэтому, как и в алгебраических уравнениях, можно “привести подобные члены”:
Ca(2+) + CO3(2-) —–> CaCO3.
Вот теперь видна вся суть происходящего. Катионы Ca(2+) и анионы CO3(2-) соединяются друг с другом, и образуют нерастворимый CaCO3.
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества
распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем
лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K+ (катион) + A– (анион)
NaCl ⇄ Na+ + Cl–

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы
и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4,
H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы.
Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Na3PO4 ⇄ 3Na+ + PO43-
Из одной молекулы ортофосфата натрия образовалось 4 иона.
K2SO4 ⇄ 2K+ + SO42-
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности,
вещества делятся на электролиты и неэлектролиты.

Электролиты – жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический
ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты – вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят
электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми
наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике – остается только то,
что сократить нельзя.

© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na+ и Cl—. В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na+ и Cl— вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na+ + Cl–

При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H+ + Cl—.

При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
α=Nпродисс/Nисх, где:
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α<1):
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).

Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na+ и PO43–:
Na3PO4 → 3Na+ +PO43-
NH4Cr(SO4)2 → NH4+ + Cr3+ + 2SO42–
Диссоциация слабых электролитов: многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
H2CO3 ↔ H+ + HCO3–
HCO3– ↔ H+ + CO32–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH–
Mg(OH)+ ⇄ Mg2+ + OH–
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K+ + HCO3– (α=1)
HCO3– ⇄ H+ + CO32– (α < 1)
Mg(OH)Cl ⇄ MgOH+ + Cl– (α=1)
MgOH+ ⇄ Mg2+ + OH– (α<< 1)
Степень диссоциации слабых электролитов намного меньше 1: α<<1.
Основные положения теории электролитической диссоциации, таким образом:
1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаются к отрицательно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к положительному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры.
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K+ + S2–, при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba2+ + 2ClO3–, опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4++ NO3–, при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe3+ + 3NO3–, при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
Ответ г).
Уравнения химических реакций в свете тэд
Как объяснить тот факт, что кислоты, соли и основания вступают в реакции не со всеми веществами, а со строго определенными? Чем определяются свойства кислот, оснований и солей?
На эти вопросы вы найдете ответы на данном уроке.
I. Химические свойства щелочей
1. Взаимодействие щелочей с кислотами: Me(OH)x + HxR
NaOH +HCl  NaCl + H2O
NaCl + H2O
Na + + OH – + H + + Cl –  Na + + Cl – + H2O
Na + + Cl – + H2O
H + +OH –  H2O
H2O
2. Взаимодействие щелочей с кислотными оксидами: Me(OH)x + неMexOy
2NaOH +CO2  Na2CO3 + H2O
Na2CO3 + H2O
2Na + + 2OH – + CO2 2Na + + CO3 2- + H2O
2Na + + CO3 2- + H2O
2OH – + CO2 CO3 2- + H2O
CO3 2- + H2O
Если через пробирку с известковой водой (Ca(OH)2) пропустить углекислый газ (CO2) , то известковая вода мутнеет, следствие образования соли – карбоната кальция (CaCO3).
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но для этого нужно, чтобы образовался осадок или слабый электролит. Если в одну пробирку с гидроксида натрия добавить хлорида аммония (NH4Cl), во вторую – с гидроксидом калия (КОН) добавить сульфат железа (III) (Fe2(SO4)3), а в третью – с гидроксидом натрия добавить хлорид бария (BaCl2) и содержимое первой пробирки нагреем, то в результате появляется резкий запах аммиака (NH3). Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло.
2NaOH +MgCl2 Mg(OH)2
Mg(OH)2  + 2NaCl
+ 2NaCl
2Na + +2OH – + Mg 2+ +2Cl –  Mg(OH)2
Mg(OH)2  +2Na + +2Cl –
+2Na + +2Cl –
2OH – + Mg 2+  Mg(OH)2
Mg(OH)2
II. Химические свойства солей
1. Взаимодействие солей с металлами: MexOy + Me*
Но нужно быть внимательным и обязательно пользоваться рядом активности металлов. Каждый металл вытесняет из раствора соли металлы, расположенные правее его в этом ряду.

При этом должны соблюдаться условия:
- обе соли (и реагирующая, и образующаяся) должны быть растворимыми
- металлы не должны реагировать с водой (т.е. щелочные и щелочноземельные металлы, которые реагируют с водой с образованием щелочей).
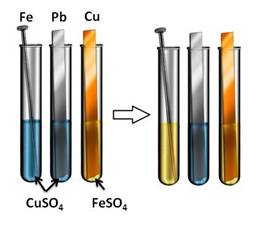
Посмотрим, как это происходит: в первую пробирку поместим железный гвоздь, во вторую – свинцовую пластину, а в третью – медную пластину. В первые две пробирки нальём раствора сульфата меди (II) (CuSO4), а в третью – раствор сульфата железа (II) (FeSO4). Через некоторое время мы можем наблюдать, что на железном гвозде осела медь, а во второй и третьей пробирке нет никаких изменений. Следовательно, в первой пробирке находился более активный металл, который вытеснил медь из раствора, во второй пробирке реакция не пошла, т.к. образующая соль (сульфат свинца (II)) является нерастворимой, в третьей пробирке реакция не прошла, т.к. медь стоит правее железа в ряду напряжений и не может вытеснить его из раствора соли.
Fe0 + Cu 2+ = Fe 2+ + Cu0↓
2. Взаимодействие солей с щелочами:
3. Взаимодействие солей с кислотами:
В реакциях солей с солями образуются новые соли, в реакциях с кислотой – образуется новая кислота, в реакциях с основаниями образуется новая соль и новое основание.
III. Химические свойства кислот
Кислоты всегда начинается с водорода, окрашивают лакмус и метиловый оранжевый в красный цвет, ведь в их составе есть ион водорода (H+), который всегда образуется при диссоциации.

Так, при диссоциации соляной кислоты (HCl), образуется ион водорода и хлорид-ион (Cl – ), при диссоциации азотной кислоты (HNO3), тоже ион водорода и нитрат-ион (NO3 – ), при диссоциации азотистой кислоты (HNO2) – ион водорода и нитрит-ион (NO2 – ).
HCl = H + + Cl –
HNO3 = H + + NO3 –
HNO2 ⇆ H + + NO2 –
Именно поэтому, кислоты окрашивают лакмус и метиловый оранжевый в красный цвет.
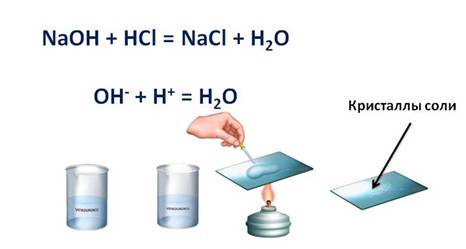
1. Кислоты реагируют с основаниями: как с растворимыми, так и с нерастворимыми. При этом образуется соль и вода. Этот тип реакций относится к реакциям обмена.
Кислота + основание = соль + вода
Например, если мы в пробирку с гидроксидом натрия (NaOH) добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты (HCl), то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.
2. Кислоты также вступают в реакции обмена с оксидами металлов. В результате реакции образуется соль и вода. Эта реакция вам уже знакома, наверняка оксиды, вам уже всё рассказали об этом.
Кислота + оксид металла = соль + вода
3. Кислоты реагируют с металлами, эти реакции относятся к реакциям замещения, при этом образуется соль и выделяется водород.
Кислота + металл = соль + водород
Для протекания данных реакций необходимо выполнение ряда условий:
- металл находиться в ряду напряжений до водорода
- должна получиться растворимая соль
- если кислота нерастворимая, то она не может вступить в реакцию с металлами.
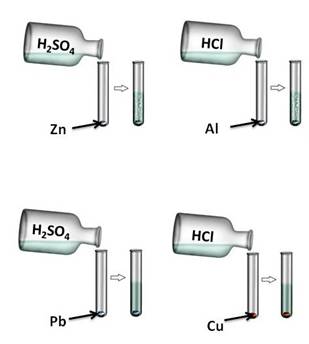
Давайте, попробуем проверить. Поместим в четыре пробирки металлы: в первую пробирку – цинк, во вторую –алюминий, в третью – свинец, четвёртую – медь. В первую и третью пробирку нальём раствора серной кислоты (H2SO4), во вторую и четвёртую – раствора соляной кислоты (HCl). Понаблюдаем за изменениями. В первой и второй пробирке наблюдается выделение водорода, в третьей и четвёртой – нет. В пробирке со свинцом и серной кислотой реакция не пошла, т.к. в результате образуется нерастворимая соль, которая покрывает всю поверхность металла защитной плёнкой. В четвёртой пробирке также изменений нет, т.к. медь стоит в ряду напряжений металлов после водорода.
Zn 0 + 2H + = Zn 2+ + H2 0 ↑
2Al 0 + 6H + = 2Al 3+ + 3H2 0 ↑
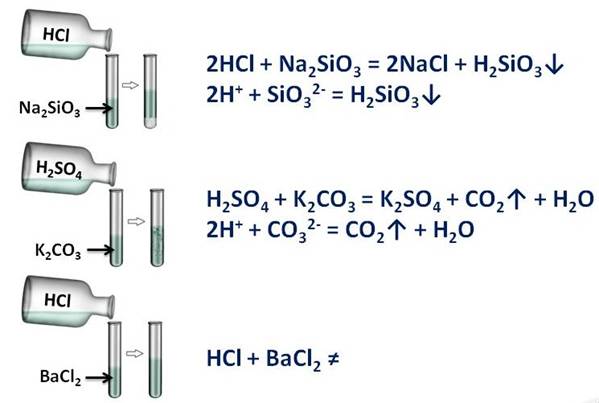
Кислоты вступаем в реакции обмена с солями, при этом образуется новая кислота и новая соль. Эти реакции протекают в том случае, если образуется осадок или газ.
Кислота + соль = новая кислота + новая соль
Соляна (HCl) и серная кислоты (H2SO4), вам покажут это: в первой пробирке будет соляная кислота и силикат натрия (Na2SiO3), во второй – серная кислота и карбоната калия (K2CO3), в третьей – опять соляной кислоты и хлорида бария (BaCl2). Посмотрим за изменениями. В первой пробирке мы наблюдаем образование студенистого осадка (H2SiO3), во второй – выделение газа (CO2), а в третьей – изменений нет. В двух пробирках реакции прошли, т.к. выполнялись следующие условия: в первой – образование осадка, во второй – выделение газа.
IV. Выполнение упражнений
Задание: составьте уравнения цепочки реакций (на “4”)
Еесли реакция является обменом, разберите ее как РИО, если реакция является ОВР, разберите ее с помощью электронного баланса (на “5”)
Химические свойства кислот в свете теории электролитической диссоциации
Разделы: Химия
Цель: изучить химические свойства кислот в свете теории электролитической диссоциации.
Задачи:
Оборудование: таблица растворимости, электрохимический ряд напряжений металлов, наборы посуды и реактивов для проведения химического эксперимента, компьютер, проектор
Планируемый результат:
Ход учебного занятия
1. Организационный момент
2. Проверка домашнего задания
Учащимся задаются частные вопросы
Какие кислоты вам известны? Запишите формулы известных вам кислот на доске (2-3 ученика записывают формулы кислот на доске, дают им названия, остальные работают в тетради)
Что мы называем кислотой?
На какие группы делятся электролиты по степени диссоциации?
Какие вещества относят к электролитам? К неэлектролитам?
Что такое степень диссоциации?
Ваше домашнее заданием было следующим, пользуясь различными источниками информации приготовить ответ на следующие вопросы: Распространенность кислот в природе?
Какие кислоты используются в качестве пищевых добавок?
(задание выдается учащимся за неделю до проведения занятия)
Компетентностно-ориентированные задания (КОЗ)
Компетентность – коммуникативная/ публичное выступление. Уровень 1.
Представь себя в роли учителя, подготовь выступление на 5 мин. и выступи перед учащимися своего класса. Для подготовки используй Интернет-ресурс.
Подготовь план своего выступления и будь готов ответить на вопросы слушателей.
| Наличие плана | Соот. выст. целям | Наличие наглядного |
матер.
Ответы на вопросы
Использ. источн.
Соблюд. регламента
есть
нет
да
нет
да
нет
нет
кратко
полн. разверн.
да
нет
да
нет
1
0
1
0
1
0
0
1
2
1
0
1
0
3. Объяснение нового материала
Рассмотрим в свете ТЭД свойства веществ, растворы которых обладают электропроводностью
Кислоты – это электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка (примеры учащиеся записывают в тетради)
По признаку основности кислоты подразделяют на 3 группы:
- одноосновные
- двухосновные
- многоосновные
Ребята, приведите примеры данных кислот.
Мы уже знаем, что диссоциация многоосновных кислот протекает ступенчато. Рассмотрим несколько примеров реакции электролитической диссоциации.
Выйти к доске и записать диссоциацию азотной, серной и фосфорной кислот.
4. Важнейшие общие химические свойства кислот
Учитель объясняет материал (объяснение сопровождается демонстрационными опытами). Все реакции проецируются на экране, учащиеся их записывают в тетради.
HCl + NaOH = NaCl + H 2O
H + + Cl – +Na + + OH – = Na + + Cl – + H 2O
Реакция между кислотой и оксидами металлов
СаO + 2H + + SO4 2- = Са 2+ + SO4 2- + H 2O
СаO + 2H + = Са 2+ + H2O
Реакция между кислотой и солью
Кислоты взаимодействуют с металлами. При этом образуются соли, и выделяется водород. Однако металлы, стоящие в электрохимическом ряду напряжений металлов правее водорода, не вытесняют его из кислот:
Zn 0 + 2H + + 2Cl – = Zn 2+ + 2Cl – + H2 0
Zn 0 + 2H + = Zn 2+ + H2 0
Cu + HCl = реакция невозможна
Концентрированные азотная и серная кислоты реагируют с металлами иначе.
5. Работа по проблемным вопросам
Где в повседневной жизни мы применяем знания о свойствах кислот?
Как, используя лишь индикатор определить растворы следующих веществ: серная кислота, вода, гидроксид натрия?
Как надо провести реакцию, чтобы увидеть ее признаки?
Следующий этап работы – работа в парах.
Учащимся выдается КОЗа.
Перед проведением лабораторного опыта учащимся напоминают правила по технике безопасности.
Компетентностно-ориентированные задания (КОЗ)
1. Компетентность разрешения проблем (идентификация (определение) проблемы, действия по решению проблемы – 1 уровень)
У известного писателя Герберта Уэллса есть замечательный научно-фантастический роман о том, что один изобретатель создал удивительную машину, которая могла переносить человека в любую эпоху прошлого или будущего. Представим себе на минутку, что мы владеем подобной машиной. Перенесемся с ее помощью на несколько веков назад.
В те далекие времена люди считали, что всемогущие, сверхъестественные силы могут сделать все. Священнослужители, для убеждения верующих в чудесах, проделывали следующее: медленно, торжественно, с молитвами чистая вода наливается в сосуд, где она немедленно краснеет, приобретая цвет вина. Это “вино” выливают в другой прозрачный сосуд, где происходит его обесцвечивание. “Вино” не дается для пробы на вкус, а любопытство верующих удовлетворяется только изменением цвета жидкости.
И сегодня нам предстоит выяснить: это чудо или же знание химии?
Для ответа на этот вопрос выполните задание, следуя инструкции.
1. В пробирку налейте 2 мл раствора гидроксида натрия и добавьте 2-3 капли фенолфталеина. Какую окраску приобрел раствор?
2. С помощью пипетки к полученному раствору постепенно прибавьте 2мл раствора соляной кислоты. Что вы наблюдаете?
Отчет о выполненной работе занесите в таблицу
| Реактивы (формула и название вещества) | Уравнения химической реакции (в молекулярной и ионной форме) | Наблюдения | Вывод |
| Реактивы (формула и название вещества) | Уравнения химической реакции (в молекулярной и ионной форме) | Наблюдения | Вывод |
| NaOH-гидроксид натрия | Раствор приобрел красную окраску | В щелочной среде фенолфталеин приобретает красную окраску | |
| NaOH-гидроксид натрия |
HCl – соляная (хлороводородная) кислота
NaOH + HCl =NaCl +H2O
Na + + OH – + H + + Cl – = Na + + Cl – +H2 O
OH – + H + = H2 O
Раствор обесцветился
При взаимодействии основания и кислоты происходит реакция нейтрализации, в результате раствор обесцвечивается
2. Компетентность разрешения проблем (идентификация (определение) проблемы, действия по решению проблемы – 2 уровень). Информационная (обработка информации- 2 уровень)
Современная теория электролитической диссоциации говорит о том, что при растворении в воде электролиты распадаются на ионы. Пользуясь этой теорией, и знаниями о свойствах и классификации кислот ответьте на следующие вопросы:
1. С какими из перечисленных веществ взаимодействует разбавленная серная кислота.
- гидроксид калия
- ртуть
- оксид магния
- оксид фосфора
- алюминий
Запишите возможные реакции в ионном виде
2. Даны сокращенные ионные уравнения:
Cоставить полные ионные и молекулярные уравнения
3. Из перечня кислот
серная кислота, азотная кислота, сернистая кислота,
хлороводородная кислота, кремниевая кислота, угольная кислота выберите:
- кислородсодержащие
- нестабильные
- нерастворимые в воде
- двухосновные
6. Модульный ответ
2K + +2OH – + 2H + + SO 2- 4 = 2K + + SO 2- 4 + 2H2O
MgO + 2H + + SO4 2- = Mg 2+ + SO 2- 4+ H 2O
MgO + 2H + = Mg 2+ + H2 O
Ba 2+ + 2Cl – + 2H + + SO4 2- = BaSO4 + 2H + + 2Cl –
2K + + CO 2- 3 + 2H + + 2Cl – = 2K + +2Cl – + CO2 + H2 O
3) нерастворимые в воде:
8. Домашнее задание
Как различить растворы серной кислоты, хлорида бария, сульфата меди (II), гидроксида натрия, не имея других реактивов? Дать объяснение, записать уравнения химических реакций в молекулярной, полной и сокращенной ионной форме.
Даны сокращенные ионные уравнения реакций:
1) 2OH – + 2H + = 2H2O
2) СаO + 2H + = Са 2+ + H2 O
4) Fe 3+ + 3OH – = Fe(OH)3
Составить полные ионные и молекулярные уравнения реакций.
Записать уравнения химических реакций в молекулярной, полной и сокращенной ионной форме.
Теория электролитической диссоциации

Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
[spoiler title=”источники:”]
http://urok.1sept.ru/articles/550243
http://chemege.ru/ted/
[/spoiler]
Электролитическая диссоциация
Электролитическая диссоциация – распад электролитов в водных растворах на ионы.
ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ (ТЭД), С.А. Аррениус:
- Электролиты в водных растворах диссоциируют на ионы: положительные (катионы) и отрицательные (анионы). Перешедшие в раствор ионы окружены молекулами воды – гидратированы.
- Сумма зарядов положительных ионов равна сумме зарядов отрицательных ионов (раствор в целом электронейтрален)
- Процесс электролитической диссоциации обратимый. Наряду с диссоциацией происходит обратный процесс – ассоциация ионов.
Процесс диссоциации записывают в виде уравнений (уравнений электролитической диссоциации):
KCl = K+ + Cl–; Al2(SO4)3 = 2Al3+ + 3SO42-; H3PO4 ↔ H+ + H2PO4–
СИЛЬНЫЕ И СЛАБЫЕ ЭЛЕКТРОЛИТЫ
Сила электролита определяется степенью диссоциации ά. На степень диссоциации влияют: виды связей в веществе, природа растворителя, концентрация раствора (с уменьшением концентрации ά увеличивается), температура ( с ростом t ά увеличивается, т.к. диссоциация – процесс эндотермический).
Сильные электролиты диссоциированы практически нацело. В растворе нет молекул, есть только ионы.
сильные кислоты (не все кислоты!)- HNO3– азотная; HCl– соляная; H2SO4-серная; HBr- бромоводородная; HI- иодоводородная
сильные основания (все щелочи) – LiOH – гидроксид лития; NaOH – гидроксид натрия; KOH – гидроксид калия; Ca(OH)2 – гидроксид кальция; Ba(OH)2 – гидроксид бария
все растворимые соли
Неперечисленные вещества являются слабыми или средней силы электролитами или неэлектролитами.
Н2О – очень слабый электролит.
Кислоты, основания и соли в свете ТЭД
Кислоты – это электролиты, диссоциирующие в растворах с образованием катионов водорода
HNO3 = Н+ + NO3– H2SO4 = 2Н+ + SO42- сероводородная кислота Н2S ↔ Н+ + НS–
Знак обратимости ↔ используется в уравнениях диссоциации
слабых и средней силы электролитов
Основания – это электролиты, диссоциирующие в растворах с образованием гидроксид – ионов (ОН–)
KOH = K+ + OH– Ba(OH)2 = Ba2+ + 2OH–
Соли – это электролиты, диссоциирующие в растворах с образованием катионов металлов и анионов кислотных остатков
К3РО4 = 3K+ + PO42- Al2(SO4)3 = 2Al3+ + 3SO42-
Формулы и заряды катионов металлов и анионов кислотных остатков есть в
таблице растворимости кислот, оснований, солей !
Итак.
1.Электролиты в водных растворах диссоциируют:
- кислота = катионы водорода + анион кислотного остатка HCl = H+ + Cl–
- основание = катион металла и гидроксид-анионы NaOH = Na+ + OH–
- соль = катионы металла + анионы кислотного остатка КCl = К+ + Cl–
2. Индекс в формуле вещества становится коэффициентом перед формулой иона в уравнении диссоциации
Na2CO3 = 2Na+ + CO32- FeCl3 = Fe3+ 3Cl–
ИОННЫЕ РЕАКЦИИ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ
Реакции, протекающие с участием растворов электролитов, являются реакциями между ионами. Их принято записывать с помощью ионных уравнений.
Правила составления ионных уравнений:
- Напишите молекулярное уравнение (не забудьте про коэффициенты). По таблице растворимости определите растворимость всех веществ и запишите над формулами
Р Р Н Р
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
- Перепишите это уравнение, записывая сильные электролиты как сумму соответствующих ионов, а слабые электролиты, нерастворимые и газообразные вещества – в молекулярной форме. Получите полное ионное уравнение
2Na+ + SO42- + Ba2+ + 2Cl– = BaSO4↓ + 2Na+ + 2Cl–
- «Сократите» одинаковые ионы (выделены курсивом) в левой и правой части уравнения и запишите сокращенное ионно-молекулярное уравнение, отражающее суть процесса (показывает участвующие в реакции частицы и продукты реакции)
Ba2+ + SO42- = BaSO4↓
Реакции в растворах могут протекать: 1)необратимо; 2) обратимо; 3) практически не идут
Реакции идут до конца (необратимо), если концентрация
ионов в растворе уменьшается за счет связывания их c образованием:
А) нерастворимых и малорастворимых веществ
p p н p
KCl + AgNO3 = AgCl↓ + KCl
K+ + Cl– + Ag+ + NO3– = AgCl↓ + K+ + NO3–
Ag+ + Cl– = AgCl↓
p p н р
2H3PO4 + 3BaCl2 = Ba3(PO4)2↓ + 6HCl (H3PO4 – не сильный электролит, H3PO4↔Н+ + H2PO4–.
Иногда H3PO4 записывают в недиссоциированном виде)
Вариант 1. 2H3PO4 + 3Ba2+ + 6Cl– = Ba3(PO4)2↓ + 6H+ + 6Cl–
2H3PO4 + 3Ba2+ = Ba3(PO4)2↓ + 6H+
Вариант 2. 2H+ + 2H2PO4– + 3Ba2+ + 6Cl– = Ba3(PO4)2↓ + 6H+ + 6Cl–
2H2PO4– + 3Ba2+ = Ba3(PO4)2↓ + 4H+
В) газов
р р р
K2S + 2HCl = 2KCl + H2S↑ (↑ – газ)
2K+ + S2- + 2H+ + 2Cl– = 2K+ + 2Cl– + H2S↑
2H+ + S2- = H2S↑
Газ получается также при образовании нестойких: угольной кислоты H2CO3 = H2O + CO2↑
сернистой кислоты H2SO3 = H2O + SO2↑
гидроксида аммония NH4OH = H2O + NH3↑
например:
p p p
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O
2Na+ + CO32- + 2H+ + 2Cl– = 2Na+ + 2Cl– + CO2↑ + H2O
CO32- + 2H+ = CO2↑ + H2O
В) слабых электролитов (обычно воды):
р р p
Ba(OH)2 + 2HCl = BaCl2 + 2H2O
Ba2+ + 2OH– + 2H+ + 2Cl– = Ba2+ + 2Cl– + 2H2O
2H+ + 2OH– = 2H2O
упростим коэффициенты H+ + OH– = H2O
Пример реакции, которая не идет до конца:
p p p p
2NaCl + Ba(NO3)2 = BaCl2 + 2NaNO3
2Na+ +2Cl– + Ba2+ + 2NO3– = Ba2+ + 2Cl– + 2Na+ + 2NO3–
Все ионы «сокращаются» – нет ионов, связывающихся и образующих продукты реакции.
