
Основные термины и понятия

Составление уравнений химических реакций невозможно без знания определённых обозначений, показывающих, как проходит реакция. Объединение атомов, имеющих одинаковый ядерный заряд, называют химическим элементом. Ядро атома состоит из протонов и нейтронов. Первые совпадают с числом атомного номера элемента, а значение вторых может варьироваться. Простейшими веществами называют элементы, состоящие из однотипных атомов.
Любой химический элемент описывается с помощью символов, условно обозначающих структуру веществ. Формулы являются неотъемлемой частью языка науки. Именно на их основе составляют уравнения и схемы. По своей сути они отражают количественный и качественный состав элементов. Например, запись HNO3 сообщает, что в соединении содержится одна молекула азотной кислоты, а оно само состоит из водорода, азота и кислорода. При этом в состав одного моля азотной кислоты входит по одному атому водорода и азота и 3 кислорода.
Символика элементов, условное обозначение, представляет собой химический язык. В значке содержится информация о названии, массовом числе и порядковом номере. Международное обозначение принято, согласно периодической таблице Менделеева, разработанной в начале 1870 года.
Взаимодействующие между собой вещества называются реагентами, а образующиеся в процессе реакции — продуктами. Составление и решение химических уравнений фактически сводится к определению результатов реакций, поэтому просто знать формулы веществ мало, нужно ещё уметь подбирать коэффициенты. Располагаются они перед формулой и указывают на количество молекул или атомов, принимающих участие в процессе. С правой стороны от химического вещества ставится индекс, указывающий место элемента в системе.
Записывают уравнения в виде цепочки, в которой указываются все стадии превращения вещества начиная с левой части. Вначале пишут формулы элементов в исходном состоянии, а затем последовательно их преобразование.
Виды химических реакций
Химические явления характеризуются тем, что из двух и более элементов образуются новые вещества. Уравнения описывают эти процессы. Впервые с объяснениями протекания реакций знакомят в восьмом классе средней образовательной школы на уроках неорганической химии. Ученикам демонстрируют опыты, в которых явно наблюдаются различия в протекании реакций.
Всего существует 4 типа химического взаимодействия веществ:

- Соединение. В реакцию могут вступать 2 простых вещества: металл и неметалл или неметалл и неметалл. Например, алюминий с серой образуют сульфид алюминия. Кислород, взаимодействуя с водородом, превращается в воду. Объединятся могут 2 оксида с растворимым основанием, как оксид кальция с водой: CaO + H2O = Ca (OH)2 или основной оксид с кислотным: CaO + SO3 = CaSO4.
- Разложение. Это процесс обратный реакции соединения: было одно вещество, а стало несколько. Например, при пропускании электрического тока через воду получается водород и кислород, а при нагревании известняка 2 оксида: CaCO3 = CaO + CO2.
- Замещение. В реакцию вступают 2 элемента. Один из них простой, а второй сложный. В итоге образуются 2 новых соединения, при котором атом простого вещества заменяет сложный, как бы вытесняя его. Условие протекания процесса: простое вещество должно быть более активным, чем сложное. Например, Zn + 2HCl = ZnCl2 + H2. Величину активности можно узнать из таблицы ряда электрохимических напряжений.
- Обмен. В этом случае между собой реагируют 2 сложных элемента, обменивающиеся своими составными частями. Условием осуществления такого типа реакции является обязательное образование воды, газа или осадка. Например, CuO + 2HCl = CuCl2 + H2O. Чтобы узнать, смогут ли вещества прореагировать, используют таблицу растворимости.
Основными признаками химических реакций является изменение цвета, выделение газа или образование осадка. Различают их по числу веществ, вступивших в реакцию и образовавшихся продуктов. Правильное определение типа реакции особо важно при составлении химических уравнений, а также определения свойств и возможностей веществ.
Окислительно-восстановительный процесс

Составление большинства реакций сводится к подбору коэффициентов. Но при этом могут возникнуть трудности с установлением равновесия, согласно закону сохранения массы веществ. Чаще всего такая ситуация возникает при решении заданий, связанных с расстановкой количества атомов в уравнениях окислительно-восстановительных процессов.
Под ними принято понимать превращения, протекающие с изменением степени окисления элементов. При окислении происходит процесс передачи атомом электронов, сопровождающийся приобретением им положительного заряда или ионом, после чего он становится нейтральным. При этом также происходит процесс восстановления, связанный с присоединением элементарных частиц атомом.
Для составления уравнений необходимо определить восстановитель, окислитель и число участвующих в реакции электронов. Коэффициенты же подбирают с помощью метода электронно-ионного баланса (полуреакций). Его суть состоит в установлении равенства путём уравнивания количества электронов, отдаваемых одним элементом и принимаемым другим.
Классический алгоритм
В основе решения задач этим методом — закон сохранения массы. Согласно ему, совокупная масса элементов до реакции и после остаётся неизменной. Другими словами, происходит перегруппировка частиц. Если рассматривать решение химического уравнения поэтапно, оно будет состоять из трёх шагов:
- Написания формул элементов, вступающих в реакцию с левой стороны.
- Указания справа формулы образующихся веществ.
- Уравнивания числа атомов с добавлением коэффициентов.
Перед тем как переходить к сложным соединениям, лучше всего потренироваться на простых. Например, нужно составить уравнение, описывающее взаимодействие двух сложных веществ: гидроксида натрия и серной кислоты. При таком соединении образуется сульфат натрия и вода.

Согласно алгоритму, в левой части уравнения необходимо записать реагенты, а в правой продукты реакции: NaOH + H2SO 4 → Na 2SO4 + H2O. Теперь следует уравнять коэффициенты. Начинают с первого элемента. В примере это натрий. В правой части содержится 2 его атома, а в левой один, поэтому необходимо возле реагента поставить цифру 2. Затем нужно уровнять водород. В результате получится выражение: 2 NaOH + H2SO 4 → Na2 SO4 +2H2O.
Ещё одним наглядным примером является процесс реакции тринитротолуола с кислородом. При их взаимодействии образуется: C7H5N3O6 + O2 → CO2 + H2O + N2. Исходя из того, что слева находится нечётное число атомов H и N, а справа чётное, нужно их уравнять: 2C7H5N3O6 + O2 → CO2 + H2O + N2.
Теперь становится понятным, что 14 и 10 атомов углерода и водорода должны образовать 14 долей диоксида и 5 молекул воды. При этом 6 атомов азота превратятся в 3. Итоговое уравнение будет выглядеть как 2C7H5N3O6 + 10,5O2 → 14CO2 + 5H2O + 3N2.
Перед тем как начинать тренировку по составлению уравнений, следует научиться расставлять валентность. Это параметр, равный числу соединившихся атомов каждого элемента. Фактически это способность к соединению. Например, в формуле NH3 валентность атома азота равна 3, а водорода 1.
Решение методом полуреакций
Алгоритм для решения примеров химических уравнений проще рассмотреть на конкретном задании. Пускай необходимо описать процесс окисления пирита азотной кислоты с малой концентрацией: FeS2 + HNO3. Решать этот пример необходимо в следующей последовательности:

- Определить продукты реакции. Так как кислота является сильным окислителем, сера получит максимальную степень оксидации S6+, а железо Fe3+. HNO3 может восстановиться до одного из двух состояний NO2 или NO.
- Исходя из состава ионов и правила, что вещества, переходящие в газовую форму или плохо растворимые, записываются в молекулярном виде, верным будет записать: FeS2 — Fe3+ + 2SO2−4. Гидролизом можно пренебречь.
- В записи уравнивают кислород. Для этого в левую часть добавляют 8 молекул воды, а в правую 16 ионов водорода: FeS2 + 8H20 — Fe3+ + 2SO2−4 + 16H+. Так как заряда в левой части нет, а в правой он равный +15, то серное железо должно будет отдать 15 электронов. Значит, уравнение примет вид: FeS2 + 8H20 — 15e → Fe3+ + 2SO2−4 + 16H+.
- Теперь переходят к реакции восстановления нитрата иона: NO-3 →NO. Для её составления нужно отнять у оксида азота 2 атома кислорода. Делают это путём прибавления к левой части 4 ионов водорода, а правой — 2 молекул воды. В итоге получится: NO-3 + 4H+ → NO + 2H2O.
- Полученную формулу уравнивают добавлением к левой части 3 электронов: NO-3 + 4H+ 3e → NO + 2H2O.
- Объединяют найденные выражения и записывают результат: FeS2 + 8H20 + 5NO-3 + 20H+ → Fe3+ + 2SO2−4 + 16H+ + 5NO + 10H2O.
-
Уравнение можно сократить на 16H+ и 8H2O. В итоге получится сокращённое выражение окислительно-восстановительной реакции: FeS2 + 5NO–3 + 4 H+ = Fe3+ + 2SO2-4 + 5NO + 2H2O.

- Добавив в обе части нужное количество ионов, записывают молекулярное уравнение: FeS2 + 8HNO3 = Fe (NO 3) 3 + 2H2SO4 + 5NO + 2H2O.
Такой алгоритм считается классическим, но для упрощения понимания лучше использовать способ электронного баланса. Процесс восстановления переписывают как N5+ + 3e → N2+. Степень же окисления составить сложнее. Сере нужно приписать степень 2+ и учесть, что на 1 атом железа приходится 2 атома серы: FeS2 → Fe3++ 2S6+. Запись общего баланса будет выглядеть: FeS2 + 5N5+ = Fe3+ + 2S6+ + 5N2+.
Пять молекул потратятся на окисление серного железа, а ещё 3 на образование Fe (NO3)3. После уравнения двух сторон запись реакции примет вид, аналогичный полученному с использованием предыдущего метода.
Использование онлайн-расчёта

Простые уравнения решать самостоятельно довольно просто. Но состоящие из сложных веществ могут вызвать трудности даже у опытных химиков. Чтобы получить точную формулу и не подбирать вручную коэффициенты, можно воспользоваться онлайн-калькуляторами. При этом их использовать сможет даже пользователь, не особо разбирающийся в науке.
Чтобы расстановка коэффициентов в химических уравнениях онлайн происходила автоматически, нужно лишь подключение к интернету и исходные данные. Система самостоятельно вычислит продукты реакции и уравняет обе стороны формулы. Интересной особенностью таких сайтов является не только быстрый и правильный расчёт, но и описание правил с алгоритмами, по которому выполняются действия.
После загрузки калькулятора в веб-обозревателе единственное, что требуется от пользователя — правильно ввести реагенты в специальные формы латинскими буквами и нажать кнопку «Уравнять». Иногда возникает ситуация, когда запись сделана верно, но коэффициенты не расставляются. Это происходит, если суммы в уравнении могут быть подсчитаны разными способами. Характерно это для реакций окисления. В таком случае нужно заменить фрагменты молекул на любой произвольный символ. Таким способом можно не только рассчитать непонятное уравнение, но и выполнить проверку своих вычислений.
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.

Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
![]()
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
![]()
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
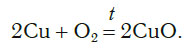
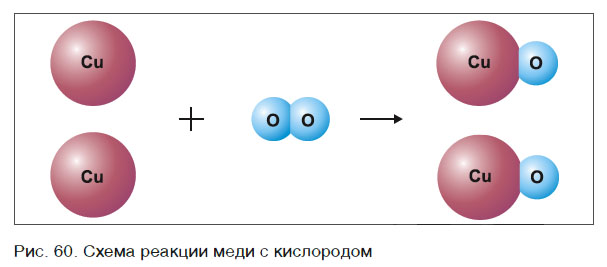
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
![]()
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
![]()
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
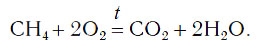
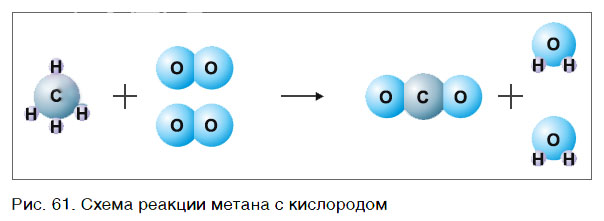
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Друзья, один из нас читает сейчас курс химии в старшей школе (10-11 кл.) С удивлением было обнаружено, что за два предыдущих года (8-9 кл.) некоторым ученикам не объяснили смысл и правила написания уравнений химических реакций. Они (ученики) уравнения реакций просто не понимают. Вопрос “как это вообще возможно – не объяснить УР” оставим за кадром, поговорим о самих уравнениях.
Смысл уравнения прост: описать, сколько каких веществ вступило в реакцию, и что при этом получилось. Собственно, можно было бы обходиться без уравнений. Можно было бы описывать химическую реакцию обычными словами, русским по белому. Получалось бы примерно так:
Два моля гидроксида натрия взаимодействуют с одним молем серной кислоты, в результате чего получается один моль сульфата натрия и два моля воды.
Удобно? По нашему мнению, не особо. Куда проще так:
2NaOH + H2SO4 = Na2SO4 + 2H2O
Ведь каждое вещество имеет формулу, и намного быстрее написать “NaOH” вместо “гидроксид натрия”. Вдобавок, используя формулы, мы чётко видим, атомы каких элементов задействованы в реакции. И можем их посчитать! Зачем? Потому что должны. Потому что законы сохранения вещества/массы/энергии и т.п. не позволяют никакому атому пропасть “в никуда” или возникнуть “из ниоткуда”. Иными словами: сколько атомов какого-либо элемента было ДО реакции, столько же осталось и ПОСЛЕ. И мы это обязаны показать. Да, они теперь в составе другого вещества, ну и что же? Для верного написания важно лишь их количество. Это всё те же атомы, другим “из ниоткуда” не возникнуть. Уравнение – от слова “равенство”, в том числе – равенство в количестве атомов одинаковых элементов.
Атомы, конечно, очень маленькие частицы. И их, конечно, очень-очень-очень много. Так, в 18 граммах воды H2O (это – примерно одна столовая ложка) содержится около 602000000000000000000000 молекул воды, соответственно – столько же атомов кислорода (число Авогадро, да. 6,02*10^23). Писать в уравнении такие гигантские цифры – ну очень неудобно, согласитесь. Мы их и не пишем. Мы пишем количество молей, помня, что один моль – это как раз 6,02*10^23 атомов (или молекул, или ионов).
Эти цифры мы пишем перед формулой вещества, просто-напросто сравнивая “сколько было” молей таких атомов и “сколько стало”. Т.е. – что в левой части уравнения (до знака равенства), и что – справа. Запишем, для примера, уравнение реакции между гидроксидом натрия и серной кислотой. NaOH + H2SO4 = Na2SO4 + H2O. Здесь слева один моль натрия (единицы мы никогда не пишем, они подразумеваются “по умолчанию”. Т.е. не “Na1O1H1”, а просто – “NaOH”). Справа же, после знака равенства, натрия – два моля. Na2SO4. Значит, не один, а два моля натрия было и в начале, не может же целый моль атомов взяться из ниоткуда! Т.е. мы просто обязаны указать для левой части записи: “два моля натрия”. Как? Пишем цифру 2. Перед формулой! Мы не имеем никакого права вписывать цифры внутри формулы, иначе это получится другое вещество. Если, к примеру, в H2O поменять двойку на любую другую цифру, это уже не будет вещество “вода”, это будет что-то другое и скорее всего ошибочное. По той же самой причине нельзя записать так: “Na2OH”.
Итак, пишем “2” перед гидроксидом натрия: 2NaOH + H2SO4 = Na2SO4 + H2O. Цифра перед формулой вещества действует для всех элементов в этой формуле. Это как общий множитель перед скобкой в математике – действует на всё, что в скобках. Запись “2NaOH” означает два моля атомов натрия, два моля атомов кислорода и два моля атомов водорода. (В растворе это вещество диссоциирует (распадается) не на атомы, конечно, а на ионы Na (+) и OH (-), заряженные частицы. Для уравнения это не имеет никакого значения).
Едем дальше, подсчитываем атомы остальных элементов. Два моля атомов водорода из 2NaOH и ещё два – из H2SO4. В сумме – четыре. А справа, после знака равенства? Всего два, из H2O. Надо, чтобы справа тоже было четыре. Записать H4O вместо H2O – недопустимо, это уже не вода тогда, а невесть что. Можем только перед формулой воды поставить цифру. Какую? Конечно, “2”. Ведь два водорода в H2O уже есть, а с “общим множителем” как раз получится 2 x 2 = 4.
Имеем: 2NaOH + H2SO4 = Na2SO4 + 2H2O. Посчитаем количество молей атомов кислорода: слева 2 в 2NaOH и ещё 4 – в H2SO4. 2 + 4 = 6. Справа 4 в Na2SO4 и ещё 2 в 2H2O. 4 + 2 = 6. Совпало, никаких дополнительных цифр ставить не надо: кислород этого “не требует”. Сера: 1 слева и 1 справа, тоже всё в порядке. То есть, уравнение записано верно. Количество атомов одного и того же элемента слева (до знака равенства) и справа (после знака равенства) одинаковое. Уравняли. Что нам это даёт, кроме чувства глубокого морального удовлетворения от того, что законы Вселенной соблюдены? Это даёт нам возможность вести расчёты по этим уравнениям. Ведь расставленные нами цифры перед формулами (мы называем их “коэффициенты”) показывают соотношение в количествах реагентов и продуктов. Запись “2NaOH + H2SO4 = ” показывает, что 2 моля NaOH реагирует с 1 молем H2SO4. И это соотношение будет выполняться всегда: если гидроксида натрия будет не 2, а 20 молей, то серной кислоты потребуется не 1, а 10 молей. Соответственно, по имеющимся данным для одного вещества всегда получится рассчитать, сколько нужно другого и сколько образуется продуктов реакции. Пример:
Сколько потребуется серной кислоты для реакции с гидроксидом натрия, если того взято 120 граммов, а реакция прошла полностью?
Многие расчётные задачи по химии сводятся к подобной. Чаще всего, в них бывает дополнительный балласт условий, чтобы действий вышло побольше. Могут даваться массовые доли растворов (например, может быть сказано – 120 граммов 20%-го раствора NaOH, и тогда ещё одним действием понадобится перейти к “чистым” веществам). Но про это как-нибудь в другой раз. Любая подобная задача всё равно сводится к “расчётам по молям”. Для этого запишем уравнение реакции и посчитаем, сколько молей NaOH составят 120 граммов.
2NaOH + H2SO4 = Na2SO4 + 2H2O. Молярная масса NaOH считается при помощи таблицы Менделеева (складываются атомные массы всех элементов: у натрия – 23, у кислорода – 16 и у водорода – 1). M (NaOH) = 23 + 16 + 1 = 40 г/моль. По условию у нас есть 120 граммов NaOH, соответственно, это 3 моля (масса m, молярная масса M и количество вещества n связаны формулой m = Mn откуда следует n = m/M). Теперь к уравнению: мы своими руками записали 2 перед NaOH. Это означает, что 2 моля гидроксида натрия будут реагировать с 1 молем серной кислоты. Но у нас 3 моля гидроксида натрия! Очевидно, если двум молям NaOH нужен один моль H2SO4, то трём молям NaOH понадобится 1,5 моля H2SO4. Это, вообще-то, решается пропорцией:
Но в случае таких простых чисел – всё легко считается и в уме. 1,5 моля серной кислоты надо “перевести” в граммы, через молярную массу H2SO4 (считается по таблице Менделеева и получается 98 г/моль). m = Mn, m (H2SO4) = 98 г/моль x 1,5 моля = 147 граммов. Это и будет ответом, который получен на основе верно записанного уравнения химической реакции. Вот для чего нужны уравнения: для расчётов.
Множество уравнений реакций, которые попадаются в школьной программе, можно уравнять простым подбором нужных коэффициентов. Что называется, “на пальцах” посчитать. Но иногда это бывает непросто, неочевидно. Хотите – напишем несколько “лайфхаков” для таких случаев? Вообще, мы бы хотели получить “обратную связь”: нужно ли время от времени делать лонгриды по “школьным” темам? Что скажете, друзья?
Составление уравнений химических реакций
Урок посвящен изучению алгоритма составления уравнения химической реакции. В ходе урока вы научитесь составлять схему и уравнение химической реакции, зная формулы исходных веществ и продуктов реакции.
I. Схема химической реакции
Сущность химической реакции с позиции атомно-молекулярной теории заключается в том, что продукты реакции образуются из тех же атомов, которые входили в состав исходных веществ.
Пример 1. При разложении воды образуются простые вещества – водород и кислород (Рис.1.).

Рис. 1. Разложение воды под действие электрического тока
Запишем формулу исходного вещества воды слева, а формулы продуктов реакции – водорода и кислорода – справа. Между ними поставим стрелку:
Н2О → Н2 + О2
Эта запись является схемой реакции.
Схема реакции показывает только состав исходных веществ и продуктов реакции, но не может полностью отражать сущность реакции. В состав молекулы воды входит один атом кислорода, а в состав простого вещества кислорода входят два атома. Это значит, что не выполняется закон сохранения массы веществ.
II. Химические уравнения реакций
Химическое уравнение – это условная запись химической реакции посредством химических формул и коэффициентов.
Видео – эксперимент: “Нагревание смеси железа и серы”
В результате химического взаимодействия серы и железа получено вещество – сульфид железа (II) – оно отличается от исходной смеси. Ни железо, ни сера не могут быть визуально обнаружены в нем. Невозможно их разделить и с помощью магнита. Произошло химическое превращение.
Исходные вещества, принимающие участие в химических реакциях называются реагентами.
Новые вещества, образующиеся в результате химической реакции называются продуктами.
Запишем протекающую реакцию в виде уравнения химической реакции:
Fe + S = FeS
Рассмотрим еще один пример: 2Н2О = 2Н2 + О2
Чтобы не было противоречий с законом сохранения массы веществ, нужно уравнять число атомов каждого химического элемента слева и справа от стрелки.
Чтобы образовалась одна молекула кислорода, в реакцию должны вступить две молекулы воды. Поставив коэффициент «2» перед формулой воды. Теперь уравняем количество атомов водорода, поставив коэффициент «2» перед формулой Н2, вместо стрелки поставим знак равенства:
Эта запись является уравнением химической реакции. В отличие от схемы реакции, уравнение учитывает, что число атомов каждого химического элемента в реакции не меняется.
Цифры, стоящие перед формулой вещества, называются коэффициентами. Коэффициент показывает количество молекул вещества.
Прочитать записанное уравнение можно так: «Из двух молекул воды образуется две молекулы водорода и 1 молекула кислорода».
III. Алгоритм составления уравнения химической реакции
|
Составим уравнение химической реакции взаимодействия фосфора и кислорода |
|
1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 → |
|
2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов: P + O2 → P2O5 |
|
3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции.
4P + 5O2 = 2P2O5 |
IV. Работа с тренажерами
V. Задания для закрепления
Задание №1
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:
Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
Задание №2
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2
2) Na и Cl2
3) Al и S



