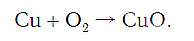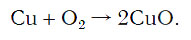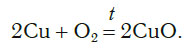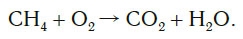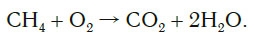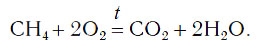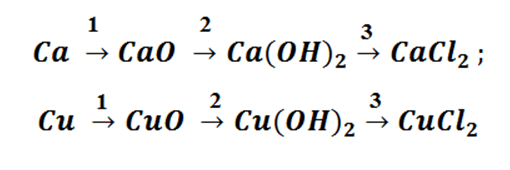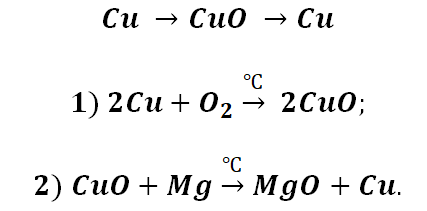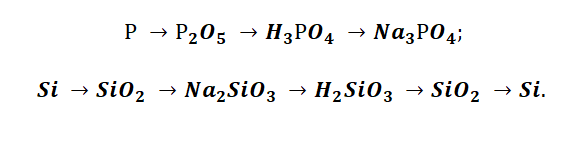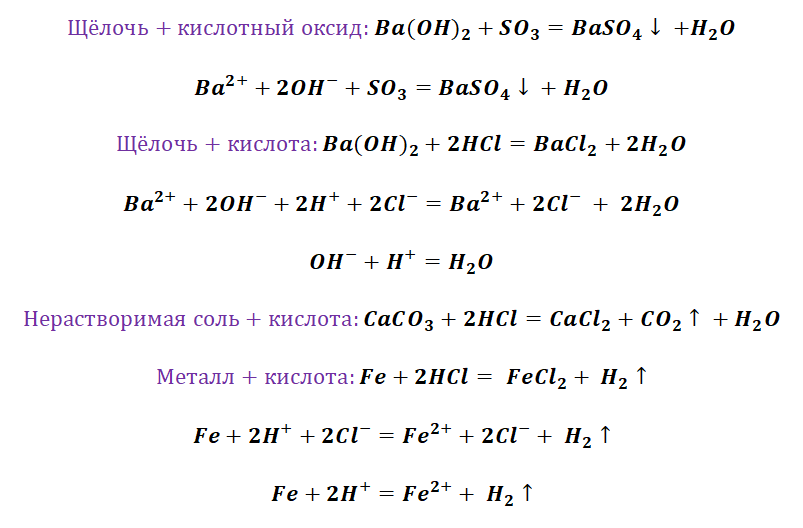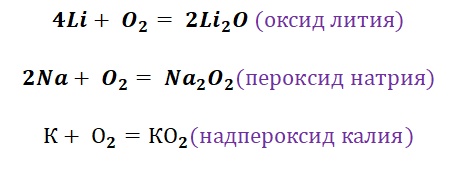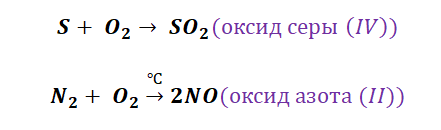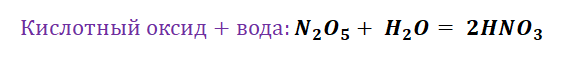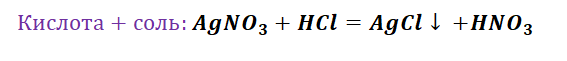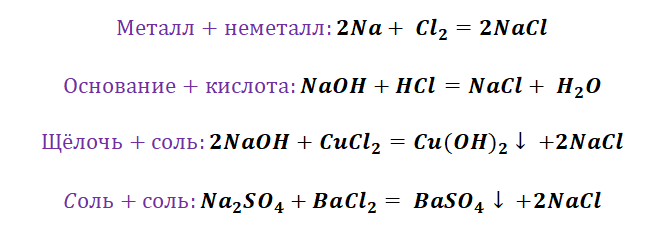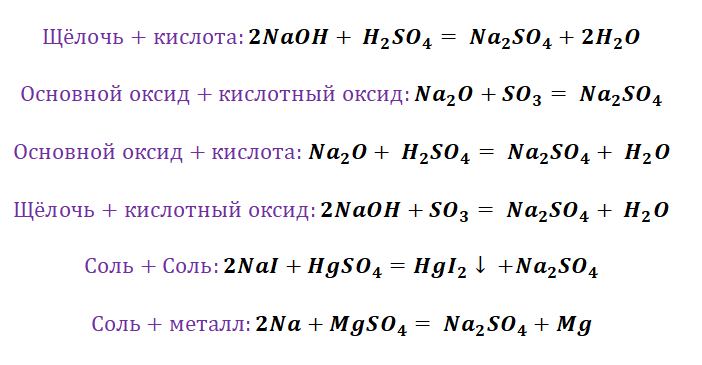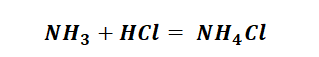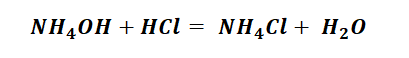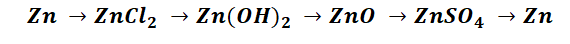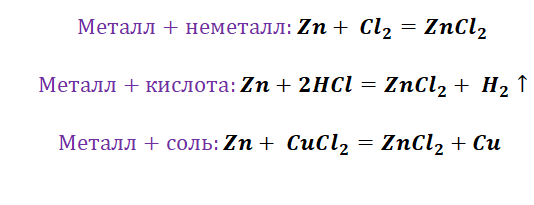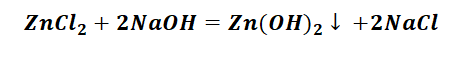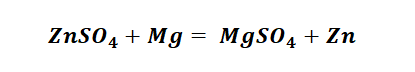Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних
веществ в другие, которые характеризуют генетическую связь между основными
классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные
классы соединений, их номенклатуру, химические свойства, механизм
осуществления реакций.
Алгоритм решения
«цепочки превращений»
1 шаг. Перепишите
цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2
→ Ca3(PO4)2
2 шаг. Пронумеруйте
количество реакций для удобства решения
1
2 3
Ca → CaO → Ca(OH)2
→ Ca3(PO4)2
Таким
образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1
уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним,
что данное превращение происходит, когда металлы окисляются на воздухе, вступая
в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте
уравнивать реакции!
1) 2Сa + O2 2Ca+2O-2
4 шаг.
Осуществляем второе превращение. Из оксида кальция (CaO) нужно
получить гидроксид кальция (Ca(OH)2). Это уравнение
возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в
итоге получается щелочь – растворимое в воде основание). Записываем
уравнение и уравниваем его.
2) 2Ca+2O-2 + H2O → Ca 2+(OH)2–
5 шаг. Осуществляем
3 превращение. Из гидроксида кальция (Ca(OH)2)
необходимо получить соль – фосфат кальция (Ca3(PO4)2).
Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода.
Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как
именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2–
+ 2H3+PO43- → Ca32+(PO4)23-
+ 6H2O
Please wait.
We are checking your browser. gomolog.ru
Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2ec976884f6b3f • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Урок 12. Составление уравнений химических реакций
В уроке 12 «Составление уравнений химических реакций» из курса «Химия для чайников» мы научимся составлять уравнения химических реакций и правильно расставлять в них коэффициенты.
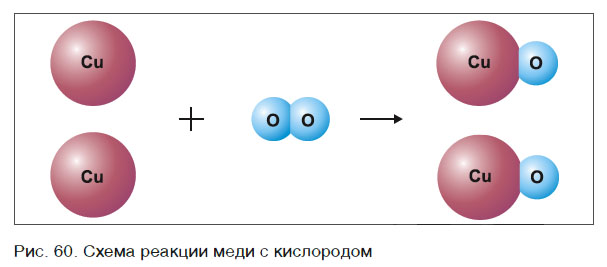
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
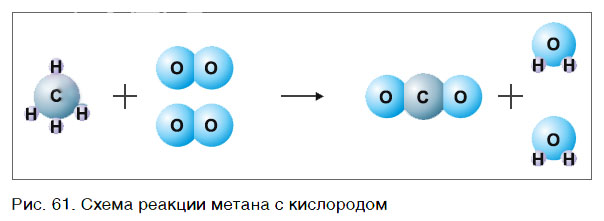
Рассмотрим еще один пример химической реакции между веществами СН4 (метан) и кислородом. Составим схему реакции, в которой слева запишем формулы метана и кислорода, а справа — формулы продуктов реакции — воды и соединения углерода с кислородом (углекислый газ):
Обратите внимание, что в левой части схемы число атомов углерода равно их числу в правой части. Поэтому уравнивать нужно числа атомов водорода и кислорода. Чтобы уравнять число атомов водорода, поставим перед формулой воды коэффициент 2:
Теперь число атомов водорода справа стало 2×2=4 и слева — также четыре. Далее посчитаем число атомов кислорода в правой части схемы: два атома кислорода в молекуле углекислого газа (1×2=2) и два атома кислорода в двух молекулах воды (2×1=2), суммарно 2+2=4. В левой части схемы кислорода только два атома в молекуле кислорода. Для того чтобы уравнять число атомов кислорода, поставим коэффициент 2 перед формулой кислорода:
В результате проведенных действий число атомов всех химических элементов до реакции равно их числу после реакции. Уравнение составлено. Читается оно так: це-аш-четыре плюс два о-два равно це-о-два плюс два аш-два-о (рис. 61).
Данный способ расстановки коэффициентов называют методом подбора.
В химии существуют и другие методы уравнивания чисел атомов элементов в левой и правой частях уравнений реакций, с которыми мы познакомимся позднее.
Краткие выводы урока:
Для составления уравнений химических реакций необходимо соблюдать следующий порядок действий.
- Установить состав исходных веществ и продуктов реакции.
- Записать формулы исходных веществ слева, продуктов реакции — справа.
- Между левой и правой частями уравнения сначала поставить стрелку.
- Расставить коэффициенты, т. е. уравнять числа атомов каждого химического элемента до и после реакции.
- Связать левую и правую части уравнения знаком «=» (равно).
Надеюсь урок 12 «Составление уравнений химических реакций» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос А12 теста ЕГЭ по химии — «Взаимосвязь неорганических веществ»
Если посмотрите это задание в вариантах ЕГЭ, то там дана схема превращений неорганических веществ и в ответах даны варианты реагентов. Как решать такие задачи?
Темы, которые нужно знать:
Составить уравнения реакций по схеме превращений
На самом деле это не так и сложно. Для этого необходимо знать типы реакций и основные условия их протекания.
1. Химические реакции соединения
- Реакция горения — одна из самых распространенных химических реакций соединения — все вещества горят — и металлы, и неметаллы:
- Химические реакции соединения металла и неметалла — приводят к образованию солей:
(а вот этот момент надо запомнить (или выучить) — железо при взаимодействии с соляной кислотой дает хлорид железа (II), а с хлором — простым веществом — хлорид железа (III))
- Неметаллы также могут взаимодействовать между собой:
2. Составление уравнений реакций по схеме — реакции разложения
- Обычно уравнения реакций разложения солей дают соответствующие основные и кислотные оксиды:
Исключения:
- по-другому разлагаются нитраты — в зависимости от металла, входящего в состав соли. Это можно прочитать >;
- хлорид аммония — NH4Cl — разлагается до аммиака и соляной кислоты: NH4Cl = NH3 + HCl;
- не разлагаются сульфаты
- соли, образованные сильными окислителями:
- Разлагаются некоторые основания:
3. Составление уравнений реакций по схеме — п римеры реакций замещения
- реакция замещения водорода в кислотах:
когда нам дана реакция замещения металлом водорода в кислотах, нужно учитывать электрохимический ряд напряжений металлов: металлы, находящиеся в ряду ДО водорода, вытесняют его из кислот:
2Na + 2HCl = 2NaCl + H2
- реакции замещения в солях:
Ca + 2NaCl = CaCl2 +2 Na
Правило: предыдущий металл вытесняет последующий из его солей
(т.е. реакция Na + CaCl2 не будет идти)
4. Составление уравнений реакций по схеме — р еакции обмена веществ
Здесь следующие правила — обменные реакции идут в сторону образования продуктов при:
- выпадении осадка: NaCl + AgNO3 = AgCl↓ + NaNO3
- выделении газа: Na2CO3 + HCl = NaCl + CO2 + H2O ;
- образовании малодиссоциирующего вещества (H2O, NH4OH, органические кислоты и соли и т.д.): NaOH + H2SO3 = Na2SO3 + H2O
Взаимосвязь неорганических веществ можно отобразить такой таблицей:
Теория, это, конечно, хорошо, но давайте попрактикуемся — попробуем составить уравнения реакций по схемам превращений
В первой реакции к меди можно прибавить либо AgNO3, либо HNO3 — в ряду напряжений медь стоит до серебра, а азотная кислота будет давать окислительно-восстановительную реакцию.
Во второй части схемы нам подходит K2S или H2S, т.к. сульфид меди — осадок.
Ответ: 1)
Составим уравнения реакций для данной схемы превращений:
Первая реакция — переход фосфора в фосфорную кислоту — такое под силу только мощным окислителям — либо серной, либо азотной кислоте.
Вторая реакция — обменная — K2SO4 даст растворимые продукты, а вот KOH — в самый раз! Получится вода — малодиссоциирующее вещество.
[spoiler title=”источники:”]
http://distant-lessons.ru/sostavit-uravneniya-reakcij-po-sxeme-prevrashhenij.html
[/spoiler]
Содержание
- Химические цепочки превращений: примеры и способы решения
- Общие принципы решения химических цепочек превращений
- Пример решения цепочки превращений
- Полезные советы
- Алгоритм решения «цепочек превращений».
- Химия
- Почему связь между классами веществ считается генетической
- Родственные связи между металлами и неметаллами
- Взаимопревращение между классами веществ
Химические цепочки превращений: примеры и способы решения
Химические цепочки превращений — это один из наиболее часто встречающихся в школьных учебниках, а также на самостоятельных, проверочных и контрольных типов задач по химии. Чтобы успешно их решать, нужно понимать, как именно они устроены и каким образом стоит подходить к ним. Рассмотрим, как решать цепочки превращений в общем и на конкретных примерах.
Общие принципы решения химических цепочек превращений
Для начала нужно внимательно прочитать условие задачи и изучить цепочку. Четко поняв, что требуется в задаче, можно переходить непосредственно к ее решению.
- Выписав отдельно цепочку химических превращений, пронумеруйте количество необходимых реакций (они обозначены стрелочками от одного вещества к другому).
- Определите, к какому классу веществ относится каждый член цепочки и, если необходимо, выпишите на черновике отдельно в столбик каждое вещество из цепочки и его класс. В случае когда имеются неназванные вещества и их класс неизвестен, проанализируйте, какие вещества могут быть получены из исходного и какого класса вещество должно выступить исходным для следующего после неназванного вещества элемента цепочки.
- Проанализируйте, каким образом можно получить вещество этого класса из исходного для каждого элемента цепочки. В случае если прямая реакция невозможна, подумайте, какие классы веществ можно получить из исходного вещества и из каких получаемых веществ можно позже синтезировать конечное требуемое вещество.
- Составьте схему уравнения первой из необходимых реакций. Не забудьте расставить коэффициенты в уравнении.
- Последовательно осуществите цепочку химических превращений, рассматривая каждую реакцию в отдельности. Проверьте себя, уделяя внимание оформлению реакций.
Пример решения цепочки превращений
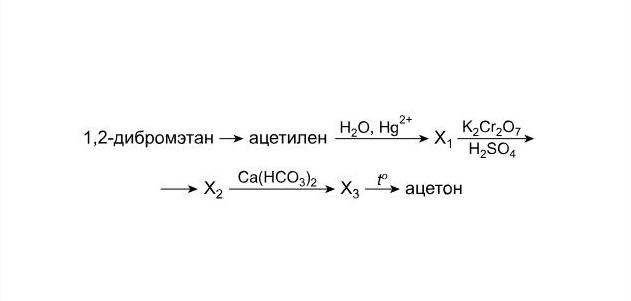
Допустим, в задаче имеется химическая цепочка превращений следующего вида:
Необходимо найти вещества, обозначенные как Х1, Х2 и Х3, и осуществить указанные реакции. Рассмотрим, какие реакции необходимо выполнить для решения этой цепочки после того, как вы пронумеруете стрелки и определите классы веществ.
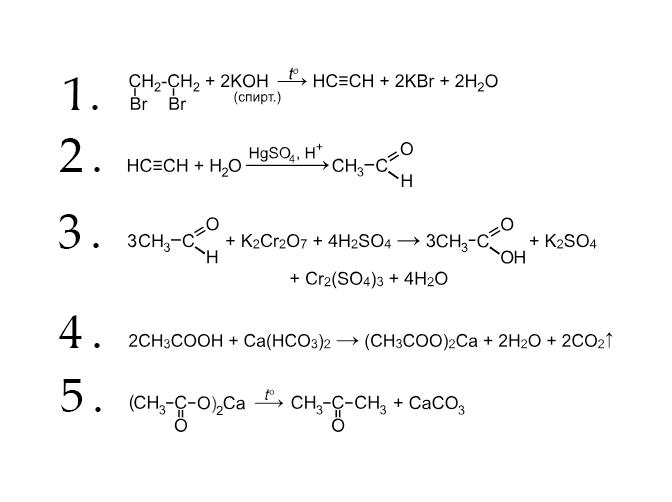
- Для того чтобы из 1,2-дибромэтана получить ацетилен, нужно воздействовать на него спиртовым раствором щелочи при нагревании. В ходе этой реакции от одной из молекул 1,2-дибромэтана отщепятся две молекулы бромоводорода. Эти молекулы будут нейтрализованы щелочью.
- Далее, исходя из условий протекания реакции, вы делаете вывод, что это реакция М. Г. Кучерова. Она приводит к образованию ацетальдегида.
- Ацетальдегид, реагируя в присутствии серной кислоты с дихроматом калия, дает уксусную кислоту.
- Гидрокарбонат вступает в реакцию обмена с раствором кислоты.
- Полученный ацетат щелочноземельного металла при нагревании разлагается, образуя карбонат металла и кетон.
Таким образом, записанное поэтапно решение данной химической цепочки превращений будет выглядеть так:
Полезные советы
Решая цепочки химических уравнений, важно помнить, что конечный результат зависит от каждой последовательно верно решенной реакции в этой цепочке. Следовательно, проверяя себя на последнем этапе, нужно перепроверить возможность каждой реакции и правильность составления и решения уравнения.
Кроме того, если вы сомневаетесь, верно ли вывели ту или иную формулу вещества, вы можете заглянуть на этапе обучения в справочник химических веществ. Важно при этом помнить, что надо не просто сверяться с ним, а запоминать формулы и стараться в дальнейшем самостоятельно воспроизводить их.
Источник
Алгоритм решения «цепочек превращений».
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений » .
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Ca → CaO → Ca ( OH ) 2 → Ca 3 ( PO 4 ) 2
2 шаг. Пронумеруйте количество реакций для удобства решения
Ca → CaO → Ca(OH) 2 → Ca 3 (PO 4 ) 2
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (С a ) надо получить оксид кальция ( CaO ). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 
4 шаг. Осуществляем второе превращение. Из оксида кальция ( CaO ) нужно получить гидроксид кальция ( Ca ( OH ) 2 ). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2 Ca +2 O -2 + H 2 O → Ca 2+ ( OH ) 2 —
5 шаг . Осуществляем 3 превращение. Из гидроксида кальция ( Ca ( OH ) 2 ) необходимо получить соль – фосфат кальция ( Ca 3 ( PO 4 ) 2 ). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H 3 PO 4 , так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3 Ca 2+ ( OH ) 2 — + 2 H 3 + PO 4 3- → Ca 3 2+ ( PO 4 ) 2 3- + 6 H 2 O
Источник
Химия
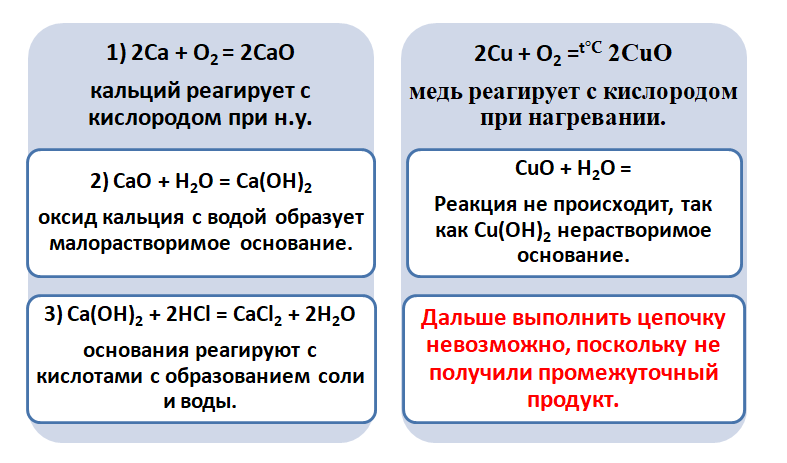
Почему связь между классами веществ считается генетической
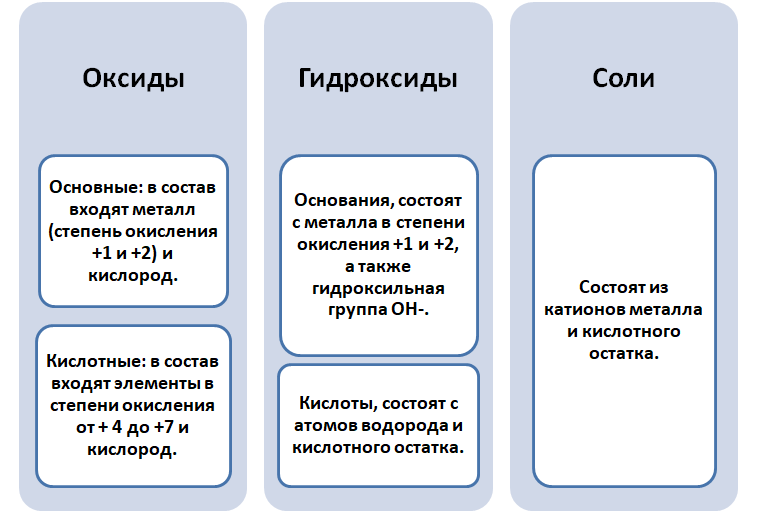
Чтобы разобраться в этом вопросе. Вспомним состав классов веществ, с которыми Вы познакомились на предыдущих занятиях.
Обратите внимание, что соли содержат в себе частицы как оснований (атомы металла), так и кислот (кислотных остатков). Если соль рассматривать как «венец» превращений, то давайте, попытаемся прийти к истокам. Всё начинается с простого, точнее металла и неметалла, как простых веществ.
Попробуем построить генетический ряд металлов, переходя от одного класса к другому.
Возьмём, к примеру, металлы кальций и медь, подставив их в цепочку уравнений.
Обратите внимание, что данные металлы отличаются своей реакционной способностью.
Получается, эта генетическая связь соединений присуща только для активных металлов, оксиды которых, реагируя с водой, дают продукт в виде щёлочи.
Для металлов, которые отличаются малой активностью, переход от вещества, находящегося в простом состоянии, к соли, происходит путём превращений.
Поскольку основные оксиды реагируют с металлами (более активными, чем металлы, которые входят в состав оксида), то эту схему можно сократить.
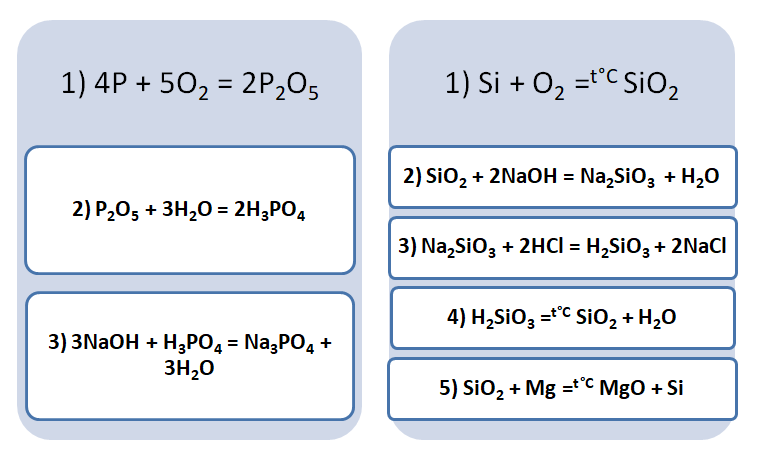
Аналогичным способом можно составить генетический ряд неметаллов, начиная от неметалла заканчивая солью или неметаллом.
Подставим в цепочку уравнений фосфор и кремний.
А возможны иные пути решения данных цепочек уравнений. Способы получения кислотных оксидов реализуются путём взаимодействия простых веществ с кислородом. А вот не с каждого оксида можно получить ему соответствующую кислоту, путём прибавления воды. Поскольку кремниевая кислота нерастворима в воде, то необходимо получить сначала соль, а потом уже и кислоту.
В данном решении предлагается добыть соль Na3PO4, взаимодействием основания и кислоты. Однако можно использовать и другие варианты, которые также будут верны.
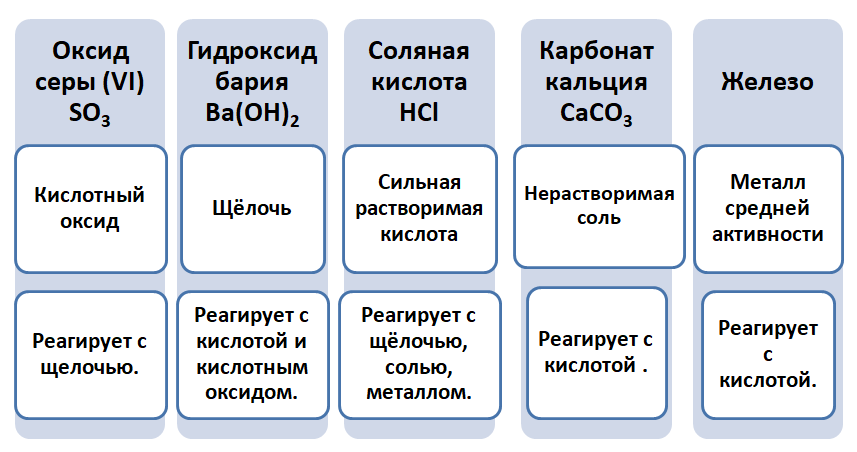
Если объединить генетические ряды металлов и неметаллов, получим дружную семью неорганических соединений, где каждое вещество связано неразрывной нитью с другими классами. Таблица 1.
Данная таблица отображает, как реагируют между собой вещества и какие продукты возможны, вследствие реакции.
Промоделируем на примере: В вашем распоряжении имеются следующие вещества: оксид серы (VI), гидроксид бария, соляная кислота, карбонат кальция и железо. Ваша задача спрогнозировать, между какими соединениями возможна реакция и, записать, соответствующие уравнения реакций.
Подтвердив свои прогнозы молекулярно-ионными уравнениями в сокращённом и полном виде.
Кислород является типичным представителем неметаллов. Он является достаточно сильным окислителем, перед которым может устоять только фтор. Получение основных оксидов происходит путём взаимодействия кислорода и металлов. Однако не все металлы охотно с ним реагируют. Щелочные реагируют бурно, именно поэтому их хранение осуществляется под слоем керосина. Необходимо заметить, что щелочные металлы не образуют оксиды во время взаимодействия с О2. Их чрезвычайная активность позволяет получать только для их характерные продукты, это будут пероксиды и надпероксиды (за исключением лития, продукт Li2O).
А вот, чтобы менее активные металлы – железо или медь прореагировали, необходимо нагревание.
Получение кислотных оксидов происходит аналогично взаимодействием неметаллов с О2.
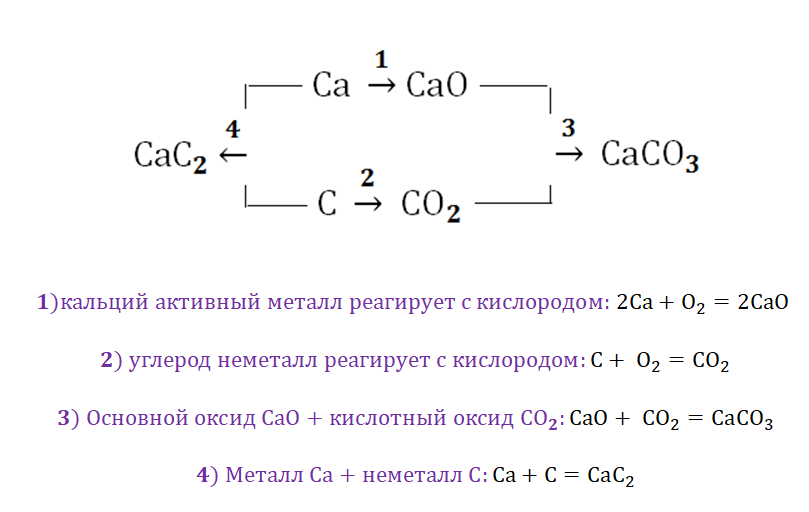
Металлы и неметаллы в химии рассматриваются как противоположности, которые, как заряды (положительные и отрицательные) имеют свойства притягиваться. Рассмотрим на примере металла кальций и неметалла углерод.
Соль СаСО3 имеет истоки от простых веществ Са и С, промежуточным звеном являются оксиды этих веществ, для которых свойственно реагировать между собой.
Вспомним с Вами один с основных постулатов химии, а именно, закон постоянства состава вещества.
Представим, что мы с Вами химики-первооткрыватели и нам предстоит сложная задача получить азотную кислоту, которая имеет важную роль в химической промышленности. Получение кислот возможно несколькими способами. Обращаясь к таблице 1, делаем вывод, что нам доступно несколько способов, а именно.
Взаимодействие кислот с солями приведёт нас к желаемому результату, однако не забывайте, что в продукте должны увидеть газ, осадок либо окрашивание.
Способы получения средних солей доказательно показывают связь между веществами. Снова выручалочкой нам послужит таблица 1. Наша задача получить вещество, без которого, полагаем, Вы не представляете своё существование, это соль NaCl. Используя данные, видим, что доступно для её получения 4 способа (Вы ищете, где продуктом является соль и применяете данные на свой пример).
Рассмотрим подробно каждый с них.
Способы получения солей отличаются, причиной этому является то, какую именно соль мы хотим получить, кислородсодержащей,сильной или слабой кислоты. К примеру, получение Na2SO4 будет отличаться от предыдущего примера с NaCl. Количество способов будет больше, так как это соль кислородсодержащей кислоты.
Здесь следуют отметить особенность щелочных, а также щелочно-земельных металлов, для которых свойственно взаимодействие с водой. По сути, идёт два параллельных процесса.
Полученная щёлочь реагирует с кислотой.
Способы получения солей аммония несколько отличаются, от солей металлов, тем, что аммиак непосредственно реагирует с кислотами (смотри урок химическая связь) с образованием донорно-акцепторных связей.
Гидроксид аммония имеет способность взаимодействовать с кислотами, с образованием необходимого продукта, не иначе как солей аммония.
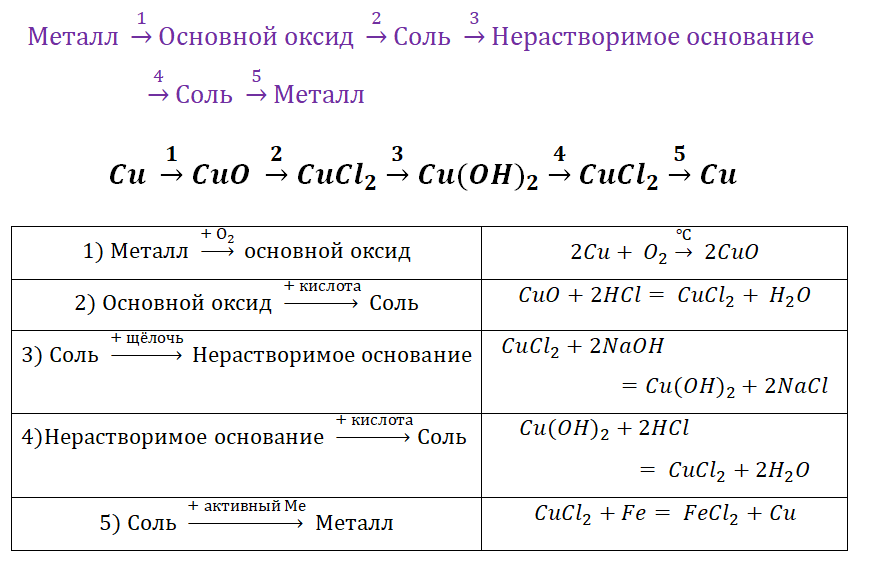
Наверняка некоторые из Вас пугал вид заданий, который был цепочек уравнений. Обобщая всё выше сказанное, рассмотрим несколько примеров.
Чтобы справится с данной задачей, проанализируем условие. Первое, что необходимо выделить – это количество уравнений (смотрим по стрелочкам, их 5). Второе определим исходное вещество – цинк, металл средней силы. Чтобы получить с него соль (не забываем о таблице 1), можно использовать 3 способа:
Выбор за Вами, одного из трёх уравнений. Переходим к следующей части цепочки ZnCl2 → Zn(OH)2. Здесь решением будет один вариант, это прибавление щёлочи.
Zn(OH)2 относится к нерастворимым основанием, поэтому при нагревании распадаются.
И наконец, итоговый продукт, металл. Его необходимо выделить из соли. Для этого необходимо взять металл, сила которого будет больше. Если эту информацию забыли, то освежить эти данные сможете с помощью урока Соли и их свойства.
Решение цепочек химических уравнений на первый взгляд кажется не посильной задачей, но если внимательно изучить свойства веществ, то они кажутся не такими уж и сложными.
Взаимопревращение между классами веществ
Обобщая сведения о свойствах неорганических соединений, составим схему 1. Взаимосвязь между классами неорганических веществ.
Эта схема и таблица 1 будут служить Вам волшебной палочкой в изучении неорганической химии.
Источник
Материал опубликовала
| Светлова Елена Александровна1655
Высшее образование. Педагогический стаж 26 лет. Высшая квалификационная категория. Победитель ПНПО “Лучших учителей России” 2014 и 2022 г.г. Руководитель школьного объединения “Эколог”. Россия, Ивановская обл., Приволжск |
4
Алгоритм решения “цепочек превращений”.
Алгоритм решения «цепочек превращения» по химии
В химии есть задания со схемами превращений одних веществ в другие, которые характеризуют генетическую связь между основными классами органических и неорганических соединений.
Схему превращения одних веществ в другие называют «цепочкой превращений».
Для выполнения этих заданий необходимо знать основные классы соединений, их номенклатуру, химические свойства, механизм осуществления реакций.
Алгоритм решения «цепочки превращений»
1 шаг. Перепишите цепочку, которую необходимо решить
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
2 шаг. Пронумеруйте количество реакций для удобства решения
1 2 3
Ca → CaO → Ca(OH)2 → Ca3(PO4)2
Таким образом, мы видим, что нам надо составить 3 уравнения реакции
3 шаг. Запишем 1 уравнение реакции – из кальция (Сa) надо получить оксид кальция (CaO). Вспомним, что данное превращение происходит, когда металлы окисляются на воздухе, вступая в реакцию с кислородом. Записываем эту реакцию. Внимание! Не забывайте уравнивать реакции!
2Сa + O2 
4 шаг. Осуществляем второе превращение. Из оксида кальция (CaO) нужно получить гидроксид кальция (Ca(OH)2). Это уравнение возможно при взаимодействии оксида с водой. (Такая реакция возможна, если в итоге получается щелочь – растворимое в воде основание). Записываем уравнение и уравниваем его.
2) 2Ca+2O-2 + H2O → Ca 2+(OH)2–
5 шаг. Осуществляем 3 превращение. Из гидроксида кальция (Ca(OH)2) необходимо получить соль – фосфат кальция (Ca3(PO4)2). Вспоминаем, что при взаимодействии основания и кислоты получается соль и вода. Значит, для этой реакции подойдет фосфорная кислота – H3PO4, так как именно она дает соли – фосфаты. Записываем уравнение реакции и уравниваем его.
3) 3Ca2+(OH)2– + 2H3+PO43- → Ca32+(PO4)23- + 6H2O
Опубликовано 17.05.20 в 10:05
Размер файла: 19.52 Кбайт
ЦЕПОЧКИ ПРЕВРАЩЕНИЙ: КАКИЕ БЫВАЮТ И ОСНОВНОЙ АЛГОРИТМ РЕШЕНИЯ
Цепочки превращений – вид качественных задач по химии.
ОСНОВНЫЕ РАЗНОВИДНОСТИ ЦЕПОЧЕК ПРЕВРАЩЕНИЙ
Можно выделить несколько основных разновидностей подобных задач:
1. Цепочки превращений, в которых известны все вещества
Предлагаются формулы конкретных химических веществ. Формулы дают представление о том, к какому (каким) классу (классам) веществ относятся участники цепочки. Это значительно упрощает ее решение. И это, пожалуй, самый простой вид цепочек превращений.
2. Цепочки с неизвестными веществами
Одно из веществ цепи может быть не известно и зашифровано с помощью какой-либо буквы (латиница или кириллица). В таком случае, над стрелкой указывается вещество, которое необходимо добавить к предыдущему, чтобы получилось зашифрованное вещество. Если этого не делать, то можно предположить несколько вариантов решения.
Очень часто вместо химических формул предлагаются названия соединений. Это очень полезно для отработки знаний их номенклатуры и умений по названию определять принадлежность к определенному классу. Например:
В цепочках данного вида могут быть не известны несколько веществ или даже все, кроме одного, например, исходного.
3. Цепочки превращений, в которых указаны только степени окисления основного химического элемента
Многие химические элементы имеют несколько степеней окисления. Подобные задачи направлены на знание окислительно-восстановительных свойств веществ и на отработку умений составлять окислительно-восстановительные реакции.
4. Цепочки превращений с неизвестными промежуточными веществами
В подобных случаях предлагаются только исходное вещество и конечный продукт. Так, в данном примере из пропана напрямую получить этиловый эфир аланина невозможно. Промежуточных стадий получения конечного продукта может быть несколько. Это определяет тот, кто решает данную цепочку превращений. Ясно, что и путей решения может быть несколько.
ЦЕПОЧКИ ПРЕВРАЩЕНИЙ: ОСНОВНОЙ АЛГОРИТМ РЕШЕНИЯ
Главное правило в решении любой цепочки превращений: из каждого предыдущего вещества необходимо получить следующее за ним.
На конкретном примере рассмотрим основной алгоритм решения:
1) записываем цепочку;
2) под формулами веществ подписываем их названия;
3) над стрелками ставим номера реакций;
4) решаем цепочку, записывая каждую реакцию под своим номером;
5) если требуется, над стрелками в реакциях указываем условия протекания реакций.
Цепочки превращений направлены на закрепление и углубление знаний химических свойств веществ и способов их получения. Они помогают развивать логическое мышление, память, умение выявлять закономерности. Часто требуют не стандартного подхода к решению.
Если вам известны другие виды цепочек превращений, пожалуйста, напишите в комментариях.
Продолжение следует…
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.