Само
название «водородные соединения» говорит о том, что в состав данных
соединений входит водород. К таким соединениям относятся гидриды и
летучие водородные соединения. Давайте разберемся, в чем их отличие.
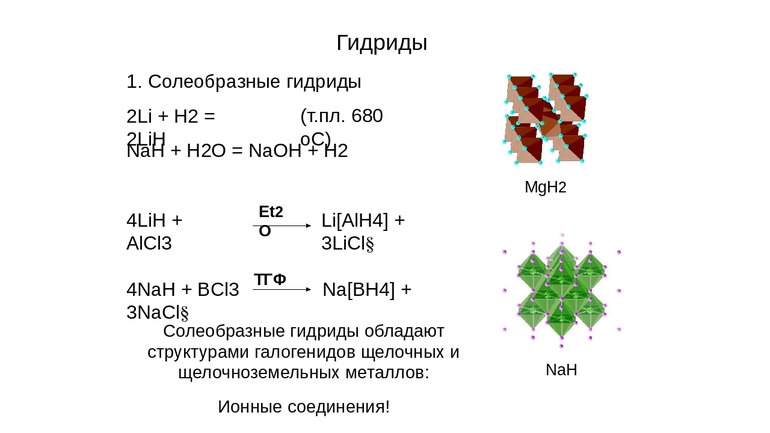
Гидриды
– это бинарные соединения металлов I
и
II A
групп
с водородом. Например: CaH2,
NaH, BaH2,
LiH. Все эти гидриды твердые,
нелетучие, тугоплавкие вещества с ионным типом связи.
Летучие
водородные соединения – это бинарные соединения неметаллов с
водородом. Эти соединения могут быть как жидкостями (например, Н2О),
так и газами (HCl,
NH3).
Рассмотрим
свойства хлороводорода – HCl.
Это бесцветный газ, тяжелее воздуха, хорошо растворим в воде. В 1 объёме
воды растворяется 500 объёмов хлороводорода. Хлороводород «дымит» на
воздухе, т.е. он поглощает пары воды из воздуха, образуя при этом туманное
облако.
Раствор
хлороводорода в воде называют соляной кислотой. Это бесцветная
жидкость, «дымит» на воздухе, тяжелее воды. Соляная кислота содержится в
желудочном соке человека и некоторых животных.
Еще
одни важным летучим водородным соединением является метан – СН4.
Метан – бесцветный газ, плохо растворим в воде, легче воздуха, не имеет
запаха. Его еще называют болотным газом, т.к. он образуется на дне болот
и водоемов при разложении растительных остатков без доступа кислорода. Кроме
того, метан содержится в природном и попутном нефтяном газе.
Известным
и распространенным водородным соединением является аммиак – NH3.
Аммиак является бесцветным газом, имеет резкий запах, в 1 объёме воды растворяется
700 объёмов аммиака, он почти в 2 раза легче воздуха. Раствор аммиака в воде
называют нашатырным спиртом, который широко используют в медицине.
Сероводород
– H2S
– тоже известное летучее водородное соединение. Он является бесцветным газом,
имеет запах тухлых яиц, ядовит, в 1 объеме воды растворяется 3 объёма
сероводорода, он тяжелее воздуха.
Оксиды
Оксиды
–
это сложные вещества, состоящие из двух элементов, одним из которых является
кислород в степени окисления -2.
В
названии оксидов сначала указывают слово оксид в
именительном падеже (от лат. названия кислорода – «оксигениум»), а затем
название элемента в родительном падеже.
Например:
CaO – оксид
кальция, K2O
– оксид калия, Al2O3
– оксид алюминия. А если элемент имеет несколько степеней
окисления или переменную валентность, то после названия оксида в скобках
римскими цифрами указывают численное значение степени окисления. Например: Fe2O3
– оксид железа (III)
(читается:
«оксид железа три»), CuO
– оксид меди (II)
(читается: «оксид меди два»), CrO3
– оксид хрома (VI)
(читается: «оксид хрома шесть»).
По
агрегатному состоянию оксиды делят на твёрдые: к ним
относятся такие оксиды, как Al2O3,
SiO2,
Fe2O3 и
др., жидкие оксиды – это H2O,
SO3,
газообразными являются такие оксиды, как СО2, NO2,
SO2 и
др.
Познакомимся
с вами с наиболее важными оксидами.
Вода
– Н2О – самое распространенное и самое
необходимое вещество на планете. Почти ¾ поверхности земного шара
занято водой. Однако, это вода морей и океанов, которая является солёной.
Она непригодна для питья, для сельского хозяйства, для промышленности. Кроме
того, тело человека на 2/3 состоит из воды. Вода составляет до 80%
массы клетки и выполняет важные функции: защитную, транспортную и др. У
некоторых медуз вода занимает почти 99% от массы тела. Содержание воды в
огурцах и арбузах превышает 90%. Большинство реакций и процессов в различных
отраслях промышленности тоже протекают в растворах. Однако запасы пресной воды
малы, всего 3% от общего объёма, поэтому нужно беречь и экономить воду.
Без воды невозможно представить жизнь человека, который потребляет ее для
бытовых нужд.
В
природе постоянно происходит круговорот воды. Под влиянием солнечного
тепла часть воды испаряется в атмосферу. При охлаждении воздуха образуются
водяные капельки, из которых состоят облака. Эти мелкие капельки сливаются в
более крупные и выпадают на землю в виде осадков: снега, дождя, града.
Круговорот
воды в природе
Еще
одним известным оксидом является диоксид углерода, углекислый газ, или оксид
углерода (IV)
– CO2.
Это бесцветный газ, не имеет запаха, в 1,5 раза тяжелее воздуха. В 1
объёме воды растворяется 1 объем углекислого газа. В воздухе содержится
0,03% (по объему) диоксида углерода.
Большое
количество углекислого газа вызывает удушье. Например, в «Собачьей
пещере» вблизи Неаполя, известной еще из древности, заходившие сюда собаки
постоянно погибали из-за скопившегося газа, который стелется по дну пещеры
слоем до полуметра. Углекислый газ образуется при дыхании, сгорании топлива,
тлении и гниении различных организмов. Большое содержание углекислого газа
в минеральной воде «Нарзан», находящейся в Кисловодске. Углекислый газ
используют для получения газированных вод, а твердый диоксид углерода, или
«сухой лед» используют для хранения продуктов питания, в частности
мороженого. Т.к. углекислый газ не поддерживает горение, его используют
для тушения пожаров. В медицине углекислый газ используют для углекислотных
ванн.
Негашеная
известь, или СаО, является белым, тугоплавким веществом,
которое энергично реагирует с водой, при этом образуется гашеная известь.
Негашеная известь применяется для получения вяжущих строительных материалов.
Основная
часть литосферы – это оксид кремния (IV)
– SiO2.
Он входит в состав минералов и горных пород. Этот оксид образует кварц,
кварцевый песок, кремнезем, горный хрусталь и др. соединения.
Еще
одно соединение, которое является основой литосферы – это оксид алюминия – Al2O3.
Он также входит в состав минералов и горных пород. Этот оксид образует
корунд, рубин, сапфир, каолин и др. соединения.
Водородные соединения – это сложные вещества, состоящие из двух элементов, один из которых водород. Водородные соединения разделяют на солеобразные гидриды и летучие водородные соединения.
Солеобразные гидриды ЭН – это соединения металлов IA, IIA групп и алюминия с водородом. Степень окисления водорода равна -1.
Летучие водородные соединения НЭ – это соединения неметаллов с водородом. Степень окисления водорода равна +1.
| Летучие водородные соединения НЭ – это соединения неметаллов с водородом | Солеобразные гидриды ЭН – это соединения металлов IA, IIA групп и алюминия с водородом |
| Степень окисления водорода равна +1.
Проявляют основные, кислотные или амфотерные свойства. Как правило, сильные восстановители. |
Степень окисления водорода равна -1.
Для солеобразных гидридов характерны некоторые свойства солей: гидролиз, обменные реакции и т.д. |
| Элементы IVА гр.: ЭН4 (SiH4 – силан, CH4 – метан)
Элементы VА гр.: ЭН3 (NH3 — аммиак, PH3 — фосфин, AsH3 – арсин, SbH3 – стибин) Элементы VIА гр.: Н2Э (Н2S – сероводород, H2Se – селеноводород, Н2Те – теллуроводород и т.д.) Элементы VIIА гр.: НЭ (НF – фтороводород, хлороводород и т.д.) |
NaH – гидрид натрия, CaH2 – гидрид кальция и т.д. |
Стибин SbH3 (сурьмянистый водород) — неорганическое бинарное химическое соединение сурьмы с водородом, имеющее чесночный запах.
Арсин AsH3 (мышьяковистый водород, гидрид мышьяка) — гидрид мышьяка, химическое соединение мышьяка и водорода. При нормальных условиях — ядовитый бесцветный газ. Абсолютно чистый химически арсин запаха не имеет, но ввиду неустойчивости продукты его окисления придают арсину чесночный запах. Сильный восстановитель.
Водород: химия водорода и его соединений
Водород
Положение в периодической системе химических элементов
Водород расположен в главной подгруппе I группы и в первом периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение водорода
Электронная конфигурация водорода в основном состоянии :
+1H 1s 1 1s
Атом водорода содержит на внешнем энергетическом уровне один неспаренный электрон в основном энергетическом состоянии.
Степени окисления атома водорода — от -1 до +1. Характерные степени окисления -1, 0, +1.
Физические свойства
Водород – легкий газ без цвета, без запаха. Молекула водорода состоит из двух атомов, связанных между собой ковалентной неполярной связью:
Н–Н
Соединения водорода
Основные степени окисления водорода +1, 0, -1.
Типичные соединения водорода:
| Степень окисления | Типичные соединения |
| +1 | кислоты H2SO4, H2S, HCl и др.
вода H2O и др. летучие водородные соединения (HCl, HBr) кислые соли (NaHCO3 и др.) основания NaOH, Cu(OH)2 основные соли (CuOH)2CO3 |
| -1 | гидриды металлов NaH, CaH2 и др. |
Способы получения
Еще один важный промышленный способ получения водорода — паровая конверсия метана. При взаимодействии перегретого водяного пара с метаном образуется угарный газ и водород:
Также возможна паровая конверсия угля:
C 0 + H2 + O → C +2 O + H2 0
Химические свойства
1. Водород проявляет свойства окислителя и свойства восстановителя. Поэтому водород реагирует с металлами и неметаллами.
1.1. С активными металлами водород реагирует с образованием гидридов :
2Na + H2 → 2NaH
1.2. В специальных условиях водород реагирует с серой с образованием бинарного соединения сероводорода:
1.3. Водород не реагирует с кремнием .
1.4. С азотом водород реагирует при нагревании под давлением в присутствии катализатора с образованием аммиака:
1.5. В специальных условиях водород реагирует с углеродом .
1.6. Водород горит , взаимодействует с кислородом со взрывом:
2. Водород взаимодействует со сложными веществами:
2.1. Восстанавливает металлы из основных и амфотерных оксидов . Восстановить из оксида водородом можно металлы, расположенные в электрохимическом ряду напряжений после алюминия. При этом образуются металл и вода.
Например , водород взаимодействует с оксидом цинка с образованием цинка и воды:
ZnO + H2 → Zn + H2O
Также водород восстанавливает медь из оксида меди:
СuO + H2 → Cu + H2O
Водород восстанавливает оксиды некоторых неметаллов .
Например , водород взаимодействует с оксидом азота (I):
2.2. С органическими веществами водород вступает в реакции присоединения (реакции гидрирования).
Применение водорода
Применение водорода основано на его физических и химических свойствах:
- как легкий газ, он используется для наполнения аэростатов (в смеси с гелием);
- кислородно-водородное пламя применяется для получения высоких температур при сварке металлов;
- как восстановитель используется для получения металлов (молибдена, вольфрама и др.) из их оксидов;
- водород используется для получения аммиака и искусственного жидкого топлива;
- получение твердых жиров (гидрогенизация).
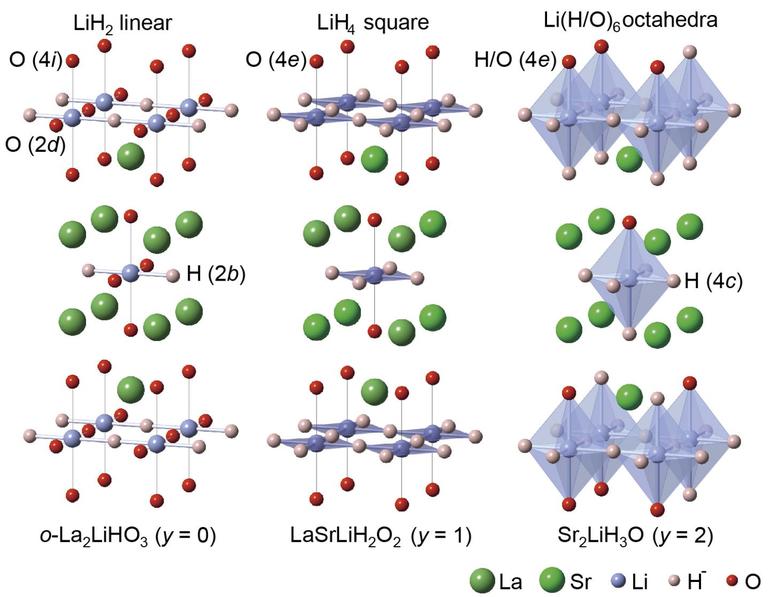
Водородные соединения металлов
Соединения металлов с водородом — солеобразные гидриды МеНх. Это твердые вещества белого цвета с ионным строением. Устойчивые гидриды образуют активные металлы (щелочные, щелочноземельные и др.).
Способы получения
Гидриды металлов можно получить непосредственным взаимодействием активных металлов и водорода.
Например , при взаимодействии натрия с водородом образуется гидрид натрия:
2Na + H2 → 2NaH
Гидрид кальция можно получить из кальция и водорода:
Химические свойства
1. Солеобразные гидриды легко разлагаются водой .
Например , гидрид натрия в водной среде разлагается на гидроксид натрия и водород:
NaH + H2O → NaOH + H2
2. При взаимодействии с кислотами гидриды металлов образуют соль и водород.
Например , гидрид натрия реагирует с соляной кислотой с образованием хлорида натрия и водорода:
NaH + HCl → NaCl + H2
3. Солеобразные гидриды проявляют сильные восстановительные свойства и взаимодействуют с окислителями (кислород, галогены и др.)
Например , гидрид натрия окисляется кислородом:
2NaH + O2 = 2NaOH
Гидрид натрия также окисляется хлором :
NaH + Cl2 = NaCl + HCl
Летучие водородные соединения
Соединения водорода с неметаллами — летучие водородные соединения.
Строение и физические свойства
Все летучие водородные соединения — газы (кроме воды).
| CH4 — метан | NH3 — аммиак | H2O — вода | HF –фтороводород |
| SiH4 — силан | PH3 — фосфин | H2S — сероводород | HCl –хлороводород |
| AsH3 — арсин | H2Se — селеноводород | HBr –бромоводород | |
| H2Te — теллуроводород | HI –иодоводород |
Способы получения силана
Силан образуется при взаимодействии соляной кислоты с силицидом магния:
Видеоопыт получения силана из силицида магния можно посмотреть здесь.
Способы получения аммиака
В лаборатории аммиак получают при взаимодействии солей аммония с щелочами. Поск ольку аммиак очень хорошо растворим в воде, для получения чистого аммиака используют твердые вещества.
Например , аммиак можно получить нагреванием смеси хлорида аммония и гидроксида кальция. При нагревании смеси происходит образование соли, аммиака и воды:
Тщательно растирают ступкой смесь соли и основания и нагревают смесь. Выделяющийся газ собирают в пробирку (аммиак — легкий газ и пробирку нужно перевернуть вверх дном). Влажная лакмусовая бумажка синеет в присутствии аммиака.
Видеоопыт получения аммиака из хлорида аммония и гидроксида кальция можно посмотреть здесь.
Еще один лабораторный способ получения аммиака – гидролиз нитридов.
Например , гидролиз нитрида кальция:
В промышленности аммиак получают с помощью процесса Габера: прямым синтезом из водорода и азота.
Процесс проводят при температуре 500-550 о С и в присутствии катализатора. Для синтеза аммиака применяют давления 15-30 МПа. В качестве катализатора используют губчатое железо с добавками оксидов алюминия, калия, кальция, кремния. Для полного использования исходных веществ применяют метод циркуляции непрореагировавших реагентов: не вступившие в реакцию азот и водород вновь возвращают в реактор.
Более подробно про технологию производства аммиака можно прочитать здесь.
Способы получения фосфина
В лаборатории фосфин получают водным или кислотным гидролизом фосфидов – бинарных соединений фосфора и металлов.
Например , фосфин образуется при водном гидролизе фосфида кальция:
Или при кислотном гидролизе, например , фосфида магния в соляной кислоте:
Еще один лабораторный способ получения фосфина – диспропорционирование фосфора в щелочах.
Например , фосфор реагирует с гидроксидом калия с образованием гипофосфита калия и фосфина:
Способы получения сероводорода
1. В лаборатории сероводород получают действием минеральных кислот на сульфиды металлов, расположенных в ряду напряжений левее железа.
Например , при действии соляной кислоты на сульфид железа (II):
FeS + 2HCl → FeCl2 + H2S↑
Еще один способ получения сероводорода – прямой синтез из водорода и серы:
Еще один лабораторный способ получения сероводорода – нагревание парафина с серой.
Видеоопыт получения и обнаружения сероводорода можно посмотреть здесь.
2. Также сероводород образуется при взаимодействии растворимых солей хрома (III) и алюминия с растворимыми сульфидами. Сульфиды хрома (III) и алюминия необратимо гидролизуются в водном растворе.
Например: х лорид хрома (III) реагирует с сульфидом натрия с образованием гидроксида хрома (III), сероводорода и хлорида натрия:
Химические свойства силана
1. Силан — неустойчивое водородное соединение (самовоспламеняется на воздухе). При сгорании силана на воздухе образуется оксид кремния (IV) и вода:
Видеоопыт сгорания силана можно посмотреть здесь.
2. Силан разлагается водой с выделением водорода:
3. Силан разлагается (окисляется) щелочами :
4. Силан при нагревании разлагается :
Химические свойства фосфина
1. В водном растворе фосфин проявляет очень слабые основные свойства (за счет неподеленной электронной пары). Принимая протон (ион H + ), он превращается в ион фосфония. Основные свойства фосфина гораздо слабее основных свойств аммиака. Проявляются при взаимодействии с безводными кислотами .
Например , фосфин реагирует с йодоводородной кислотой:
Соли фосфония неустойчивые, легко гидролизуются.
2. Фосфин PH3 – сильный восстановитель за счет фосфора в степени окисления -3. На воздухе самопроизвольно самовоспламеняется:
3. Как сильный восстановитель, фосфин легко окисляется под действием окислителей.
Например , азотная кислота окисляет фосфин. При этом фосфор переходит в степень окисления +5 и образует фосфорную кислоту.
Серная кислота также окисляет фосфин:
С фосфином также реагируют другие соединения фосфора, с более высокими степенями окисления фосфора.
Например , хлорид фосфора (III) окисляет фосфин:
2PH3 + 2PCl3 → 4P + 6HCl
Химические свойства сероводорода
1. В водном растворе сероводород проявляет слабые кислотные свойства. Взаимодействует с сильными основаниями, образуя сульфиды и гидросульфиды:
Например , сероводород реагирует с гидроксидом натрия:
H2S + 2NaOH → Na2S + 2H2O
H2S + NaOH → NaНS + H2O
2. Сероводород H2S – очень сильный восстановитель за счет серы в степени окисления -2. При недостатке кислорода и в растворе H2S окисляется до свободной серы (раствор мутнеет):
В избытке кислорода:
3. Как сильный восстановитель, сероводород легко окисляется под действием окислителей.
Например, бром и хлор окисляют сероводород до молекулярной серы:
H2S + Br2 → 2HBr + S↓
H2S + Cl2 → 2HCl + S↓
Под действием избытка хлора в водном растворе сероводород окисляется до серной кислоты:
Например , азотная кислота окисляет сероводород до молекулярной серы:
При кипячении сера окисляется до серной кислоты:
Прочие окислители окисляют сероводород, как правило, до молекулярной серы.
Например , оксид серы (IV) окисляет сероводород:
Соединения железа (III) также окисляют сероводород:
H2S + 2FeCl3 → 2FeCl2 + S + 2HCl
Бихроматы, хроматы и прочие окислители также окисляют сероводород до молекулярной серы:
Серная кислота окисляет сероводород либо до молекулярной серы:
Либо до оксида серы (IV):
4. Сероводород в растворе реагирует с растворимыми солями тяжелых металлов : меди, серебра, свинца, ртути, образуя черные сульфиды, нерастворимые ни в воде, ни в минеральных кислотах.
Например , сероводород реагирует в растворе с нитратом свинца (II). при этом образуется темно-коричневый (почти черный) осадок, нерастворимый ни в воде, ни в минеральных кислотах:
Взаимодействие с нитратом свинца в растворе – это качественная реакция на сероводород и сульфид-ионы.
Видеоопыт взаимодействия сероводорода с нитратом свинца можно посмотреть здесь.
Химические свойства прочих водородных соединений
Кислоты образуют в водном растворе: водородные соединения VIA (кроме воды) и VIIA подгрупп.
Прочитать про химические свойства галогеноводородов вы можете здесь.
Физические свойства
Молекулы воды связаны водородными связями: nH2O = (Н2O)n, поэтому вода жидкая в отличие от ее газообразных аналогов H2S, H2Se и Н2Те.
Химические свойства
1. Вода реагирует с металлами и неметаллами .
1.1. С активными металлами вода реагирует при комнатной температуре с образованием щелочей и водорода :
2Na + 2H2O → 2NaOH + H2
- с магнием реагирует при кипячении:
- алюминий не реагирует с водой, так как покрыт оксидной плёнкой. Алюминий, очищенный от оксидной плёнки, взаимодействует с водой, образуя гидроксид:
- металлы, расположенные в ряду активности от Al до Н , реагируют с водяным паром при высокой температуре, образуя оксиды и водород:
- металлы, расположенные в ряду активности от после Н , не реагируют с водой:
Ag + Н2O ≠
2. Вода реагирует с оксидами щелочных и щелочноземельных металлов , образуя щелочи (с оксидом магния – при кипячении):
3. Вода взаимодействует с кислотными оксидами (кроме SiO2):
4. Некоторые соли реагируют с с водой. Как правило, в таблице растворимости такие соли отмечены прочерком :
Например , сульфид алюминия разлагается водой:
5. Бинарные соединения металлов и неметаллов , которые не являются кислотами и основаниями, разлагаются водой.
Например , фосфид кальция разлагается водой:
6. Бинарные соединения неметаллов также гидролизуются водой.
Например , фосфид хлора (V) разлагается водой:
6. Некоторые органические вещества гидролизуются водой или вступают в реакции присоединения с водой (алкены, алкины, алкадиены, сложные эфиры и др.).
Водород (H) и его химические реакции
Водород – простое вещество H2 (диводород, дипротий, легкий водород).
Краткая характеристика водорода:
- Неметалл.
- Бесцветный газ, трудно поддающийся сжижению.
- Плохо растворяется в воде.
- Лучше растворяется в органических растворителях.
- Хемосорбируется металлами: железом, никелем, платиной, палладием.
- Сильный восстановитель.
- Взаимодействует (при высоких температурах) с неметаллами, металлами, оксидами металлов.
- Наибольшей восстановительной способностью обладает атомный водород H 0 , получаемый при термическом разложении H2.
- Изотопы водорода:
- 1 H – протий
- 2 H – дейтерий (D)
- 3 H – тритий (Т)
- Относительная молекулярная масса = 2,016
- Относительная плотность твердого водорода (t=-260°C) = 0,08667
- Относительная плотность жидкого водорода (t=-253°C) = 0,07108
- Избыточное давление (н.у.) = 0,08988 г/л
- tплавления = -259,19°C
- tкипения = -252,87°C
- Объемный коэффициент растворимости водорода:
- (t=0°C) = 2,15;
- (t=20°C) = 1,82;
- (t=60°C) = 1,60;
1. Термическое разложение водорода (t=2000-3500°C):
H2 ↔ 2H 0
2. Взаимодействие водорода с неметаллами:
3. Взаимодействие водорода со сложными веществами:
4. Участие водорода в окислительно-восстановительных реакциях:
Водородные соединения
D2 – дидейтерий:
- Тяжелый водород.
- Бесцветный газ, трудно поддаваемый сжижению.
- Дидейтерия содержится в природной водороде 0,012-0,016% (по массе).
- В газовой смеси дидейтерия и протия изотопный обмен протекает при высоких температурах.
- Плохорастворим в обычной и тяжелой воде.
- С обычной водой изотопный обмен незначителен.
- Химические свойства аналогичны легкому водороду, но дидейтерий обладает меньшей реакционной способностью.
- Относительная молекулярная масса = 4,028
- Относительная плотность жидкого дидейтерия (t=-253°C) = 0,17
- tплавления = -254,5°C
- tкипения = -249,49°C
T2 – дитритий:
- Сверхтяжелый водород.
- Бесцветный радиоактивный газ.
- Период полураспада 12,34 года.
- Химические свойства аналогичны H2.
- В природе дитритий образуется в результате бомбардировки нейтронами космического излучения ядер 14 N, следы дитрития обнаружены в природных водах.
- Получают дитритий в ядерном реакторе бомбардировкой лития медленными нейтронами.
- Относительная молекулярная масса = 6,032
- tплавления = -252,52°C
- tкипения = -248,12°C
HD – дейтериоводород:
- Бесцветный газ.
- Не растворяется в воде.
- Химические свойства аналогичны H2.
- Относительная молекулярная масса = 3,022
- Относительная плотность твердого дейтериоводорода (t=-257°C) = 0,146
- Избыточное давление (н.у.) = 0,135 г/л
- tплавления = -256,5°C
- tкипения = -251,02°C
Оксиды водорода
H2O – вода:
- Бесцветная жидкость.
- По изотопному составу кислорода вода состоит из H2 16 O с примесями H2 18 O и H2 17 O
- По изотопному составу водорода вода состоит из 1 H2O с примесью HDO.
- Жидкая вода подвергается протолизу (H3O + и OH – ):
- H3O + (катион оксония) является самой сильной кислотой в водном растворе;
- OH – (гидроксид-ион) является самым сильным основанием в водном растворе;
- Вода – самый слабый сопряженный протолит.
- Со многими веществами вода образует кристаллогидраты.
- Вода является химически активным веществом.
- Вода является универсальным жидким растворителем неорганических соединений.
- Относительная молекулярная масса воды = 18,02
- Относительная плотность твердой воды (льда) (t=0°C) = 0,917
- Относительная плотность жидкой воды:
- (t=0°C) = 0,999841
- (t=20°C) = 0,998203
- (t=25°C) = 0,997044
- (t=50°C) = 0,97180
- (t=100°C) = 0,95835
- плотность (н.у.) = 0,8652 г/л
- tплавления = 0°C
- tкипения = 100°C
- Ионное произведение воды (25°C) = 1,008·10 -14
1. Термическое разложение воды:
2H2O ↔ 2H2+O2 (выше 1000°C)
D2O – оксид дейтерия:
- Тяжелая вода.
- Бесцветная гигроскопичная жидкость.
- Вязкость выше, чем у воды.
- Смешивается с обычной водой в неограниченных количествах.
- При изотопном обмене образуется полутяжелая вода HDO.
- Растворяющая способность ниже, чем у обычной воды.
- Химические свойства оксида дейтерия аналогичны химическим свойствам воды, но все реакции протекают медленнее.
- Тяжелая вода присутствует в природной воде (массовое отношение к обычной воде 1:5500).
- Оксид дейтерия получают многократным электролизом природной воды, при котором тяжелая вода накапливается в остатке электролита.
- Относительная молекулярная масса тяжелой воды = 20,03
- Относительная плотность жидкой тяжелой воды (t=11,6°C) = 1,1071
- Относительная плотность жидкой тяжелой воды (t=25°C) = 1,1042
- tплавления = 3,813°C
- tкипения = 101,43°C
T2O – оксид трития:
- Сверхтяжелая вода.
- Бесцветная жидкость.
- Вязкость выше, а растворяющая способность ниже, чем у обычной и тяжелой воды.
- Смешивается с обычной и тяжелой водой в неограниченных количествах.
- Изотопный обмен с обычной и тяжелой водой приводит к образованию HTO, DTO.
- Химические свойства сверхтяжелой воды аналогичны химическим свойствам воды, но все реакции протекают еще медленнее, чем в тяжелой воде.
- Следы оксида трития находят в природной воде и атмосфере.
- Получают сверхтяжелую воду пропусканием трития над раскаленным оксидом меди CuO.
- Относительная молекулярная масса сверхтяжелой воды = 22,03
- tплавления = 4,5°C
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Урок 22. Химические свойства водорода
В уроке 22 «Химические свойства водорода» из курса «Химия для чайников» узнаем с какими веществами реагирует водород; выясним, какими химическими свойствами обладает водород.
Водород вступает в химические реакции с простыми и сложными веществами. Однако при обычных условиях водород малоактивен. Для его взаимодействия с другими веществами необходимо создать условия: повысить температуру, применить катализатор и др.
Реакции водорода с простыми веществами
При нагревании водород вступает в реакции соединения с простыми веществами — кислородом, хлором, азотом, серой.
Если поджечь на воздухе чистый водород, выходящий из газоотводной трубки, он горит ровным, еле заметным пламенем. Теперь поместим трубку с горящим водородом в банку с кислородом (рис. 95).
Горение водорода продолжается, при этом на стенках банки видны капли воды, образующейся в результате реакции:
При горении водорода выделяется много теплоты. Температура кислородно-водородного пламени достигает больше 2000 °С.
Химическая реакция водорода с кислородом относится к реакциям соединения. В результате реакции образуется оксид водорода (вода). Это значит, что произошло окисление водорода кислородом, т. е. эту реакцию мы можем назвать и реакцией окисления.
Если же в пробирку, опрокинутую вверх дном, собрать немного водорода методом вытеснения воздуха, а затем поднести к ее отверстию горящую спичку, то раздастся громкий «лающий» звук небольшого взрыва смеси водорода с воздухом. Такую смесь называют «гремучей».
На заметку: Способность водорода в смеси с воздухом образовывать «гремучий газ» часто являлась причиной катастроф на воздушных шарах, заполненных водородом. Нарушение герметичности оболочки шара приводило к пожару и даже взрыву. В наше время воздушные шары заполняют гелием или постоянно нагнетаемым горячим воздухом.
В атмосфере хлора водород сгорает с образованием сложного вещества — хлороводорода. При этом протекает реакция:
Реакция водорода с азотом происходит при повышенной температуре и давлении в присутствии катализатора. В результате реакции образуется аммиак NH3:
Если струю водорода направить на расплавленную в пробирке серу, то у ее отверстия ощутится запах тухлых яиц. Так пахнет газ сероводород H2S — продукт реакции водорода с серой:
На заметку: Водород способен не только растворяться в некоторых металлах, но и реагировать с ними. При этом образуются химические соединения, называемые гидридами (NaH — гидрид натрия). Гидриды некоторых металлов используют как горючее в ракетных двигателях на твердом топливе, а также при получении термоядерной энергии.
Реакции водорода со сложными веществами
Водород реагирует при повышенной температуре не только с простыми, но и со сложными веществами. Рассмотрим в качестве примера его реакцию с оксидом меди(II) CuO (рис. 96).
Пропустим водород над нагретым порошком оксида меди(II) CuO. По мере протекания реакции цвет порошка изменяется с черного на коричнево красный. Это цвет простого вещества меди Cu. В ходе реакции на холодных частях пробирки появляются капельки жидкости. Это еще один продукт реакции — вода H2O. Отметим, что в отличие от простого вещества меди вода — сложное вещество.
Уравнение реакции оксида меди(II) с водородом:
Водород в реакции с оксидом меди(II) проявляет способность отнимать у оксида металла кислород, тем самым восстанавливать металл из этого оксида. В результате происходит восстановление меди из сложного вещества CuO до металлической меди (Cu).
Реакции восстановления — это реакции, в ходе которых сложные вещества отдают атомы кислорода другим веществам.
Вещество, отнимающее атомы кислорода, называют восстановителем. В реакции с оксидом меди(II) восстановитель — водород. Так же реагирует водород и с оксидами некоторых других металлов, например PbO, HgO, MoO3, WO3 и др. Окисление и восстановление всегда взаимосвязаны между собой. Если одно вещество (Н2) окисляется, то другое (CuO) — восстанавливается, и наоборот.
Краткие выводы урока:
- При нагревании водород реагирует с кислородом, хлором, азотом, серой.
- Восстановление — это отдача атомов кислорода сложными веществами другим веществам.
- Процессы окисления и восстановления взаимосвязаны между собой.
Надеюсь урок 22 «Химические свойства водорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
[spoiler title=”источники:”]
http://prosto-o-slognom.ru/chimia_spravochnik/1_vodorod_H.html
[/spoiler]
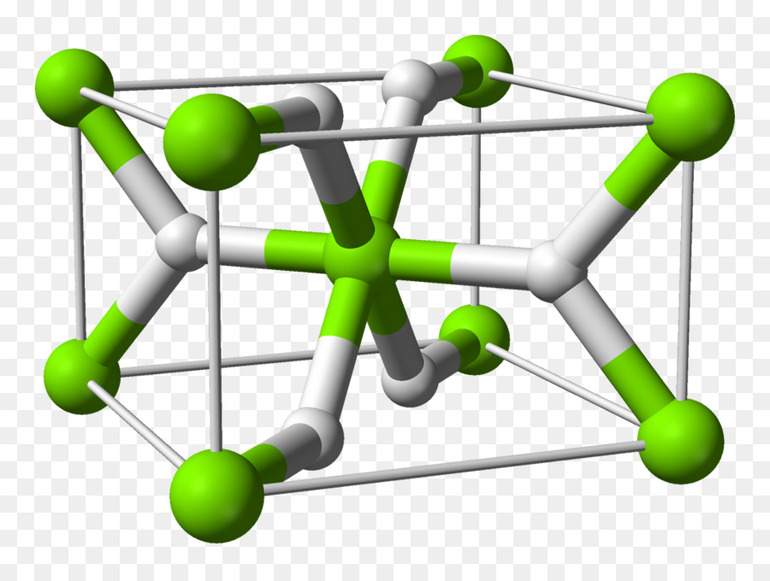
Типы и классификация
Вещества, созданные водородом с металлами и неметаллами многобразны. В зависимости от характера полученного соединения, выделяют:
- Простые гидриды — бинарные, в них только 2 элемента, они встречаются чаще всего.
- Со многими переходными металлами (элементы р-подгруппы) водород образует ко́мплексные соединения. Ко́мплексные гидриды металлов (к примеру, боро- или алюмогидриды) вместо атома водорода, имеют алюмогруппу (AlH4) или борогруппу (BH4). Из них натрийборогидрид Na (BH4) и литийалюмогидрид Li (AlH4), будучи сильными восстановителями, нашли применение в лабораторной практике. Кроме этого, Na (BH4) используют для отбеливания бумаги.
- И также есть гидриды интерметаллидов (пример: TiAl или Ti3Al, алюминид титана), в кристаллических решётках которых водород просто растворяется, аккумулируется.
У разных химических элементов строение атомов и молекул отличается. Соответственно, связи в образованных гидридах тоже неодинаковы. Классификация по виду связи определяет полученные вещества, как:
- металлоподобные;
- ионные (солеобразные);
- ковалентные.
Бинарные соединения самые распространённые, есть у всех элементов. Исключения здесь металлы платиновой группы (платиноиды), Au, Ag, Hg, Ti, Cd, In, а также благородные газы. Между этими веществами нет чётко выраженных границ, деление по характеру связи для них немного условно.
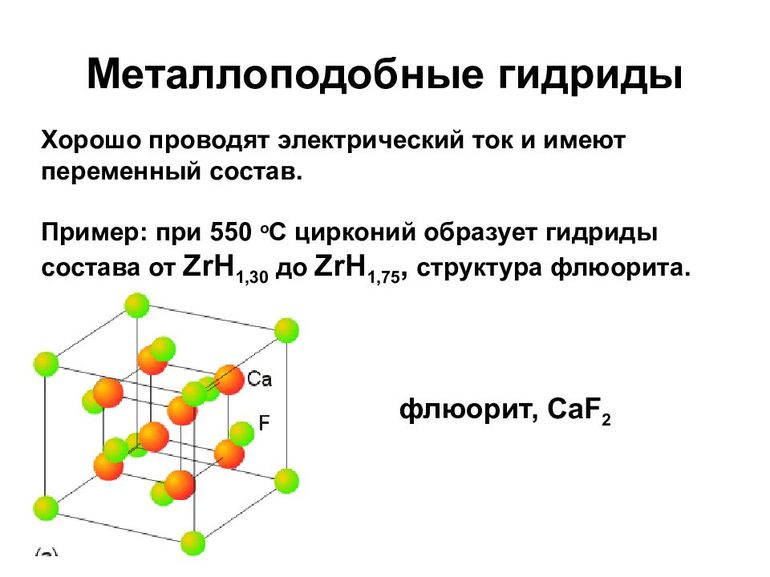
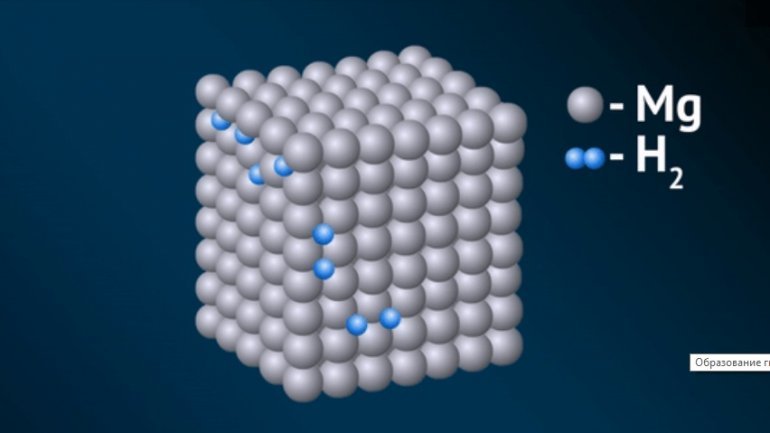
К металлическим принадлежат соединения водорода с переходными металлами и редкоземельными элементами. Это, скорее, раствор неметалла в металле, с внедрением атомов в кристаллическую решётку. Характерно для них следующее:
- В основном такие гидриды являются бертоллидами, состав их зависит от способа получения, непостоянен, законам постоянных и кратных отношений не подчиняется.
- В формулах для них указывают предельное содержание водорода.
- В отличие от прочих, они сохраняют исходную металлическую решётку.
- Их вид и физические свойства соответствуют металлам, с которыми они образованы.
- Имеют характе́рный металлический блеск, взаимодействуют с H2O (в жидком или газообразном состоянии), кислородом, при нормальных условиях, но медленно.
- Как и металлы, обладают значительной теплопроводностью и проводимостью.
- При нагревании распадаются на водород и исходный металл.
Образуются в процессе адсорбции водорода на металлической поверхности, диссоциации H2 и диффузного проникновения атомов в металлическую решётку. Поглощение обратимо, но химические связи весьма крепкие.
От металлоподобных, через гидриды меди (CuH, водородистая медь), цинка, ZnH2, водородистый цинк и им подобных, осуществляется переход к полимерам.
Это химические вещества со сложной структурой, в которой присутствуют цепи и полиэдры. Твёрдые, устойчивые, с кристаллическим строением (полимерные гидриды лёгких металлов стабильнее всего), данные соединения распадаются при нагреве на составляющие элементы.
От них, через гидриды бора и галлия — к водородным соединениям с неметаллами. В них водород имеет степень окисления +1.
Соединения с ионным типом связи
Их образует водород с металлами 1А и 2А групп, кроме Mg, а также с Al. Они отчасти показывают свойства соответствующих галогенидов, откуда и появилось второе наименование — солеобразные.
Это химические соединения, такие как гидрид натрия (NaH), кальция (CaH2), лития, с формулой LiH, другие. Для них характерно:
- Получают при высокой температуре и под давлением.
- В этих соединениях, проявляющих, как правило, щелочные свойства, у водорода степень окисления -1. С металлами 1А и 2А групп, такими, как Na, Li, Be, K, Rb, Sr он выступает окислителем, подобно галогенам. Например, гидрид натрия, с химической формулой NaH — в этом соединении ион водорода имеет отрицательный заряд.
- Это кристаллические вещества белого цвета, с ионной решёткой, структура подобна строению соответствующего галогенида.
- При нормальных условиях устойчивы.
- Распад на металл и водород при нагреве, минуя этап плавления (исключением является LiH, его температура плавления 688 градусов Цельсия).
- В расплаве — хорошие проводники, при этом на аноде будет выделяться H2.
- Вспыхивают при растирании на воздухе.
- Все являются сильными восстановителями. Применяются для получения чистых металлов из солей и оксидов, для удаления окалины, коррозии.
- Реагируют с оксидом углерода, формируют соли муравьиной кислоты (формиаты).
- Как и соли, могут участвовать в обменных реакциях, гидролизе.
Солеобразными бывают не только бинарные (простые) соединения водорода. Дигидриды, образуемые добавлением групп бора (BH4) или алюминия (AlH4) к металлу, также имеют ионный тип связи.
Окислительная активность водорода небольшая по сравнению с галогенами. Дополнительный электрон он отдаёт с трудом, при нагреве (реакция проходит с поглощением тепла). Это и обусловливает различие между свойствами ионных гидридов и галогенидов.
По химической природе такие соединения ведут себя как основные. Ионные гидриды обладают высокой химической активностью. Они бурно реагируют с кислородом и H2O в парообразном состоянии.
Но выраженный ионный характер — свойство, проявляемое соединениями кальция, натрия, щелочных и щёлочноземельных элементов. На них проще всего и нагляднее можно показать химию взаимодействий этих веществ:
- С водой: 2NaH + H2O = 2NaOH + H2O.
- С кислородом: NaH + O2 = NaO + H2O.
- Реакция разложения: CaH2 = Ca + H2.
- С оксидами углерода: NaH + CO2 = NaCOOH.
- Кремния: 4NaH + 3SiO2 = 2Na2SiO3 + Si + 2H2.
- Металлов: 4NaH + Fe3O4 = 4NaOH + 3Fe.
- Восстановление: 2NaH + 2SO2 = Na2SO4 + H2S.
- С аммиаком: NaH + NH3 = NaNH2 + H2.
- С кислотами: 2NaH + H2SO4 = Na2SO4 + 2H2.
- Со спиртами: KH + HO-R = KOR + H2.
По свойствам и природе связи промежуточное положение между ионными и ковалентными занимает гидрид магния, с формулой MgH2.
Соли и оксиды калия, кальция, меди и других щелочных и щёлочноземельных металлов образуют с гидридом кислорода (водой) ещё один вид соединений — дигидраты. Это соли серной кислоты (сульфаты), галогениды, оксиды плюс 2 присоединённых молекулы H2O. Формула алебастра — Ca5O4 плюс 2H2O, гипс — CaSO4 плюс 2H2O, в природе они не редкость.
Гидросульфид натрия, NaHS, образует не только дигидрат, NaHS плюс 2H2O, но и тригидрат, с присоединением 3H2O.
Когда связь ковалентна
Это соединения, в которых степень окисления водорода +1, как правило, газы, летучие жидкости. Их водород даёт с неметаллами, а также с германием, алюминием, бериллием, оловом, мышьяком, сурьмой — элементами 4, 5, 6 и 7 групп периодической системы. И также ковалентную связь имеют соединения водорода и бора.
Это могут быть вещества простые, бинарные, такие как метан (CH4), силан (формула SiH4). Сложные тоже имеются, с длинными цепями, многоатомные молекулы — они образуются водородом с кремнием, бором, германием.
Многие из них неустойчивы, так гидрид олова (SnH4) распадается уже при комнатной температуре, а гидрид свинца недолго существует и при отрицательных температурах. Самый простой гидрид бора не существует в природных условиях вообще.
Отличительные свойства:
- Все сильные восстановители, степень окисления водорода +1.
- Проявляют кислотные, а также амфотерные свойства.
- Агрегатное состояние — газ или летучая жидкость, исключения тут гидрид кислорода (вода), азота, фтороводород (плавиковая кислота), те, в которых молекулы полярны и возникает водородная связь. Последние существуют, как нелетучая жидкость или в твёрдом состоянии.
- Электронодефицитные виды, получаемые с элементами главной подгруппы 3 группы, например, гидрид алюминия AlH3 или бериллия, химическая формула BeH2, очень активны и образуют многоатомные, длинные полимерные цепи, с больши́м весом. Такие полимеры — твёрдые вещества.
- При нагреве легко и практически необратимо, разлагаются на элемент и водород H2. Требуется температура от 100 до 300 градусов по Цельсию (для гидрида серы H2S — порядка 400 градусов).
- Чаще всего они имеют высокую токсичность.
- Характерна высокая химическая активность, реакционная способность.
- Получить можно непосредственным взаимодействием элементов, разложением металлических соединений водой, кислотой, восстановлением галогенидов гидридами бора, алюминия, щелочных металлов.
- Высшие гидриды германия, кремния, с общей химической формулой EnH2n+2 — это полимеры, их стабильность тем ниже, чем больше атомный вес и количество атомов элемента.
- Принадлежащие к s-подгруппе хорошо растворяются в воде и проявляют кислотные свойства. Прочие — в незначительной мере, свойства у них основные. Все хорошо растворимы в неполярных органических растворителях.
- При взаимодействии с водой (H2O), выделяется чистый водород (H2) и оксид, с общей химической формулой EO2.
Тяжёлые элементы дают соединения с небольшой устойчивостью.
За счёт водородных связей и способности к донорно-акцепторному взаимодействию, вода (H2O), плавиковая кислота (HF), аммиака (NH3), а частично HCl и H2S, хорошие растворители.
Химические вещества, образованные двумя или более металлов, такие как FeTi, Ca2Ru, Mg2Ni — это интерметаллические соединения. Они хорошо поглощают водород и соединяясь с ним дают гидриды-интерметаллиды.
Содержат атомы железа, магния, меди, кальция, титана, алюминия, редкоземельные элементы. Их легко получить даже с H2 нехимическим (для технических нужд, до 2% примесей). Применяют для хранения водорода и аккумуляторных батарей.
У гидридов много областей применения. Особенно широко используют NaH. С его помощью удаляют термическую окалину с металлов, производят добавки, повышающие октановое число бензина, катализаторы полимеризации. Он необходим при производстве красителей, моющих средств, в качестве мощного восстановителя применяется в металлургии.
В органической химии комплексные водородные соединения применяют уже более 50 лет, для получения особо чистых химических элементов. В химии алкалоидов также широко используют комплексные гидриды металлов. Без них не обходится производство металлокерамики, дегазаторов, многих фармакологических средств.
Азот с водородом образует аммиак, кислород — воду, сера даёт сероводород, в природе постоянно идёт синтез подобных веществ. С миром химии человек пересекается постоянно. Поэтому знания о наиболее распространёных веществах принесут пользу каждому.
H2 – это элемент IА-группы, порядковый № 1. Заряд атомного ядра +1, потому что в ядре 1 протон. Вокруг ядра вращается всего 1 электрон. До завершения уровня атому не хватает 1 электрона. Завершать энергетический уровень атом водорода может различными способами: образовывать летучие водородные соединения и гидриды.
Оглавление:
- Способы завершения энергетического уровня
- Типы гидридов
- Особенности водородных соединений
H2 – это элемент IА-группы, порядковый № 1. Заряд атомного ядра +1, потому что в ядре 1 протон. Вокруг ядра вращается всего 1 электрон. До завершения уровня атому не хватает 1 электрона. Завершать энергетический уровень атом водорода может различными способами: образовывать летучие водородные соединения и гидриды.
Способы завершения энергетического уровня
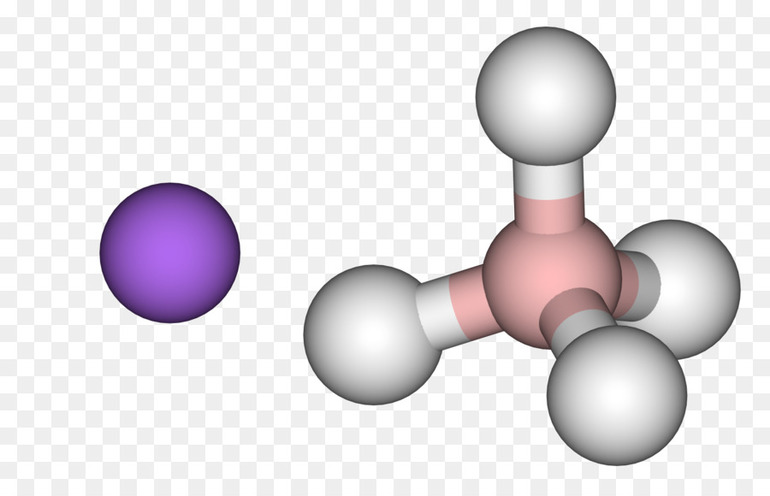
Водород — один из немногих химических элементов, который может иметь как положительную, так и отрицательную степень окисления в соединениях. Как, например, бром ( NaBr -1, Br +1 2O ) и хлор ( NaCl -1, HClO3+5):
- Может принимать на внешний уровень один недостающий электрон – атом водорода превращается в ион, заряженный отрицательно. Такая реакция происходит при взаимодействии с металлами, которые в соединениях проявляют только положительную степень окисления. Степень окисления водорода будет равна -1, так как заряд отрицательный. Металлы с H2 создают соединения, которые называются гидридами. Способствует их образованию H2 с самыми активными металлами: щелочными и щелочноземельными. Например: NaH (гидрид натрия), CaH2 (гидрид кальция), LiH (гидрид лития), CuH (гидрид меди).
- Может отдавать один электрон со своего внешнего энергетического уровня — остается только ядро атома водорода, состоящее из протона. Таким образом, H2 образует химические соединения с неметаллами, которые при этом будут проявлять только отрицательную степень окисления. В соединениях с водородом степень окисления неметалла будет низшая. В этом случае водород становится частицей с положительным зарядом иона или степенью окисления +1. Соединения H2 с неметаллами называют летучие водородные соединения. Например: HCl (соляная кислота/хлороводород), NH3 (водородное соединение азота — аммиак), NH4OH (нашатырный спирт), NaHS (гидросульфид натрия).
Помимо способов завершения энергетического уровня, существует классификация гидридов, в соответствии с их характером связи. Они подразделяются на 3 большие группы.
Типы гидридов
Стоит рассмотреть основные группы, поскольку побочные группы (полимерные, интерметаллические и комплексные) являются подвидами основных, а также имеют схожие с ними физические и химические свойства.
Ионные гидриды
Ионные (солеобразные) — соединения H2 с металлами IA и IIA (кроме магния), а также с алюминием. Их главное отличие от двух других видов в том, что они активно реагируют с H2O с образованием щёлочи и выделением H2 в виде газа. Самым ярким представителем ионных гидридов является гидрид натрия.
Физические свойства: белые твёрдые вещества с кристаллической решёткой, содержащей катион (плюс) металла и гидрид-анион (минус) Н–. Проводят электрический ток. Устойчивы при нормальных условиях (н.у.).
Как и любое вещество (химический элемент, простое вещество или химическое соединение), ионные гидриды обладают свойствами. Они проявляются в процессе реакции и влияют на неё. Химические свойства:
- Разлагаются при нагревании еще до достижения своей температуры плавления: CaH2 = Ca + H2↑.
- При растирании на воздухе воспламеняются: CaH2 + O2 = CaO + H2O.
- Реагирует с водой с образованием щелочи и выделением водорода: 2NaH + H2O = 2NaOH + H2↑.
- Являются сильными восстановителями (при t 700-800°С восстанавливают оксиды до металлов), но их использование в лаборатории осложнено, поскольку они с легкостью реагируют с кислородом и влагой воздуха.
Применение: для получения металлов из их оксидов, удаления окалины с поверхности металлических изделий, как ракетное топливо.
Получение: при взаимодействии металлов с водородом при t 200-600°С:
- H2 + 2Na = (300°C) 2NaH;
- H2 + Ca = (600°C) CaH2.
Ковалентные соединения
Ковалентные — гидриды, образованные неметаллами IV, V, VI и VII групп, а также бором. Например, гидрид углерода/метан CH4, силан SiH4, гидрид серы/сероводород H2S.
Физические свойства: газообразные, легко воспламеняются на воздухе.
Ковалентные гидриды во многом отличаются от ионных и металлических. Если последние обладают химическими свойствами, схожими с металлами, то свойства ковалентных следует рассмотреть подробнее. Химические свойства:
- При высоких температурах разлагаются практически необратимо: H2S = (около 400°С) S + H2.
- Сильные восстановители.
- Высокая токсичность.
- B2H6 и SiH4 разлагаются водой с выделением водорода: B2H6 + 6H2O → 2H3BO3 + 6H2.
- Гидриды элементов V-VII групп не разлагаются водой.
Применение: для получения полупроводниковых пленочных покрытий, защитных покрытий на поверхности металлов.
Получение: термическое разложение, восстановление галогенидов.
Существуют многочисленные производные ковалентных гидридов, в которых часть атомов H2 замещена атомами галогенов или металлов.
Магний по своим свойствам и химической связи располагается между ионными и ковалентными гидридами. С водой и водными растворами MgH2 реагирует с выделением H2, но не так энергично, как ионные гидриды.
Соединения железа с водородом крайней неустойчивы и в чистом виде не обнаружены. Формула неустойчивого гидрида железа выглядит так: C5H5Fe.
Металлические соединения
Металлические — соединения переходных металлов. Фактически они являются твёрдым раствором H2 в металле, атомы водорода помещаются в кристаллическую решётку металла. Их образованию всегда способствует адсорбция водорода на поверхности металла.
Физические свойства: представляют собой кристаллические вещества с металлическим блеском. Обладают интенсивной окраской, проявляют металлические или полупроводниковые свойства. Устойчивы на воздухе. С кислородом и водой реагируют медленно. Магнитными, механическими, тепло- и электропроводными свойствами схожи с металлами.
Химическая связь очень прочная.
Применение: применяются в качестве источников водорода особой чистоты (который используется в топливных элементах), также для удаления водорода из газовых смесей.
Получение: реакция металла с водородом при обычной температуре или при нагревании: Ti + H2 = (150-200°С) TiH2.
При взаимодействии H2 с интерметаллическими соединениями, такими как TiFe, LaNi5, можно получить гидриды интерметаллидов TiFeH2, LaNi5H6, которые с высокой скоростью обратимо поглощают водород при атмосферном давлении.
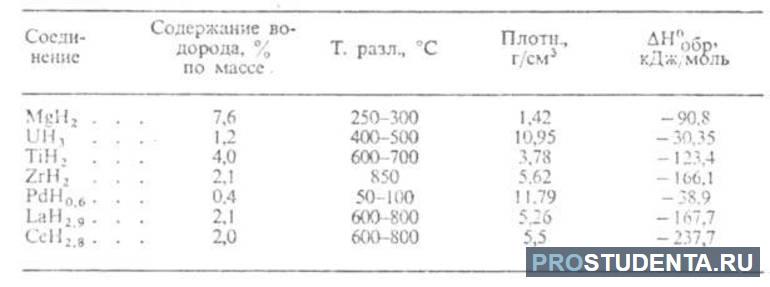
В прикрепленных таблицах указано содержание водорода, температура разложения, плотность и пр., что поможет в более глубоком понимании физических свойств водорода разных типов гидридов.
Особенности водородных соединений
Как и в любом разделе химии, водородные соединения имеют свои исключения. В их числе He, Ne, Ar, Kr, Pm, Os, Ir, Rn, Fr и Ra. Они не образуют бинарные соединения с водородом.
Информация, изложенная выше доказывает то, что химия интереснейший и увлекательный предмет, который стоит потраченного внимания и времени.