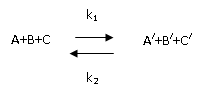
Математическим
выражением закона термодинамики для
равновесия химических процессов
(реакций) является закон
действующих масс, устанавливающий
связь между равновесными концентрациями
или парциальными давлениями компонентов
реакции
Действующими
массами называются:
–
парциальные равновесные давления
реагентов ();
–
равновесные концентрации веществ ();
–
числа молей ();
–
мольные доли ().
ЗДМ
при
равновесии отношение произведений
концентраций конечных продуктов, взятых
в степенях, равных их стехиометрическим
коэффициентам, к такому же произведению
концентраций исходных веществ в обратимой
реакции при данной температуре есть
величина постоянная, называемая
константой равновесия химической
реакции (К).

где
СC,
СD,
CA,
СВ
– равновесие концентрации веществ-участников
реакции; а, в, с, d
– стехиометрические коэффициенты.
Для гомогенной газовой реакции
Рассмотрим
ЗДМ для газовой реакции
Условия:
–
все реагенты-участники реакции – газы;
–
все газы идеальные, для которых справедливо
уравнение зависимости изменения энергии
Гиббса от давления
(*);
– процесс протекает
при постоянной температуре, т.е. Т=const.
В этом случае можно
записать:
С
учетом (*), получаем:
,
или
при
условии равновесия получаем:

иначе,

равновесные!!!)
Например,
.
Запись константы равновесия для данной
реакции будет иметь вид:
Единицы измерения константы равновесия
зависят от того какие единицы измерения
используются при определении равновесных
давлений, в данном случае это могут быть
Если
изменить парциальное давление, например,
–
константа равновесия останется величиной
постоянной, т.к. изменяться давления
других реагентов.
Кр
зависит от (природы вещества, температуры).
В
записи константы равновесия, как уже
отмечалось, помимо парциальных равновесных
давлений могут участвовать числа молей
компонентов-участников реакции, мольные
доли, равновесные концентрации веществ.
Тогда,

При этом константы равновесия при записи
помечаются соответствующими индексами:
Кр, Кс, Кn,
Кх. Эти величины связаны между собой
соотношениями:
Кр=Кс(RT)n=Кх(Р
общ)n=Kn(RT/V)n,
где
Р общ –
общее давление равновесной газовой
смеси, V – объем газовой смеси, n
–
,n
– разность числа молей конечных и исходных
газообразных участников реакции.
Например , 2СО +
О2 = 2СО2
H2
+ J2 = 2HJ
Таким
образом, если n
в уравнении равно 0, то численное значение
константы равновесия Кр, Кс, Кn, и Кх
совпадают.
Если
величина Кр:
Кр=1
в этом случае в системе наблюдается
равновесие
Кр>1
реакция идет прямо
Кр<1
реакция протекает в обратном направлении
Кр>>1
реакция идет в прямом направлении и она
необратима
Кр<<1
реакция идет в обратном направлении и
она необратима.
Для гетерогенной реакции
Гетерогенными
называются реакции, в которых реагенты
находятся в разных агрегатных состояниях.
При этом для таких реакций с участием
газов, когда не образуются твердые и
жидкие растворы, в записи закона
действующих масс
участвуют только равновесные действующие
массы газообразных компонентов. Например,
3Fe(тв)
+ СН4(газ) =
Fe3C(тв)
+ 2Н2(газ)
условия
равновесия G
= 0 выполняются если
из
которого следует

При Т=const правая
часть этого уравнения – величина
постоянная, а выражение
равно константе равновесия данной
гетерогенной реакции
где
–
равновесные парциальные давления газов.
Для реакции СО2
+ СО
2СО константа равновесия Кр и Кс запишутся
так

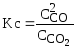
Если же вещества,
участвующие в реакции растворяются
друг в друге или в каких-то инертных
растворителях, роль которых в
пирометаллургических процессах могут
играть шлаковые или металлические фазы,
то в константу равновесия записываются
их равновесные концентрации или
термодинамические активности.
Например,
[FeO]+[C]=[Fe]+CO
Квадратная скобка
[ ] указывает, что данное вещество
является
компонентом металлической фазы
Fe,
FeO,
C
– термодинамические
активности Fe, FeO и C в расплаве (жидкой
стали).
Для реакции
(MgCl2)+CaC2=(CaCl2)+Mgпар+2Cтв
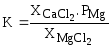
Круглые скобки (
) указывают, что MgCl2
и CaCl2
являются компонентами шлаковой
(солевой) фазы.
,
–
мольные доли CaCl2
и MgCl2 в
солевом расплаве.
Константа равновесия
зависит от температуры и природы веществ.
-
влияние
температуры на константу равновесия
Практически любой технологический
процесс проводится в условиях, отличных
от стандартных (Т
= 298,16 К,
Р = 1 атм). Поэтому
при проведении реальных термодинамических
расчетов необходимо знать температурную
зависимость (закон изменения) константы
равновесия. Это позволит установить
влияние температуры на изменение
парциальных давлений (или концентраций)
компонентов и определить направление
смещения равновесия изучаемой реакции
или процесса.
и
называется уравнением
изобары Вант-Гоффа.
Аналогично можно получить уравнение
зависимости константы равновесия от
температуры для изохорических условий.
В этом случае уравнение
изохоры Вант-Гоффа
имеет вид:
.
Так как чаще всего металлургические
процессы протекают при постоянном
давлении, то чаще всего для анализа
зависимости используютуравнение
изобары.
Проанализируем уравнение изобары,
преобразовав его в интегральную форму.
Если расчеты производятся для небольшого
интервала температур, то тепловой эффект
реакции H
в уравнении изобары можно считать
величиной постоянной. Тогда это уравнение
в интегральной форме будет иметь вид:
.
(**)
С
уравнению, влияние температуры на
константу равновесия обуславливаетсязнаком
теплового эффекта.
При положительных значениях (т.е.
протекает эндотермическая реакция) 
и константа равновесия возрастает с
повышением температуры. В случае
экзотермической реакции – наоборот.
Это говорит о том, что при
изменении температуры давления
(концентрации) компонентов при равновесии
изменяются.
Данный общий принцип, отражающий влияние
различных факторов на положение
равновесия, носит название принципа
смещения равновесий
или принципа
Ле-Шателье,
с которым мы уже встречались при
рассмотрении вопросов подвижности
равновесия:
если
на систему, находящуюся в устойчивом
равновесии, воздействовать извне,
изменяя какое-нибудь из условий,
определяющих положение равновесия, то
в системе усилится то из направлений
процесса, течение которого ослабляет
влияние произведенного воздействия, и
положение равновесия сместится в том
же направлении.
Из уравнения Вант-Гоффа следует, что
для определения температурной зависимости
константы равновесия любой химической
реакции необходимо знать температурную
зависимость теплового эффекта
Степень влияния
температуры на константу равновесия
реакции зависит от абсолютного значения
теплового эффекта: чем больше Н,
тем сильнее влияет температура на Кр.
На рис. представлена
температурная зависимость константы
равновесия реакции в координатах lnKp –
1/T в виде прямых линий.
Определив Кр
реакции при двух температурах (Т1
и Т2),
можно рассчитать тепловой эффект реакции
(Н),
решая совместно уравнение (**) для двух
температур:
,
.
И вычитая одно
уравнение из другого, получим

откуда
По уравнению

двух температур Т1или
Т2 и
Нреакции
можно найти К при другой температуре
или
.
-
уравнение
изотермы вант-гоффа
Химическая
термодинамика позволяет расчетным
путем определить полезную работу
химической реакции через изменение
функции F
и G
и тем самым судить о направлении
химического процесса.
Вант-Гофф вывел
уравнение изотермы реакции, которое
носит его имя и связывает изменение
функций F
и G
с константой равновесия реакции и
парциальными давлениями или концентрациями
веществ, участвующих в реакции.
Уравнение
изотермы Вант-Гоффа имеет вид:
для
реакций, протекающих в изохорных
условиях:
для
реакций, протекающих в изобарных
условиях:
где
F
– изменение энергии Гельмгольца реакции,
G
– изменение энергии Гиббса реакции, Кр,
Кс – константы равновесия химических
реакций, П – константа неравновесия
химических реакций.
Проанализируем
уравнение изотермы Вант-Гоффа для
изобарных процессов как наиболее часто
встречающиеся на практике.
Возьмем реакцию,
где все участники – газы:
аА + bB = dD + rR
Для реакции,
протекающей в изобарных условиях,
уравнение изотермы примет вид

где
– парциальные давления газов в исходной
реакционной смеси, PD, PR,
PA, PB
– парциальные
давления газов в равновесной газовой
смеси.
Поскольку

Кр, то при Т=const эта величина является
величиной постоянной, а константа
неравновесия П=
значений исходных давлений реагентов.
Если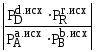
Кр, тоG<0,
реакция протекает в прямом направлении;

Кр, то G>0,
реакция протекает в обратном направлении;

Кр, то G=0,
система находится в состоянии равновесия.
-
методы
определения константы равновесия.
стандартное химическое сродство
Существует несколько
методов определения константы равновесия:
-
Константа
равновесия может быть определена из
опытных данных. Можно провести
термодинамический процесс (осуществить
химическую реакцию) и измерить равновесные
давления реагентов. Путь сложный, но
иногда используется. -
Константу
равновесия определяют по величинам
стандартных электродных потенциалов
и ЭДС гальванического элемента. -
Определяют
по величине произведения растворимости. -
Так
называемый энтропийный метод: для этого
используют уравнение нормального
химического сродства.
Химическим
сродством называется способность
различных веществ реагировать друг с
другом.
Количественной
мерой химического сродства является
изменение функций F
и G
для процессов (реакций), протекающих
при постоянных V и Т и Р и Т, соответственно.
Величины F
и G
не зависят от пути процесса, а зависят
только от свойств реагирующих веществ
и их термодинамического состояния; знак
F
и G
определяют направление процесса; при
равновесии эти функции имеют минимальное
значение, а их изменение (уменьшение)
при переходе из химически неравновесного
в равновесное состояние равно максимальной
работе обратимого процесса и, наконец,
эти величины (F
и G)
можно рассчитать с помощью уравнений
изотермы Вант-Гоффа.
Для того, чтобы в
одинаковых условиях сравнивать
устойчивость химических соединений,
реакционную способность веществ ввели
понятие стандартного
химического сродства.
Стандартным
химическим сродством называется
сродство, которое имеет место, когда
исходные парциальные давления или
концентрации каждого вещества,
принимающего участие в реакции, равны
единице.
В этом случае член
lnП в уравнениях изотермы становится
равным 0 и выражение для стандартного
химического сродства имеет вид
Fo=
-RTlnKc; Go=
-RTlnKp.
Сравнивая Go
(Fo)
разных реакций, можно оценить степень
удаления смесей веществ при Рi=1
или Сi=1
от равновесного состояния.
Для оценки
химического сродства чаще пользуются
величиной Go
реакции,
протекающей при стандартной температуре
298 К. Величины
образования веществ являются критерием
прочности химических соединений.
Вещество тем прочнее, чем изменение
стандартной энергии Гиббса его образования
величина более отрицательна.
Например:
=
-527934 Дж,
=
-362615 Дж.
Более прочным из
двух оксидов является ВаО, т.к.
более отрицательна, чем
.
Если требуется
оценить
вещества при температуре, отличной от
стандартной, то можно воспользоваться
уравнением температурной зависимости,
приводимыми в ряде справочников.
Например:
=
-232160 + 45,31Т,
Дж/моль
= -144210 + 72,21
Т, Дж/ моль.
Расчет стандартного
химического сродства при температурах
Т, отличных от стандартной, осуществляется
с учетом температурных зависимостей
изменения функций Н
и S
химических реакций по уравнению

Для оценки
химического сродства при заданных
давлениях (концентрациях) участников
реакций, отличных от стандартных
значений, пользуются уравнением изотермы
Вант-Гоффа,
Таким образом,
величина константы равновесия может
быть определена по уравнению:
.
В свою очередьможет быть рассчитано:
-
С
использованием
(образования)
веществ,
участвующих в реакции по уравнению
-
С
использованием таблиц стандартных
термодинамических характеристик
веществ по уравнению Гиббса – Гельмгольца
.
Одновременно
уравнение Гиббса-Гельмгольца показывает,
как влияет температура на
.
Возможно несколько
ситуаций:
Условия протекания экзотермических
реакций: H<0.При этом возможность условия
самопроизвольного протекания реакции
определяется знакомG
= H
– TS
Рассмотрим, как меняется знак Gпри варьировании величиныS.
а
ЕслиS>0,тоG
= H
– TS<0.Процесс идет самопроизвольно. Например,
протекание реакции
в
этом случаеS>0,
т.к. процесс протекает с увеличением
числа молей газообразных веществ
(вспомним, что ).
Следовательно, при H<0
и S>0
значение G
приобретает более отрицательное значение
и реакция идет самопроизвольно в прямом
направлении (рис. 14).
б) Если S=0,тоG
= H
– TS<0.Процесс идет самопроизвольно.
в) Если S<0,тоG
= H
– TS
может иметь различные знаки в
зависимости от абсолютной величины
TS:
-
.
.
При этомG<0.
Процесс идет самопроизвольно. -
При этомG=0.
Состояние равновесия. -
При
этомG>0.
Процесс не идет слева направо.
Например, протекание реакции
в
этом случаеS<0,
т.к. процесс протекает с уменьшением
числа молей газообразных веществ,
следовательно, G
приобретает более положительное
значение и реакция самопроизвольно в
прямом направлении
не идет (рис.15).
Таким образом, экзотермические реакции
термодинамически запрещены только при
значительном уменьшении энтропии,
например, в некоторых процессах
структурирования, образования
дополнительных связей и т.д.
Условия протекания эндотермических
реакций (H>0).При этом возможность условия
самопроизвольного протекания реакции
определяется знакомG
= H
– TS
Как и в предыдущем случае, рассмотрим,
как меняется знак Gпри варьировании величиныS.
а) Если S>0,тоG
= H
– TS
может иметь различные знаки в
зависимости от абсолютной величины
TS:
-
H < TS.
При этомG<0.
Процесс идет самопроизвольно. -
H = TS.При этомG=0.
Состояние равновесия. -
H > TS.
При этомG>0.
Процесс не идет самопроизвольно
слева направо.
б) Если S=0,
то G
= H
– TS>0.
Процесс не идет самопроизвольно
слева направо.
в) Если S<0,тоG
= H
– TS
>0. Процесс не идет самопроизвольно
слева направо.
Кинетика гомогенных процессов
Кинетикой химических реакций
называетсяучение
о скорости их протекания, механизме
химического взаимодействия
и зависимости их от различных факторов
(например,
таких как, концентрация реагирующих
веществ, температура, влияние катализаторов
и т.п.).Эти
вопросы представляют большой практический
и теоретический интерес
и являются центральными при изучении
данного раздела. Известно, что разные
реакции совершаются с самыми различными
скоростями. Некоторые, такие как
реакции разложения взрывчатых веществ,
заканчиваются в доли секунды; другие
продолжаются минутами, часами, днями,
а третьи, например, некоторые
процессы, совершающиеся в земной коре,
растягиваются на десятки, сотни и тысячи
лет. Кроме того, большое различие
существует не только в скоростях разных
реакций, нои скорость
какой-нибудь данной реакции может очень
значительно меняться в зависимости
от условий, в которых она происходит.
При практическом использовании от
скорости реакции, применяемой в
каком-нибудь производственном процессе,
будет зависеть производительность
аппарата и, следовательно, количество
вырабатываемой продукции. Поэтому очень
важно знать, с какой скоростью будет
совершаться та или
иная реакция в данных условиях и как
нужно изменить эти условия, чтобы
она протекала с желательной скоростью.
Теоретическое значение вопросов кинетики
заключаетсяв том,
что изучение их позволяет выяснить
многие важные детали химических
процессов и глубже понять механизм
взаимодействия веществ.
Физическая химия изучает системы с
позиций термодинамики и кинетики.
Сравнивая начальные и конечные состояния
системы, термодинамика предсказывает
возможность протекания реакции, а не
действительный переход безотносительно
ко времени, за которое он может произойти.
Несовпадение, в большинстве случаев,
возможного и действительного объясняют
двумя причинами:
1. Результат термодинамического анализа
(G)
является вероятностным, так как в него
входит вероятностная функция – энтропия.
2. Переход системы из одного состояния
в другое связан зачастую с преодолением
энергетического барьера, тем
большего, чем ниже температура перехода.
Таким образом, термодинамический анализ,
позволяющий оценить возможность
процесса, должен быть дополнен
кинетическим, который позволяет оценить
скорость процесса, возможность которого
доказана термодинамическим расчетом!!!
зависимость скорости реакции от
концентрации реагирующих веществ
При количественном
рассмотрении скорость
химической реакции принято характеризовать
изменением концентрации
реагирующих веществ в единицу времени.
По существу безразлично,
концентрацию какого из реагирующих
веществ рассматривать.
Концентрации
исходных веществ будут уменьшаться, а
получаемых — возрастать.Обычно скорость химической реакции при
постоянных внешних условиях не остается
постоянной, а изменяется во времени.
Это изменение можно отобразить с помощью
графической зависимости, приведенной
на рисунке. Очевидно, что по мере
расходования исходных веществ скорость
протекания процесса уменьшается. В
связи с этим численные значения скорости
реакции будут различными в определенный
промежуток или интервал времени.
Различают
среднюю скоростьреакции иистинную
скорость.
При определении средней скоростиреакции за данный промежуток времени
оперируют конечным изменением концентрации,
относящимся к промежутку времени:

Далее мы будем оперировать только
истинными скоростямиреакции,
которые определяются отношением
изменения концентрации к бесконечно
малому промежутку времени, или иначе,
как производная от концентрации по
времени:
.
Скорость
реакции всегда считается положительной.
Отношение
и производная
могут быть как положительными, так и
отрицательными в зависимости от того,
представляет ли«с» концентрацию
одного из исходных или одного из продуктов
реакции. Допустим, протекает химическая
реакция:,
согласно рисунку, криваясв,
характеризующая изменение концентрации
исходного вещества В, убывает во времени,
таким образом,и
,
следовательно, чтобы скорость была
величиной положительной необходимо в
правой части уравнения брать знак
«минус». Если же«с» представляет
концентрацию одного из получаемых
веществ, криваясс, то
наблюдается противоположная картина,
концентрация получаемого вещества
возрастает во времени, таким образом,и
.
Следовательно, в правой части уравнения
нужно брать знак «плюс».
Допустим, рассматриваемая нами реакция
обусловлена взаимодействием только
газообразных веществ. Очевидно, что
необходимым условием, определяющим
возможность взаимодействия между двумя
молекулами, является их взаимное
столкновение, т.е. сближение до
такого расстояния, при котором электроны
и атомы одной
молекулы попадают в сферу действия
электрических полей, возбуждаемых
частицами другой молекулы. Только при
таких условиях могут произойти те
переходы электронов и перегруппировки
атомов, в результате которых образуются
новые молекулы.
Конечно, не каждое
столкновение приводит к такому
взаимодействию. Число столкновений,
испытываемых каждой молекулойгаза
в обычных условиях, очень велико и
достигает десятков миллиардов в
секунду. Отсюда следует, что в реакциях,
протекающихс
конечными скоростями (а не мгновенно),
к взаимодействию приводит только
какая-то малая часть столкновений.Возможность и
вероятность химического взаимодействия
будет зависеть от состояния молекул
(полярность) в момент столкновения и от
длительности самого столкновения.
Независимо от того, какие именно
столкновения сопровождаются
взаимодействием, можно принять, что при
постоянных внешних условиях некоторая
постоянная доля
(часть) столкновений является эффективной
для взаимодействия. Поэтому чем
больше будет происходить столкновений,тем, при прочих
равных условиях, больше будет число
случаев взаимодействия, а,
следовательно, и количество образовавшегося
нового вещества, т. е. тем скорее будет
протекать реакция.
Число столкновений
должно увеличиваться с повышением
концентрации
реагирующих веществ. Для наиболее
простых по кинетике гомогенных
реакций опыт показывает, что зависимость
скорости процесса от концентраций
реагентов, в общем виде выражают в формеосновного постулата кинетики–ОПК
при постоянной
температуре скорость данной реакции
прямо пропорциональна
произведению концентраций реагирующих
веществ, причем каждая из концентраций
участвует в степени, в простейших случаях
равной коэффициенту перед формулой
данного вещества в уравнении реакции.
Этим правилом и определяется влияние
концентрации на скорость реакции. Оно
было выражено (в несколько иной форме)
впервые Гульдбергом и Вааге (1867).Его также называютзаконом действия
масс, как и закон, выражающий
константу равновесия реакции, они тесно
связаны между собой. Для газовых реакций
это правило является строгим только в
пределах применимости законов идеальных
газов. Оно применимо также и к реакциям
в разбавленных растворах (строго только
для бесконечно разбавленных растворов).
В математической форме в применении,
например, к реакции
оно выражается в виде:
,
где k- коэффициент
пропорциональности, который для каждой
конкретной, т.е. данной реакции приT=constявляется
величиной постоянной и называетсяконстантой скорости реакции.
Ончисленно равен скорости реакции в
условиях, когда концентрация каждого
из исходных веществ равна единице.
кинетическая классификация химических
реакций
В отношении
кинетики химические реакции классифицируют
по двум признакам:
– по признаку
молекулярности
реакции;
–
по признаку порядка
реакции.
Молекулярность реакции
определяется числом молекул,
одновременным взаимодействием между
которыми осуществляется акт
химического превращения.
По этому признаку реакции разделяются
на:
– одномолекулярные (или мономолекулярные);
– двухмолекулярные (или бимолекулярные);
– трехмолекулярные (или тримолекулярные).
Можно говорить и о
более высокой молекулярности, но в
действительности одновременное
столкновение трех молекул уже является
очень маловероятным и трехмолекулярные
реакции встречаются
крайне редко. Реакций же более высокой
молекулярности практически неизвестно.
К одномолекулярнымреакциям относятся
некоторые реакции разложения молекул
и внутримолекулярных перегруппировок.
Например, газовая реакция:
.
Для простых (элементарных) одномолекулярных
реакций зависимость скорости реакции
от концентрации описывается уравнением:
,
где С –
концентрация исходного вещества. Или
иначе можно записать, что
.
Здесь kимеет размерность
обратного времени, выражается в с-1,
мин-1или других соответствующих
единицах.
К двухмолекулярнымреакциям относятся
такие, реализация которых происходит
при столкновении двух молекул различного
или одинакового типа:
или
.
Для таких реакций:
,
где
и
–
концентрации исходных веществ.
Для таких
реакций:
.
В частном
случае, когда
,
имеем:
.
Для
двухмолекулярных реакций константа
скорости kимеет размерностьили
.
По аналогии, к трехмолекулярным реакциям
относят реакции, в которых для
взаимодействия необходимо одновременное
столкновение трех молекул одного или
различного видов. В общем случае уравнение
скорости простых (элементарных)
трехмолекулярных реакций имеет вид:
.
Примером трехмолекулярной реакции
рассмотренная ранее реакция
.
Порядок реакцииопределяется
по виду уравнения, выражающего зависимость
скорости реакции от концентрации
реагирующих веществ.Порядок реакции
равен сумме
показателей степеней концентраций в
уравнении, выражающем
зависимость скорости реакции от
концентраций реагирующих веществ.
Реакции разделяются на реакции:
– первого порядка,
– второго порядка,
– третьего порядка (реакции более
высоких порядков не встречаются).
Кроме того, известны так называемые
реакции нулевого порядка и некоторые
реакции, порядок которых выражаетсядробным числом. Таким образом,
порядок химической реакции изменяется
от 0 до 3, может принимать дробное значение!
Прежде такое распределение считали
совпадающим с делением по признаку
молекулярности, т.е. все
одномолекулярные реакции являются
реакциями первого порядка, и наоборот,
а все двухмолекулярные реакции
являются реакциями второго порядка, и
наоборот. Однако экспериментальные
исследования внесли свои коррективы.
Скорость химической реакции определяется
совокупностью огромного числа элементарных
актов взаимодействия между молекулами
(или атомами, или ионами). Акты эти могут
быть одинаковыми
(в простых реакциях) или различными,
происходящими параллельно или
последовательно.
Кроме того, в
некоторых случаях один из компонентов
реакции присутствует в таком большом
избытке, что расход его в реакции
практически не отражается на его
концентрации. В результате кинетика
этой реакции описывается, например,
уравнениями кинетики
реакции первого порядка, хотя реакция
является по существу бимолекулярной.
Реакциями нулевого
порядки называют процессы, в которых
скорость процессасохраняется
постоянной во времени. Это встречается
в некоторых гетерогенных системах(например, если
применять эфир, малорастворимый в воде,
и взять его в избытке, чтобы в системе
присутствовал эфирный слой, то расход
эфира будет постоянно восполняться из
эфирного слоя. Таким образом, концентрация
его в водном слое будет постоянной и,
следовательно, постоянной будет скорость
процесса
).
Реакции первого порядка
Вспомним уравнение
(уравнение для
одномолекулярных реакций), разделим
переменные и получим,
интегрируя его, получаем:
.
Обозначая через С0начальную
концентрацию приτ=0,
определяем постоянную интегрирования.
Отсюда
или
,
где
–
концентрация вещества к моменту времениτ.
Для кинетики реакций первого порядка
характерно, что в левой части уравнения
содержится только отношение концентраций.Изменение обеих концентраций в одинаковое
число раз не меняет промежутка времениτ. Следовательно, если в
одном опыте концентрация черезnминут станет вдвое меньше начальной,
то и в других опытах (при других начальных
концентрациях) в данной реакции она заnминут уменьшится тоже
в два раза. Это означает, что за одинаковые
промежутки времени прореагирует
одинаковая доля взятого количества
исходного вещества. Например, если за
первые 10 минут в реакцию вступило 5 % от
взятого количества вещества, то за
следующие 10 минут прореагируют 5 % от
оставшихся 95 % исходного вещества.
Для характеристики скорости реакций
первого порядка наряду с константой
скорости часто пользуются величиной,
называемой периодом полураспада
τ1/2, равным промежутку
времени, в течение которого реагирует
половина взятого количества вещества.
Из уравненияили
,
принимая, что,
следует, что,
следовательно,или для константы равновесия имеем

Если решить данное уравнение для периода
полураспада, то имеем,
из данного уравнения следует, что период
полураспада в реакциях первого порядка
не зависит от начальной концентрации
реагирующего вещества и определяется
только константой скорости реакцииk.
Принимая во внимание, что,
получаем, что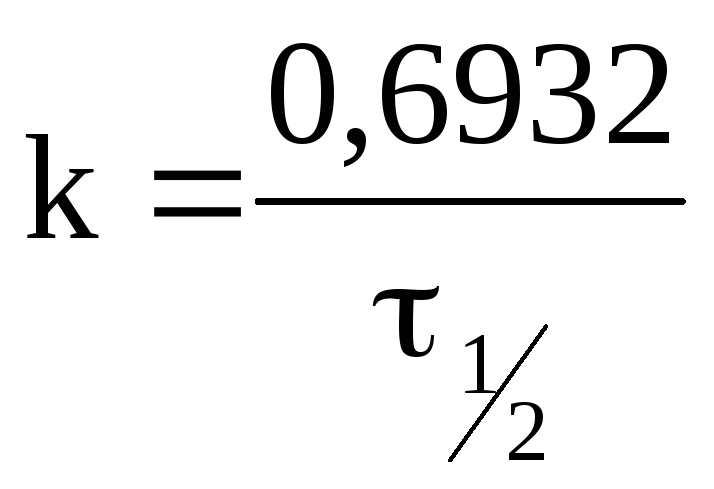
Это соотношение показывает, чтоконстанта
скорости реакции первого порядка обратно
пропорциональна периоду полураспада.
Зависимость константы скорости только
от отношения концентраций позволяет
заменять их при расчете другими
пропорциональными величинами. Часто
вместо концентраций используют отношение
количеств вещества, а в газовых реакциях
– отношение давлений.
Реакции второго порядка
Рассмотрим реакцию, протекающую по
уравнению:
.
Скорость реакции можно выразить по
основному закону кинетики через
концентрации САи СВ.
.
В данном уравнении три переменные. Для
исключения одной из них выразим САи СВчерез количество прореагировавших
веществ за время τ:
При
;
При
;
,
где х – количество молей А и В,
прореагировавших к моменту времени τ.
В этом случае основной постулат кинетики:
.
После интегрирования в пределах от
до τ , от
до х, получим:

Решив данное
уравнение относительно k,
найдем:

Из данного уравнения следует, что
размерность kв уравнении
скорости второго порядка
[время-1×концентрация-1].
Следовательно, числовые значения
константы скорости в реакциях второго
порядка будут зависеть от того, в каких
единицах выражаются время и концентрация
реагирующих веществ.
Из данного уравнения всегда можно
определить количество прореагировавшего
х:

Если начальные концентрации
,
уравнениепринимает вид:
или
,
или
.
При
записи в общем виде индексы у концентраций
реагентов можно опуститьили
.
Интегрируя в пределах от
до τ, получим:
.
В этом случае константу скорости можно
определить:
.
Данное выражение можно представить в
виде:
или
.
Отложив на оси ординат
,
а на оси абсцисс время τ, получим прямую,
тангенс угла которой равенk.
Период
полураспада реакции второго порядкаопределяется по формуле:
.
В отличие
от реакции первого порядка время
половинного превращения для реакции
второго порядка обратно пропорционально
С0.
Реакции
n-го порядка
Как мы уже знаем, сложные реакции типа
могут протекать поn-му
порядку, при этомnможет
быть целым или дробным числом. Скорость
реакцииn-го порядкапри
равных начальных концентрацияхреагирующих веществ выражается
уравнением:
Разделив
переменные, получаем:
.
Интегрируя
данное выражение в пределах от
до τ, и от С0до Сτ, получаем

Данное уравнение можно представить
относительно Сτ, что позволяет
рассчитать концентрацию реагента в
любой момент времени, если известныkиn:
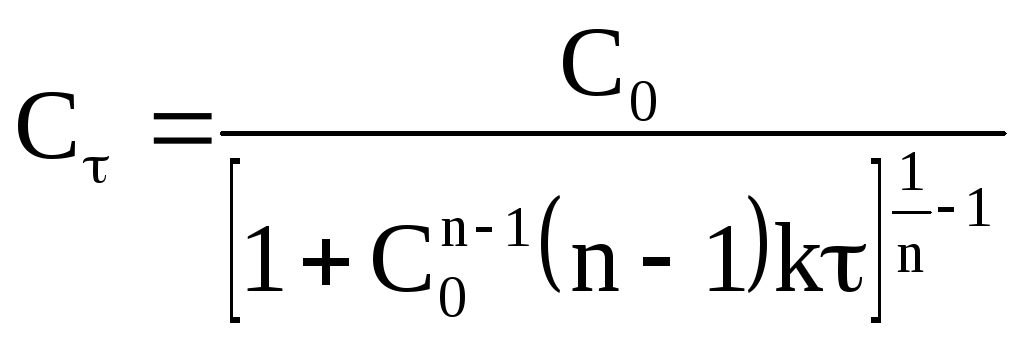
Уравнение для времени половинного
превращения можно получить, как и ранее,
приняв, что
:
.
Представленные уравнения можно
использовать для реакций n-го
порядка (кроме первого!).
|
n |
Кинетическое |
Вид зависимости |
Уравнения |
|
|
k |
|
|||
|
0 |
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
|
3 |
|
|
|
|
определение порядка реакции
Для определения порядка реакции
используются различные методы.
Метод подстановки (аналитический):
заключается в подстановке
экспериментальных данных в уравнения
кинетики реакции нулевого, первого,
второго и третьего порядков и определении,
которое из этих уравнений приводит к
постоянному значению константы скорости
реакции (можно считать, что уравнение
описывает процесс, если рассчитанные
по нему значения констант колеблются
около какой-то средней величины и
отклонения от среднего лежат в пределах
возможных погрешностей определения).
Если ни одно из уравнений не дает такого
результата, то реакция является сложной.
Графический метод: заключается
в построении графика, выражающего
зависимость различных функций концентрации
от времени, и определении, для которой
из них зависимость выражается прямой
линией. Так для реакции первого порядка
прямая получается в системе координат;
для реакции второго порядка;
для реакции третьего порядка.
По тангенсу угла наклона прямой можно
определить константу скорости реакции.
Для реакции нулевого порядка зависимость
концентрации от времени дает прямые,
параллельные оси абсцисс.
Метод определения периода полураспада:
основан на определении промежутка
времени, в течение которого концентрации
(или количества) исходных веществ
уменьшаются ровно в два раза. Проводя
реакцию при двух различных начальных
концентрацияхи

полураспадаи

Вспомним
уравнение для периода полураспада
реакции n-го порядка:
.
Получим


разделив одно уравнение на другое,
получим:
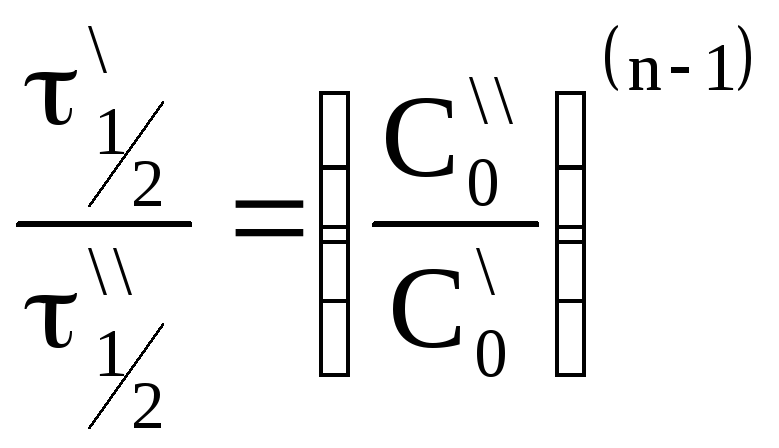
Откуда
Например,
и

периоды полураспада

Определить порядок реакции (n=1,96≈2).
Метод изоляции или метод избытка:
реагентов заключается в том, что
проводят серии опытов, в каждом из
которых изучается влияние изменения
концентрации только одного из исходных
веществ на скорость реакции. это
достигается применением всех остальных
исходных веществ в данной серии опытов
в таком избытке, что расход их в ходе
реакции существенно не меняет их
количества (концентрации), которые
поэтому можно считать постоянными.
Охватывая, таким образом, все исходные
вещества, можно установить влияние
изменения концентрации каждого из них
на скорость реакции и отсюда определить
порядок реакции и уравнение кинетики.
Рассмотреть
самостоятельно – дифференциальный
метод (разновидность графического
метода?)!
сложные реакции
Кинетика сложных реакций, состоящих из
двух или большего числа простых реакций,
в той или иной форме связанных между
собой, зависит от формы связи между
этими реакциями и от соотношения их
скоростей. Типичными по форме такой
связи являются реакции:
– параллельные;
– последовательные;
– сопряженные;
– обратимые.
Параллельные: две реакции
называются параллельными, если в обеих
в качестве исходного вещества выступает
одно и то же вещество, т.е. это реакции
вида:
Обозначим, через
начальную концентрацию вещества А,
через х – изменение его концентрации
к моменту времени τ, черези
концентрации образовавшихся веществ
и черези
константы скоростей соответствующих
реакций. Тогда для скорости образования
продуктов реакции имеем:
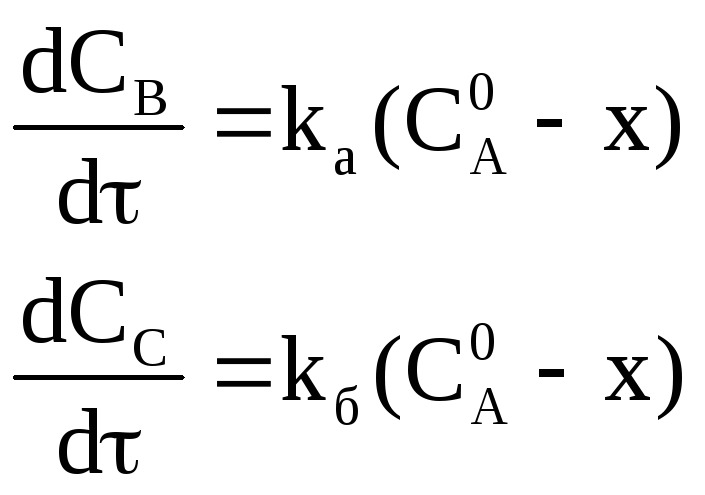
Сумма этих
скоростей определяет скорость расходования
исходных веществ:
.
С другой
стороны, отношение этих двух уравнений
(*) дает:
.
Таким образом, если в данных условиях
термодинамически возможны два или три
направления химический реакции, то
преобладание того или другого из них и
относительные количества получаемых
продуктов реакции определяются всецело
соотношением скоростей этих реакций,
а не соотношением термодинамической
устойчивости конечных продуктов.
Если реакции значительно различаются
по скорости, то обычно реакцию, обладающую
большей скоростью, называют главной
(основной), а остальные – побочными. При
не слишком большом различии в скоростях
главной реакцией называют реакцию,
приводящую к получению основного нужного
продукта, хотя бы она и обладала меньшей
скоростью.
Последовательные (или консекутивные):
две реакции называются последовательными,
если вещество, образующееся в одной
стадии, является исходным для другой,
т.е. это реакции вида:
,
где В
промежуточный продукт в процессе
получения вещества С; k1
иk2– константы
скоростей двух стадий превращения.
Данная схема представляет собой
простейшую последовательную реакцию,
которая происходит в две ступени, и
каждая из этих ступеней является простой
мономолекулярной реакцией. В общем же
случае ступеней может быть больше, а
стадии могут не быть мономолекулярными.
Расчет кинетики последовательных
реакций очень сложен. Отметим только,
что если одна из ступенейобладает
значительно меньшей скоростью, чем
остальные, то общая скорость реакции
определяется скоростью именно этой
реакции!!!
Зависимость концентрации веществ,
участников реакции, от времени можно
рассмотреть на примере простейшей
последовательной реакции:
Из данных графических зависимостей
следует, что в начале процесса, когда
концентрация вещества А еще сравнительно
высока, скорость первой реакции
значительна и увеличение концентрации
В происходит быстро. По мере израсходования
вещества А уменьшается и скорость
образования вещества В. Это приводит к
тому, что расход вещества В на образование
вещества С, начиная с какого-то момента
времени, уже не компенсируется в полном
степени образованием его из вещества
А и концентрация вещества В в системе
начинает уменьшаться. Вследствие этого
кривая Св проходит через максимум.
Положение таких кривых для различных
последовательных реакций неодинаково,
т.к. оно зависит от соотношения в скоростях
этих реакций, но общий характер зависимости
остается обычно таким, как он рассмотрен
нами.
Кривые на рисунке описываются уравнениями:
,
,
.
(реакции первого
порядка)
Было доказано,
что максимальная концентрация
промежуточного продукта В, достигаемая
в ходе реакции, не зависит от абсолютных
значений констант скоростейk1
иk2, а зависит
только от их отношения,
т.е. чем больше значение α, тем больше
должна быть концентрация Св, макс.
При k1
>k2скорость
образования промежуточного продукта
будет значительно выше скорости его
расходования. Таким образом, если
промежуточный продукт является целевым
и необходимо увеличить его выход, то
это может быть достигнуто увеличениемk1, что можно достигнуть
введением в реакционную систему
селективного катализатора, который
увеличил бы скорость первой стадии при
неизменной скорости второй. Если
зависимость скоростей стадий от
температуры различна, то тот же эффект
может быть достигнут изменением
температуры.
При k1
<k2в этом случае
скорость превращения промежуточного
веществаВвСбудет значительно
выше скорости его возникновения изА,
а его концентрация будет весьма низкой.
С
А+В→М
А+С→N
опряженные:называются реакции
вида:
из которых
одна, например, А+В→М, протекает лишь
совместно с другой, т.е. индуцируется
последней. В таких случаях вещество Сслужит индуктором первой реакции(например, окисление
сульфата железа и йодистого водорода
перекисью водорода. Сульфат железа
окисляется независимо от присутствия
йодистого водорода, последний же в
чистом виде перекисью водорода не
окисляется, но при одновременном
окислении сульфата железа окисляется
совместно с ним). Это явление
называетсяхимической индукцией.
В этом случае вещество А, общее для обеих
реакций называетсяактором, вещество
В –акцептор, а вещество С –индуктор.
Обратимые:скорость обратимой
реакции равна разности между скоростями
прямой и обратной реакций. Если
обратиться к общему случаю реакции
вида:
то скорость
изменения (убывания) концентрации
вещества А при протекании прямой реакции
определяется уравнением:
а скорость
изменения (возрастания) ее при протекании
обратной реакции – уравнением
Если в начальном состоянии системы в
ней содержались только вещества А, В,
с, то скорость прямой реакции уменьшается
по мере течения ее в соответствии с
уменьшением этих концентраций. Таким
образом, зависимость этой скорости от
времени представляется кривой 1, если
бы не было обратной реакции, эта кривая
достигла бы оси абсцисс при израсходовании
одного их исходных компонентов. Кривая
2, относящаяся к скорости обратной
реакции, начинается в начале координат
(т.к. в начальный момент времени
концентрации продуктов реакции равны
нулю) и повышается по мере течения прямой
реакции и вызываемого ею увеличения
этих концентраций.
Общая скорость реакции в любой момент
времени равна разности скоростей прямой
и обратной реакций:
.
Очевидно, что при дальнейшем течении
реакции указанные две кривые – скоростей
прямой и обратной реакций – должны
где-то пересечься, т.е. должно быть
достигнуто такое состояние, при котором
скорости прямой и обратной реакций
станут равными между собой. После
достижения этого состояния – состояния
равновесия, концентрации каждого из
компонентов реакции будут постоянными.
Так как скорости прямой и обратной
реакций при этом будут равны по абсолютному
значению, следовательно, должны быть
равны между собой и:
.
Откуда
.
Правая часть
этого равенства представляет собой
константу равновесия Кс данной реакции
и, следовательно,
,
т.е. константа
равновесия равна отношению констант
скоростей прямой и обратной реакций.
Этот вывод четко показывает динамический
характер равновесия в химических
реакциях.
влияние температуры на скорость
ХИМИЧЕСКОЙ реакции.
энергия активации
При повышении температуры скорость
химической реакции увеличивается; это
увеличение весьма значительно. Зависимость
скорости протекания реакции от температуры
схематично представлена на рисунке.
П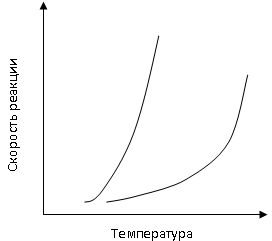
повышении температуры и постоянных
концентрациях реагентов скорость
химической реакции увеличивается из-за
возрастания константы скорости.
Опытные данные показывают, что если
рассматривать зависимость логарифма
константы скорости от обратного значения
абсолютной температуры, то экспериментальные
точки, относящиеся к одной реакции,
располагаются обычно практически на
одной прямой, т.е. логарифм константы
скорости реакции находится в линейной
зависимости от обратного значения
абсолютной температуры (1/Т). Искомая
зависимость выражается уравнением
Аррениуса:
,
где А и В
индивидуальные константы, характерные
для данной реакции.
Аррениусом было предложено объяснение
физического смысла постоянной А в данном
уравнении.
В
уравнение изохоры Вант-Гоффа в
дифференциальной форме:
,
которое
выражает температурный коэффициент
константы равновесия через тепловой
эффект химической реакции. Подставляя
в это уравнение вместо Кс отношение
констант скоростей прямой и обратной
реакций
,
можно получить:
.
Вант-Гофф
высказал предположение о возможности
рассматривать тепловой эффект реакции,
как разность двух энергетических величин
и
,
относящихся к прямой и обратной реакциям,
отсюда.
С учетом данного равенства, уравнениеможно разложить на два уравнения вида:
и
.
Интегрируя
данные уравнения при постоянстве
,
получаем:
и
,
где
и
–
постоянные интегрирования.
Величины
и
называютсяэнергиями активации.
Они связаны с постоянной А уравненияпростым соотношением
.
Согласно представленным уравнениям,константа скорости реакции, а,
следовательно, и скорость химической
реакции сильнее изменяются с температурой
в тех реакциях, в которых энергия
активации больше. И наоборот, если в
данной реакции энергия активации
незначительна, то скорость этой реакции
слабо изменяется с температурой.
Кроме того, чем больше энергия активации
данной реакции, тем при более высоких
температурах она совершается.
Рассмотрим физический смысл энергии
активации.
В реакциях, протекающих с конечной
скоростью, число столкновений между
молекулами, приводящих к химическому
взаимодействию (число эффективных
столкновений), составляет лишь некоторую
часть от общего числа столкновений.
Эффективными считаются лишь столкновения
между молекулами, которые в момент
столкновения обладают некоторым избытком
внутренней энергии по сравнению со
средней для данной температуры величиной.
Именно этот избыток энергии, необходимый
молекулам для данной реакции в данных
условиях, и представляется энергией
активации
и
.Энергия активации – это то избыточное
количество энергии (по сравнению со
средней величиной), которой должна
обладать молекула в момент столкновения,
чтобы быть способной к данному химическому
взаимодействию. Рассмотрим на примере
рисунка. На рисунке по вертикальной оси
отложена энергия активации рассматриваемой
системы молекул, а по горизонтальной –
ход реакции. Допустим прямая реакция
(переход из состояния 1 в состояние 2)
является экзотермической, то общий
запас продуктов реакции меньше, чем
исходных веществ, т.е. система в результате
этой реакции переходит на более низкий
энергетический уровень(это
также показывает, что повышение
температуры всегда сильнее увеличивает
скорость эндотермического направления
реакции, т.к. энергия активации больше.
А также, повышение температуры всегда
смещает равновесия в направлении
эндотермического процесса и тем в
большей степени, чем выше тепловой
эффект, т.е. чем больше разница в энергиях
активации прямой и обратной реакций).
Разность в энергиях этих у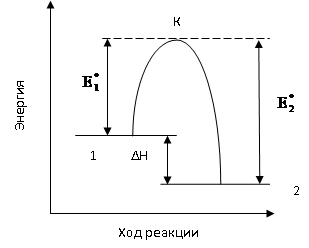
равна тепловому эффекту реакции ΔН.
Уровень К определяет наименьший запас
энергии, которым должны обладать
молекулы. Чтобы их столкновение было
эффективным. Разность между этим уровнем
К и уровнем 1 представляет собой энергию
активации прямой реакции,
а разность между уровнями К и 2 – энергию
активации обратной реакции.
Таким образом, по пути из исходного
состояния в конечное система должна
преодолеть так называемыйэнергетический
барьер. Только молекулы, обладающие
в момент столкновения необходимым
избытком энергии, так называемые активные
молекулы, могут вступать в химическое
взаимодействие. Катализаторы, ускоряющие
реакцию, обычно, тем или иным путем,
снижают ее энергию активации и этим
увеличивают относительное число активных
молекул. Повышение температуры увеличивает
среднюю кинетическую энергию, что
повышает и относительное число молекул,
обладающих энергией, превосходящей
энергию уровня К. Избыточная энергия
может быть в молекуле в различных формах,
это может быть: 1) повышенная кинетическая
энергия поступательного или вращательного
движения, 2) повышенная энергия взаимного
колебания атомов или атомных групп,
составляющих молекулу, 3) повышенная
энергия движения тех или других
электронов. Для различных реакций не
все формы этой энергии равноценны.
расчеты констант скоростей и энергии
активации
Для выражения зависимости константы
скорости реакции от температуры и
определения энергии активации, а также
для расчета константы скорости при
различных температурах используют
уравнение
.
Две постоянные в данном уравнении могут
быть определены, если известны значения
констант скорости данной реакцииk1
иk2при двух
температурах Т1и Т2. Имеем
систему из двух уравнений:
с двумя
неизвестными А и В. Вычитая первое
уравнение из второго, получим:
.
Это дает
возможность непосредственно определить
А (а, следовательно, энергию активации,
т.к.
).
Подставляя полученное значение А в одно
из уравнений, рассчитывают постоянную
В. Полученное уравнение с численными
значениями постоянных А и В можно
использовать для расчета константы
скорости при промежуточных температурах.
Существует также графический способ
определения энергии активации!
Обозначим
через
константу скорости при температуреt0С
и черезконстанту скорости той же реакции при
температуре (t+10)0С.
Отношениеназывается температурным коэффициентом
скорости. Было предложено приближенное
правило, согласно которомуповышение
температуры на 100С
увеличивает скорости реакций примерно
в 2-4 раза (правило Вант-Гоффа), т.о.можно принять равным примерно 2-4.
Данное правило
определяет только порядок изменения
скорости, присущий значительной части
различных химических реакций при обычных
температурах. Однако для ориентировочной
оценки возможного влияния температуры
оно нередко бывает полезным, в особенности
при отсутствии данных для более точного
расчета.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 ноября 2019 года; проверки требует 1 правка.
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ. Закон действующих масс открыли в 1864—1867 годах норвежские ученые К.Гульдберг (1836—1902) и П.Вааге (1833—1900).
Закон действующих масс справедлив только для газов и жидких веществ (гомогенных систем) и не выполняется для реакций с участием твёрдых веществ (гетерогенных систем).
Закон действующих масс в химической кинетике[править | править код]
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции, для элементарной реакции[1]. Это положение сформулировано в 1864—1867 годах норвежскими учёными К. Гульдбергом и П. Вааге. Для элементарной химической реакции:
закон действующих масс может быть записан в виде кинетического уравнения вида:
где 

Для сложных реакций в общем виде это соотношение не выполняется. Тем не менее, многие сложные реакции условно можно рассматривать как ряд последовательных элементарных стадий с неустойчивыми промежуточными продуктами, формально эквивалентный переходу из начального состояния в конечное в «один шаг». Такие реакции называют формально простыми[2]. Для формально простых реакций кинетическое уравнение может быть получено в виде:
(для трех исходных веществ, аналогично приведённому выше уравнению). Здесь 










Закон действующих масс в химической термодинамике[править | править код]
В химической термодинамике закон действующих масс связывает между собой равновесные активности исходных веществ и продуктов реакции, согласно соотношению:
где
— активность веществ. Вместо активности могут быть использованы концентрация (для реакции в идеальном растворе), парциальные давления (реакция в смеси идеальных газов), фугитивность (реакция в смеси реальных газов);
— стехиометрический коэффициент (для исходных веществ принимается отрицательным, для продуктов — положительным);
— константа химического равновесия. Индекс «a» здесь означает использование величины активности в формуле.
На практике в расчётах, не требующих особой точности, значения активности обычно заменяются на соответствующие значения концентраций (для реакций в растворах) либо парциальных давлений (для реакций между газами). Константу равновесия при этом обозначают 

Впервые закон действующих масс был выведен из кинетических представлений Гульдбергом и Вааге, а термодинамический вывод его дан Вант-Гоффом в 1885 году[3].
Пример: для стандартной реакции
константа химического равновесия определяется по формуле
Примечания[править | править код]
- ↑ Краснов К. С., Воробьев Н. К., Годнев И. Н. и др. Физическая химия. В 2 кн. Кн. 2. Электрохимия. Химическая кинетика и катализ: Учеб. для вузов. — 2-е изд., перераб. и доп. — М. : Высш. шк., 1995. — 319 с. — ISBN 5-06-002914-X
- ↑ Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим.-технол. спец. вузов/Под ред. А. Г. Стромберга. — 2-е изд., перераб. и доп. — М. : Высш. шк., 1988. — 496 с.
- ↑ Краснов К. С., Воробьев Н. К., Годнев И. Н. и др. Физическая химия. В 2 кн. Кн. 1. Строение вещества. Термодинамика: Учеб. для вузов. — 2-е изд., перераб. и доп. — М. : Высш. шк., 1995. — 512 с. — ISBN 5-06-002913-1
Закон действующих (действия) масс
Необходимым условием для осуществления химического акта является соударение молекул реагирующих веществ. Соударения молекул происходят тем чаще, чем больше их количество в единице объема, т.е. чем больше их концентрация.
Зависимость скорости реакции от концентрации выражается основным законом химической кинетики — законом действующих масс, сформулированным в 1867 г. норвежскими учеными Гульдбер- гом и Вааге: при постоянной температуре скорость протекающих в одну стадию элементарных реакций прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, показателями которых являются стехиометрические коэффициенты в уравнении реакции.
В общем виде для реакции:
закон действующих масс выражается соотношением:
где C(A),C(B) — концентрации веществ А и В; т, п — стехиометрические коэффициенты; к — коэффициент пропорциональности, называемый константой скорости реакции.
Так, для реакции
При С(А) = С(В) = 1 моль/л из уравнения (4.33) следует: v = к, т.е. константа скорости равна скорости при единичных концентрациях реагирующих веществ. Таким образом, константа скорости зависит только от температуры, природы реагирующих веществ и катализатора, но не зависит от концентрации.
Необходимым условием для осуществления химического акта является соударение реагирующих частиц в одной точке. Вероятность соударения трех частиц в одной точке невелика, а более трех — пренебрежительно мала. Поэтому большинство реакций с суммой стехиометрических коэффициентов исходных веществ т + п = 3 и все реакции, в которых т + п > 3, являются неэлементарными, т.е. протекают по стадиям, а уравнение (4.32) отражает лишь конечный результат. Поэтому в более общем виде для любой реакции закон действующих масс выражается соотношением
Сумма т’ + п’ называется порядком реакции, а величины т’ и п’ называются порядками реакции, соответственно, по веществам А и В. Для элементарных реакций т’ = т и п — п, а для неэлементарных
т’фти п’ф п. Порядки реакции определяют экспериментально и по результатам судят о механизме их протекания.
Например, разложение оксида азота (V) выражается уравнением:
Если бы реакция была элементарной, ей соответствовал бы второй порядок: v = kC(N^0^y Однако экспериментально установлено,
что эта реакция – реакция первого порядка, потому что она описывается кинетическим уравнением: v = A:C(N2os). Это объясняется
тем, что истинный механизм данной реакции включает две последовательные стадии:
Причем первая стадия является наиболее медленной, а общая скорость реакции определяется наиболее медленной стадией. Она определяет и порядок реакции.
Реакции гидролиза, как правило, протекают по первому порядку, поскольку концентрация воды несравненно больше концентрации гидролизующегося вещества и в процессе гидролиза остается практически неизменной. Например, для гидролиза этилацетата в водном растворе в присутствии сильных кислот:
Реакции с порядком выше трех неизвестны. В реакциях со сложным механизмом протекания возможен и дробный порядок.
Порядок реакции характеризует особенности убывания концентрации исходных веществ во времени.
Для гомогенных реакций первого порядка, например разложения типа А -» В + D, выражение скорости реакции имеет вид:
После преобразований получим: где С0 — исходная концентрация исходного вещества А; С — оставшаяся его концентрация в момент времени т, моль/л; т — время от начала процесса, с.
Следовательно, в реакциях первого порядка концентрация убывает во времени логарифмически. Полученное выражение позволяет найти концентрацию С в любой момент времени, время достижения заданного значения С и т.п. Следует отметить, что соотношение С0 /С не зависит от вида используемой концентрации и может задаваться любым способом, например, в %. Так, если прореагировало 25% исходного вещества, то это соотношение принимает значение
Поскольку полное разложение вещества закончится по истечении бесконечного количества времени, часто используют понятие «период полураспада» — время, через которое распадется половина исходного вещества:
Реакция распада радионуклидов протекает по первому порядку Радионуклиды стронция jgSrn цезия ‘^Cs – самые экологически опасные продукты деления ядерного горючего, например урана 2 ^2 U , имеющие период полураспада примерно 30 лет. После Чернобыльской катастрофы (1986 г.) они распадутся наполовину в 2016 г., но это совсем не значит, что в 2046 г. они распадутся полностью: распадется еще половина, т.е. останется 25% от их исходного количества и т.д. Через какое же время останется лишь 1%, который можно считать относительно безопасным?
Из уравнения (4.38):
Для реакции второго порядка типа 2А —» . или А + В ^ . (при равных исходных концентрациях А и В) выражение скорости имеет вид:
После преобразований получим:
Такая зависимость линейна в координатах ^ – т.
Элементарные реакции и отдельные стадии сложных реакций характеризуют молекулярностъю – количеством молекул, одновременное взаимодействие которых друг с другом приводит к акту химического превращения. Реакции подразделяют на моно-, ди- и тримо- лекулярные. Молекулярность и порядок совпадают, как правило, только для элементарных реакций. Первая стадия реакции (4.35) мо- номолекулярна, а вторая — бимолекулярна. Реакция гидролиза этил- ацетата (4.36) бимолекулярна. Тримолекулярных реакций немного, например: 2NO (г) + С12 (г) = 2NOC1 (г). Реакции с молекулярностью больше трех неизвестны.
Скорость химической реакции
Говорить об осуществимости процесса можно по изменению энергии Гибсса системы. Но данная величина не отражает настоящую возможность протекания, механизм и скорость химической реакции.
Понятие скорости химической реакции
Для полноценного представления химической реакции, надо иметь знания о том, какие существуют временные закономерности при ее осуществлении, т.е. скорость химической реакции и ее детальный механизм.
Определение скорости химической реакции:
Скорость химической реакции — это изменение концентрации реагирующих веществ в единицу времени
Скорость и механизм реакции изучает химическая кинетика – наука о химическом процессе.
С точки зрения химической кинетики, реакции можно классифицировать на простые и сложные.
Простые реакции – процессы, протекающие без образования промежуточных соединений. По количеству частиц, принимающих в ней участие, они делятся на мономолекулярные, бимолекулярные, тримолекулярные. Соударение большего чем 3 числа частиц маловероятно, поэтому тримолекулярные реакции достаточно редки, а четырехмолекулярные — неизвестны.
Сложные реакции – процессы, состоящие из нескольких элементарных реакций.
Любой процесс протекает с присущей ему скоростью, которую можно определить по изменениям, происходящим за некий отрезок времени.
Среднюю скорость химической реакции выражают изменением количества вещества n израсходованного или полученного вещества в единице объема V за единицу времени t.
Если вещество расходуется, то ставим знак «-», если накапливается – «+»
При постоянном объеме:
Единица измерения скорости реакции — моль/л·с
В целом, υ — величина постоянная и не зависит от того, за каким участвующим в реакции веществом, мы следим.
Зависимость концентрации реагента или продукта от времени протекания реакции представляют в виде кинетической кривой, которая имеет вид:
Вычислять υ из экспериментальных данных удобнее, если указанные выше выражения преобразовать в следующее выражение:
Закон действующих масс. Порядок и константа скорости реакции
Одна из формулировок закона действующих масс звучит следующим образом:
Скорость элементарной гомогенной химической реакции прямо пропорциональна произведению концентраций реагентов.
Т.е. скорость прямой химической реакции зависит от концентраций исходных веществ.
Если исследуемый процесс представить в виде:
а А + b В = продукты
то скорость химической реакции можно выразить кинетическим уравнением:
а и b – стехиометрические коэффициенты простой реакции,
k – константа скорости реакции.
Химический смысл величины константы скорости реакции k — это скорость реакции при единичных концентрациях.
То есть, если концентрации веществ А и В равны 1, то υ = k.
Надо учитывать, что в сложных химических процессах коэффициенты а и b не совпадают со стехиометрическими.
Закон действующих масс выполняется при соблюдении ряда условий:
- Реакция активируется термично, т.е. энергией теплового движения молекул.
- Концентрация реагентов распределена равномерно.
- Свойства и условия среды в ходе процесса не меняются.
- Свойства среды не должны влиять на k.
К сложным процессам закон действия масс применить нельзя!
Это можно объяснить тем, что сложный процесс состоит из нескольких элементарных стадий, и его скорость будет определяться не суммарной скоростью всех стадий, лишь одной самой медленной стадией, которая называется лимитирующей.
Каждая реакция имеет свой порядок. Определяют частный (парциальный) порядок по реагенту и общий (полный) порядок.
Например, в выражении скорости химической реакции для процесса
а А + b В = продукты
a – порядок по реагенту А
Для простых процессов порядок реакции указывает на количество реагирующих частиц (совпадает со стехиометрическими коэффициентами) и принимает целочисленные значения.
Для сложных процессов порядок реакции не совпадает со стехиометрическими коэффициентами и может быть любым.
Факторы, влияющие на скорость химической реакции
Определим факторы, влияющие на скорость химической реакции υ:
1. Зависимость скорости реакции от концентрации реагирующих веществ
определяется законом действующих масс:
Очевидно, что с увеличением концентраций реагирующих веществ, скорость реакции υ увеличивается, т.к. увеличивается число соударений между участвующими в химическом процессе веществами.
Причем, важно учитывать порядок реакции:
если это n = 1 по некоторому реагенту, то ее скорость прямо пропорциональна концентрации этого вещества.
Если по какому-либо реагенту n = 2, то удвоение его концентрации приведет к росту скорости реакции в 2 2 = 4 раза.
А увеличение концентрации в 3 раза ускорит реакцию в 3 2 = 9 раз.
2. Зависимость скорости реакции от давления
Справедлива для веществ в газообразном состоянии и определяется уравнением Клапейрона – Менделеева , которое связывает концентрацию и давление:
Таким образом, изменение концентрации в системе, а следовательно и скорости реакции имеет прямую зависимость от изменения давления.
Например, для реакции первого порядка, увеличение давления в 2 раза вызовет рост концентрации вещества в 2 раза, что непременно изменит скорость реакции υ – она станет в 2 раза больше.
3. Зависимость скорости реакции от площади поверхности
Для гетерогенных реакций скорость реакции зависит от площади соприкосновения частиц:
где S — площадь соприкосновения частиц, мм 2 ,
Δn — изменение количества веществ, принимающих участие в реакции (исходных веществ или продуктов реакции), моль;
Δt — промежуток времени, с;
Единица измерения скорости гетерогенной реакции, моль/м 2 ⋅с.
Таким образом, вещества реагируют быстрее, если площадь поверхности, на которой может происходить взаимодействие веществ больше.
Растворяя вещество, мы уменьшаем его размеры до размеров молекулы, увеличивая тем самым площадь поверхности.
Поэтому химические процессы между веществами, находящимися в растворенном, жидком или газообразном состоянии имеют большую скорость, чем взаимодействия между твердыми веществами.
4. Зависимость скорости реакции от природы вещества .
В этом случае, большое значение имеет строение электронной оболочки атома, тип химической связи и ее прочность в молекулах, структура вещества, прочность его кристаллической решетки.
Например, натрий будет активнее взаимодействовать с водой, чем олово. Поэтому и скорость взаимодействия натрия с водой выше скорости взаимодействия олова с водой.
5. Зависимость скорости реакции от температуры
определяется правилом Вант-Гоффа и уравнением Аррениуса
Повышая температуру, мы сообщаем молекулам дополнительную энергию (увеличивая, тем самым, энергию активации), которая способствует протеканию реакции.
Поэтому, при повышении температуры скорость химической реакции увеличивается.
Сванте Аррениус в 1889 году, изучая зависимость скорости реакции υ от температуры, установил, что большинство химических процессов подчиняются уравнению:
где k — константа скорости реакции
Еа -энергия активации – минимальная (критическая) энергия, необходимая для осуществления реакции, единица измерения Дж/моль
Т — абсолютная температура
R – газовая постоянная, R = 8,314 Дж/моль·град
A — предэкспоненциальный множитель (частотный фактор), единица измерения совпадает с k. Эта константа выражает вероятность того, что при столкновении молекулы будут ориентированы так, чтобы взаимодействие было возможно.
Если известна константа скорости k при одной температуре Т1, а требуется найти константу скорости k при некой другой температуре Т2, то это легко сделать, если взять логарифм уравнения Аррениуса при Т1 и Т2:
Вычитая второе равенство из первого, получаем:
Уравнение Аррениуса при определении скорости химической реакции (в случае, если υ описывается степенным уравнением) , принимает вид:
Если принять, что концентрации веществ А и В постоянны и прологарифмировать данное выражение, то получим следующее выражение:
Правило Вант-Гоффа
Также удобно пользоваться эмпирическим правилом, которое сформулировал Якоб Вант-Гофф:
увеличение температуры на каждые 10 градусов, приводит к росту скорости реакции в 2 – 4 раза.
Правило Вант-Гоффа имеет математическое выражение:
γ — температурный коэффициент реакции, значения которого лежат в интервале от 2 до 4.
Приведем пример применения правила Вант-Гоффа.
υT1/υT2 = 3 2 = 9. Это означает, что υ возросла в 9 раз.
6. Зависимость скорости реакции от присутствия катализатора
Катализ – это любое изменение скорости реакции под действием катализатора. Он может быть положительным и отрицательным. Суть катализа – генерирование активного субстрата или реагента с участием катализаторов.
Катализатор представляет собой вещество, которое селективно ускоряет химическую реакцию, вступая при этом в промежуточную стадию, но регенирируясь к ее концу (к моменту образования конечных продуктов). Например, в биохимической среде в качестве катализаторов выступают ферменты.
Если такое вещество замедляет химическую реакцию, то оно называется ингибитором.
Влияние катализатора на скорость реакции основывается на том, что он изменяет энергию активации Еа. Понижение энергии активации под действием катализатора схематично представлено на рисунке ниже:
Видно, что веществам А и В требуется большое количество энергии, чтобы образовать конечные продукты. Но в присутствии катализатора для получения конечных продуктов требуется гораздо меньше энергии, т.к. идет понижение полной энергии активации, и тем самым, увеличение скорости реакции.
Обращаю ваше внимание на то, что энергии как начальных, так и конечных веществ остаются одинаковыми в обеих реакциях.
Химическая кинетика. Скорость химических реакций
Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
Факторы, влияющие на скорость химической реакции
1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
[spoiler title=”источники:”]
http://zadachi-po-khimii.ru/obshaya-himiya/skorost-ximicheskoj-reakcii.html
http://chemege.ru/kinetika/
[/spoiler]
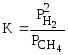
 аправлении
аправлении