В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
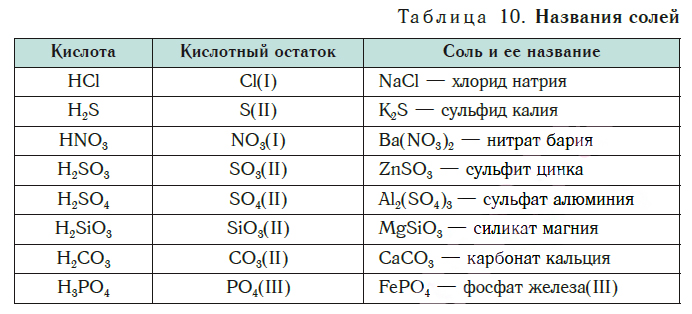
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» – краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
–
HCl соляная
кислота Cl хлорид
–
HF фтороводородная
кислота F фторид
–
HBr бромоводородная
кислота Br бромид
–
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
–
HNO3
азотная кислота NO3 нитрат
–
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
–
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Правила
составления формул основных солей по
названию.
Пример
1.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксохлорид
железа
(III)FeOHCl
Приставка
ГИДРОКСО означает, что соль основная,поэтому,
в составе – одна ОН группаНазвание
ХЛОРИД означает, что это соль солянойкислоты,
поэтому, в составе кислотного остатка
Cl
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( – 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксохлорид
железа
(III)+3
-1 -1FeOHCl
Валентность
железа равна III ( указано в названии
),поэтому,
заряд атома железа равен ( + 3 )Валентность
кислотного остатка Cl
равна
I , т.к. в НCl один атом водорода, поэтому,
заряд хлора равен ( – 1 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть – металл с ОН группой;
вторая часть – кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группа+3
-1(
FeOH )Заряд
первой части равен:+3
+ (-1) = +2+3
-1 -1FeOHCl
+2
-1Вторая
часть: кислотный остаток(
Cl )Заряд
второй части равен: -1
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа(
FeOH )Заряд
первой части равен:+3
+ (-1) = +2У
группы FeOH индекс1
не пишем+3
-1 -1FeOHCl2
+2
+ (-2) = 0Вторая
часть: кислотный остаток ( Cl )Для
равенства зарядов у кислотногоостатка
Cl пишем индекс: 2Заряд
второй части равен:-1
•
2 = – 2
¾
12 ¾
Пример
2.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
дигидроксохлорид
железа
(III)Fe(OH)2Cl
Приставка
ДИГИДРОКСО означает, что соль
основная,и
в её составе – две ОН группы“ДИ”
означает ДВЕ ( две ОН группы )Название
ХЛОРИД означает, что это соль солянойкислоты,
поэтому, в составе кислотного остатка
группа Cl
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( – 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
дигидроксохлорид
железа
(III)+3
-1 -1Fe(OH)2Cl
Валентность
железа равна III ( указано в названии
),поэтому,
заряд атома железа равен ( + 3 )Валентность
кислотного остатка Cl
равна
I , т.к. в НCl один атом водорода, поэтому,
заряд хлора равен ( – 1 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть – металл с ОН группой;
вторая часть – кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группы+3
-1(
Fe(OH)2
)Заряд
первой части равен:+3
+ ( -1 •
2
) = +1+3
-1 -1Fe(OH)2Cl
+1
-1Вторая
часть: кислотный остаток(
Cl )Заряд
второй части равен: -1
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа+3
-1(
Fe(OH)2
)Заряд
первой части равен:+3
+ ( -1 •
2
) = +1+3
-1 -1Fe(OH)2Cl
+1
+ ( -1 ) = 0Вторая
часть: кислотный остаток ( Cl )Заряд
второй части равен:-1
•
1 = – 1Заряды
частей равны, поэтому, индексы ставить
не надо, т.к. формула составлена.
¾
13 ¾
Пример
3.
1)
Прочитайте название вещества и напишите
составные части символами элементов:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксокарбонат
меди
(II)СuOHCO3
Приставка
ГИДРОКСО означает, что соль основная,поэтому,
в составе – одна ОН группаНазвание
КАРБОНАТ означает, что это соль
угольнойкислоты,
поэтому, в составе кислотного остатка
группа CО3
2)
Проставьте заряды частиц, входящих в
состав формулы. Заряд металла положителен
и равен численно валентности металла.
Заряд ОН группы равен ( – 1 ). Заряд
кислотного остатка отрицателен и чсленно
равен валентности кислотного остатка:
-
Название
вещества:
Выполненное
действие:
Пояснения:
гидроксокарбонат
меди
(II)+2
-1 -2СuOHCO3
Валентность
меди равна II ( указано в названии ),поэтому,
заряд атома меди равен ( + 2 )Валентность
кислотного остатка CО3
равна
II , т.к.в
Н2CО3
два атома водорода, поэтому, заряд
CО3равен
( – 2 )Заряд
ОН группы всегда равен ( -1 )
3)
Формула основной соли делится на две
части: первая часть – металл с ОН группой;
вторая часть – кислотный остаток.
Посчитайте суммы зарядов в составных
частях.
-
П
ервая
часть: металл и ОН группа+2
-1(
СuOH )Заряд
первой части равен:+2
+ (-1) = +1+2
-1 -2CuOHCO3
+1
-2Вторая
часть: кислотный остаток(
CO3
)Заряд
второй части равен: -2
4)
Используя принцип электронейтральности
молекулы вещества ( сумма зарядов
составных частей равна нулю ), проставьте
в формулу индексы.
-
П
ервая
часть: металл и ОН группа(
CuOH )Заряд
первой части равен:+2
+ (-1) = +1У
группы CuOH запишите индекс 2+2
-1 -2(СuOH)2CO3
+1
+ (-2) = -1Вторая
часть: кислотный остаток ( Cl )Заряд
второй части равен:-1
•
2 = – 2У
кислотного остатка CO3индекс
1 не пишем
¾
14 ¾
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как составить формулы солей по химии
Знаток
(299),
закрыт
15 лет назад
Настя Ушанова
Профи
(712)
15 лет назад
Берешь любую кислоту заменяешь водород на нужный металл и все. Главное надо учитывать степень окисления металла. Например: КF(окисление у фтора +1);BaFдва (окисление у бария +2)
Inno4k@
Гуру
(2870)
15 лет назад
Вообще всё зависит от химического уравнения…. К примеру можешь взять основание NaOH и кислоту H3PO4 и получишь соль Na3PO4 и ещё вода будет (Н2О). Химическая формула солей состоит из мееталла и кислотного остатка.
Mozes Pombl4Мастер (1299)
15 лет назад
Скорее будет образовываться Na2HPO4, т.к. третья константа кислотности азотной кислоты крайне мала, тогда как очень велика константа гидролиза фосфата натрия по первой ступени.
Mozes Pombl4
Мастер
(1299)
15 лет назад
Разбирая химическую формулу соли, мы неприменно должны обнаружить по меньшей мери две части. Это катион и анион. Катион – составляющая частица соли, ион, имеющий положительный заряд. Анион – отрицательный. В качестве катиона могут выступать ионы металлов, ион аммония (NH4+) и ион водорода (в кислых солях, например NaHCO3). Анионом могут быть известные нам кислотные остатки, ОН группа (в основных солях, например Са (ОН) Cl ), а также составные комплексные ионы (часто это применимо для амфотерных металлов, к примеру соль Na2[Zn(OH)4] ).
Для составления формул необходимо знать заряды соответствующих ионов (это плюсик или минусик, с цифрой или без, который рисуется сверху справа у значка иона) . Далее руководствуемся правилом, что молекула соли всегда заряжена нейтрально, тоесть домножаем зарады катиона и аниона на соответствующие коэффициенты, чтобы в сумме они давали нуль. К примеру, имеем ионы Са2+ и РО4 3-, т. е. нужно домножить Са2+ на 3, а РО4 3- на 2. 3*2 + 2*(-3) = 0. Формула Са3(РО4)2.
Источник: моцке
дарья верхола
Ученик
(156)
6 лет назад
Формулы солей содержат металл и кислотный остаток, т. е. на первом месте обяъательно должен стоять металл, а на втором кислотный остаток!!!!
Формулы соли составить просто, например хлорид меди (II) – эта II – двойка, показывает, что медь двухвалентна, т. е. заряд у меди будет +2, а так как у хлора он всегда с металлами -1, то все дальше просто:
CuCl2
Нитрат натрия – натрий одновалентный металл, т. е. его степень окисления всегда +1, у нитрат – аниона всегда -1, значит формула:
NaNO3
P.S. Если не понятно, пиши в ЛС объясню по – другому)))
P.S. Если хочешь по практиковаться – пиши в ЛС, скину названия солей, а ты мне в ответ их составишь))))))
| 01 |
Соли — самый разнообразный и многочисленный класс неорганических соединений. Они бывают средними, кислыми, основными, двойными, смешанными и комплексными. При н. у. все соли являются твердыми кристаллическими веществами, часто имеющими красивую окраску, причудливую форму кристаллов и самые разнообразные свойства. |
||||||||
Средние соли |
|||||||||
| 02 | Наиболее простые среди прочих видов солей — средние:
средние соли — это соединения, состоящие из атомов металлов и кислотных остатков Свое название эти соли получили именно потому, что представляют собой нечто среднее между основанием и кислотой: |
||||||||
| 03 |
Согласно правилам систематической номенклатуры название средней соли состоит из названия кислотного остатка, названия металла и валентности металла, если она не постоянна:
|
| 04 | Чтобы определить неизвестную валентность металла по формуле соли, необходимо:
|
||||||
| 05 | Можно воспользоваться альтернативным способом определения валентности металла:
|
||||||
| 06 | Чтобы написать формулу средней соли по ее названию, например:
необходимо, как и в любых подобных ситуациях:
|
||||||
| 07 |
К средним солям относится и хорошо знакомая нам поваренная соль — это хлорид натрия NaCl. Обычно ее добывают в солончаках, к числу которых относятся, например, высохшие соляные озера (рис. 1). |
Кислые соли |
|||||
| 10 | Кислые соли называются так потому, что при их образовании не все атомы водорода в кислоте были замещены атомами металлов:
кислые соли — это соединения, состоящие из атомов металлов, кислотных остатков и не замещенных металлами атомов водорода Например, серная кислота может образовывать как средние, так и кислые соли:
В то же время бромистоводородная кислота HBr, не может образовывать кислых солей вообще, поскольку имеет лишь один атом водорода: либо он есть, либо его нет. А вот фосфорная кислота способна давать две кислых соли, отщепляя поочередно по одному атому водорода: LiH2PO4, Li2HPO4. |
||||
| 11 |
Каждый атом водорода уменьшает валентность кислотного остатка на единицу. Так, если для образования средней соли одному атому двухвалентного кальция требовался один сульфат, то в случае кислой соли их потребуется уже два:
|
||||
| 12 |
Название кислой соли состоит из названия кислотного остатка, к которому добавляется префикс гидро- или дигидро-, в зависимости от того, сколько атомов водорода — один или два, — с ним связано, а также названия металла и его валентности, если она не постоянна:
|
||||
| 13 | Валентность металла в кислой соли, например Cr(HSO3)3, определяется по известному алгоритму: | ||||
| 14 | Теперь попробуем вывести формулу кислой соли по ее названию, например:
Для этого:
|
||||
Основные соли |
|||||
| 15 | Осно́вные соли называются так потому, что при их образовании не все гидроксилы в соответствующем основании были замещены кислотными остатками:
основные соли — это соединения, состоящие из атомов металлов, незамещенных гидроксилов и кислотных остатков. Так, кальций может образовывать одну основную соль:
а трехвалентное железо — две: Гидроксиды же одновалентных металлов, очевидно, вообще не могут образовывать основных солей. |
||||
| 16 |
Каждый гидроксил уменьшает валентность металла на единицу: в средней соли на один карбонат приходится один атом кальция, а в основной соли — уже два:
|
||||
| 17 |
Название основной соли состоит из названия кислотного остатка, названия металла, к которому добавляется префикс гидроксо-, дигидроксо- или тригидроксо-, в зависимости от того, сколько гидроксилов — один, два или три, — связано с одним атомом металла, а также валентности металла, если она не постоянна:
|
||||
| 18 | Валентность металла в основной соли, например Sn(OH)3NO3, определяется таким же способом, как и в других типах солей: | ||||
| 19 | Чтобы вывести формулу основной соли по ее названию, например
силикат гидроксомеди (II), сделаем следующее:
|
||||



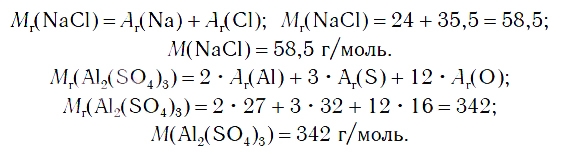























2.jpg)
3.jpg)



2.jpg)

2.jpg)

2CO3.jpg)
2Br.jpg)
