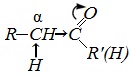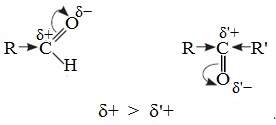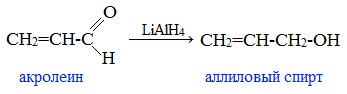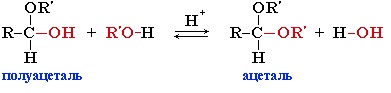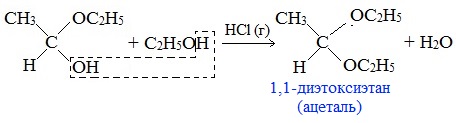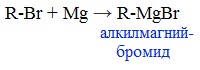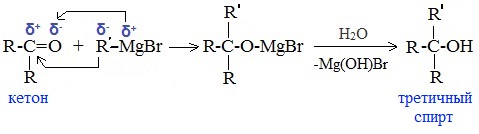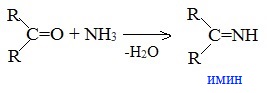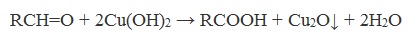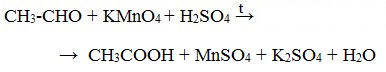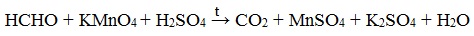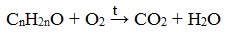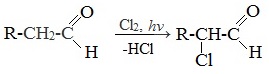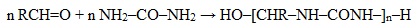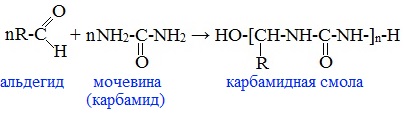в торичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
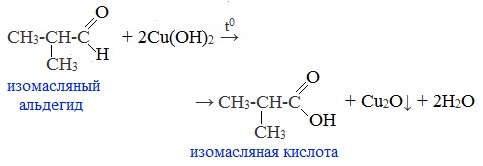
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + 2Cu(OH)2 = 2Cu + CO2 + 3H2O
Чаще в этой реакции образуется оксид меди (I):
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
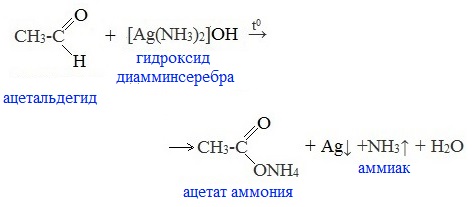
Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота

Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
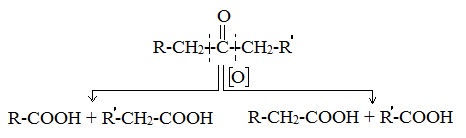
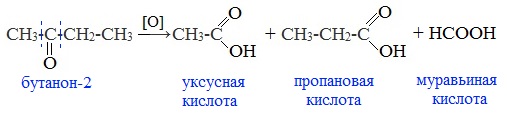
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
Например, уравнение сгорания метаналя:
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
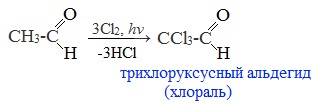
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
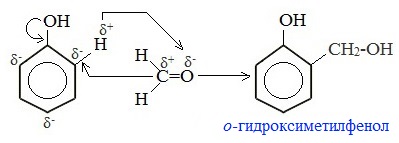
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
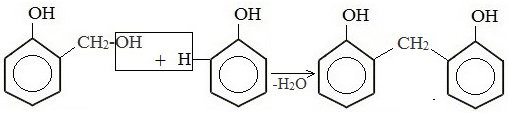
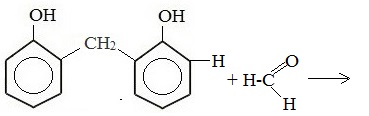
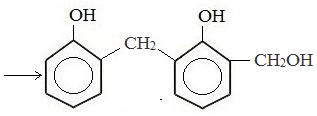
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Урок 24. Химические свойства и применение альдегидов
Химические свойства. Рассмотрим поведение альдегидов в отношении стандартного набора реагентов: кислорода воздуха О2, окислителей [О], а также Н2, Н2О, спиртов, Na, НСl.
Альдегиды медленно окисляются кислородом воздуха в карбоновые кислоты:
Качественная реакция на альдегиды – реакция «серебряного зеркала». Реакция состоит во взаимодействии альдегида RСНО с водно-аммиачным раствором оксида серебра(I), представляющим растворимое комплексное соединение [Ag(NН3)2]OH. Реакцию проводят при температуре, близкой к температуре кипения воды (80–100 °С). В результате на стенках стеклянного сосуда (пробирки, колбы) образуется осадок металлического серебра – «cеребряное зеркало»:
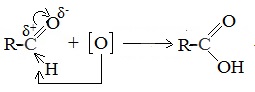
Восстановление гидроксида меди(II) в оксид меди(I) – другая характерная реакция альдегидов. Реакция протекает при кипячении смеси и состоит в окислении альдегида. Точнее сказать, происходит внедрение атома [О] окислителя Cu(OH)2 по связи С–Н альдегидной группы. При этом изменяются степени окисления карбонильного углерода (от +1 до +3) и атома меди (от +2 до +1). При нагревании голубого осадка Cu(OH)2 в смеси с альдегидом наблюдается исчезновение голубой окраски и образование красного осадка Cu2O:
Альдегиды присоединяют водород Н2 по двойной связи С=О при нагревании в присутствии катализатора (Ni, Pt, Pd). Реакция сопровождается разрывом -связи в карбонильной группе С=О и присоединением по месту ее разрыва двух атомов Н молекулы водорода Н–Н. Таким образом из альдегидов получают спирты:
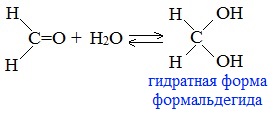
Альдегиды с электроноакцепторными заместителями в -положении к альдегидной группе присоединяют воду с образованием гидратов альдегидов (диолов-1,1):
Для того чтобы удерживать две электроотрицательные гидроксильные группы, атом углерода должен нести достаточный положительный заряд. Созданию дополнительного положительного заряда на карбонильном углероде способствуют три электроноакцепторных атома хлора при соседнем -углероде хлораля.
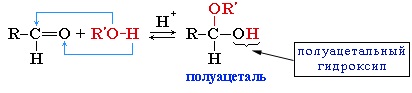
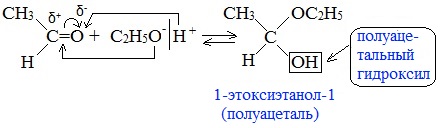
Реакция альдегидов со спиртами. Синтез полуацеталей и ацеталей. В благоприятных условиях (например: а) при нагревании с кислотой или в присутствии водоотнимающих средств; б) при внутримолекулярной конденсации с образованием пяти- и шестичленных циклов) альдегиды реагируют со спиртами. При этом к одной молекуле альдегида может присоединиться либо одна молекула спирта (продукт – полуацеталь), либо две молекулы спирта (продукт – ацеталь):
Альдегиды не присоединяют НСl по двойной связи С=О. Также альдегиды не реагируют с Na, т.е. альдегидный водород группы –СНО не обладает заметными кислотными свойствами.
Применение альдегидов основано на их высокой реакционной способности. Альдегиды используют в качестве исходных и промежуточных соединений в синтезе веществ с полезными свойствами других классов.
Формальдегид НСНО – бесцветный газ с резким запахом – используют для производства полимерных материалов. Вещества с подвижными атомами Н в молекуле (обычно при связях С–Н или N–H, но не О–Н) соединяются с формальдегидом СН2О по типу:
Если в молекуле исходного вещества два или несколько подвижных протонов (у фенола С6Н5ОН – три таких протона), то в реакции с формальдегидом получается полимер. Например, с фенолом – фенолформальдегидная смола:
Подобным образом мочевина с формальдегидом дает мочевиноформальдегидные смолы:
Формальдегид служит исходным веществом для производства красителей, фармацевтических препаратов, синтетического каучука, взрывчатых веществ и многих других органических соединений.
Формалин (40%-й водный раствор формальдегида) применяется в качестве антисептика (обеззараживающего средства). Свойство формалина свертывать белок используется в кожевенном производстве и для сохранения биопрепаратов.
Ацетальдегид СН3СНО – бесцветная жидкость (tкип = 21 °С) с резким запахом, хорошо растворимая в воде. Главное использование ацетальдегида – получение уксусной кислоты. Из него также получают синтетические смолы, лекарства и т.д.
УПРАЖНЕНИЯ
1. Опишите, с помощью каких химических реакций можно различить следующие пары веществ:
а) бензальдегид и бензиловый спирт; б) пропионовый альдегид и пропиловый спирт. Укажите, что будет наблюдаться в ходе каждой реакции.
2. Приведите уравнения реакций, подтверждающих наличие в молекуле
п-гидроксибензальдегида соответствующих функциональных группировок.
4. Составьте уравнения реакций для цепочки химических превращений:
5. В результате гидролиза ацеталя образуются альдегид RCHO и спирт R’ОН в мольном соотношении 1:2. Составьте уравнения реакций гидролиза следующих ацеталей:
6. При окислении предельного одноатомного спирта оксидом меди(II) образовалось 11,6 г органического соединения с выходом 50%. При взаимодействии полученного вещества с избытком аммиачного раствора оксида серебра выделилось 43,2 г осадка. Какой спирт был взят и какова его масса?
7. 5-Гидроксигексаналь в подкисленном водном растворе находится преимущественно в форме шестичленного циклического полуацеталя. Составьте уравнение соответствующей реакции:
Ответы на упражнения к теме 2
Урок 24
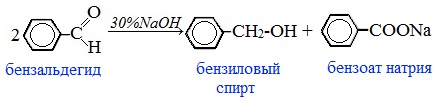
1. Различить два вещества можно с помощью реакций, характерных только для одного из этих веществ. Например, альдегиды окисляются в кислоты при действии слабых окислителей. Нагревание смеси бензальдегида и аммиачного раствора оксида серебра протекает с образованием на стенках колбы «серебряного зеркала»:
Бензальдегид восстанавливается при каталитическом гидрировании в бензиловый спирт:
Бензиловый спирт реагирует с натрием, в реакции выделяется водород:
2С6Н5СН2ОН + 2Na 2C6Н5CН2ONa + Н2.
При нагревании в присутствии катализатора меди бензиловый спирт окисляется кислородом воздуха в бензальдегид, что обнаруживается по характерному запаху горького миндаля:
Аналогичным образом можно различить пропионовый альдегид и пропиловый спирт.
2. В п-гидроксибензальдегиде три функциональные группы: 1) ароматическое кольцо; 2) фенольный гидроксил; 3) альдегидная группа. В специальных условиях – при защите альдегидной группы от окисления (обозначение – [–СНО]) – можно провести хлорирование п-гидроксибензальдегида в бензольное кольцо:
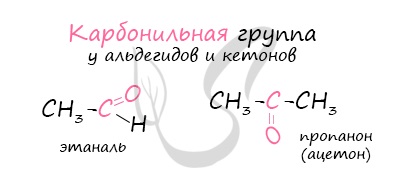
Карбонильные соединения – это органические вещества, молекулы которых содержат карбонильную группу:
Карбонильные соединения делятся на альдегиды и кетоны. Общая формула карбонильных соединений: СnH2nO.
Строение, изомерия и гомологический ряд альдегидов и кетонов
Химические свойства альдегидов и кетонов
Способы получения альдегидов и кетонов
Альдегидами называются органические соединения, содержащие карбонильную группу, в которой атом углерода связан с радикалом и одним атомом водорода.
Структурная формула альдегидов:
Кетонами называются соединения, в молекуле которых карбонильная группа связана с двумя углеводородными радикалами.
Структурная формула кетонов:
Химические свойства альдегидов и кетонов
1. Реакции присоединения
В молекулах карбонильных соединений присутствует двойная связь С=О, поэтому для карбонильных соединений характерны реакции присоединения по двойной связи. Присоединение к альдегидам протекает легче, чем к кетонам.
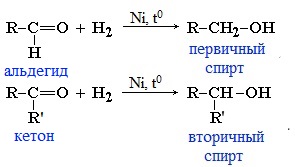
1.1. Гидрирование
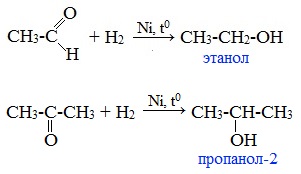
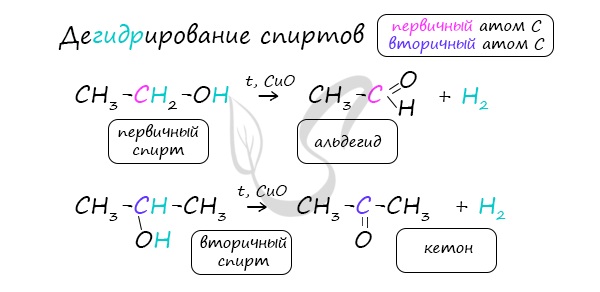
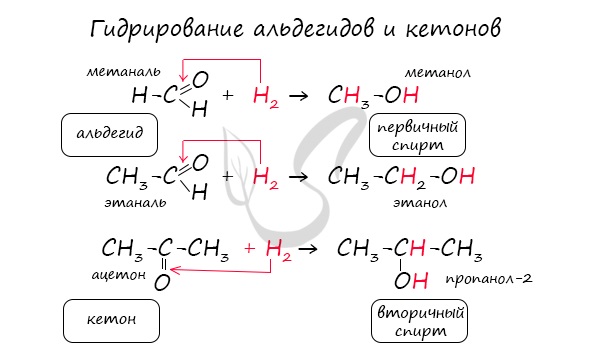
Альдегиды при взаимодействии с водородом в присутствии катализатора (например, металлического никеля) образуют первичные спирты, кетоны — вторичные:
1.2. Присоединение воды
При гидратации формальдегида образуется малоустойчивое вещество, называемое гидрат. Оно существует только при низкой температуре.
1.3. Присоединение спиртов
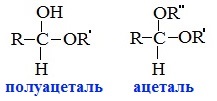
При присоединении спиртов к альдегидам образуются вещества, которые называются полуацетали.
В качестве катализаторов процесса используют кислоты или основания.
Полуацетали существует только при низкой температуре.
Полуацетали – это соединения, в которых атом углерода связан с гидроксильной и алкоксильной (-OR) группами.
Полуацеталь может взаимодействовать с еще одной молекулой спирта в присутствии кислоты. При этом происходит замещение полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
1.4. Присоединение циановодородной (синильной) кислоты
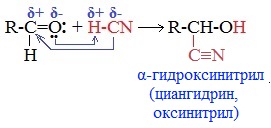
Карбонильные соединения присоединяют синильную кислоту HCN. При этом образуется гидроксинитрил (циангидрин):
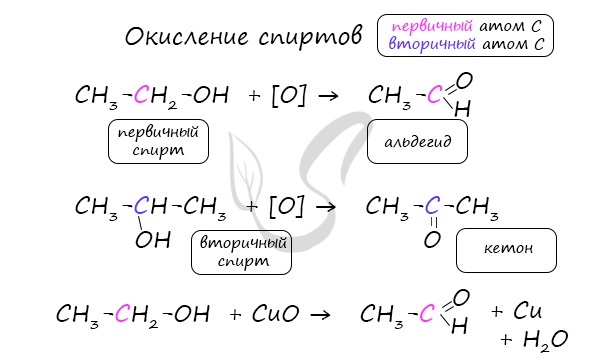
2. Окисление альдегидов и кетонов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Альдегид → карбоновая кислота
Формальдегид→ муравьиная кислота→ углекислый газ
вторичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Видеоопыт окисления муравьиного альдегида гидроксидом меди (II) можно посмотреть здесь.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + 2Cu(OH)2 = 2Cu + CO2 + 3H2O
Чаще в этой реакции образуется оксид меди (I):
CH3CHO + 2Cu(OH)2 = Cu2O + CH3COOH + 2H2O
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
CnH2nО + (3n-1)/2O2 → nCO2 + nH2O + Q
Например, уравнение сгорания метаналя:
CH2O + O2 = CO2 + H2O
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
в торичные спирты → кетоны
Типичные окислители — гидроксид меди (II), перманганат калия KMnO4, K2Cr2O7, аммиачный раствор оксида серебра (I).
Кетоны окисляются только при действии сильных окислителей и нагревании.
2.1. Окисление гидроксидом меди (II)
Происходит при нагревании альдегидов со свежеосажденным гидроксидом меди, при этом образуется красно-кирпичный осадок оксида меди (I) Cu2O. Это — одна из качественных реакций на альдегиды.
Например, муравьиный альдегид окисляется гидроксидом меди (II)
HCHO + 2Cu(OH)2 = 2Cu + CO2 + 3H2O
Чаще в этой реакции образуется оксид меди (I):
2.2. Окисление аммиачным раствором оксида серебра
Альдегиды окисляются аммиачным раствором оксида серебра (реакция «серебряного зеркала»).
Поскольку раствор содержит избыток аммиака, продуктом окисления альдегида будет соль аммония карбоновой кислоты.
Например, при окислении муравьиного альдегида аммиачным раствором оксида серебра (I) образуется карбонат аммония
Например, при окислении уксусного альдегида аммиачным раствором оксида серебра образуется ацетат аммония
Образование осадка серебра при взаимодействии с аммиачным раствором оксида серебра — качественная реакция на альдегиды.
Упрощенный вариант реакции:
2.3. Жесткое окисление
При окислении под действием перманганатов или соединений хрома (VI) альдегиды окисляются до карбоновых кислот или до солей карбоновых кислот (в нейтральной среде). Муравьиный альдегид окисляется до углекислого газа или до солей угольной кислоты (в нейтральной среде).
Например, при окислении уксусного альдегида перманганатом калия в серной кислоте образуется уксусная кислота
Кетоны окисляются только в очень жестких условиях (в кислой среде при высокой температуре) под действием сильных окислителей: перманганатов или дихроматов.
Реакция протекает с разрывом С–С-связей (соседних с карбонильной группой) и с образованием смеси карбоновых кислот с меньшей молекулярной массой или СО2.
| Карбонильное соединение/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метаналь СН2О | CO2 | K2CO3 |
| Альдегид R-СНО | R-COOH | R-COOK |
| Кетон | R-COOH/ СО2 | R-COOK/ K2СО3 |
2.4. Горение карбонильных соединений
При горении карбонильных соединений образуются углекислый газ и вода и выделяется большое количество теплоты.
Например, уравнение сгорания метаналя:
3. Замещение водорода у атома углерода, соседнего с карбонильной группой
Карбонильные соединения вступают в реакцию с галогенами, в результате которой получается хлорзамещенный (у ближайшего к карбонильной группе атома углерода) альдегид или кетон.
Например, при хлорировании уксусного альдегида образуется хлорпроизводное этаналя
Полученное из ацетальдегида вещество называется хлораль. Продукт присоединения воды к хлоралю (хлоральгидрат) устойчив и используется как лекарство.
4. Конденсация с фенолами
Формальдегид может взаимодействовать с фенолом. Катализатором процесса выступают кислоты или основания:
Дальнейшее взаимодействие с другими молекулами формальдегида и фенола приводит к образованию фенолоформальдегидных смол и воды:
Фенол и формальдегид вступают в реакцию поликонденсации.
Поликонденсация — это процесс соединения молекул в длинную цепь (полимер) с образованием побочных продуктов с низкой молекулярной массой (вода или др.).
5. Полимеризация альдегидов
Полимеризация характерна в основном для легких альдегидов. Для альдегидов характерна линейная и циклическая полимеризация.
Например, в растворе формалина (40 %-ного водного раствора формальдегида) образуется белый осадок полимера формальдегида, который называется полиформальдегид или параформ:
Альдегид плюс спирт уравнение реакции
Химические свойства альдегидов и кетонов определяются тем, что в состав их молекул входит карбонильная группа с полярной двойной связью >C=O.
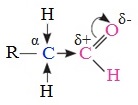
1. Высокая полярность связи С=О вызывает на карбонильном атоме углерода значительный дефицит электронной плотности (C δ+ ), и по этому атому углерода возможна нуклеофильная атака. При этом, взаимодействие с нуклеофилами приводит к разрыву π-связи и образованию более прочной σ-связи.
2. Высокая полярность связи С=О вызывает на атоме углерода, соседнем с карбонильной группой (α-углеродном атоме), повышенную полярность связи С-Н α-углеродного атома. Это характеризует данные соединения как СН-кислоты.
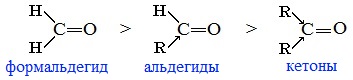
Для альдегидов и кетонов наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения (AN).
Реакционная способность в таких реакциях уменьшается от альдегидов к кетонам:
Самый активный из альдегидов – формальдегид Н2СО.
Сравнение реакционной способности альдегидов и кетонов
При сравнении реакционной способности альдегидов и кетонов необходимо учесть 2 фактора: электронный и пространственный.
Альдегиды более реакционноспособны, чем кетоны. Кетоны реагируют обычно в более жестких условиях, чем альдегиды, а в некоторые реакции даже и не вступают.
Электронный фактор связан с величиной положительного заряда на карбонильном атоме углерода и влиянием на него электронодонорных эффектов заместителей R и R’.
В молекулах кетонов на карбонильный атом углерода действуют индуктивные эффекты двух углеводородных радикалов R и R’, а в молекулах альдегидов одного радикала R, поэтому в случае кетонов величина положительного заряда на этом атоме меньше.
Следовательно, взаимодействие кетонов с нуклеофилами протекает труднее.
Пространственный фактор связан с доступностью реакционного центра (C δ+ ) для нуклеофильной атаки, а это зависит от размеров заместителей R и R’.
В молекулах альдегидов (содержат один радикал R) карбонильный атом углерода оказывается более доступен по сравнению с кетонами, поэтому нуклеофильные реакции для альдегидов протекают легче, чем для кетонов.
Реакционная способность карбонильных соединений определяется величиной частичного положительного заряда δ + на атоме углерода в карбонильной группе. Чем этот заряд больше, тем выше химическая активность карбонильного соединения.
- Углеводородные радикалы у группы С=О увеличивают пространственные препятствия присоединению к карбонильному атому углерода новых атомов или атомных групп.
- Углеводородные радикалы за счет +I-эффекта уменьшают положительный заряд на атоме углерода карбонильной группы, что затрудняет присоединение нуклеофильного реагента.
Для карбонильных соединений характерны реакции:
- присоединение по карбонильной группе;
- реакции замещения у α-углеродного атома;
- полимеризация;
- поликонденсация;
- окисление.
Реакции присоединения
Присоединение большинства реагентов по двойной связи С=О происходит как ионная реакция по механизму нуклеофильного присоединения AN.
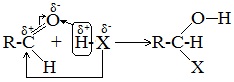
1. Гидрирование (восстановление)
Реакцию восстановления альдегидов и кетонов широко используют для получения спиртов. Присоединение водорода по кратной связи С=О происходит при нагревании в присутствии катализаторов (Ni, Pt, Pd).
В результате образуются спирты соответствующего строения. Гидрирование альдегидов приводит к образованию первичных спиртов, гидрирование кетонов – ко вторичным.
Так, при гидрировании уксусного альдегида на никелевом катализаторе образуется этиловый спирт, а при гидрировании ацетона – пропанол-2:
В лабораторных условиях для восстановления альдегидов и кетонов используется алюмогидрид лития (тетрагидроалюминат лития) LiAlH4:
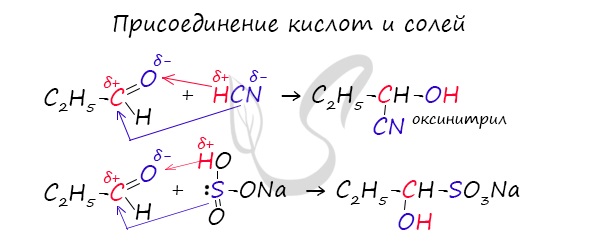
2. Присоединение циановодородной (синильной) кислоты НСN
Альдегиды и кетоны, взаимодействуя с синильной кислотой, образуют циангидрины – органические соединения, молекулы которых содержат две функциональные группы: циано-группу 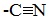
Присоединение идет в соответствии с распределением электронной плотности в молекулах:
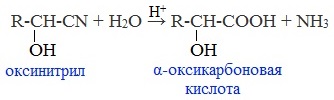
Образовавшееся соединение содержит на один атом углерода больше, чем исходный альдегид или кетон, поэтому подобные реакции используют для удлинения углеродной цепи. А также для получения α-гидроксикислот R-CH (COOH) OH:
Циангидрин CH3— CH(CN) — OH — яд! Он содержится в ядрах косточек вишен, слив, персика.
Циангидрины используют как промежуточные соединения в синтезах окси- и аминокислот. Некоторые циангидрины встречаются в растениях. Употребление таких растений в пищу может привести к тяжелым отравлениям вследствие высвобождения синильной кислоты в организме.
3. Взаимодействие со спиртами (в присутствии кислоты или основания как катализатора)
Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали или ацетали.
Полуацетали — соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную (ОR) группы.
Ацетали – это соединения, содержащие при одном атоме углерода две алкоксильные группы.
Присоединение спиртов с образованием полуацеталей:
Гидроксильная группа полуацеталей (полуацетальный гидроксил) очень реакционноспособна. Взаимодействие полуацеталя с еще одной молекулой спирта (в присутствии кислоты) приводит к замещению полуацетального гидроксила на алкоксильную группу OR’ и образованию ацеталя:
Ацетали обладают приятным цветочным ароматом. Именно образованием ацеталей обусловлен букет выдержанных вин.
Ацеталь, полученный из масляного альдегида и поливинилового спирта, используется в качестве клея при изготовлении безосколочных стекол.
Кетоны в этих условиях кетали не образуют.
4. Гидратация (присоединение воды)
Альдегиды в водных растворах существуют в виде гидратных форм, образующихся в результате присоединения воды к карбонильной группе:
Эта реакция возможна только для формальдегида и уксусного альдегида.
Кетоны не реагируют с водой.
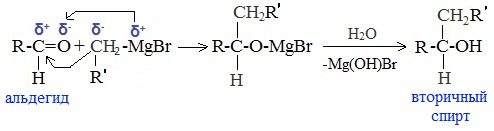
5. Присоединение реактива Гриньяра — образование спиртов
При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра.
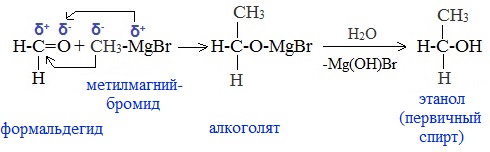
а) Взаимодействием реактива Гриньяра с формальдегидом можно получить первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют с водой:
б) При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
в) Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
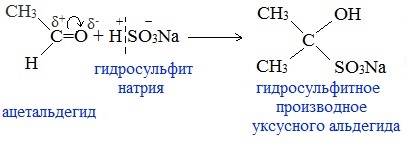
6. Присоединение гидросульфита натрия NaHSO3 с образованием гидросульфитных производных альдегидов
Качественная реакция на альдегидную группу!
Альдегиды при встряхивании с концентрированным раствором гидросульфита натрия образуют кристаллические соединения:
С помощью этой реакции выделяют альдегиды из смесей с другими веществами и для получения их в чистом виде.
7. Взаимодействие с аммиаком
При взаимодействии с аммиаком образуются имины:
Реакции окисления
В молекулах альдегидов атом углерода карбонильной группы, имеющий избыточный положительный заряд, притягивает к себе электроны связи С-Н. Вследствие этого атом водорода приобретает большую реакционную активность, что проявляется в способности альдегидов к окислению.
Альдегиды легко окисляются в соответствующие карбоновые кислоты под действием таких мягких окислителей, как оксид серебра и гидроксид меди (II). Окисление происходит по связи С-Н в альдегидной группе –СН=О, которая превращается при этом в карбоксильную группу –С(ОН)=О.
1. Реакция «серебряного зеркала» — окисление аммиачным раствором оксида серебра (реактив Толленса)
Качественная реакция на альдегидную группу!
Металлическое серебро осаждается на стенках пробирки в виде тонкого слоя, образуя зеркальную поверхность.
Видеоопыт «Реакция «серебряного зеркала»
Реакцию «серебряного зеркала» широко используют для изготовления зеркал, серебрения украшений и елочных игрушек.
Кетоны не вступают в эту реакцию.
2. Окисление гидроксидом меди (II)
Качественная реакция на альдегидную группу!
Для реакции используют свежеприготовленный Cu (ОН)2, образующийся при взаимодействии растворимой соли меди (II) со щелочью.
Голубая суспензия гидроксида меди (II) при нагревании с альдегидом приобретает окраску оранжево-красного осадка оксида меди (I):
Альдегид окисляется до соответствующей ему карбоновой кислоты.
Видеоопыт «Качественная реакция на альдегиды с гидроксидом меди (II)»
Кетоны в эту реакцию не вступают.
3. Реакция на альдегиды с фуксиносернистой кислотой
Качественная реакция на альдегидную группу!
Краситель красного цвета — фуксин, при насыщении его раствора газообразным сернистым ангидридом (SO2) образует бесцветный раствор фуксиносернистой кислоты. Этот реактив при взаимодействии с альдегидами дает красно-фиолетовое окрашивание, что является качественной реакцией на альдегидную группу.
Видеоопыт «Качественная реакция на альдегиды с фуксинсернистой кислотой»
Кетоны не вступают в эту реакцию.
Кетоны окисляются с трудом лишь при действии более сильных окислителей и повышенной температуре. При этом происходит разрыв С–С-связей (соседних с карбонилом) и образование смеси карбоновых кислот с более короткой углеродной цепью:
4. Окисление перманганатом калия
Альдегиды можно окислить подкисленным раствором перманганат калия КMnO4 при нагревании:
Происходит обесцвечивание раствора. Альдегидная группа окисляется до карбоксильной, т.е. альдегид окисляется до соответствующей ему карбоновой кислоты.
Муравьиный альдегид (формальдегид) окисляется до углекислого газа, потому что соответствующая ему муравьиная кислота неустойчива к действию сильных окислителей:
Для кетонов эта реакция не имеет практического значения, так как происходит разрушение молекулы и в результате получается смесь продуктов.
5. Горение (полное окисление)
Альдегиды и кетоны сгорают до углекислого газа и воды:
Реакции замещения
1. α -Галогенирование
Альдегиды и кетоны легко вступают в реакцию с галогенами (Cl2, Br2, I2) с образованием ɑ-галогенпроизводных.
Такой эффект наблюдается только для ɑ-атома углерода, т.е атома, следующего за альдегидной группой, независимо от длины углеродного радикала.
Галогенопроизводные альдегидов и кетонов проявляют слезоточивое действие и называются лакриматорами.
При избытке галогена замещению подвергаются все атомы водорода при ɑ-углеродном атоме:
Хлораль обладает снотворным действием. На основе хлораля получают средства борьбы с насекомыми (инсектициды), в том числе хлорофос, а также различные гербициды.
При растворении хлораля в воде образуется хлоралгидрат ССl3CH (OH)2.
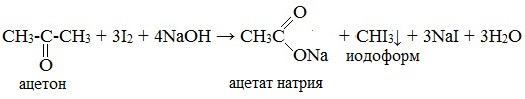
2. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на метилкетоны и ацетальдегид!
Иодоформная реакция – обработка карбонильного соединения избытком иода в присутствии щелочи. Выпадение желтого осадка иодоформа указывает на наличие в исходном соединении метильной группы, связанной с карбонилом:
Иодоформ широко используется как антисептик в медицине и ветеринарии.
Реакции полимеризации
Полимеризация — частный случай реакций присоединения — характерна в основном для альдегидов.
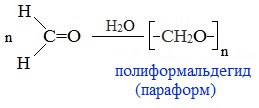
1. Линейная полимеризация
При испарении или длительном стоянии 40% водного раствора формальдегида (формалина) образуется полимер формальдегида в виде белого осадка с невысокой молекулярной массой – параформ:
Параформ используют для изготовления волокон, пленок и других изделий.
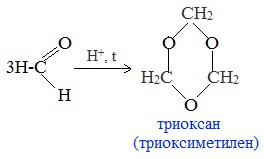
2. Циклическая полимеризация (тримеризация, тетрамеризация)
При взаимодействии молекул альдегидов возможно также образование циклических соединений.
а) Тример метаналя получается при перегонке подкисленного раствора формальдегида:
Триоксан используется для получения полиформальдегида (полиоксиметилена) с высокой молекулярной массой, обладающего повышенной стабильностью и механической прочностью.
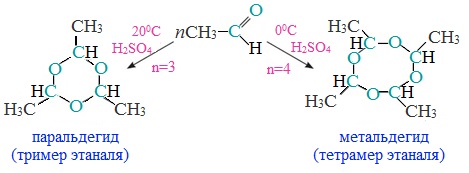
б) Полимеризация ацетальдегида в присутствии следов серной кислоты приводит к образованию в зависимости от условий двух циклических продуктов — паральдегида и метальдегида. Паральдегид образуется, если реакцию проводить при 20 0 С, а метальдегид — при 0 0 С:
Паральдегид — жидкость (т. кип. 128 0 С), метальдегид — твердое вещество, используется в быту как сухое горючее под названием «сухой спирт».
Реакции поликонденсации
Конденсацией называется реакция, приводящая к усложнению углеродного скелета и возникновению новой углеродной связи, причем из двух или более относительно простых молекул образуется новая, более сложная молекула. Обычно в результате реакции конденсации выделяется молекула воды или другого вещества.
Конденсация, приводящая к образованию высокомолекулярных соединений, называется реакцией поликонденсации.
1. Конденсация с фенолами
Практическое значение имеет реакция формальдегида с фенолом (катализаторы — кислоты или основания).
Вначале в присутствии катализатора происходит взаимодействие между молекулой формальдегида и молекулой фенола с образованием фенолспирта:
Для фенола эта реакция электрофильного замещения (SE), а для формальдегида – нуклеофильного присоединения (АN).
Образовавшееся соединение взаимодействует далее с фенолом с выделением молекулы воды:
Новое соединение взаимодействует с формальдегидом:
Это соединение конденсируется с фенолом, затем снова с формальдегидом и т.д.
В результате поликонденсации фенола с формальдегидом в присутствии катализаторов образуются фенолформальдегидные смолы, из которых получают пластмассы – фенопласты.
Фенопласты – важнейшие заменители цветных и черных металлов во многих отраслях промышленности. Из них изготавливают большое количество изделий широкого потребления, электроизоляционные материалы и строительные детали.
2. Конденсация альдегидов с карбамидом (мочевиной) (NH2)2C=O — получение карбамидных (мочевино-формальдегидных) смол
Видеоопыт «Поликонденсация формальдегида и мочевины (получение пенопласта)»
3. Конденсация формальдегида с меламином С3Н6N6 (меламино-формальдегидные смолы)
Меламино-формальдегидные смолы применяют для пропитки бумаги, картона и тканей с целью придания им водостойкости, несминаемости и снижения усадки.
Важно! Посуда, изготовленная из меламино-формальдегидных полимеров (неправильно называемых «меламином»), обычно ярко оформлена, токсична и очень опасна для здоровья.
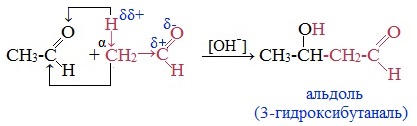
4. Альдольно-кротоновая конденсация
При альдольной конденсации происходит присоединение одной молекулы карбонильного соединения к другой молекуле, образуется альдегидоспирт (альдоль) или кетоноспирт (кетол).
Например, уксусный альдегид на холоду при действии разбавленных растворов щелочей превращается в альдоль:
Альдольная конденсация широко используется в промышленности для получения синтетических каучуков, смол, лаков и различных душистых веществ.
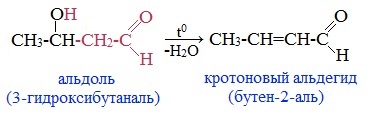
При кротоновой конденсации образуется молекула непредельного альдегида или кетона. Химическая реакция сопровождается выделением молекулы воды.
Реакция проводится в более жестких условиях (при нагревании или в присутствии кислоты) альдоль дегидратируется с образованием кротонового альдегида:
Легкое отщепление воды от альдоля объясняется подвижностью водородного атома в α-звене, на которое действует –I-эффекты двух групп (ОН и С=О).
Соединения, содержащие третичный углеродный атом возле карбонильной группы не вступают в реакцию альдольной конденсации.
Впервые эти конденсации осуществили одновременно (1872 г.) и независимо друг от друга А.П. Бородин и Ш.А. Вюрц.
Реакции диспропорционирования
Реакция Канниццаро
Важной в промышленности реакцией самоокисления-самовосстановления является реакция Канниццаро.
Альдегиды, не содержащие атом водорода у α-углеродного атома, в щелочной среде способны вступать в окислительно-восстановительную реакцию (диспропорционирования):
Одна молекула альдегида при этом окисляется до карбоновой кислоты, а другая молекула восстанавливается до спирта.
Альдегиды
Альдегиды — летучие жидкости органического состава, являющиеся продуктом неполного окисления спиртов. Карбонильная группа в молекулах альдегидов связана с одним атомом водорода и одной группой R.
Не часто встречаются в природе в отдельном виде, но, несомненно, играют важную роль в физиологических процессах растений и животных. Общая формула альдегидов CnH2nO.
Многие альдегиды имеют специфический запах. Высшие альдегиды, в особенности непредельные, используются в пищевой промышленности и парфюмерии.
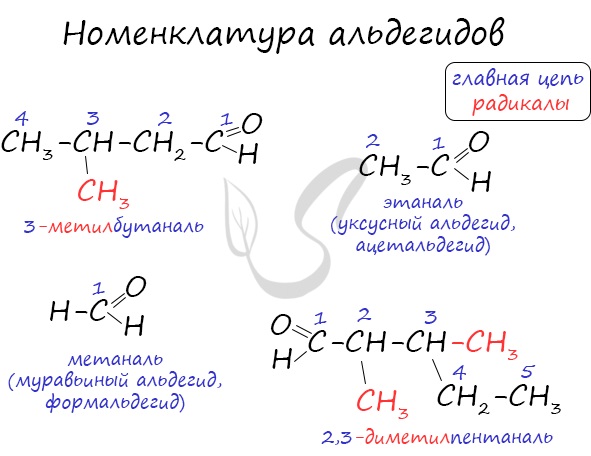
Номенклатура и изомерия альдегидов
Названия альдегидов формируются путем добавления суффикса «аль» к названию алкана с соответствующим числом атомов углерода: метаналь, этаналь, пропаналь, бутаналь, пентаналь и т.д.
Вы можете встретить их молекулярные формулы, где группа OH записана наоборот — HO. Например: метаналь — HCHO, этаналь — CH3CHO, пропаналь — C2H5CHO. Это делают специально для того, чтобы их было легче отличить от спиртов.
Многие альдегиды имеют тривиальные названия. Наиболее известные: метаналь — формальдегид, этаналь — ацетальдегид. Замечу, что формалином называется 40% раствор формальдегида.
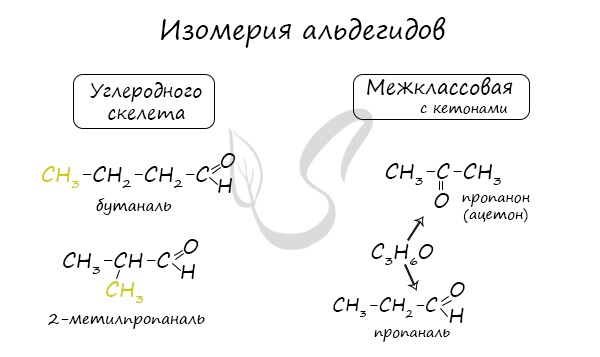
Для альдегидов характерна структурная изомерия: углеродного скелета, межклассовая изомерия с кетонами.
Получение альдегидов и кетонов
- Окисление спиртов
Важно заметить, что при окислении первичных спиртов образуются альдегиды, при окислении вторичных спиртов — кетоны. Окисление с помощью оксида меди относится к лабораторным способам получения альдегидов.
Этот способ также просто осуществить в лабораторных условиях. При пиролизе (нагревании без доступа кислорода) кальциевых или бариевых солей карбоновых кислот возможно получение кетонов.
В присутствии катализатора и при нагревании спиртов от гидроксогруппы и прилежащего к ней атома углерода отщепляется по атому водорода. В результате образуется карбонильная группа.
Реакцией Кучерова называют гидратацию алкинов в присутствии солей двухвалентной ртути.
В результате такой реакции ацетилен превращается в уксусный альдегид. Все остальные его гомологи: пропин, бутин, пентин и т.д. превращаются в соответствующие кетоны.
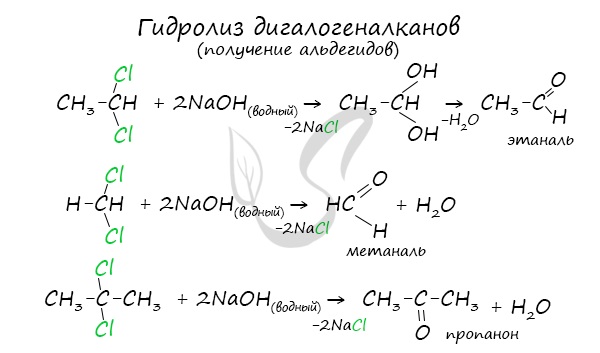
Для получения альдегида два атома галогена должны находиться у первичного атома углерода, для получения кетонов — у вторичного.
В результате такого гидролиза образуются двухатомные спирты, в которых две OH-группы прилежат к одному атому углерода. Такие соединения неустойчивы и распадаются на карбонильное соединение (альдегид или кетон) и воду.
В промышленности окислением метана при температуре 500 °C и в присутствии катализатора получают формальдегид.
В прошлой теме, посвященной фенолам, мы касались данного способа. В результате такой реакции образуется не только фенол, но и ацетон.
Химические свойства альдегидов и кетонов
Запомните, что для альдегидов и кетонов характерны реакции присоединения по карбонильной группе. Это является важным отличием альдегидов от карбоновых кислот, для которых реакции присоединения не характерны.
Для понимания механизма реакции важно вспомнить об электроотрицательности. В карбонильной группе кислорд, как более электроотрицательный элемент, тянет электронную плотность на себя от углерода. На атоме кислорода возникает частичный отрицательный заряд (δ-), а на атоме углерода частичный положительный (δ+).
Основы школьного курса физики подсказывают, что отрицательный заряд притягивает положительный: именно так и будет происходить при присоединении различных молекул к карбонильной группе альдегидов и кетонов.
Реакция гидрирования альдегидов происходит по типу присоединения, сопровождается разрывом двойной связи в карбонильной группе. Гидрирование альдегидов приводит к образованию первичных, а гидрирование кетонов — вторичных спиртов.
В результате полного окисления, горения, образуется углекислый газ и вода.
Альдегиды легко окисляются до карбоновых кислот в лабораторных условиях. Это осуществляется с помощью известной реакции серебряного зеркала. Данная реакция является качественной для альдегидов.
Кетоны, в отличие от альдегидов, в реакции окисления не вступают.
Обратите особое внимание, что при написании реакции с аммиачным раствором серебра в полном виде, правильнее будет указать не кислоту, а ее аммиачную соль. Это связано с тем, что выделяющийся аммиак, который обладает основными свойствами, реагирует с кислотой с образованием соли
Важно заметить, что при окислении метаналя, образовавшаяся муравьиная кислота тут же окисляется до угольной кислоты, которая распадается на углекислый газ и воду. Это связано с интересным фактом — наличием альдегидной группы у муравьиной кислоты.
Окисление также возможно другим реагентом — гидроксидом меди II. Эта реакция также относится к качественным для альдегидов, в результате образуется кирпично-красный осадок оксида меди I.
© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
источники:
http://himija-online.ru/organicheskaya-ximiya/aldegidy-i-ketony/ximicheskie-svojstva-aldegidov-i-ketonov.html
http://studarium.ru/article/189
Химия
Лекция
Тема:
Альдегиды и кетоны
Карбонильные
соединения
Карбонильные
соединения — это производные углеводородов,
содержащие функциональную группу С = О (карбонил).
В
зависимости от строения молекулы карбонильного соединения различают альдегиды и
кетоны.
Номенклатура
и изомерия альдегидов
В молекулах
альдегидов атом углерода карбонильной группы связан с атомом водорода и
углеводородным радикалом (исключение составляет простейший альдегид —
формальдегид, в молекуле которого вместо радикала — атом водорода). Группа
О
–
С
Н
получила название
альдегидной группы и является функциональной группой этого класса соединений:
Альдегиды,
— органические соединения, молекулы которых содержат альдегидную группу, соединенную
с углеводородным радикалом.
В
зависимости от строения углеводородных радикалов альдегиды могут быть
предельными и непредельными, циклическими и ароматическими.
Номенклатура.
Название альдегидов по систематической номенклатуре образуют от
название соответствующего алкана добавлением окончания -аль.
Для
альдегидов, наряду с систематической номенклатурой широко используют рациональные
(тривиальные) названия, происходящие от названия кислот, в которые они
переходят при окислении: уксусный альдегид уксусная кислота
Изомерия.
Альдегидная группа всегда расположена в начале углеродной цепи,
поэтому для альдегидов характерна изомерия углеродного скелета (С > 4).
При наличии разветвленного скелета главную цепь выбирают таким образом, чтобы
альдегидная группа оказалась в ней; нумерацию начинают с атома углерод
функциональной группы:
Электронное
строение карбонильной группы
В
карбонильной группе атом углерода находится в состоянии sр2-гибридизации.
Три его гибридные орбитали образуют три о-связи, которые располагаются в одной
плоскости под углом 120° друг к другу. Четвертая негибридизированная р-орбиталь
атома углерода перекрывается с р-орбиталью атома кислорода образуя п-связь С – О,
которая направлена перпендикулярно плоскости о-связей.
Таким образом,
атом углерода в карбонильной группе связан с атомом кислорода двойной связью С =
О (одна о-связь и одна п-связь), по своей природе она сходна с
углерод-углеродной двойной связью С = С. Ее отличие от двойной связи этиленовых
угле водородов состоит в том, что электронная плотность п-связи в карбонильной
группе смещена в сторону более электроотрицательного атома кислорода. В результате
на атоме кислорода, появляется частичный отрицательный заряд, а на атоме углерода
— частичный положительный заряд.
Полярность
связи С = О определяет многие физические и химические свойства карбонильных
соединений.
II. Реакции окисления.
Неполное
окисление
Реакции
присоединения характерны как для альдегидов, так для кетонов. Напротив, реакции
окисления характерны только для альдегидов. Они легче, чем спирты, окисляются
в соответствующие карбоновые кислоты под действием не только сильных
окислителей (кислород воздуха, подкисленные растворы КМпО4 или К2Сг2О7),
но и слабых (аммиачный раствор оксида серебра или гидроксид меди (II)).
Реакция
с аммиачным раствором оксида серебра.
Если к
аммиачному раствору оксида серебра прилить раствор муравьиного или уксусного
альдегида и смесь осторожно нагреть, на стенках пробирки осаждается металлическое
серебро, образуя зеркальную поверхность. Поэтому эта реакция получила название
реакции «серебряного зеркала», она является каченной для обнаружения
альдегидов.
Гидрирование
(восстановление). При взаимодействии альдегидов с водородом (в присутствии
катализатора) образуются первичные спирты
этаналь
+ Н2 этанол
Реакции
полимеризации.
Они
характерны для низших альдегидов. Важное значение имеет реакции полимеризации
формальдегида. В промышленных условиях проводят в присутствии катализатора и
получают полимер степенью полимеризации около 1000 — полиформальдегид, который используют для изготовления волокон, пленок и различных
изделий.
Полимеризация формальдегида
(как, например, и этилена) происходит за счет разрыва п -связи.
Вопросы.
1. Осуществите
следующие превращения, используя структурные формулы органических веществ:
этан —> хлорэтан —> этанол —> ацетальдегид —> уксусная кислота
Укажите условия
протекания реакций.
2. Укажите,
какие вещества вступили в реакцию и при каких условиях, если в результате
образовались следующие продукты:
а) 3СО2
+ 3Н2О; в) 2СН3СООН + Сu2O
+ Н2O;
б) НСООН
+ 2Ag; г) СН3 – СН2OН.
3. При
окислении 0,5 г технического ацетальдегида избытком аммиачного раствора оксида
серебра образовалось 2,16 г серебра. Вычислите массовую долю ацетальдегида в
техническом образце.
4. Для
каталитического гидрирования 17,8 г смеси муравьиного и уксусного альдегидов до
соответствующих спиртов потребовалось 11,2 л (н. у.) водорода. Определите
массовые доли альдегидов в смеси.
5. Одним
реактивом распознайте растворы глицерина, ацетальдегида и ацетона. Напишите
уравнения соответствующих реакций.
6. Подобно
реакции с водой, альдегиды могут присоединять по двойной связи спирты.
Составьте уравнение реакции уксусного альдегида с метиловым спиртом и поясните
ее на основе электронных представлений.
7. Для
сжигания 24,2 г альдегида потребовалось 30,8 л кислорода (н.у.)
Выведите молекулярную
формулу альдегида и укажите тип гибридизации всех атомов углерода в его
молекуле.
Получение
и применение карбонильных соединений
Многие
ароматические и непредельные альдегиды встречаются в живой природе. Они
содержатся во многих плодах, фруктах, цветах, душистых растениях и придают им
характерный запах. Например: бензальдегид, его
производные найдены в миндале;
3-фенилпропеналь (коричный альдегид),
содержится в корице; 4-гидрокси-3-метоксибензальдегид (ванилин), содержим в
плодах ванили.
Альдегиды,
содержащие 8—12 углеродных атомов, обладают приятным запахом. На этом свойстве
основано их применение в пищевой промышленности и парфюмерии.
Альдегиды получают
синтетическими методами
Общие
методы получения
Окисление спиртов. Из первичных спиртов получают альдегиды.
Например, в промышленности формальдегид получают пропуская через реактор с
раскаленной сеткой из меди или серебра
смесь паров метилового спирта с воздухом:
2СН3ОН
+ О2(воздух) 2НСНО + 2Н2О
Применение.
Из карбонильных соединений наибольшее применение находят формальдегид,
ацетальдегид и ацетон. Формальдегид в виде водного раствора — формалин
— используют для хранения (консервирования) анатомических препаратов, в
сельском хозяйстве для дезинфекции зерно- и овощехранилищ, парников и теплиц,
для протравливания семян, в кожевенном производстве — для обработки кож.
Взаимодействием формальдегида с аммиаком получают уротропин — лекарственный
препарат (используют в качестве мочегонного средства при лечении почечных
заболеваний и др.), его применяют качестве ингибитора кислотной коррозии
металлов.
Однако
основное количество формальдегида идет на производство синтетических
материалов, таких, как полиформальдегид, фенолформальдегидные смолы, из которых
изготовляют электротехнические изделия, различные детали, предметы быта.
Ацетальдегид
находит широкое применение в промышленном органическом синтезе. Он служит
сырьем для получения уксусной кислоты и ее производных, этилового и бутилов
спиртов, синтетических смол и ряда других соединений.
Ацетон
в качестве растворителя применяют в больших количествах в лакокрасочной
промышленности, в производств ацетатного шелка, кинопленки. Он служит исходным
веществом при производстве небьющегося органического стекла.