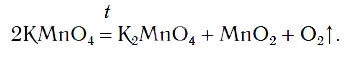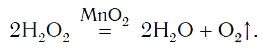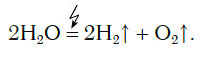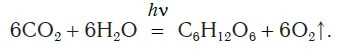В уроке 17 «Получение кислорода» из курса «Химия для чайников» выясним, как получают кислород в лабораторных условиях; узнаем, что такое катализатор, и как растения влияют на производство кислорода на нашей планете.
Наиболее важным для человека и других живых организмов веществом, входящим в состав воздуха, является кислород. Большие количества кислорода используются в промышленности, поэтому важно знать, как можно его получать.
Содержание
- Получение кислорода в лабораторных условиях
- Кислород в природе
- Получение кислорода и азота из воздуха
Получение кислорода в лабораторных условиях
В химической лаборатории кислород можно получать нагреванием некоторых сложных веществ, в состав которых входят атомы кислорода. К числу таких веществ относится вещество KMnO4, которое имеется в вашей домашней аптечке под названием «марганцовка».
Вы знакомы с простейшими приборами для получения газов. Если в один из таких приборов поместить немного порошка KMnO4 и нагреть, то будет выделяться кислород (рис. 76):
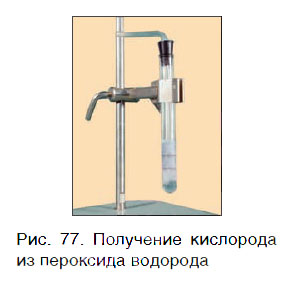
Кислород можно также получить разложением пероксида водорода H2O2. Для этого в пробирку с H2O2 следует добавить очень небольшое количество особого вещества — катализатора — и закрыть пробирку пробкой с газоотводной трубкой (рис. 77).
Для данной реакции катализатором является вещество, формула которого MnO2. При этом протекает следующая химическая реакция:
Обратите внимание на то, что ни в левой, ни в правой частях уравнения формулы катализатора нет. Его формулу принято записывать в уравнении реакции над знаком равенства. Для чего же добавляется катализатор? Процесс разложения H2O2 при комнатных условиях протекает очень медленно. Поэтому для получения заметных количеств кислорода необходимо много времени. Однако эту реакцию можно резко ускорить путем прибавления катализатора.
Катализатор — это вещество, которое ускоряет химическую реакцию, но само в ней не расходуется.
Именно потому, что катализатор не расходуется в реакции, мы не записываем его формулу ни в одной из частей уравнения реакции.
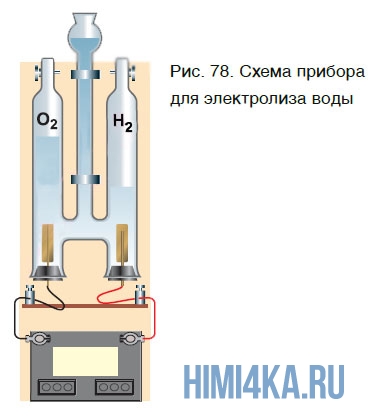
Еще один способ получения кислорода — разложение воды под действием постоянного электрического тока. Этот процесс называется электролизом воды. Получить кислород можно в приборе, схематично изображенном на рисунке 78.
При этом протекает следующая химическая реакция:
Кислород в природе
Огромное количество газообразного кислорода содержится в атмосфере, растворено в водах морей и океанов. Кислород необходим всем живым организмам для дыхания. Без кислорода невозможно было бы получать энергию за счет сжигания различных видов топлива. На эти нужды ежегодно расходуется примерно 2% атмосферного кислорода.
Откуда берется кислород на Земле и почему его количество остается примерно постоянным, несмотря на такой расход? Единственным источником кислорода на нашей планете являются зеленые растения, производящие его под действием солнечного света в процессе фотосинтеза. Это очень сложный процесс, включающий много стадий. В результате фотосинтеза в зеленых частях растений углекислый газ и вода превращаются в глюкозу C6H12O6 и кислород. Суммарное
уравнение реакций, протекающих в процессе фотосинтеза, можно представить следующим образом:
Установлено, что примерно одну десятую часть (11%) производимого зелеными растениями кислорода дают наземные растения, а остальные девять десятых (89%) — водные растения.
Получение кислорода и азота из воздуха
Огромные запасы кислорода в атмосфере позволяют получать и использовать его в различных производствах. В промышленных условиях кислород, азот и некоторые другие газы (аргон, неон) получают из воздуха.
Для этого воздух сначала превращают в жидкость (рис. 79) путем охлаждения до такой низкой температуры, при которой все его компоненты переходят в жидкое агрегатное состояние.
Затем эту жидкость медленно нагревают, в результате чего при разных температурах происходит последовательное выкипание (т. е. переход в газообразное состояние) веществ, которые содержатся в воздухе. Собирая выкипающие при разных температурах газы, по отдельности получают азот, кислород и другие вещества.
Краткие выводы урока:
- В лабораторных условиях кислород получают разложением некоторых сложных веществ, в состав которых входят атомы кислорода.
- Катализатор — вещество, которое ускоряет протекание химической реакции, но само при этом не расходуется.
- Источником кислорода на нашей планете являются зеленые растения, в которых протекает процесс фотосинтеза.
- В промышленности кислород получают из воздуха.
Надеюсь урок 17 «Получение кислорода» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Ученик
(169),
закрыт
7 лет назад
Практическая Логика
Оракул
(58049)
11 лет назад
В настоящее время в промышленности кислород получают из воздуха. Основным промышленным способом получения кислорода, является криогенная ректификация. Также хорошо известны и успешно применяются в промышленности кислородные установки, работающие на основе мембранной технологии.
Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4:
2KMnO4 → K2MnO4 + MnO2 + O2↑;
используют также реакцию каталитического разложения пероксида водорода Н2О2:
2Н2О2 → 2Н2О + О2↑.
Катализатором является диоксид марганца (MnO2) или кусочек сырых овощей (в них содержатся ферменты, ускоряющие разложение пероксида водорода) .
Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3:
2KClO3 → 2KCl + 3O2↑.
К лабораторным способам получения кислорода относится метод электролиза водных растворов щелочей.
Павел Нефёдов
Профи
(565)
11 лет назад
1) Разложение перекиси водорода:
2Н2О2 → 2Н2О + О2↑
2) Разложение марганцовокислого калия:
2KMnO4 → K2MnO4 + MnO2 + O2↑
3) Электролиз воды:
2H20 –> 2H2 + O2
4) Разложение оксида ртути (ll):
2HgO –> 2Hg + O2
Ольга Волкова
Знаток
(268)
3 года назад
1) Разложение перекиси водорода:
2Н2О2 → 2Н2О + О2↑
2) Разложение марганцовокислого калия:
2KMnO4 → K2MnO4 + MnO2 + O2↑
3) Электролиз воды:
2H20 –> 2H2 + O2
4) Разложение оксида ртути (ll):
2HgO –> 2Hg + O2
Запишите уравнения реакций получения кислорода в лаборатории. Каким образом можно: а) собрать кислород в сосуд; б) доказать наличие кислорода в сосуде?
reshalka.com
ГДЗ Химия 8 класс класс Габриелян. §13. Проверьте свои знания. Номер №3
Решение
Запишем уравнения реакций получения кислорода в лаборатории:
2
K
M
n
O
4
=
K
2
M
n
O
4
+
M
n
O
2
+
O
2
↑
2
H
2
O
2
= 2
H
2
O +
O
2
↑
2
K
C
l
O
3
= 2KCl + 3
O
2
↑
а) Кислород собирается в сосуд методом вытеснения воздуха, так как он тяжелее воздуха (32>29).
Рис. 43. Получение кислорода и собирание его методом вытеснения воздуха
б) Доказать наличие кислорода в сосуде можно с помощью тлеющей лучинки, так как кислород поддерживает горение.
Рис. 44. Получение кислорода разложением пероксида водорода и обнаружение с помощью тлеющей лучинки
- В лаборатории кислород получают разложением некоторых кислородсодержащих веществ. Собирают его вытеснением воды или воздуха.
Разложение марганцовки (перманганата калия) при нагревании:
Рис. (1). Разложение перманганата калия
Разложение пероксида водорода в присутствии катализатора:
Рис. (2). Разложение пероксида
водорода
Электролиз воды:
Можно получить кислород и при разложении некоторых других веществ: бертолетовой соли
KClO3
, нитратов
NaNO3
,
KNO3
и т. д.
- В промышленных масштабах кислород получают из воздуха. Для этого воздух при повышенном давлении охлаждают и превращают в жидкость. Затем жидкий воздух нагревают. Сначала выделяется азот (температура кипения (–196) °С). Жидкий кислород остаётся, так как его температура кипения выше ((–183) °С). Хранят жидкий кислород в стальных баллонах голубого цвета.
Применение кислорода
- В металлургической промышленности кислород используется при выплавке чугуна и стали.
- В смеси с водородом или ацетиленом кислород применяется для резки и варки металлов.
- Находит применение кислород в качестве окислителя ракетного топлива.
- Используется он для обеспечения жизнедеятельности на подводных лодках и космических кораблях, при работе водолазов.
- Находит применение в медицине в лечебных целях.
Источники:
Рис. 1. Разложение перманганата калия © ЯКласс
Рис. 2. Разложение пероксида водорода © ЯКласс
1. Какой способ получения кислорода вы будете использовать во время работы? Составьте уравнение соответствующей реакции.
Разложение пероксида водорода.
2H2O2 ->MnO2 2H2O + O2
2. Какие физические свойства кислорода вы обнаружите, выполняя опыт №1 “Получение и собирание кислорода”?
Безцветный газ, без запаха, тяжелее воздуха.
3. Каким образом можно обнаружить кислород в стакане (цилиндре)? На каком свойстве кислорода основан этот способ идентификации?
Тлеющая лучинка вспыхивает. Кислород поддерживает горение.
4. Какие химические свойства кислорода вы исследуете во втором опыте? Составьте уравнения соответствующих реакций.
С+О2 ->СО2
СО2+Са(ОН)2 -> СаСО3+Н2О
5. Сформулируйте цель и выводы к работе.
Цель: Получить кислород при помощи разделения пероксида, изучить свойства кислорода.
Вывод: кислород можно получить при нагревании перекиси водорода в присутствии MnO2, как катализатора. Кислород – газ, который поддерживает горение, при горении образуются оксиды.
Сохраните или поделитесь с одноклассниками: