Специальные предложения по обзорам литературы и статистической обработке
(для статей, кандидатских, докторских, магистерских и PhD диссертаций) для медицинских специалистов из СНГ и ближнего зарубежья!
Инструкция по поиску клинических исследований
Существует два ресурса, чаще всего используемых для поиска клинических исследований, проводимых в Российской Федерации. Первый – официальный реестр Минздрава России www.grls.rosminzdrav.ru». Его преимущество в том, что он на русском языке и содержит список медицинских центров в России, в которых проводится исследование. Второй – www.clinicaltrials.gov– международный реестр клинических исследований Национального института здоровья США. Этот ресурс полезен более подробной и важной информацией об исследованиях как, например, критерии включения, но он ведется на английском языке. Поэтому при поиске клинического исследования мы рекомендуем пользоваться двумя ресурсами параллельно
1. Поиск клинического исследования на сайте grls.rosminzdrav.ru
Шаг 1. Зайдите на сайт www.grls.rosminzdrav.ru. Наведите курсор мышки на кнопку «Главная» в верхнем меню сайта. Появится выпадающее меню, где нужно кликнуть на ссылку «Реестр разрешенных клинических исследований», после чего Вы попадете на страницу поиска.
 клинические исследования — поиск
клинические исследования — поиск
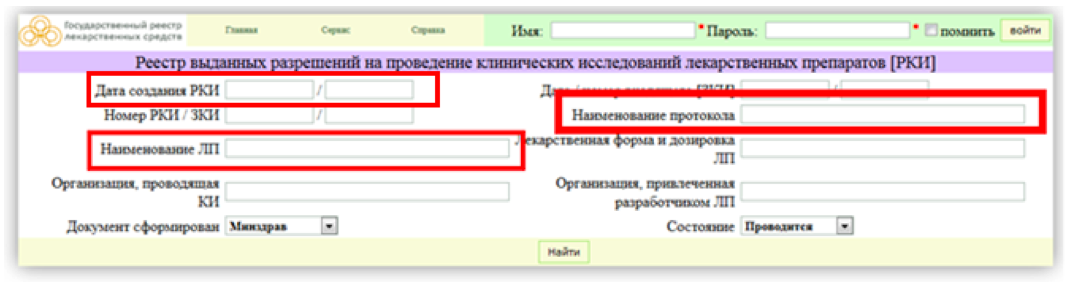
Шаг 2. Основные параметры поиска в «Реестре разрешенных клинических исследований» — «Наименование ЛП» или «Наименование протокола». Это применимо, если Вы знаете данную информацию. Если нет, то мы рекомендуем просмотреть все клинические исследования за последние полгода/год. Для этого введите нужные даты в графу «Дата создания РКИ».
Шаг 3. Если поиск дал результаты и Вам кажется, что Вы нашли подходящее исследование, то следующим шагом нужно попробовать найти информацию о критериях включения, так как это одно из условий того, чтобы стать участником исследования.
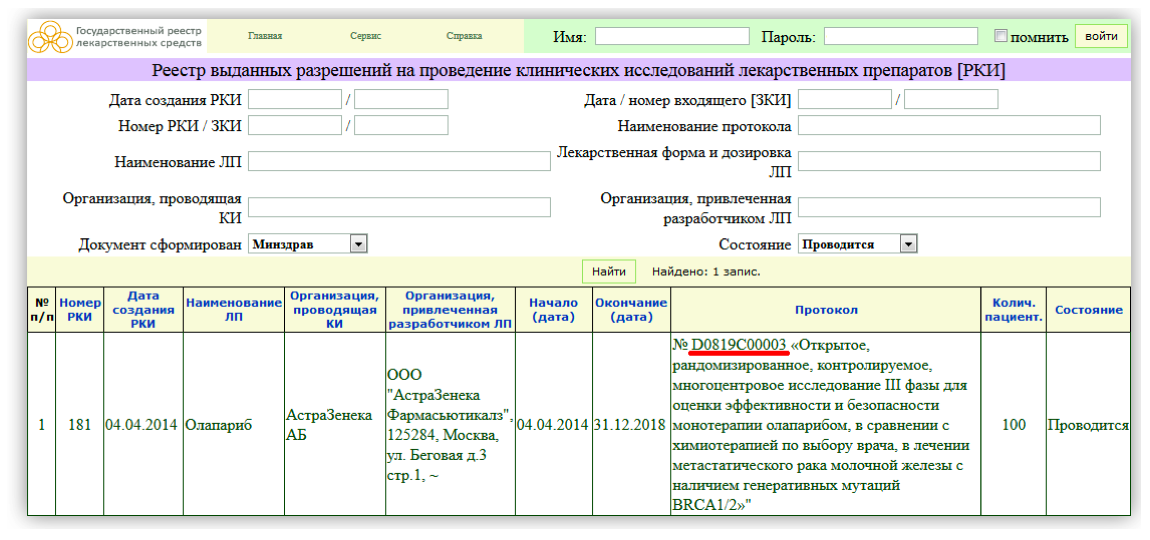
Критерии включения – это те характеристики, при соответствии которым пациент может быть принят в клиническое исследование. В числе таких характеристик могут быть пол, возраст, определенное заболевание, стадия и его длительность, особенности предшествующего лечения и пр.
Эту информацию можно попробовать найти на сайте www.clinicaltrials.gov (см. §2), осуществив поиск по номеру протокола, который указан в графе «Протокол» (ниже на рисунке-примере номер протокола подчеркнут красной линией).
Шаг 4. Обратите отдельное внимание на даты проведения исследования, если оно началось давно, набор пациентов, возможно, уже закрыт. В любом случае, уточнить это Вы можете либо в медицинском центре, либо в компании, организующей исследование.
Шаг 5. Кликнув на строку с исследованием, Вы можете посмотреть список медицинских центров, в которых оно проходит, а также цель клинического исследования, лекарственную форму и дозировку препарата.
2. Поиск на сайте www.clinicaltrials.gov
Данный ресурс дает много возможностей поиска, поэтому рекомендуем пробовать варианты поиска по разным параметрам. Со всеми возможностями поиска Вы можете ознакомиться по ссылке http://www.clinicaltrials.gov/ct2/help/how-find/basic
Ниже описан способ поиска исследования по отдельным критериям.
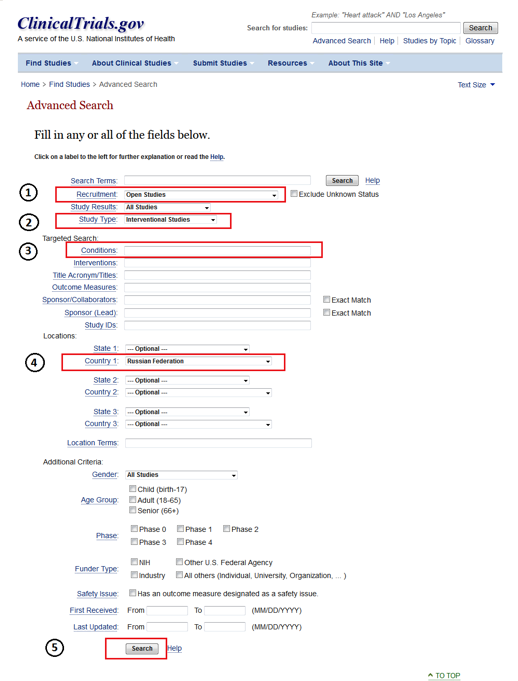
Шаг 1. Зайдите на сайт http://www.clinicaltrials.gov/ и выберете раздел “Advanced search”
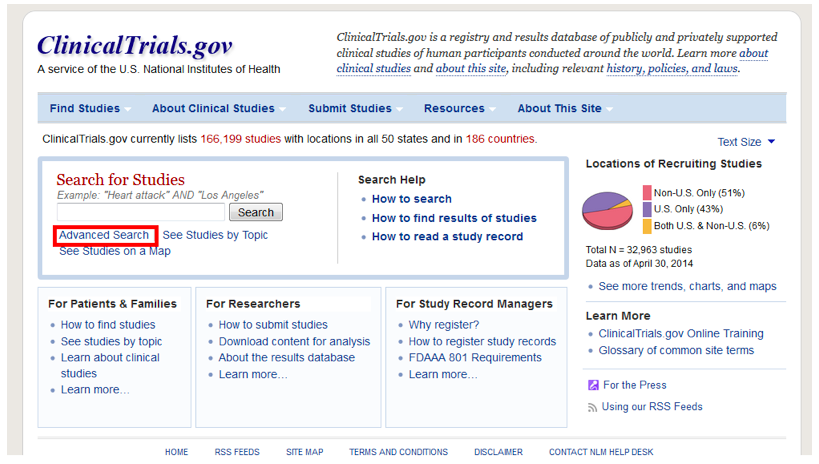
Шаг 2. Далее в разделе “Advanced search” укажите следующую информацию:
- Recruitment – выберите Open studies (исследования, в которых в данный момент уже идет набор пациентов, либо он еще не начался, а также программы расширенного доступа);
- Study Type – выберите Interventional Studies;
- Conditions – диагноз на английском языке;
- Country 1 – Russian Federation (Надо отметить, что Российская Федерация не всегда указана в списке стран, поэтому также рекомендуем повторно осуществить поиск, не указывая страну);
- 5. Search – поиск.
Шаг 3. Если поиск дал результаты, Вы увидите список исследований, подходящих под параметры запроса.
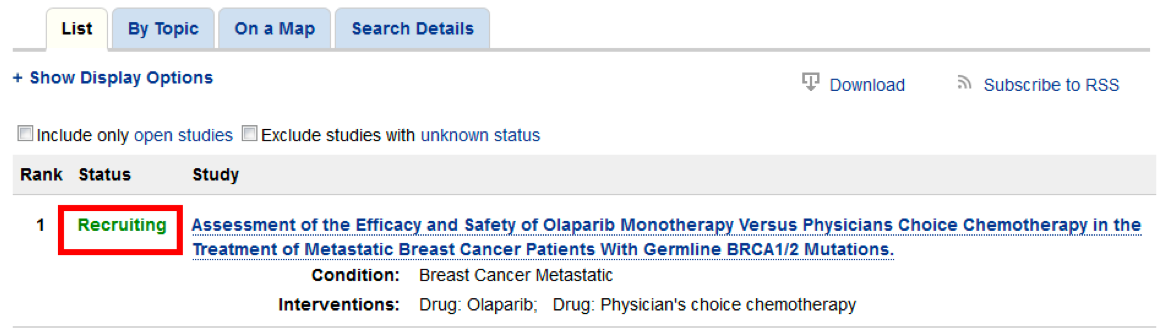
Шаг 4. Вы можете ознакомиться с более подробной информацией, кликнув на строчку с интересующем Вас исследованием.
Обратите особое внимание на следующую информацию:
- Purpose – цель исследования;
- Drug — название лекарственного препарата;
- Eligibility – критерии включения в клиническое исследование.
- Other Study ID Numbers – номера протоколов для идентификации в других реестрах, в том числе для поиска в реестре Минздрава России.
Шаг 5. Если Вам кажется, что Вы нашли походящее клиническое исследование, следующим шагом проверьте, идет ли оно в России. Для этого зайдите на сайт www.grls.rosminzrav.ru и попробуйте найти это исследование в реестре Минздрава России – см. §1.
Исследование можно найти по номеру протокола, указанному в строке «Other Study ID Numbers».
Если в этой строке указано более одного номера протокола, попробуйте поочередный поиск.
Клинические исследования – Россия
Исследований найдено: 13131
Сортировать:
| РКИ № | 271 от 23 мая 2023 г. |
| Препарат: | Кеторолак |
| Разработчик: | Сан Фармасьютикал Индастриз Лтд. |
| Тип: | КИ |
| Фаза: | III |
| Начало: | 23 мая 2023 г. |
| Окончание: | 31 декабря 2025 г. |
| Страна: | Индия |
| CRO: | Представительство компании с ограниченной ответственностью «Сан Фармасьютикал Индастриз Лимитед» (Индия) г. Москва Сокращенное наименование:Представительство компании «Сан Фармасьютикал Индастриз Лимитед» (Индия), 000000, г Москва, г Россия, 107023, г. Москва, ул. Электрозаводская, д. 27, стр. 8, офисы 29, 30, Россия |
| Протокол № | SPIL-KET-2022 |
Оценка эффективности и безопасности применения препарата Кеторолак в сравнении с препаратом Кеторол® для купирования болевого синдрома у пациентов с острым травматическим закрытым повреждением мягких тканей нижних конечностей
подробнее
Проспективное, открытое, рандомизированное, четырехпериодное, с четырьмя последовательностями, репликативное, перекрестное исследование по изучению сравнительной фармакокинетики и биоэквивалентности препаратов Метформин Лонг (МНН: метформин), таблетки с пролонгированным высвобождением, 1000 мг (ООО «Гротекс», Россия) и Глюкофаж® Лонг (МНН: метформин), таблетки с пролонгированным высвобождением, 1000 мг (Мерк Сантэ С.а.С., Франция) у здоровых добровольцев с однократным приемом внутрь натощак и после приема пищи
| РКИ № | 272 от 23 мая 2023 г. |
| Препарат: | Метформин Лонг (SS_612) |
| Разработчик: | ООО “Гротекс” |
| Тип: | КИ |
| Фаза: | Биоэквивалентность |
| Начало: | 23 мая 2023 г. |
| Окончание: | 1 марта 2024 г. |
| Страна: | Россия |
| CRO: | Общество с ограниченной ответственностью “Гротекс”, 195279, г Санкт-Петербург, г Санкт-Петербург, пр-кт Индустриальный, дом 71, корпус 2, литера А, Россия |
| Протокол № | SS_612 |
Оценка сравнительной фармакокинетики и биоэквивалентности препаратов Метформин Лонг и Глюкофаж® Лонг у здоровых добровольцев
подробнее
| РКИ № | 273 от 23 мая 2023 г. |
| Препарат: | Телмисартан |
| Разработчик: | ООО «СитиФарм», Россия |
| Тип: | КИ |
| Фаза: | Биоэквивалентность |
| Начало: | 23 мая 2023 г. |
| Окончание: | 31 декабря 2023 г. |
| Страна: | Россия |
| CRO: | Национальный научный центр исследований и фармаконадзора, 420107, Респ Татарстан, г Казань, ул Островского, дом 67, строение -, корпус -, кв. 304, Россия |
| Протокол № | TEL22 |
Оценка биоэквивалентности препаратов ТЕЛМИСАРТАН и Микардис® у здоровых добровольцев
подробнее
| РКИ № | 274 от 23 мая 2023 г. |
| Препарат: | GP40261 |
| Разработчик: | Общество с ограниченной ответственностью «ГЕРОФАРМ» |
| Тип: | КИ |
| Фаза: | I |
| Начало: | 23 мая 2023 г. |
| Окончание: | 7 марта 2025 г. |
| Страна: | Россия |
| CRO: | Общество с ограниченной ответственностью «ГЕРОФАРМ», 191119, г Санкт-Петербург, г Санкт-Петербург, ул Звенигородская, дом 9, Россия |
| Протокол № | GP40261-P4-01-01 |
Оценка фармакокинетики и фармакодинамики препаратов GP40261 и Люмжев® с использованием метода эугликемического гиперинсулинемического клэмпа на здоровых добровольцах
подробнее
| РКИ № | 268 от 22 мая 2023 г. |
| Препарат: | Палбоциклиб (DT-PLB) |
| Разработчик: | АО “Р-Фарм” |
| Тип: | КИ |
| Фаза: | Биоэквивалентность |
| Начало: | 22 мая 2023 г. |
| Окончание: | 31 декабря 2025 г. |
| Страна: | Россия |
| CRO: | АО “Р-Фарм”, 123154, г Москва, г Москва, ул Берзарина, дом 19, корпус 1, Россия |
| Протокол № | CL011051157 |
Изучение сравнительной фармакокинетики и биоэквивалентности препарата DT-PLB в сравнении с референтным препаратом Итулси® у здоровых добровольцев
подробнее
Открытое, рандомизированное, перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препарата «Итоприд», таблетки, покрытые пленочной оболочкой 50 мг, производитель АО «Производственная фармацевтическая компания Обновление», Россия и «Ганатон®», таблетки, покрытые пленочной оболочкой 50 мг, производитель Майлан ЕПД Г.К., Кацуяма Плант, Япония, у здоровых добровольцев при однократном приеме натощак
| РКИ № | 269 от 22 мая 2023 г. |
| Препарат: | Итоприд |
| Разработчик: | Акционерное общество “Производственная фармацевтическая компания Обновление” |
| Тип: | КИ |
| Фаза: | Биоэквивалентность |
| Начало: | 22 мая 2023 г. |
| Окончание: | 31 декабря 2025 г. |
| Страна: | Россия |
| CRO: | Акционерное общество “Производственная фармацевтическая компания Обновление”, 633621, Новосибирская обл., р-н Сузунский, рп Сузун, ул Комиссара Зятькова, дом 18, Россия |
| Протокол № | ITPRD-01/2023 |
Оценка сравнительной фармакокинетики и биоэквивалентности препарата Итоприд и Ганатон® у здоровых добровольцев
подробнее
| РКИ № | 270 от 22 мая 2023 г. |
| Препарат: | Ленватиниб (DT-LNV) |
| Разработчик: | АО “Р-Фарм” |
| Тип: | КИ |
| Фаза: | Биоэквивалентность |
| Начало: | 22 мая 2023 г. |
| Окончание: | 31 декабря 2025 г. |
| Страна: | Россия |
| CRO: | АО “Р-Фарм”, 123154, г Москва, г Москва, ул Берзарина, дом 19, корпус 1, Россия |
| Протокол № | CL011056162 |
Оценка сравнительной фармакокинетики и биоэквивалентности препарата DT-LNV в сравнении с референтным препаратом Ленвима® у здоровых добровольцев
подробнее
| РКИ № | 267 от 19 мая 2023 г. |
| Препарат: | LOFC00501 |
| Разработчик: | Общество с ограниченной ответственностью “ПРОМОМЕД РУС” |
| Тип: | КИ |
| Фаза: | III |
| Начало: | 19 мая 2023 г. |
| Окончание: | 31 декабря 2024 г. |
| Страна: | Россия |
| CRO: | Общество с ограниченной ответственностью “ПРОМОМЕД РУС”, 129090, г Москва, г Москва, пр-кт Мира, дом 13, строение 1, офис 13, Россия |
| Протокол № | TOC-102022 |
Оценка эффективности, безопасности и иммуногенности лекарственного препарата LOFC00501 у пациентов с умеренной или высокой активностью ревматоидного артрита, имеющих неадекватный ответ на терапию метотрексатом
подробнее
| РКИ № | 266 от 18 мая 2023 г. |
| Препарат: | Клофазимин |
| Разработчик: | ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ “ЭДВАНСД ФАРМАСЬЮТИКАЛС” (ООО “ЭДВАНСД ФАРМА”) |
| Тип: | КИ |
| Фаза: | Биоэквивалентность |
| Начало: | 18 мая 2023 г. |
| Окончание: | 21 декабря 2026 г. |
| Страна: | Россия |
| CRO: | ОБЩЕСТВО С ОГРАНИЧЕННОЙ ОТВЕТСТВЕННОСТЬЮ “ЭДВАНСД ФАРМАСЬЮТИКАЛС” (ООО “ЭДВАНСД ФАРМА”), 308010, Белгородская обл., муниципальный район Белгородский, г.п. поселок Северный, пгт. Северный, ул Березовая, зд. 5, Россия |
| Протокол № | № APH-CFZ-09/2022 |
Оценка сравнительной фармакокинетики и биоэквивалентности препаратов Клофазимин и Лампрен® с участием здоровых добровольцев
подробнее
Открытое, рандомизированное, перекрестное исследование сравнительной фармакокинетики и биоэквивалентности препарата «Адеметионин», таблетки, покрытые кишечнорастворимой оболочкой 400 мг, производитель АО «Производственная фармацевтическая компания Обновление», Россия и «Гептрал®», таблетки, покрытые кишечнорастворимой оболочкой 400 мг, производитель ЭббВи С.р.Л., Италия, у здоровых добровольцев при однократном приеме натощак
| РКИ № | 265 от 15 мая 2023 г. |
| Препарат: | Адеметионин |
| Разработчик: | Акционерное общество “Производственная фармацевтическая компания Обновление”(АО “ПФК Обновление”) |
| Тип: | КИ |
| Фаза: | Биоэквивалентность |
| Начало: | 15 мая 2023 г. |
| Окончание: | 31 декабря 2024 г. |
| Страна: | Россия |
| CRO: | Акционерное общество “Производственная фармацевтическая компания Обновление”, 633621, Новосибирская обл., р-н Сузунский, рп Сузун, ул Комиссара Зятькова, дом 18, Россия |
| Протокол № | ADMTN-07/2022 |
Оценка сравнительной фармакокинетики и биоэквивалентности препарата Адеметионин и Гептрал® у здоровых добровольцев
подробнее
Давайте разберемся, что такое клиническое исследование, какие фазы у него бывают, как найти клиническое исследование и понять, что оно вам подходит. Знание ответов на эти вопросы сможет помочь вам чувствовать себя увереннее при принятии решения о том, следует ли принять участие в одном из них.
Что такое клинические исследования?
Клинические исследования (КИ) представляют собой исследования новых лекарственных препаратов, а также новых способов предотвращения, выявления или лечения болезней с использованием людей-добровольцев. Когда новое лекарство изучается, то обычно неизвестно будет ли оно полезным, вредным или не будет отличаться от уже существующих альтернатив. Задачей клинического исследования является определение того эффективен или нет изучаемый препарат, а также является ли новый способ лечения безопасным.
Кто проводит клинические исследования?
КИ финансируются или спонсируются различными организациями. Чаще всего в качестве спонсоров выступают фармацевтические компании – разработчики лекарственных препаратов, но в этой роли могут выступать и врачи, фонды, медицинские учреждения, общественные группы.
Исследователем является врач или группа врачей клинических центров, где разрешено проведение исследования. Также в проведении КИ принимает участие исследовательская группа, которая может включать врачей, медсестер, социальных работников и других специалистов в области здравоохранения.
Зачем участвовать в клинических исследованиях?
Люди принимают участие в КИ по разным причинам. Для кого-то мотивом к участию в исследовании является возможность внести свой вклад в развитие новых методов лечения и, таким образом, помочь другим людям выздороветь.
Большинство людей со сложными продолжительными заболеваниями считают, что КИ – это возможность получать лучшее лечение, дающее надежду на излечение тогда, когда существующие методы терпят неудачу. Благодаря участию в КИ пациенты получают бесплатный доступ к инновационным и еще не зарегистрированным лекарственным средствам, современной диагностике по мировым стандартам и наблюдению у высококвалифицированных специалистов и дополнительной медицинской помощи.
Кто может принять участие в клинических исследованиях?
КИ проводятся в соответствии с планом, известным как протокол. Каждое КИ имеет специфические требования для того, кто может участвовать, и все они перечислены в протоколе.
Одна из причин того, что вас не допускают до участия в КИ, может быть в несоответствии набора критериев, по которым подбираются участники клинических исследований.
Факторы, которые позволяют кому-то принять участие в клиническом испытании, называются «критериями включения». Те, которые исключают из участников или не допускают их участия, называются «критериями исключения». Эти критерии основаны на таких факторах, как возраст, пол, тип заболевания, его стадия, предшествующая история лечения и других заболеваний.
Фазы клинических исследований
Сначала в лабораториях проводятся доклинические исследования, в которых лекарства тестируются на клетках и на животных. Затем, наиболее перспективные экспериментальные препараты допускаются на стадию КИ, которые проводятся в несколько этапов (фаз). Если исследуемый препарат показывает хорошие результаты на текущей фазе исследования, то только в этом случае он переходит на следующую.
Каждая фаза предназначена для ответа на определенные вопросы. Знание фазы интересующего вас КИ является важным, поскольку дает вам некоторое представление о том, как много известно о изучаемом препарате или методе лечения. Свои плюсы и минусы есть в каждой фазе клинических испытаний.
Фаза I. Первый опыт применения экспериментального препарата у человека. КИ в этой фазе включает обычно небольшое число участников – от 20 до 80.
Основная цель I фазы – найти самую высокую дозу нового лекарства, которую может применять безопасно без серьезных побочных эффектов. Первые участники КИ обычно получают низкую дозу препарата и находятся под тщательным наблюдением. Если после приема препарата есть только незначительная токсичность, следующие несколько участников могут получить более высокую дозу. Этот процесс продолжается до тех пор, пока врачи не сочтут дозу эффективной и имеющей приемлемый уровень токсичности.
Из-за небольшого числа участников в исследованиях фазы I, редкие побочные эффекты могут быть не выявлены.
В целом, КИ данной фазы имеют наибольший потенциальный риск.
Фаза II. Если новый препарат оказывается достаточно безопасным в фазе I КИ, то далее открывают фазу II, чтобы выяснить, работает ли он.
Для тестирования препарата набирается группа от 100 до 300 участников. Исследуется эффективность препарата при определенном заболевании, изучается фармакокинетика препарата. Также продолжается проверка безопасности препарата. Как правило, все участники получают препарат в одинаковой дозе, установленной во время фазы I.
Фаза III. Если достаточное количество пациентов получает пользу от лечения новым лекарством или методом, и побочные эффекты не так уж плохи, переходят к фазе III КИ. В этой фазе препарат исследуют с привлечением большого количество пациентов, по крайней мере, нескольких сотен, чтобы на представительной группе больных подтвердить его эффективность при конкретном заболевании, а также выявить редкие побочные действия и сравнить безопасность и эффективность нового лечения со стандартным лечением.
Так как врачи пока не знают, какое лечение лучше, участники исследования часто выбираются в произвольном порядке (так называемая рандомизация), чтобы получить либо стандартное лечение, либо новое лечение. Когда это возможно, ни врач, ни пациент не знает, какой из методов лечения пациент получает. Этот тип исследования называется двойное слепое исследование.
Проводится III фаза, как правило, в виде международных многоцентровых исследований, в которых участвуют пациенты разных стран.
Данные, полученные в клинических испытаниях III фазы, являются основой для создания инструкции по применению препарата.
Если препарат успешно проходит испытания в первых трёх фазах, он получает регистрационное удостоверение.
Фаза IV проводится после начала продажи препарата. В этой фазе КИ проводятся с целью выявления и оценки долгосрочных последствий применения нового препарата для большого числа пациентов, например, как он взаимодействует с другими лекарственными веществами, как его эффекты проявляются у следующих поколений. Сведения полученные в IV фазе исследования могут способствовать тому, что препарат будет выведен с рынка или на его использование будут введены ограничения.
Это самая безопасная фаза КИ, потому что исследуемый препарат уже хорошо изучен и его использовали тысячи людей.
Каковы возможные риски участников клинических исследований?
Добровольцы в клинических испытаниях участвуют в разработке медицинских методов лечения, которые могут предложить лучшие виды лечения и даже излечения жизнеугрожающих и хронических заболеваний. Тем не менее, участие в КИ связано с потенциальными рисками:
- новый метод лечение может оказаться для вас неэффективным;
- побочные эффекты могут быть более серьезными, чем при стандартном лечении;
- могут потребоваться более частые тесты и визиты к врачу, чем при лечении вне протокола. Это означает поездки в клинику, дополнительные анализы и обследования, более длительное пребывание в стационаре.
Как искать клинические исследования?
Так как не всегда лечащий врач в курсе ведущихся КИ по вашему заболеванию, то вы имеете право получить второе мнение или искать КИ самостоятельно.
Чаще всего КИ проводятся в крупных онкологических центрах, больницах или клиниках. Поэтому на первом этапе поиска разумно обратиться в ведущие центры по заболеванию вашего профиля.
Если в доступных заведениях нет подходящего КИ, то вы можете искать его на сайтах соответствующей тематики. Так информация обо всех клинических исследованиях, осуществляемых в Российской Федерации, размещена на сайте Минздрава России.
.
Крупный ресурс www.clinicaltrials.gov предлагает детальную информацию обо всем, что касается участия в клинических испытаниях по всему миру. Также имеется крупный портал по поиску КИ на сайте ВОЗ.
Используя эти ресурсы, можно почти всегда подобрать КИ. К сожалению, набор в подходящее вам КИ не всегда будет проводиться в вашем городе или даже в вашей стране. Однако существует возможность принять участие в КИ бесплатно в других странах.
Для этого, подобрав, например, на www.clinicaltrials.gov КИ, представляющее для вас интерес, необходимо написать или позвонить тем людям, которые указаны в контактной информации к КИ. Таким образом, вы узнаете, ведется ли еще набор в КИ, какие документы нужно выслать для того, чтоб оценить подходите ли вы под критерии отбора и другие дополнительные условия.
Поскольку пациент не всегда соответствует критериям включения/исключения КИ, то лучше всего подбирать сразу несколько КИ – списываться с разными клиниками в разных странах, пытаться стать кандидатом на участие в разных КИ.
Платно ли для пациента участие в КИ?
Пациент ничего не платит за доступ к препарату, изучаемому в исследовании. Также все обследования, анализы и дополнительные лекарства предусмотренные протоколом КИ, оплачиваются спонсором исследования.
Однако стоит учитывать, что при участии в КИ, возможно, вам придется оплачивать транспортные расходы, жилье, визы и дополнительные исследования или медикаменты, не входящие в стоимость исследования.
Платят ли пациентам за участие в исследование?
Обычно оплачивается только участие в исследованиях I фазы, когда препарат исследуется на здоровых добровольцах. На других стадиях материальный стимул исключается, чтобы решение об участии было действительно добровольным и независимым.
В некоторых исследованиях может быть предусмотрена оплата участникам расходов на парковку, транспорт и питание.
Если участник получит какую-то оплату или компенсацию за участие в КИ, то об этом обязательно будет написано в информированном согласии.
Личный опыт
Ольга А.:
Мне в 2011 г. поставили диагноз Лимфома Ходжкина. Я начала лечение по стандартному протоколу для данного заболевания, но он не дал успеха. Дальнейшее лечение, по международным схемам химиотерапий второй линии, тоже не было достаточно результативным. Потому я стала искать в интернете новейшие методы лечения, которые еще только разрабатываются, и выяснила, что в Германии изучается новый препарат AFM-13. Главный исследователь по этому КИ в униклинике Вюрцбурга, изучив мои медицинские документы, сказал, что я подхожу под требования включения и предложил мне принять участие в исследовании этого препарата. Взвесив за и против, и изучив информированное согласие, я решилась на этот шаг. Мне обеспечили бесплатное лечение и наблюдение у ведущих врачей униклиники, кроме того, спонсор КИ оплатил мой переезд к месту КИ и проживание в Вюрцбурге на все время проведения исследования. Я платила только за предварительное медобследование до включения в КИ и койко-место в палате.
Во время КИ врачи вели за мной регулярное и тщательное наблюдение, приходилось сдавать очень много анализов крови. В начале получения препарата – каждый день, что было немного утомительно. Но это неудобство компенсировалось дружелюбием и оптимизмом всей команды специалистов КИ и работников клиники.
В ходе проведения КИ контрольное обследование показало отсутствие улучшений в течении моего заболевания. Это позволило врачам заподозрить, что проблема не в эффективности препарата, а в диагнозе. И они оказались правы, лимфома у меня изменилась и требовала совсем другого лечения. В итоге, нужное лечение я смогла получить вне рамок КИ и вышла в ремиссию.
Мое мнение, что участие в КИ – это возможность получить доступ к наблюдению и обследованию у специалистов высокого уровня, а также внести свой вклад в изучение лекарства, которое может помочь в будущем другим людям, болеющим таким же заболеванием.
Ольга Ш.:
С 2004 года мне официально поставили диагноз лимфогранулематоз. Лечение первой линии, второй линии, облучение, трансплантация собственного костного мозга не вводило в долгосрочную ремиссию. После того, как мои лечащие врачи не смогли мне больше предложить лечение, я стала искать альтернативные варианты. Совершенно случайно мне предложили участие в клинических исследованиях нового препарата для борьбы с моим заболеванием. Лечение проходило в Италии. Спонсор оплачивал препарат и все медицинские манипуляции. От меня требовалось лишь за свой счет прибыть в клинику и самостоятельно снимать жилье.
Прежде чем отправиться в Италию, я разместила просьбу о поиске жилья и переводчика на сайте «Русские в Италии». Было много советов. Почти сразу откликнулись семья – мама с дочкой – они готовы были меня приютить и помочь с переводом, за небольшую сумму денег.
В назначенную дату я прибыла в больницу, сдала все необходимые анализы (кровь, ПЭТ) и договорились о госпитализации в клинику на следующий день. Лечение подразумевало в себе однократное внутривенное введение препарата. Через неделю меня отпустили домой, с условием, что через месяц я должна прибыть на обследование. В общей сложности я 1,5 года участвовала в данном КИ, получив 3 курса лекарства. Эффект от лечения был явно положительный. Однако в конечном итоге спонсор перестал финансировать КИ из-за кризиса.
Если вы сталкивались с клиническими исследованиями, поделитесь, пожалуйста, с другими своим опытом в комментариях.
Прежде чем попасть к пациентам, любой лекарственный препарат проходит многоступенчатую процедуру исследований. Отбор проводится жёсткий: более 90% лекарств не получают государственную регистрацию, которую оформляет специальный департамент Минздрава РФ, и не попадают на рынок. При этом процедура регистрации одинакова как зарубежных, так и для отечественных лекарств. Производитель должен убедительно доказать, что новое средство эффективнее и безопаснее, чем предыдущие аналоги.
Внедрение новых методов терапии также строго регламентировано. Инновационные способы лечения также не включаются в терапевтические стандарты до тех пор, пока исследователи не накопят достаточный объём положительной статистики.
Заключительная стадия исследований подразумевает участие в клинических испытаниях людей, имеющих соответствующий диагноз.
Рассказываем, как проводятся исследования лекарств, предназначенных для лечения онкологических заболеваний и какие преимущества получают пациенты, участвующие в исследовательских программах.
Что такое клинические исследования?

Рис.1 Исследование
Ещё сто лет назад медицину называли искусством, точность постановки диагноза и эффективность лечения почти полностью зависела от одарённости доктора. Сегодня медицина превратилась в строгую науку, по точности практически не уступающую математике. Большое значение придаётся статистике: медики должны использовать только те методы и препараты, которые имеют минимальную вероятность возникновения случайных эффектов и результатов.
Клинические испытания — один из ключевых инструментов доказательной медицины. Это научное исследование лекарственных препаратов, а также новых методов диагностики и терапии, которое осуществляется при участии людей в качестве испытуемых.
Цель исследований — определение эффективности и безопасности нового средства или расширение списка показаний для уже зарегистрированного лекарства.
Важно отметить, что официальные исследования, проводимые при участии пациентов, не имеют ничего общего с негативно окрашенным понятием «эксперименты на людях».
Строгий протокол и комитет по этике

Рис.2 Исследование крови
Процедура клинических исследований проводится в соответствии с международным стандартом Good Clinical Practice (Надлежащая Клиническая Практика). GCP регламентирует каждый этап исследований, определяет необходимый уровень квалификации исследователей и предъявляет строгие требования к планированию, осуществлению, документальному оформлению результатов. Соблюдение стандарта — гарантия безопасности и благополучия субъектов (участников) исследования.
За правильным выполнением КИ следят Росздравнадзор и Департамент регулирования обращения лекарственных средств.
Заявка на проведение клинических исследований включает ряд документов, перечисленных в статье № 39 ФЗ «Об обращении лекарственных средств» (редакция от 01.03.2023):
- сведения о квалификации и достаточном опыте работы исследователей по соответствующим специальностям;
- сведения о медицинских организациях, на базе которых будет проводиться исследование;
- документ от производителя лекарственного средства с указанием состава, характеристик, способа применения препарата (в случае испытаний нового метода терапии даётся его подробное описание);
- брошюра исследователя — краткое изложение доклинических и клинических данных, которые важны для дальнейших испытаний с участием людей.
Кроме того, исследователям необходимо получить заключение Комитета по этике — независимой группы, состоящей из врачей, учёных, представителей общественности. Комитет изучает полный пакет документов, включая информированные согласия пациентов, чтобы удостовериться, что ничьи права не нарушены. В обязанности членов Комитета входит постоянный контроль за проведением процедур, осуществляемый на протяжении всего периода испытаний.
Доклинические исследования

Рис.3 Исследования препаратов на животных
Сначала появляется идея. В области онкологических заболеваний исследования начинаются с обнаружения «слабых мест» развития опухоли. Методы лечения онкологии построены на различных принципах:
- замедление процесса деления раковых клеток;
- предохранение соседних клеток от перерождения в злокачественные формы;
- блокировка роста сосудов, обеспечивающих питание опухоли;
- активизация определённых механизмов иммунной системы, помогающих организму бороться с опухолью.
Первичные испытания новых веществ или методик проводятся in vitro и/или in silicio, то есть, в лабораторных условиях, а также при помощи компьютерного моделирования.
Пример: лучевая терапия. Самый старый способ лучевого лечения — брахитерапия, введение радиоактивного раствора непосредственно в ткани. Со временем опыты показали, что в ряде случаев (при поражении кожи, слизистых оболочек) эффективнее использовать внешние источники излучения. Внутриполостная лучевая терапия, когда источник излучения вводят в организм пациента, применяется для разрушения опухолей пищевода, матки, мочевого пузыря и других полостных новообразований.
Если исследования in vitro показывают многообещающие результаты, учёные приступают к следующему этапу проверки — тестированию препарата/метода на животных (in vivo). Исследователям необходимо проверить, как новый способ лечения влияет на организм млекопитающих. Значимые факторы:
- уровень токсичного воздействия на ткани и органы;
- наличие и характер аллергических реакций;
- влияние на репродуктивную систему;
- скорость всасывания, роста концентрации в крови, выведения активного вещества.
Эти и другие данные показывают, можно ли использовать препарат для лечения людей, превышает ли польза от его применения потенциальный вред.
После проверки этического комитета и одобрения заявки исследования переходят в стадию клинических испытаний.
Фазы клинических исследований при участии людей

Рис.4 Фазы клинических исследований
Клинический этап испытаний длится годами и даже десятилетиями — это позволяет накопить надёжную медицинскую статистику. При подтверждённых благоприятных результатах испытаний препарат поступает в массовое производства и включается в стандарты лечения онкологических заболеваний.
Последовательность испытаний вещества или метода терапии при участии людей:
- Первая фаза — оценка безопасности лекарственной формулы. Препарат впервые вводится в человеческий организм. Исследование позволяет получить данные о фармакодинамике и фармакокинетике, распределении вещества в организме, накоплении его в тканях, путях выведения. Набор участников первой фазы ограничивается группой в 20–30 человек. При успешном прохождении испытаний учёные переходят к расширенному опыту.
- Вторая фаза — проверка эффективности в группе пациентов численностью от нескольких десятков до нескольких сотен человек. Исследователи проверяют, эффективна ли формула для лечения целевых заболеваний, регистрируют побочные действия, определяют дозировку и оптимальные схемы лечения.
- Третья фаза — самый масштабный этап клинических исследований, участие в нём могут принимать сотни врачей и тысячи пациентов. Цель испытания — доказать, что новое средство эффективнее стандартной терапии, выявить соотношение вреда и пользы в длительном наблюдении за пациентами, выработать меры предосторожности и определить способы реабилитации больных. По завершении третьей фазы исследователь может подать заявку на получение регистрационного удостоверения для нового метода терапии.
- Четвёртая фаза — это исследование, которое продолжается после одобрения препарата (комбинации препаратов) Минздравом. Производители изучают эффективность и безопасность препарата в долгосрочной перспективе. В идеале мониторинг должен включать несколько поколений, поэтому можно сказать, что на сегодняшний день нет ни одного препарата, который полностью прошёл все четыре фазы исследований. Тем не менее формулы доказали свою эффективность и успешно применяются для лечения различных типов онкологии.
Для чистоты результатов исследование может быть «слепым» — пациент не знает, какой именно препарат ему необходимо принимать в рамках испытаний. «Двойное слепое» исследование подразумевает, что лечащий врач тоже не знает, что представляет из себя новое вещество и какой эффект должно оказывать. Это позволяет избежать ситуаций, когда участники невольно «подгоняют» объективные данные под ожидаемый результат.
При рандомизированном исследовании пациенты распределяются на группы в зависимости от возраста, пола, стадии заболевания и других факторов. Участники получают разное лечение — стандартное, новое или плацебо (таблетки без действующего вещества).
Эталоном КИ считается рандомизированное, плацебо-контролируемое двойное слепое исследование, в рамках которого рандомизация осуществляется тайно для всех участников (и медиков, и пациентов).
Какую пользу может принести пациенту участие в клинических исследованиях онкологии?

Рис.5 Исследование меланомы
Люди принимают участие в клинических испытаниях по разным причинам: кому-то не помогают стандартные схемы лечения, кто-то столкнулся с рецидивом и разочаровался в традиционной терапии. Для многих участников главной мотивацией становится возможность внести свой вклад в важное дело, помочь тысячам таких же пациентов.
Клинические исследования спроектированы таким образом, чтобы принести максимальную пользу всем участникам проекта. Участие в исследованиях имеет немало важных преимуществ.
Доступность инновационных препаратов

Рис.6 Инновационные препараты
Несмотря на работающую систему ОМС, объём бесплатной помощи, на которую могут рассчитывать пациенты с онкологическими заболеваниями, различается от региона к региону. Доступность методик и видов терапии зависит от размеров финансирования, качества медицинских кадров, наличия достаточной медицинской базы (стационаров, лабораторий, аппаратуры).
Иногда возникают перебои с поставками иностранных препаратов. Аптеки отменяют уже сформированные заказы из-за отсутствия лекарства, врачи выписывают рецепты на аналоги с тем же действующим веществом, но другой формулой или формой выпуска препарата.
Кроме того, зарубежные препараты поступают на российский рынок с опозданием в два-три года, даже если они успешно прошли три необходимые фазы стандартных исследований в Израиле, Канаде или США и уже используются в мировой медицине. В России препарат будет зарегистрирован только после дополнительных испытаний.
Пример: любое противоопухолевое средство широкого спектра действия, такое, как израильский препарат Methotrexat «Ebewe». Лекарство имеет внушительный список показаний: различные лимфомы, бластомы, лейкозы, тяжёлые формы псориаза и артрита. Допустим, на территории РФ официально подтверждена эффективность только при половине возможных диагнозов. Значит, препарат будет рекомендован только для этих форм заболеваний. Например, пациент с ревматоидным артритом получит бесплатное лечение импортным метотрексатом по ОМС, а больной с ювенильным артритом — нет.
Статистика показывает, что время имеет решающее значение при многих видах онкологии. Например, при раке лёгкого оптимальный промежуток между постановкой диагноза и началом терапии составляет 8 недель. Чем дольше откладывается начало лечения, тем хуже прогноз.
Участники клинических исследований своевременно получают новейшие препараты, которые уже подтвердили свою эффективность на начальных этапах испытаний, но ещё долго не поступят в аптеки.
Тщательный контроль и безопасность

Рис.7 Анализ крови
В рамках клинического исследования врачи тщательно наблюдают за состоянием каждого пациента. Уровень контроля обычно значительно выше, чем при стандартном лечении в клинике: во-первых, исследователи заинтересованы в получении как можно более детальной картины по каждому пациенту, во-вторых, врач несёт дополнительную ответственность перед компанией-спонсором исследований.
Клиническое испытание — идеально смоделированный проект, в рамках которого все медицинские манипуляции проводятся вовремя. Пациенты получают необходимые виды обследований и лечение в строго соблюдаемые сроки, без очередей, сбора направлений и прочих проволочек. Каждое нарушение графика может исказить результаты, что совсем не в интересах исследователей.
Потенциальные риски применения нового препарата выявляются ещё на стадии доклинических исследований — все они внесены в протокол КИ. Меры по устранению нежелательных последствий терапии разрабатываются заранее. Лекарственные средства хранятся в строжайшем соответствии с правилами: при оптимальной температуре, без доступа света и т. п.
Клиника, на базе которой проводится исследование, имеет отделение реанимации, собственную лабораторию, специальные помещения для хранения документации, препаратов, инструментов. Уход за пациентами осуществляют сертифицированные медсёстры.
Таким образом, врачебная группа имеет возможность обеспечить максимальную безопасность для участников исследования.
Бесплатное лечение и компенсация рисков
Поскольку лечение экспериментальное, нельзя дать абсолютную гарантию, что здоровью пациента не будет причинён тот или иной вред. Ведь одной из задач исследований как раз и является выявление возможных побочных эффектов терапии.
Возможные риски подробно отражены в форме информированного согласия, которое каждый участник подписывает перед заключением договора. Кроме того, компания, проводящая исследования, обязана оформить страховой полис на каждого участника: в случае причинения вреда здоровью пациент получит денежную компенсацию от страховой компании.
Участие в испытаниях подразумевает бесплатное лечение, включающее основную, дополнительную, неотложную или симптоматическую лекарственную терапию, а также выполнение необходимых процедур, анализов, инструментальных обследований.
Когда это необходимо, инициаторы проекта оплачивают участникам проезд до медицинского учреждения, проживание рядом с клиникой, компенсируют другие расходы. Если пациент нуждается в помощи или не достиг взрослого возраста, компенсация распространяется на расходы сопровождающего лица. По условиям договора вознаграждение за участие в клиническом исследовании оплачивается отдельно от компенсации сопутствующих расходов.
Как принять участие в клинических исследованиях?

Рис.8 Исследование
Право на проведение исследовательской деятельности получают только те учреждения, которые способны обеспечить полное соответствие стандартам GCP. Соответственно, большинство проектов реализуются на базе медицинских центров, расположенных в крупных городах.
Многие люди просто не знают, что у них есть шанс получить бесплатное и своевременное лечение в рамках клинического исследования.
Информацию о проводимых на территории РФ исследованиях можно получить на официальном сайте Минздрава. Российское общество клинической онкологии также ведёт реестр актуальных исследовательских проектов в области медицины. Возможность участия в клиническом исследовании следует обсудить со своим лечащим врачом. Закажите бесплатную консультацию специалистов по справочнику препаратов из Израиля на сайте Pharm Atlas.
Где проводятся клинические исследования и как я могу получить информацию об исследованиях, в которых я могу принять участие?

Наиболее часто, клинические исследования проводятся по заказу и на средства фармацевтических компаний, которые производят исследуемый препарат. Для того, чтобы быстро и эффективно провести исследование, компании производители заинтересованы в как можно более коротких сроках набора пациентов для участия (ведь процесс наблюдения за ними для получения результатов может занимать годы) и качественном проведении исследования с соблюдением требований протокола.
Соответственно, фармацевтические компании или нанятые ими организации проводят исследования в тех клиниках и центрах, где имеется большое количество пациентов с интересующими их заболеваниями и где есть высококвалифицированные врачи-специалисты, обладающие необходимыми навыками и опытом. Из этого следует, что наибольшее количество исследований проводится в крупных клиниках, например федеральных и региональных научно-исследовательских центрах.
Обратитесь с вопросом к Вашему лечащему врачу, узнайте, проходят ли какие-либо клинические исследования в том лечебном учреждении, где вы проходите лечение в настоящий момент. Если в Вашей клинике или городе не проводятся исследования, в которых Вы могли бы принять участие, Вы можете самостоятельно обратиться в какое-либо другое лечебное учреждение.
Все клинические исследования, проходящие в мире, регистрируются на веб-сайте
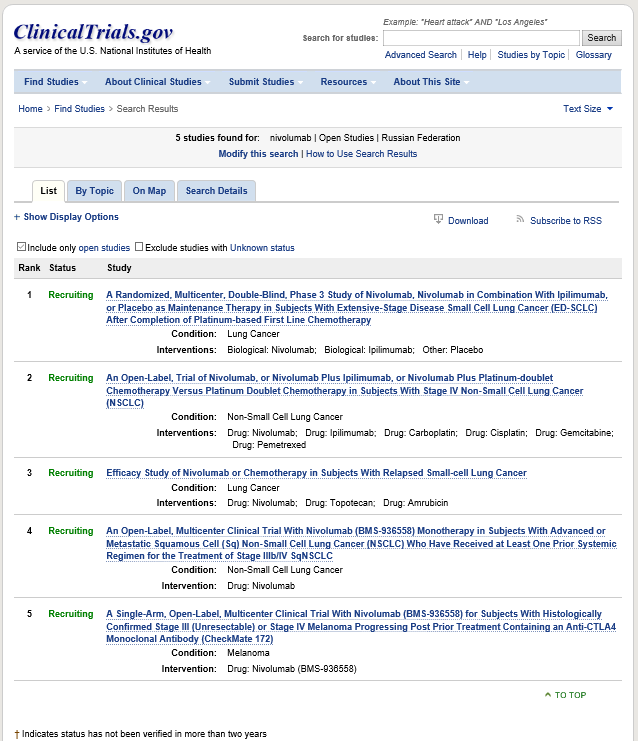
ссылка. К сожалению, доступна только англоязычная версия данного сайта. На этом сайте Вы сможете найти интересующие Вас исследования и получить информацию о критериях включения и исключения, а также центрах, в которых они проводятся, в том числе – в России. В качестве примера на иллюстрации ниже представлены все исследования, зарегистрированные на данном сайте, в которые производится набор больных для иммунотерапевтического препарата ниволумаб.
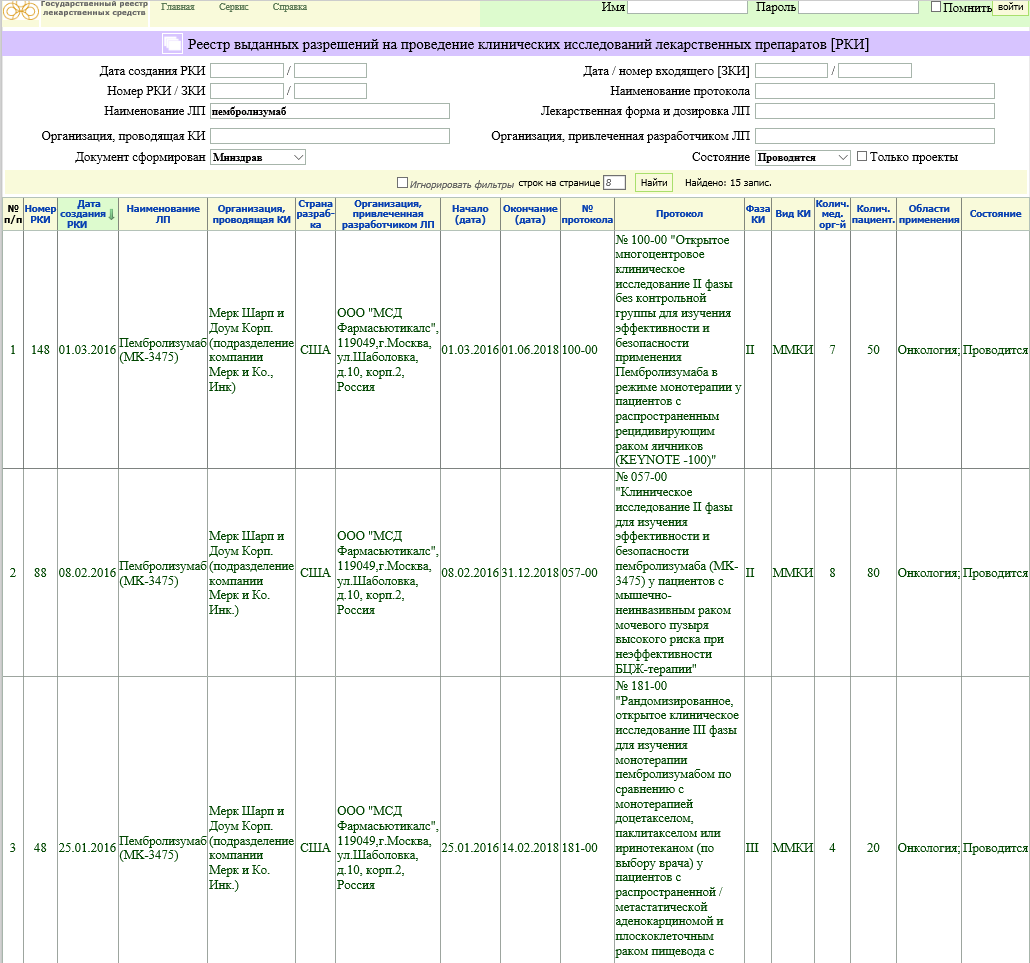
На территории Российской Федерации создан и функционирует собственный реестр клинических исследований. Все исследования, одобренные к проведению в России в обязательном порядке регистрируются на сайте Министерства Здравоохранения (
ссылка) и фиксируются в Реестре выданных разрешений на проведение клинических исследований лекарственных препаратов, доступному по адресу
ссылка. На этом портале возможно искать идущие в настоящее время и завершенные клинические исследования по дате их создания, названию лекарственного препарата, организации, проводящей исследование или по названию протокола. После выбора интересующего исследования можно увидеть список лечебных учреждений, которые участвуют в его проведении и их адреса. Дизайн сайта на примере поиска исследований по препарату пембролизумаб представлен на иллюстрации ниже.