Понятие
“активность” введено в науку для того,
чтобы законы, сформулированные для
идеальных систем, были применимы к
(неидеальным) реальным системам.
Подстановка величин активности вместо
молярных концентраций в уравнение
закона действия масс делает эти уравнения
применимыми к нёидеальным (реальным)
системам. Например, для обратимой реакции
А + В↔С + D после замены молярных
концентраций их активностями получим;
K
= aC
· a
D
/ aA
· aB
или,
заменив активности их значениями а
= с f,
будем иметь:
Kравн
= cC
· γC
· cD
·γD
/ cA
· γA
· cB
·γB
Точно
так же при замене в уравнениях констант
ионизации равновесных концентраций
активностями ионов получаются уравнения,
справедливые в отношении растворов
сильных электролитов, концентрированных
растворов слабых электролитов и растворов
слабых электролитов в присутствии
сильных электролитов.
Константы
электролитической ионизации, определяемые
с помощью активностей, называются
истинными или термодинамическими
константами электролитической ионизации.
Величины термодинамических констант
не зависят от концентрации растворов
и потому подчиняются закону действия
масс.
Пользуясь
величинами термодинамических констант,
можно находить активности ионов в
растворе и решать ряд других задач,
например находить рН и рОН растворов и
т. д.
Пример
5. Вычислить
активность ионов водорода в растворе,
содержащем в 1 л 0,1 моль
уксусной кислоты и 0,2 моль
натрия ацетата, если термодинамическая
константа ионизации уксусной кислоты
Kа(СН3СООН)
=1,74·10-5.
Решение.
1.
Из уравнения термодинамической константы
ионизации уксусной кислоты :

Находим активность
ионов водорода:

2.
Коэффициент активности недиссоциированных
молекул (в данном случае γ(сн3соон)
принимают равным единице, а концентрацию
считают практически равной общей
концентрации (здесь 0,1 М).
Концентрацию
анионов [СН3СОO‾]
можно принять равной концентрации соли
[СН3СООNа]
= 0,2 М,
так как образование анионов СН3СОО‾
в результате диссоциации уксусной
кислоты происходит в очень малой
степени. Для нахождения коэффициента
активности γ(сн3соо–)
необходимо вычислить ионную силу
раствора, которая будет обусловлена
ионами соли:
I
= ½ ([Na+]·12+[CH3COO‾
]·12)
= ½ (0,2·1+
0,2·1) = 0,2 М
3.
По таблице 2.2 находим, что при ионной
силе, равной 0,2, коэффициент активности
ионов водорода равен 0,76. Следовательно,
|
aH+ |
0,1 |
= |
|
0,2 |
4 Смещение ионных равновесий. Действие одноименного иона.
Степень
и константа ионизации характеризуют
собой один и тот же процесс распада
молекул на ионы, поэтому можно одну из
этих величин выразить через другую.
Если
обозначить молярную концентрацию
электролита через См,
а степень ионизации через ,
то концентрация каждого из ионов будет
равна См
· ,
а концентрация неионизированных молекул
будет равна
См—См,
или См(1—).
Подставив полученные значения в уравнение
константы ионизации бинарного электролита,
получим:
![]()
или
![]()
В
такой форме полученное уравнение
выражает закон разбавления, выведенный
В. Оствальдом. Он устанавливает зависимость
между степенью ионизации слабого
электролита и его концентрацией.
Если электролит является достаточно
слабым и раствор его не слишком разбавлен,
то степень ионизации его ()
мала и величина (1 – )
мало отличается от 1. Следовательно,
можно принять, что
![]()
![]()
Закон
разбавления позволяет вычислять степень
ионизации, если известна константа
ионизации и молярная концентрация
раствора электролита, и, наоборот,
определив тем или иным методом степень
ионизации, можно вычислить константу
ионизации по уравнению:
![]()
Ознакомимся
с методикой вычисления константы и
степени ионизации на основе использования
закона разбавления.
Пример
6.
Вычислить константу ионизации уксусной
кислоты, если степень ионизации 0,1 н.
раствора ее равна 1,35%.
Решение.
Для
вычисления константы ионизации уксусной
кислоты необходимо перейти от величины
степени ионизации, выраженной в
процентах, к ее величине, выраженной
в молях. Уксусная кислота одноосновная,
следовательно, 0,1 н. раствор ее является
0,1 М.
Отсюда:
Соседние файлы в папке Лекции
- #
- #
- #
- #
- #
- #
- #

Содержание
- Ионизационный баланс
- Ка
- Уравнение Хендерсона-Хассельбаха
- Использовать
- Постоянные упражнения ионизации
- Упражнение 1
- Упражнение 2.
- Упражнение 3.
- Ссылки
В константа ионизацииконстанта диссоциации или константа кислотности – это свойство, которое отражает тенденцию вещества выделять ионы водорода; то есть напрямую зависит от силы кислоты. Чем выше значение константы диссоциации (Ka), тем больше выделяется кислотой ионы водорода.
Например, когда речь идет о воде, ее ионизация известна как «автопротолиз» или «автоионизация». Здесь молекула воды дает H+ к другому, производя ионы H3ИЛИ+ и ОН–, как показано на изображении ниже.

Диссоциацию кислоты из водного раствора можно описать следующим образом:
HA + H2O <=> H3ИЛИ+ + А–
Где HA представляет собой кислоту, которая ионизирует, H3ИЛИ+ к иону гидроксония, а A– его сопряженное основание. Если Ka высокий, больше HA будет диссоциировать и, следовательно, будет более высокая концентрация иона гидроксония. Это повышение кислотности можно определить, наблюдая за изменением pH раствора, значение которого ниже 7.
Ионизационный баланс
Двойные стрелки в верхнем химическом уравнении указывают на то, что установлен баланс между реагентами и продуктом. Поскольку каждое равновесие имеет константу, то же самое происходит с ионизацией кислоты и выражается следующим образом:
K = [H3ИЛИ+] [TO–] / [HA] [H2ИЛИ]
Термодинамически постоянная Ka определяется в терминах активности, а не концентрации. Однако в разбавленных водных растворах активность воды составляет около 1, а активности иона гидроксония, сопряженного основания и недиссоциированной кислоты близки к их молярным концентрациям.
По этим причинам было введено использование константы диссоциации (ka), которая не включает концентрацию воды. Это позволяет схематизировать диссоциацию слабой кислоты, и константа диссоциации (Ka) выражается в той же форме.
HA <=> H+ + А–
Ka = [H+] [TO–] / [У НЕГО ЕСТЬ]
Ка
Константа диссоциации (Ka) – это форма выражения константы равновесия.
Концентрации недиссоциированной кислоты, сопряженного основания и иона гидроксония или водорода остаются постоянными после достижения состояния равновесия. С другой стороны, концентрация сопряженного основания и иона гидроксония абсолютно одинакова.
Их значения даны в степени 10 с отрицательными показателями, поэтому была введена более простая и управляемая форма выражения Ka, которую они назвали pKa.
pKa = – log Ka
PKa обычно называют константой диссоциации кислоты. Значение pKa является четким показателем силы кислоты.
Те кислоты, которые имеют значение pKa меньше или более отрицательное, чем -1,74 (pKa иона гидроксония), считаются сильными кислотами. Хотя кислоты с pKa больше -1,74, они считаются несильными кислотами.
Уравнение Хендерсона-Хассельбаха
Уравнение, которое чрезвычайно полезно в аналитических расчетах, следует из выражения Ka.
Ka = [H+] [TO–] / [У НЕГО ЕСТЬ]
Логарифмируя,
журнал Ka = журнал H+ + журнал A– – журнал HA
И решая для log H+:
-log H = – log Ka + log A– – журнал HA
Затем, используя определения pH и pKa и перегруппировав термины:
pH = pKa + log (A– / У НЕГО ЕСТЬ)
Это знаменитое уравнение Хендерсона-Хассельбаха.
Использовать
Уравнение Хендерсона-Хассельбаха используется для оценки pH буферов, а также того, как относительные концентрации конъюгированного основания и кислоты влияют на pH.
Когда концентрация конъюгированного основания равна концентрации кислоты, соотношение между концентрациями обоих членов равно 1; и поэтому его логарифм равен 0.
Как следствие, pH = pKa, что очень важно, поскольку в этой ситуации эффективность буферизации максимальна.
Обычно берется зона pH, в которой существует максимальная буферная емкость, где pH = pka ± 1 единица pH.
Постоянные упражнения ионизации
Упражнение 1
Разбавленный раствор слабой кислоты имеет в равновесии следующие концентрации: недиссоциированная кислота = 0,065 М и концентрация конъюгированного основания = 9 · 10.-4 М. Рассчитайте Ka и pKa кислоты.
Концентрация иона водорода или иона гидроксония равна концентрации сопряженного основания, поскольку они происходят в результате ионизации одной и той же кислоты.
Подставляя в уравнение:
Ka = [H+] [TO–] / У НЕГО ЕСТЬ
Подставляя в уравнение их соответствующие значения:
Ka = (910-4 M) (910-4 М) / 6510-3 M
= 1,246·10-5
А затем вычисляя его pKa
pKa = – log Ka
= – журнал 1,246 10-5
= 4,904
Упражнение 2.
Слабая кислота с концентрацией 0,03 М имеет константу диссоциации (Ka) = 1,5 · 10-4. Рассчитайте: а) pH водного раствора; б) степень ионизации кислоты.
В состоянии равновесия концентрация кислоты равна (0,03 M – x), где x – количество кислоты, которая диссоциирует. Следовательно, концентрация водорода или иона гидроксония равна x, как и концентрация конъюгированного основания.
Ka = [H+] [TO–] / [HA] = 1,5 · 10-6
[ЧАС+] = [A–] = х
Y [HA] = 0,03 M-x. Небольшое значение Ka указывает на то, что кислота, вероятно, диссоциировала очень мало, поэтому (0,03 M – x) приблизительно равно 0,03 M.
Подставляя в Ka:
1,5·10-6 = х2 /3·10-2
Икс2 = 4,5·10-8 M2
х = 2,12 х 10-4 M
А поскольку x = [H+]
pH = – log [H+]
= – журнал [2,12 x 10-4]
pH = 3,67
И, наконец, о степени ионизации: ее можно рассчитать, используя следующее выражение:
[ЧАС+] или [A–] / HA] x 100%
(2,12·10-4 / 3·10-2) х 100%
0,71%
Упражнение 3.
Я рассчитываю Ka по проценту ионизации кислоты, зная, что она ионизируется на 4,8% от начальной концентрации 1,5 · 10.-3 М.
Для расчета количества ионизированной кислоты определяют ее 4,8%.
Ионизированное количество = 1,5 · 10-3 М (4,8 / 100)
= 7,2 х 10-5 M
Это количество ионизированной кислоты равно концентрации конъюгированного основания и концентрации иона гидроксония или водорода в состоянии равновесия.
Концентрация кислоты при равновесии = исходная концентрация кислоты – количество ионизированной кислоты.
[HA] = 1,5 · 10-3 M – 7,2 10-5 M
= 1,428 х 10-3 M
А затем решая те же уравнения
Ka = [H+] [TO–] / [У НЕГО ЕСТЬ]
Ka = (7,2 · 10-5 М х 7,2 10-5 М) / 1,428 10-3 M
= 3,63 х 10-6
pKa = – log Ka
= – журнал 3,63 x 10-6
= 5,44
Ссылки
- Химия LibreTexts. (н.д.). Константа диссоциации. Получено с: chem.libretexts.org
- Википедия. (2018). Константа диссоциации. Получено с: en.wikipedia.org
- Уиттен, К. В., Дэвис, Р. Э., Пек, Л. П., Стэнли, Г. Г. Химия. (2008) Восьмое издание. Cengage Learning.
- Сегель И. Х. (1975). Биохимические расчеты. 2-й. Издание. Джон Вили и сыновья. INC.
- Кабара Э. (2018). Как рассчитать константу ионизации кислоты. Исследование. Получено с: study.com.
Постоянное уравнение ионизации по Хендерсону Хассельбальчу и упражнения
константа ионизации (или диссоциация) – это свойство, которое отражает тенденцию вещества выделять ионы водорода; то есть это напрямую связано с силой кислоты. Чем больше значение константы диссоциации (Ка), тем больше высвобождение водородных связей кислотой.
Например, когда речь заходит о воде, ее ионизация называется «автопротолизом» или «автоионизацией». Здесь молекула воды дает H + к другому, производя ионы H3О + и ОН – , как вы можете видеть на изображении ниже.

Диссоциация кислоты из водного раствора может быть схематизирована следующим образом:
Где HA представляет собой кислоту, которая является ионизированной, H3О + к иону гидрония и А – его сопряженное основание. Если Ka является высоким, большая часть HA будет диссоциировать и, следовательно, будет более высокая концентрация иона гидрония. Это повышение кислотности можно определить, наблюдая за изменением рН раствора, значение которого ниже 7..
- 1 ионизационный баланс
- 1,1 Ка
- 2 Уравнение Хендерсона-Хассельбальха
- 2.1 Использование
- 3 Ионизационные постоянные упражнения
- 3.1 Упражнение 1
- 3.2 Упражнение 2
- 3.3 Упражнение 3
- 4 Ссылки
Ионизационный баланс
Двойные стрелки в верхнем химическом уравнении показывают, что между реагентами и продуктом установлен баланс. Поскольку все равновесие имеет константу, то же самое происходит с ионизацией кислоты и выражается следующим образом:
Термодинамически постоянная Ka определяется с точки зрения активности, а не концентрации. Однако в разбавленных водных растворах активность воды составляет около 1, а активность ионов гидрония, конъюгата и недиссоциированной кислоты близка к их молярным концентрациям..
По этим причинам было введено использование константы диссоциации (ka), которая не включает концентрацию воды. Это позволяет упростить схематическое представление о диссоциации слабой кислоты, а константа диссоциации (Ka) выражается таким же образом.
Ka = [H + ] [A – ] / [HA]
Ка
Константа диссоциации (Ка) является формой выражения константы равновесия.
Концентрации недиссоциированной кислоты, конъюгатного основания и гидрония или иона водорода остаются постоянными после достижения равновесного состояния. С другой стороны, концентрация сопряженного основания и иона гидроксония абсолютно одинакова.
Их значения даны в степенях 10 с отрицательными показателями, поэтому была введена более простая и управляемая форма выражения Ка, которую они назвали pKa.
PKa обычно называют константой диссоциации кислоты. Значение рКа является четким показателем силы кислоты.
Те кислоты, которые имеют значение pKa ниже или более отрицательно, чем -1,74 (pKa иона гидроксония), считаются сильными кислотами. В то время как кислоты, которые имеют pKa больше чем -1,74, считаются не сильными кислотами.
Уравнение Хендерсона-Хассельбальха
Из выражения Ка получено уравнение, которое очень полезно в аналитических расчетах.
Ka = [H + ] [A – ] / [HA]
log Ka = log H + + журнал A – – log HA
И очистка журнала H + :
-log H = – log Ka + log A – – log HA
Используя затем определения pH и pKa, и термины перегруппировки:
pH = pKa + log (A – / HA)
Это знаменитое уравнение Хендерсона-Хассельбальха.
использование
Уравнение Хендерсона-Хассельбаха используется для оценки pH буферных растворов, а также того, как они влияют на относительные концентрации основания конъюгата и кислоты в pH.
Когда концентрация основания конъюгата равна концентрации кислоты, соотношение между концентрациями обоих слагаемых равно 1; и, следовательно, его логарифм равен 0.
Как следствие, pH = pKa, что очень важно, поскольку в этой ситуации эффективность буфера максимальна..
Обычно берется зона pH, где существует максимальная буферная емкость, где pH = pka ± 1 единица pH.
Ионизация постоянных упражнений
Упражнение 1
Разбавленный раствор слабой кислоты имеет следующие концентрации в равновесии: недиссоциированная кислота = 0,065 М и концентрация конъюгата основания = 9 · 10. -4 М. Рассчитайте Ka и pKa кислоты.
Концентрация иона водорода или иона гидрония равна концентрации конъюгата основания, так как они происходят от ионизации одной и той же кислоты.
Подставляя в уравнение:
Ka = [H + ] [A – ] / HA
Подставляя в уравнение их соответствующие значения:
Ка = (9 · 10 -4 М) (9 · 10 -4 М) / 65 · 10 -3 M
И рассчитываю тогда свою пКа
= – журнал 1246 · 10 -5
Упражнение 2
Слабая кислота с концентрацией 0,03 М, имеет константу диссоциации (Ка) = 1,5 · 10. -4 . Рассчитайте: а) рН водного раствора; б) степень ионизации кислоты.
В равновесном состоянии концентрация кислоты равна (0,03 М – х), где х – количество кислоты, которая диссоциирует. Следовательно, концентрация иона водорода или гидрония равна x, так же как и концентрация сопряженного основания..
Ka = [H + ] [A – ] / [HA] = 1,5 · 10 -6
Y [HA] = 0,03 М – х. Небольшое значение Ka указывает на то, что кислота, вероятно, очень мало диссоциирует, так что (0,03 М – х) приблизительно равно 0,03 М..
Подставляя в Ка:
1,5 · 10 -6 = х 2 / 3 · 10 -2
х 2 = 4,5 · 10 -8 M 2
х = 2,12 х 10 -4 M
И, наконец, в отношении степени ионизации: ее можно рассчитать с помощью следующего выражения:
[Н + ] или [A – ] / HA] x 100%
(2.12 · 10 -4 / 3 · 10 -2 ) х 100%
Упражнение 3
Я рассчитываю Ka по проценту ионизации кислоты, зная, что она ионизирована на 4,8% от начальной концентрации 1,5 · 10. -3 M.
Для расчета количества кислоты, которая ионизируется, определяют ее 4,8%..
Ионизированное количество = 1,5 · 10 -3 М (4,8 / 100)
Это количество ионизированной кислоты равно концентрации сопряженного основания и концентрации иона гидроксония или иона водорода в равновесии.
Концентрация кислоты в равновесии = начальная концентрация кислоты – количество ионизированной кислоты.
[HA] = 1,5 · 10 -3 М – 7,2 · 10 -5 M
И решить тогда с теми же уравнениями
Ka = [H + ] [A – ] / [HA]
Ка = (7,2 · 10 -5 М х 7,2 · 10 -5 М) / 1,428 · 10 -3 M
Тема №3 Протолитическое равновесие в водных растворах слабых кислот, слабых оснований и солей

ПРОТОЛИТИЧЕСКОЕ РАВНОВЕСИЕ В ВОДНЫХ РАСТВОРАХ СЛАБЫХ КИСЛОТ, СЛАБЫХ ОСНОВАНИй И СОЛЕЙ
Типовые задачи по данной теме
1. Расчет степени ионизации и концентрации ионов в водных
растворах слабых электролитов.
2. Расчет рН водных растворов слабых кислот и оснований.
3. Расчет концентрации слабых кислот и оснований по
величине рН раствора.
4. Расчет рН водных растворов солей.
Основные теоретические положения
Кислотно-основные реакции – это частный случай равновесия в гомогенной системе, поэтому расчеты равновесных концентраций компонентов реакции базируются на законе действующих масс и условии материального баланса.
Кислотно-основные реакции осуществляются за счет переноса протона от кислоты к основанию. Согласно протолитической теории Бренстеда-Лоури кислота – это вещество, являющееся донором протонов, а основание – акцептором протонов. Вещества, способные и отдавать, и принимать протоны, называются амфолитами.
Кислоты могут быть молекулярными (HNO2, HCN, H2CO3), катионными (H3O+, NH4+, Al(H2O)63+) и анионными (HC2O4-, HCO3-, H2PO4-).
Основания могут быть молекулярными (NH3, CH3NH2), катионными (AlOH(H2O)5)2+, BaOH+) и анионными (CN-, CO32-, OH-).
Амфолиты могут быть нейтральными (H2O, NH2CH2COOH) и заряженными (HCO3-, HC2O4-, HS-, H2PO4-, AlOH(H2O)52+).
Растворы слабых кислот
Сила слабой монопротонной (одноосновной) кислоты НАn, ионизация которой в водном растворе протекает согласно уравнению
НАn + Н2О  Н3О+ + Аn-, (1)
Н3О+ + Аn-, (1)
характеризуется константой кислотности Ка(НАn) или силовым показателем рКа(НАn):
 (2)
(2)
При записи уравнения (1) в виде Н3О+ + Аn-  НАn + Н2О термодинамическая константа реакции образования молекулы слабой кислоты НАn из Аn- и Н3О+ называется константой протонирования Кн(Аn–):
НАn + Н2О термодинамическая константа реакции образования молекулы слабой кислоты НАn из Аn- и Н3О+ называется константой протонирования Кн(Аn–):
 (3)
(3)
Константа кислотности Ка(НАn) и константа протонирования Кн(Аn–) имеют постоянные значения при постоянной температуре и любой ионной силе раствора.
Обозначим молярную концентрацию слабой монопротонной кислоты НАn, ионизация которой в водном растворе описывается уравнением (1), через Са, а степень ее ионизации как αа. С учетом того, что в растворах слабых электролитов концентрация ионов мала, будем считать активности ионов равными их концентрациям (Ic = 0, f(An–) = f(H3O+) = 1).
Если кислота НАn не является очень слабой (Ка(НАn) > 10–6), а ее раствор не очень разбавленным (Са(НАn) > 10–4 моль/л), то конкурирующей реакцией автопротолиза воды можно пренебречь.
Тогда при подстановке значений
в формулу (2) получим формулу (4), связывающую Ка, Са и αа:
 (4)
(4)
Если для раствора кислоты НАn отношение Са/Ка ≥ 400, то степень ее ионизации меньше или равна 5% (αа ≤ 0,05, 1 – α ≈ 1). В этом случае [HAn] = Са, Ка = Са αа2 и справедливы соотношения (5-7):
 (5)
(5)
а(Н3О+) =  (6)
(6)
pH = –  lg (KaCa) =
lg (KaCa) =  (pKa + pCa) (7)
(pKa + pCa) (7)
Если для раствора кислоты НАn отношение Са/Ка 0,05, 1–α ≠ 1). В этом случае [НАn] ≠ Са и после преобразования формулы (4) получим соотношения (8,9):
 (8)
(8)
а(Н3О+) = [H3O+] =Саαа=  (9)
(9)
Выражения (5-9) справедливы для растворов средних солей, образованных остатками слабых оснований (NH4Cl, CuCl2, FeCl3 и т. п.) и для слабых полипротонных кислот (Н3PO4, H2SO3 и т. п.), для которых Ka(HmAn) » Ka(Hm-1An-).
Растворы слабых оснований
Сила слабого основания Аn-, ионизация которого в водном растворе описывается уравнением:
Аn – + Н2О  НАn + ОН –
НАn + ОН –
 (10)
(10)
Как было показано выше, для характеристики силы основания Аn – может использоваться константа протонирования Кн(Аn-):
Кн(Аn-) = 
Аналогично предыдущим рассуждениям легко получить формулы для вычисления степени ионизации, равновесных концентраций и рН растворов слабых оснований.
Для слабого однокислотного основания Аn – с молярной концентрацией Сb и степенью ионизации αb ≤ 0,05 (Cb/Kb ≥ 400) в случае, когда ионизацией воды можно пренебречь, получаем:
 (11)
(11)
a(OH-) = [OH-] = [HAn] = αbCb =  (12)
(12)
рН = 14 – рОН = 14 –  (pKb + pCb) (13)
(pKb + pCb) (13)
Если αb > 0,05 (Cb/Kb 400, то αа 5% и для расчета αа и рН воспользуемся формулами (8,9):
 =
=
= = 0,233 или 23,3%
= 0,233 или 23,3%
рН = – lg [H3O+] = – lg 2,33·10-2 = 1,63
Пример 3. Рассчитайте степень ионизации аммиака, концентрацию ионов аммония и оксония и рН 0,100 моль/л водного раствора аммиака.
Решение: Ионизация аммиака в водном растворе описывается уравнением:
NH3(b) + HOH = NH4+(a) + OH-
Константа основности Кb равна:
 = 1,76·10-5
= 1,76·10-5
Так как Cb/Kb = 0,100/1,76·10-5 > 400, то степень ионизации аммиака αb
Вопрос №22 Растворы слабых электролитов. Применение ЗДМ к ионизации слабых электролитов. Константа ионизации(диссоциации). Ступенчатый характер ионизации.
Электролиты, которые не полностью диссоциируют на ионы( ионизируются ) называются слабыми электролитами. К ним принадлежит большинство органических кислот, а также некоторые неорганические соединения: H2S, HCN, H2CO3, H2SO3, HCLO, H2O, H3BO3, Hg2CL2, Fe(SCN)3 и др. Слабые электролиты не могут дать большой концентрации ионов в растворе. Они плохо (или почти не проводят) электрический ток. На степень диссоциации слабых электролитов влияет добавление одноименных ионов. Так, введение в равновесную систему СН3СООН → Н+ + СН3СООˉ сильного электролита СН3СООNa увеличивает концентрацию ионов СН3СООˉ , что в соответствии с принципом Ле Шателье приводит к значительному сдвигу равновесия диссоциации влево, т.е. к уменьшению степени диссоциации. Таким образом, добавление к раствору слабого электролита одноименных ионов уменьшает степень его диссоциации.
Количественно электролитическую диссоциацию как равновесный обратимый процесс можно охарактеризовать константой диссоциации(ионизации), определяемой законом действующих масс. Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.Закон действующих масс, строго говоря, применим к обратимым реакциям, т.е. к растворам слабых электролитов. Так например, диссоциацию электролита АaВbможно представить в виде равновесного процесса:
АaВb aАx- + bВy+ ( х и у в степени)
Согласно закону действующих масс константу равновесия записывают следующим образом:
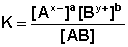 (1.1)
(1.1)
где числитель– молярные равновесные концентрации ионов электролита, а знаменатель-
молярная равновесная концентрация недиссоциированных молекул электролита, К-константа равновесия, называемая константой диссоциации.
Например для диссоциации уксусной кислоты СН3СООН
СН3СООН → Н+ + СН3СООˉ
константа диссоциации:
К = [Н+] [СНзСООˉ]
[СН3СООН]
Пусть имеется диссоциирующий на два иона слабый бинарный электролит КtАn, молярная концентрация которого с(Х), а степень диссоциации – α. В растворе этого электролита устанавливается рав-

Это соотношение называют законом разведения Оствальда. Уравнение (4.7) выражает зависимость степени диссоциации от концентрации раствора. Если электролит очень слабый, а
Многоосновные кислоты и многокислотные основания диссоциируют ступенчато.
Например, диссоциация фосфорной кислоты происходит в три ступени:
Н3РО4 = Н+ + Н2РО4 – ( 1 ступень )
Н2РО4 – = Н+ + НРО4 2- ( 2 ступень )
НРО4 2- = Н+ + РО4 3- ( 3 ступень )
Диссоциация по ступеням характеризуется константами:
Суммарное уравнение и общая константа диссоциации:
Н3РО4 = 3Н+ + РО4 3-
К = К1*К2*К3 = [H+]^3 * [PO4 3-]
[H3PO4]
Аналогично для многокислотных оснований, например Са(ОН)2 диссоциация проходит в две ступени.
Степенчатая диссоциация характеризуется тем, что распад электролита по каждой последующей ступени происходит в меньшей степени, чем по предыдущей, т.к К1больше К2большеК3. Такой характер изменения констант диссоциации можно объяснить электростатическим притяжением на основе закона Кулона. Энергия ионизации минимальна, когда ион открывается от нейтральной молекулы электролита. Отрыв иона на каждой следующей ступени диссоциации требует возрастающей энергии, т.к удаление иона происходит от частицы, заряд которой на последующих ступенях становится больше. Силу электролита можно выразить другим, более удобным способом. Вместо константы диссоциации часто используют её десятичный логарифм, взятый с обратным знаком: рКд=-lg Кд. Например у уксусной кислоты Кд=-1, 76*10(-5), соответственно рКд=4, 76
Вопрос № 23 Теория кислот и оснований(Аррениуса, Льюиса, Бренстеда-Лоури). Константы кислотности и основности.
Теория Аррениуса.
кислотой называют электролит, диссоциирующий в растворах с образованием водород-ионов Н+;
основанием называют электролит, диссоциирующий в растворах с образованием гидроксид-ионов ОН-;
амфолитом(амфотерным гидроксидом) называют электролит, диссоциирующий в растворе с образованием как водород-ионов, так и гидроксид-ионов. ( цинк, алюминий, хром и др. амфотерные Э, аминокислоты, белки, нукл. Кислоты)
По принципу Ле Шателье
(Н+)+(ЭО-)=ЭОН=(Э+)+(ОН-)
показывает, что с увеличение в системе концентрации гидроксид-ионов (ОН-) возрастает вероятность диссоциации по кислотному типу. Увеличение в системе концентрации водород-ионов (Н+) приводит к преимущественной диссоциации по основному типу.
=> в кислой среде амфолит проявляет основной, а в щелочной среде-кислотный характер.
=> согласно теории свойства кислот обусловлены наличием в их растворах водород-ионов, а свойства оснований-присутствием в их растворах гидроксид-ионов. Но это характерно только для водных растворов.
Аммиак не содержит гидроксид-ион, но проявляет свойства основания. Углекислый газ не содержит ион водорода, но проявляет в растворах кислотные свойства. Теория Аррениуса имеет ряд ограничений. Она объясняет кислотно-основные свойства молекулы, но не может объяснить кислотно-основные свойства заряженных частиц – ионов
Протонная теория Брёнстеда-Лаури
Протолитическая (протонная) теория кислот и оснований была предложена в 1923 году независимо друг от друга датским учёным Й. Брёнстедом и английским учёным Т. Лаури. В ней понятие о кислотах и основаниях было объединено в единое целое, проявляющееся в кислотно-основном взаимодействии: А =В + Н+ (А – кислота, В – основание).
кислотойназывают всякое вещество, молекулярные частицы которого ( в том числе и ионы ) способны отдавать протон, т.е быть донором протонов;
основанием называют всякое вещество, молекулярные частицы которого ( в том числе и ионы ) способны присоединять протоны, т.е быть акцептором протонов.
. Кислоты и основания получили общее название протолитов
Согласно протонной теории кислоты подразделяют на три типа:
1) нейтральные кислоты ( HCL, H2SO4, H3PO4 и др.)
H2SO4=(H+)+(HSO4-)
2) катионные кислоты, представляющие собой положительные ионы ( NH4+, H3O+ )
(NH4+)=NH3+(H+)
3) анионные кислоты, представляющие собой отрицательные ионы ( (HSO4-), (H2PO4-) )
(HSO4-)=(H+)+(SO4(2-))
классификация оснований:
1)нейтральные основания ( NH3, H2O, C2H5OH )
NH3+(H+)= (NH4+)
2) анионные основания, представляющие собой отрицательные ионы ( (CL-), (CH3COO-),
(OH-) ) (CH3COO-)+(H+)=CH3COOH
3) катионные основания, представляющие собой положительные ионы ( H2N-(NH3+)
согласно теории, отдавая протон, кислота превращается в основание, которое называют сопряженным этой кислоте:
(кислота)1=(сопряженное основание)1+(Н+)
т.е. каждой кислоте соответствует сопряженное основание. И наоборот, основание, присоединяя протон, превращается в сопряженную кислоту: (основание)2+(Н+)=(сопряженная кислота)2
например, кислоте H2SO4 соответствует сопряженное основание (HSO4-), основанию (CL-)- сопряженная кислота HCL
т.к. протон в растворах не существует в свободном виде, кислота может отдать протон только основанию, которое, приняв протон, становится кислотой. Поэтому согласно протонной теории имеет место кислотно-основное равновесие, обусловленное переносом протона:
(кислота)1+(основание)2=(кислота)2+(основание)1
Для краткости обратимый процесс кислотно-основного взаимодействия называют кислотно-основным равновесием.
например
HCL+NH3=(NH4+)+(CL-)
кислота1 основание2 кислота 2 основание 1
Одно и то же вещество в зависимости от условий взаимодействия может быть как кислотой, так и основанием (амфотерность). Например, вода при взаимодействии с сильными кислотами является основанием: H2O + H+ H3О+, а реагируя с аммиаком, становится кислотой: NH3 + H2O NH4+ + OH
Теория Льюиса (электронная теория)
кислотой называют вещество, принимающее электронные пары,-акцептор электронов;
основанием называют вещество, поставляющее электроны для образования химической связи,-донор электронов.
Иначе говоря, взаимодействие между кислотой и основанием заключается в образовании химической донорно-акцепторной связи между реагирующими частицами:
D(основание) +A(кислота)=DA
где D-донор электронной пары, A-акцептор этой электронной пары.
Таким образом, теория Льюиса рассматривает разные химические процессы как однотипные:реакцию нейтрализации в водных растворах, взаимодействие аминов с галогенидом бора, комплексообразование.
К основаниям Льюиса относят галогенид-ионы, аммиак, алифатические и ароматические амины, кислородосодержащие соединения общей формулы R2CO( где R-органический радикал)
К кислотам Льюиса относят галогениды бора, алюминия, кремния, олова и др.Э.
Рассмотренные теории диссоциации (ионизации ) кислот и оснований не противоречат, а дополняют друг друга и имеют глубокую внутренную связь. Так, кислоты, по Бренстеду, можно рассматривать как частный случай льюисовских кислот, поскольку протон характеризуется большим сродством к электронной паре и может рассматриваться, по Льюису, как кислота:
(HO-)+(H+)=HOH
Константы кислотности и основности.
Сила кислот определяется их способностью отдавать протон. Мерой этой способности служит константа кислотности (Ka). В водном растворе для произвольной кислоты HB функцию основания выполняет вода:

В дальнейшем любую кислоту будем обозначать «а», а основание – «b». В обозначении иногда приписывают индекс «1» или «2», при этом у основания и кислоты одной сопряженной пары индекс одинаковый. Если одну из протолитических пар образует вода, то ей приписывают индекс «2». Важно отметить, что действующие концентрации значительно выше, чем концентрации H+ и OH-.
Константа равновесия в соответствии с законом действующих масс 
Чем больше константа кислотности, тем сильнее кислота. Например, уксусная кислота сильнее, чем циановодородная кислота, так как Ka(CH3COOH) = 1,74•10-5, Ka(HCN) = 1•10-9. Для удобства расчетов и записи часто пользуются не самими константами, а их отрицательными десятичными логарифмами: pKa = -lgKa. Величину pKa называют силовым показателем кислоты. Например, pKa(CH3COOH) = = -lgKa(CH3COOH) = -lg1,74•10-5 = 4,76; pKa(HCN) = 9. Чем больше величина pKa, тем слабее кислота.
[spoiler title=”источники:”]
http://pandia.ru/text/80/167/16767.php
http://poisk-ru.ru/s3036t10.html
[/spoiler]
