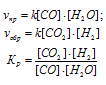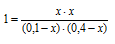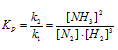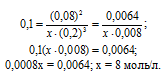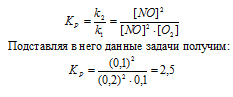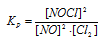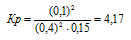Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
2NO(г) + O2(г) → 2NO2(г); ΔHо298 = — 113,4 кДж/моль.
Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Константа химического равновесия
Для химической реакции:
2NO(г) + O2(г) → 2NO2(г)
константа химической реакции Кс есть отношение:
Кс = [NO2]2/([NO]2 · [O2]) (1)
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGTо = – RTlnK (2)
Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
2CO(г) + O2(г) →2CO2(г)
|
Вещество |
CO | O2 | CO2 |
| Сисходн, моль/л | 0,36 | 0,40 | 0 |
| Спрореагир,моль/л | 0,16 | 0,08 | 0,16 |
| Сравн, моль/л | 0,2 | 0,32 | 0,16 |
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
3 H2 (г) + N2 (г) →2 NH3 (г) при 298 К.
Решение.
ΔG298о = 2·(- 16,71) кДж = -33,42·103 Дж.
ΔGTо = — RTlnK.
lnK = 33,42·103/(8,314× 298) = 13,489. K = 7,21× 105.
Задача 3. Определите равновесную концентрацию HI в системе
H2(г) + I2(г) →2HI(г),
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х)2/((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔНоТ » ΔНо298, а ΔSоT » ΔSо298.
Решение.
Если К = 1, то ΔGоT = — RTlnK = 0;
ΔGоT = ΔНо298 — ТΔ Sо298 .
ΔНо298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 103 Дж;
ΔSо298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Т = 786,15К
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
SO2(г) + Cl2(г) →SO2Cl2(г)
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Тогда получаем:
(х + 1)/(2 — х)2 = 4
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
1) 2 NH3 (г) → 3H2 (г) + N2 (г)
2) ZnCO3 (к) → ZnO(к) + CO2 (г)
3) 2HBr (г) → H2 (г) + Br2 (ж)
4) CO2 (г) + C (графит) →2CO (г)
|
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества |
2. При некоторой температуре равновесные концентрации в системе:
2HBr (г) →H2 (г) + Br2 (г)
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
CO2(г) + C(графит) →2CO(г)
становится равной 1. Примите, что ΔНоТ≈ΔНо298, а ΔSоT≈ΔSо298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
С2Н4(г) →С2Н2(г) + Н2(г) при 298 К
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
СО2(г) + 3Н2(г) → СН3ОН(г) + Н2О(г)
равна 3,4·10-5. Вычислите Δ Gо500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔGоf,800(С3Н6(г)), если ΔGоf,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
|
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л; |
П
р и м е р.
Вычислите
константу химического равновесия для
обратимой гомогенной реакции, СО + Н2О
= СО2
+ Н2,
исходя из того, что равновесие концентрации
веществ:
[СО]р
= 0,045 моль/л,
[Н2О]р
= 0,064 моль/л,
[СО2]р
= 0,18 моль/л.
Дано:
[СО]р
= 0,045 моль/л
[Н2О]р
= 0,064 моль/л
[СО2]р
= 0,18 моль/л
Кх.р
– ?
Решение:
Молярное
отношение продуктов реакции 1:1, поэтому
[СО2]р
= [Н2]р
= 0,18 моль/л.
Исходя
из выражения (2.1) рассчитываем величину
константы химического равновесия:
Кх.р
= [СО2]р
[Н2]р
/
[СО2]р
[Н2О]р
= 0,18 · 0,18/0,045 · 0,064
Ответ:
11,25.
2. Вычисление равновесных концентраций по исходным концентрациям реагирующих веществ и наоборот
П
р и м е р 1.
Обратимая
газовая реакция протекает по уравнению:
СО
+ CI2
= COCI2.
Исходные
концентрации реагирующих веществ:
[СО]0
= 0,03 моль/л;
[Cl2]0
= 0,02 моль/л.
После
наступления равновесия концентрация
угарного газа стала:
[СО]р
= 0,021 моль/л.
Вычислить
равновесные концентрации остальных
веществ и величину константы химического
равновесия.
Дано:
[СО]0
= 0,03 моль/л
[С12]0
= 0,02 моль/л
[СО]р
= 0,021 моль/л
[CI2]p,
[COCI2]p,
Kx.p
– ?
Решение:
К
моменту равновесия изменение концентрации
СО составило:
∆[СО]
= [СО]0
– [СО]р
= 0,03 – 0,021 = 0,009 моль/л.
Поскольку
молярное отношение веществ, участвующих
в реакции 1:1:1, то изменение концентрации
всех веществ одинаково:
[С12]р
=
[С12]0
– ∆[С12]
= 0,02 – 0,009 = 0,011 моль/л,
[СОС12]р
= 0,009 моль/л,
Кх·р
= [СОС12]Р
/ [СО]Р
[С12]р
= 0,009/0,021 · 0,011 = 39.
Результаты
вычислений внесем в таблицу, где знаки
«+» и «–» означают соответственно
увеличение или понижение концентрации
вещества.
|
Начальная |
Изменение |
Равновесная |
|
[CO]0
[Cl2]0
[COCl2]0 |
∆[CO]
∆[Cl2]
∆[COCl2] |
[CO]p
[Cl2]
[COCl2] |
Ответ:
[С12]р
= 0,011 моль/л; [СОС12]р
= 0,009 моль/л; Кх·р
=
39.
П
р и м е р 2.
Равновесные
концентрации веществ, участвующих в
обратимой реакции 2NO
+ О2
= 2NО2,
следующие
(моль/л):
[NО]р
= 0,056;
[О2]
= 0,028;
[NO2]р
= 0,044.
Рассчитать
начальные концентрации исходных веществ.
Дано:
[NО]р
= 0,056 моль/л
[O2]р
= 0,028 моль/л
[NO2]р
= 0,044 моль/л
[NO]0,
[О2]0
– ?
Решение:
Начальная
концентрация оксида азота (IV)
была [NO2]0
= 0, а ее изменение к моменту равновесия
составляет ∆[NО2]
= 0,044 моль/л.
Молярное
отношение NO
и NО2
в реакции 2:2 (1:1), следовательно, начальная
концентрация NO
будет:
[NO]0
= [NO]р
+ 0,044 = 0,056 + 0,044 = 0,1 моль/л.
Молярное
отношение О2
и NO2
составляет 1:2, отсюда начальная
концентрация О2
будет:
[О2]0
= [О2]р
+ 0,044/2 = 0,028 + 0,022 = 0,05 моль/л.
Результаты
вычислений записываем в таблицу
|
Равновесная |
Изменение |
Начальная |
|
[NO2]p
[NO]p
[O2]p |
∆[NO2]p
∆[NO]p
∆[O2]p |
[NO2]0
[NO]0
[O2]0 |
Ответ:
[NО]0
= 0,1 моль/л; [О2]0
= 0,05 моль/л.
П
р и м е р 3.
Реакция
синтеза аммиака протекает по уравнению
ЗН2
+ N2
= 2NH3.
Начальные концентрации исходных веществ
равны (моль/л): водорода – 0,05; азота –
0,04: константа скорости реакции равна
0,3. Рассчитать: а) начальную скорость
реакции; б) скорость реакции, когда
концентрация аммиака стала равной 0,02
моль/л.
Дано:
а)
[Н2]0
= 0,05 моль/л
[N2]0
= 0,04 моль/л
k
=0,3
υ0
– ?
б)
[NH3]
= 0,02 моль/л
k
=
0,3
υ
– ?
Решение:
а)
В соответствии с законом действующих
масс находим начальную скорость реакции:
υ0
= k[H2]03[N2]0
= 3 · 10–1
[5 · 10–2]3
[4 · 10–2]
= 1,5 · 10–6
моль/л·с.
б)
Исходя из уравнения реакции молярное
отношение водорода и аммиака 3:2. Увеличение
концентрации аммиака на 0,02 моль/л
вызывает уменьшение концентрации
водорода на 0,03 моль/л (0,02 – 3/2 = 0,03).
Таким
образом, к моменту когда концентрация
аммиака выросла на 0,02 моль/л, концентрация
водорода уменьшилась до 0,02 моль/л (0,05 –
0,03 = 0,02). Молярное отношение азота и
аммиака
1:2. Концентрация азота уменьшится на
0,01 моль (0,02 – 1/2 =
= 0,01) и станет равной 0,03 моль/л (0,04 – 0,01
= 0,03). Скорость реакции с уменьшением
концентрации реагирующих веществ также
понизится:
υ
= k[H2]3[N2]
= 3 · 10–1[2
· 10–2]3[3
· 10–2]
= 7,2 · 10–8
моль/л·с.
Ответ:
а)
1,5 · 10–6
моль/л·с; б) 7,2 · 10–8
моль/л·с.
П
р и м е р 4.
Реакция
протекает по уравнению 2NO
+ О2
= 2NO2,
через некоторое время после начала
реакции концентрации всех веществ,
участвующих в реакции, стали: [NO]
= 0,04 моль/л; [О2]
= 0,01 моль/л;
[NО2]
= 0,02 моль/л. Рассчитать начальные
концентрации исходных веществ и начальную
скорость реакции, если константа скорости
реакции k
= 1.
Дано:
[NO]
= 0,04 моль/л
[О2]
= 0,01 моль/л
[N02]
= 0,02 моль/л
k
= 1
[NO]0,
[O2]0,
x0
–
?
Решение:
В
соответствии с уравнением реакции
молярное отношение NO
и NO2
равно 2:2 (1:1).
Увеличение
концентрации продукта реакции NO2
до 0,02 моль/л вызвало уменьшение
концентрации NO
на 0,02 моль. Следовательно, начальная
концентрация оксида азота (II)
была:
[NО]0
= [NO]
+0,02 = 0,04 + 0,02 = 0,06 моль/л.
Молярное
отношение О2
и NO2
составляет 1:2, поэтому повышение
концентрации NO2
до 0,02 моль вызвало уменьшение концентрации
кислорода на 0,01 моль (0,02 · 1/2 = 0,01). В
результате начальная концентрация
кислорода была:
[О2]0
= [О2]
+ 0,01 = 0,01 + 0,01 = 0,02 моль/л.
Начальная
скорость реакции
υ0
= k[NO]02[O2]0
= 1 [6 · 10–2]2[2
· 10–2]
= 7,2 · 10–5
моль/л·с.
Ответ:
[NO]0
= 0,06 моль/л; [О2]0
= 0,02 моль/л;
х0
= 7,2 · 10–5моль/л·с.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
У этого термина существуют и другие значения, см. Константа.
Конста́нта равнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями (либо, в зависимости от условий протекания реакции, парциальными давлениями, концентрациями или фугитивностями) исходных веществ и продуктов в состоянии химического равновесия (в соответствии с законом действующих масс). Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции.
Способы выражения константы равновесия[править | править код]
Для реакции в смеси идеальных газов константа равновесия может быть выражена через равновесные парциальные давления компонентов 
где 

Например, для реакции окисления монооксида углерода:
константа равновесия может быть рассчитана по уравнению:
Если реакция протекает в идеальном растворе и концентрация компонентов выражена через молярность 
Для реакций в смеси реальных газов или в реальном растворе вместо парциального давления и концентрации используют соответственно фугитивность 

В некоторых случаях (в зависимости от способа выражения) константа равновесия может являться функцией не только температуры, но и давления. Так, для реакции в смеси идеальных газов парциальное давление компонента может быть выражено по закону Дальтона через суммарное давление и мольную долю компонента (
где 



Часто вместо самой константы равновесия 


Стандартная константа равновесия[править | править код]
Стандартная константа равновесия реакции в смеси идеальных газов (когда начальные парциальные давления участников реакции равны их значениям в стандартном состоянии 
где 

Стандартная константа равновесия — безразмерная величина. Она связана с 
Видно, что если 


Для реакции в смеси реальных газов в стандартном начальном состоянии парциальные фугитивности газов принимаются равными их парциальным давлениям 


где 

Константа равновесия реакций в гетерогенных системах[править | править код]
Для гетерогенной химической реакции, например, между компонентами реального газа и реального раствора, константа равновесия в общем случае может быть выражена уравнением:
где 

Если конденсированные фазы (твёрдые или жидкие) представляют собой практически чистые вещества, их активности постоянны и могут быть включены в константу равновесия (то есть в левую часть выражения выше). Условно можно принять их равными единице и, таким образом, исключить из выражения.
Например, для реакции твёрдофазного восстановления оксида железа:
константа равновесия (при условии, что газовая фаза идеальна) имеет вид:
Термодинамическое описание равновесия[править | править код]
Наряду с обозначением 

- (обозначения для приведённой ниже реакции; последнее равенство написано в обозначении, что стехиометрические коэффициент берутся со знаком «+» для продуктов и со знаком «−» для исходных веществ)
в химической термодинамике используется обозначение 
- (то есть соотношения активностей в момент
, в момент равновесия). Далее приведено термодинамическое описание химического равновесия и описана связь
со стандартной энергией Гиббса процесса.
В системе, где протекает химическая реакция
равновесие может быть описано условием
где 
или, то же самое условие равновесия может быть записано с использованием химических потенциалов как
где химические потенциалы
здесь 
Выражение для энергии Гиббса принимает вид
а так как 
При равновесии (иначе говоря, при условии что время 
Записав теперь условие равновесия 

Равновесный состав смеси и направление реакции[править | править код]
Упомянутый выше «коэффициент реакции» 


отражает соотношение текущих активностей всех участников реакции и может быть использован для определения направления реакции в момент, для которого известен 
- Если в момент
коэффициент
, то текущие активности продуктов больше равновесных, и значит они должны уменьшиться к тому моменту, когда установится равновесие, то есть в данный момент протекает обратная реакция;
- Если
, то равновесное состояние достигнуто и скорости прямой и обратной реакций равны;
- Если
, то
С использованием величины 
где 



а стандартная энергия Гиббса и стандартная константа суть
где 
Уравнение изотермы показывает, как величина 
- при
для прямой реакции
, то есть
для продуктов прямой реакции больше, чем для исходных веществ — это означает, что прямая реакция запрещена (значит, не запрещена обратная);
- при
для прямой реакции
, то есть реакция достигла равновесного состояния;
- при
для прямой реакции
, то есть эта самопроизвольное протекание этой реакции разрешено
Величина 



- Если
, то в системе преобладают продукты (прямой) реакции.
- Если
, то в системе преобладают исходные вещества (продукты обратной реакции)[5].
Стандартные состояния[править | править код]
Стандартная энергия Гиббса реакции в газовой смеси — энергия Гиббса реакции при стандартных парциальных давлениях всех компонентов, равных 0,1013 МПа (1 атм).
Стандартная энергия Гиббса реакции в растворе — энергия Гиббса при стандартном состоянии раствора, за которое принимают гипотетический раствор со свойствами предельно разбавленного раствора, но с концентрацией всех реагентов, равной единице.
Для чистого вещества и жидкости стандартная энергия Гиббса совпадает с энергией Гиббса образования этих веществ.
Величина стандартной энергии Гиббса реакции может быть использована для приближенной оценки термодинамической возможности протекания реакции в данном направлении, если начальные условия не сильно отличаются от стандартных. Кроме того, сравнивая величины стандартной энергии Гиббса нескольких реакций, можно выбрать наиболее предпочтительные, для которых 
Кинетическое описание[править | править код]
Для обратимой химической реакции константа равновесия 
Рассмотрим элементарную обратимую химическую реакцию первого порядка
По определению, равновесие задаётся условием 
В соответствии с законом действующих масс
где 

можно записать условие равновесия в виде
То есть
(см. термодинамическое описание константы равновесия), что возможно только если
Это важное соотношение даёт одну из «точек соприкосновения» химической кинетики и химической термодинамики[4][6].
Множественные равновесия[править | править код]
В случае, когда в системе устанавливается сразу несколько равновесий (то есть одновременного или последовательного протекает нескольких процессов), каждый из них может быть охарактеризован своей константой равновесия, из которых можно выразить общую константу равновесия для всей совокупности процессов. Можно рассмотреть такую ситуацию на примере ступенчатой диссоциации двухосновной кислоты 






Другой пример множественного равновесия — анализ системы осадок/растворимое комплексное соединение.
Допустим, имеется равновесие
Реакцию можно представить в виде двух последовательных равновесий — равновесия разложения комплексного иона на составляющие его ионы, которое характеризуется «константой нестойкости» (величина, обратная «константе устойчивости» 
и равновесия перехода ионов из объёма растворителя в кристаллическую решётку
с учётом того, что для твёрдых веществ активность принимается равной 1, а в разбавленных растворах активности могут быть заменены на молярные концентрации, получаем
где 
Тогда суммарное равновесие будет описываться константой
И значение этой константы будет условием преобладания в равновесной смеси комплексного соединения или твёрдой соли: как и выше, если 

Зависимость константы равновесия от температуры[править | править код]
Зависимость константы равновесия реакции от температуры может быть описана уравнением изобары химической реакции (изобары Вант-Гоффа):
и изохоры химической реакции (изохоры Вант-Гоффа):
Здесь 



Методы расчета константы равновесия[править | править код]
Расчётные методы определения константы равновесия реакции обычно сводятся к вычислению тем или иным способом стандартного изменения энергии Гиббса в ходе реакции (
, где
— универсальная газовая постоянная.
При этом следует помнить, что энергия Гиббса — функция состояния системы, то есть она не зависит от пути процесса, от механизма реакции, а определяется лишь
начальным и конечным состояниями системы. Следовательно, если непосредственное определение или расчёт 

Энтропийный расчёт изменения энергии Гиббса и константы равновесия реакции[править | править код]
Энтропийный метод расчёта 
или, соответственно, для стандартного изменения энергии Гиббса:
Здесь 
Необходимо получить изменение энтропии в ходе реакции. Эта задача может быть решена несколькими способами, например:
- По термическим данным — с опорой на тепловую теорему Нернста и с использованием сведений о температурной зависимости теплоёмкости участников реакции. Например, для веществ, при нормальных условиях находящихся в твёрдом состоянии:
где 
-
.
- (здесь индекс sol — от англ. solid, «твердый»). При некоторой заданной температуре
:
- Для жидких или газообразных при нормальной температуре веществ, или, в более общем случае, для веществ, в интервале температур от 0 (или 298) и до
претерпевающих фазовый переход, следует учитывать изменение энтропии, связанное с этим фазовым переходом.
- Для идеальных газов — методами квантовой статистики.
- Различными эмпирическими и полуэмпирическими методами, для этого часто достаточно небольшого объёма исходных данных. Например, для твёрдых неорганических веществ оценить энтропию можно по формуле[7]:
- где
и
— табличные константы, зависящие от типа рассматриваемого соединения,
— молекулярная масса.
Итак, если известны 


Несколько упрощённый вариант этой формулы получают, считая сумму теплоёмкостей веществ не зависящей от температуры и равной сумме теплоёмкостей при 298 K:
И ещё более упрощённый расчёт проводят, приравнивая сумму теплоёмкостей к нулю:
Переход от 
Расчёт константы равновесия методами статистической термодинамики[править | править код]
|
|
Этот раздел статьи ещё не написан. Здесь может располагаться отдельный раздел. Помогите Википедии, написав его. (30 июня 2016) |
Экспериментальное определение константы равновесия[править | править код]
|
|
Этот раздел статьи ещё не написан. Здесь может располагаться отдельный раздел. Помогите Википедии, написав его. (30 июня 2016) |
См. также[править | править код]
- Константа диссоциации
- Константа автопротолиза
- Константа гидролиза
- Константа устойчивости
- Константа Михаэлиса
- Энергия Гиббса
Примечания[править | править код]
- ↑ 1 2 Стромберг А. Г., Семченко Д. П. Физическая химия: Учеб. для хим.-технол. спец. вузов / Под ред. А. Г. Стромберга. — 2-е изд. — М.: Высш. шк., 1988. — 496 с.
- ↑ 1 2 3 Патров Б. В., Сладков И. Б. Физическая химия. Ч. 1 : учеб. пособие. — СПб.: Изд-во Политехн. ун-та, 2009. — 127 с. — ISBN 978-5-7422-2206-4.
- ↑ Эткинс П. Физическая химия в 2 т., том 1. — М.: Мир, 1980. — 580 с.
- ↑ 1 2 3 Жмурко Г. П., Казаков Е. Ф., Кузнецова В. Н., Яценко А. В. Общая химия. — М.: Академия, 2012. — ISBN 978-5-7695-9188-4. — 512 с.
- ↑ 1 2 Неорганическая химия в 3 т. /Под редакцией Третьякова Ю. Д. — Том 1: Физико-химические основы неорганической химии. — М.: Академия, 2004. — 240 с.
- ↑ Эткинс П. Физическая химия в 2 т., том 2. — М.: Мир, 1980. — 584 с.
- ↑ Физическая химия. Теоретическое и практическое руководство. Учеб. пособие для вузов / Под ред. акад. Б. П. Никольского. — 2-е изд., перераб. и доп. — Л.: Химия, 1987. — 880 с.
Литература[править | править код]
- Киреев В. А. Методы практических расчётов в термодинамике химических реакций. — 2-е изд. — М., 1975.
- Жоров Ю. М. Термодинамика химических процессов. — М., 1985.
Вычисление константы равновесия системы
Константа равновесия для гомогенной реакции
Задание 135.
Вычислите константу равновесия для гомогенной системы:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
если равновесные концентрации реагирующих веществ (молы/л):
[СО]р = 0,004; [Н2О]р = 0,064; [СО2]р = 0,016; [Н2]р = 0,016,
Чему равны исходные концентрации воды и СО? Ответ: Кр = 1; [H2O]исх = 0,08 моль/л; [СО]исх = 0, 02 моль/л.
Решение:
Уравнение реакции имеет вид:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
Константа уравнения данной реакции имеет выражение:
Kp = [CO2].[H2]/ [CO].[H2O]
Подставляя в выражение данные задачи получим:
Кр = (0,016 . 0,016)/(0,004 . 0,064) = 1.
Для нахождения исходных концентраций веществ Н2О и СО учтём, что согласно уравнению реакции из 1 моль СО и 1 моль Н2О образуется 1 моль СО2 и 1 моль Н2. Поскольку по условию задачи в каждом литре системы образовалось 0,016 моль СО2 и 0,016 моль Н2, то при этом было израсходовано по 0,016 моль СО и Н2О. Таким образом, искомые исходные концентрации равны:
[H2O]исх = [Н2О]Р + 0,016 = 0,004 + 0,016 = 0,02 моль/л;
[СО]исх = [СО]Р + 0,016 = 0,064 + 0,016 = 0, 08 моль/л.
Ответ: Кp = 1; [H2O]исх = 0,08 моль/л; [СО]исх =0, 02 моль/л.
Задание 136.
Константа равновесия гомогенной системы:
СО (г) + Н2О (г) ⇔ СО2 (г) + Н2 (г)
при некоторой температуре равна 1,00. Вычислите равновесные концентрации всех реагирующих веществ, если исходные концентрации равны (молы/л): [СО]исх = 0,10; [Н2О]исх = 0,40.
Ответ: [СО2]Р = [Н2]Р = 0,08; [СO]P = 0,02; [Н2O]P = 0,32.
Решение:
Уравнение реакции имеет вид:
СО (г) + Н2О (г) ↔ СО2 (г) + Н2 (г)
При равновесии скорости прямой и обратной реакций равны, а отношение констант этих скоростей постоянно и называется константой равновесия данной системы:
Обозначаем за “х” моль/л равновесную концентрацию одного из продуктов реакции, тогда равновесная концентрация другого будет также х моль/л так как они оба образуются в одинаковом количестве. Равновесные концентрации исходных веществ будут:
[СО]исх = 0,10 – х моль/л; [Н2О]исх = 0,40 – х моль/л. (так как на образование х моль/л продукта реакции расходуется соответственно по х моль/л СО и Н2О. В момент равновесия концентрация всех веществ будет (моль/л): [СО2]Р = [Н2]Р = х; [СO]P= 0,10 – х; [Н2O]P = 0,4 – х.
Подставляем эти значения в выражение константы равновесия:
Решая уравнение, находим х = 0,08. Отсюда равновесные концентрации (моль/л):
[СО2]Р = [Н2]Р = х = 0,08 моль/л;
[Н2O]P = 0,4 – х = 0,4 – 0.08 = 0,32 моль/л;
[СO]P= 0,10 – х = 0,10 – 0,08 = 0,02 моль/л.
Задание 137.
Константа равновесия гомогенной системы N2 + ЗН2 = 2NH3 при некоторой температуре равна 0,1. Равновесные концентрации водорода и аммиака соответственно равны 0,2 и 0,08 моль/л. Вычислите равновесную и исходную концентрации азота. Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Решение:
Уравнение реакции имеет вид:
N2 + ЗН2 ↔ 2NH3
Обозначим равновесную концентрацию N2 через х моль/л. Выражение константы равновесия данной реакции имеет вид:
Подставим в выражение константы равновесия данные задачи и найдём концентрацию N2
Для нахождения исходной концентрации N2, учтём, что, согласно уравнению реакции на образование 1 моль NH3 затрачивается ½ моль N2. Поскольку по условию задачи в каждом литре системы образовалось 0,08 моль NH3, то при этом было израсходовано 0,08 . 1/2 = 0,04 моль N2. Таким образом, искомая исходная концентрация N2 равна:
[N2]исх = [N2]P + 0,04 = 8 + 0,04 = 8,04 моль/л.
Ответ: [N2]P = 8 молы/л; [N2]исх = 8,04 моль/л.
Задание 138.
При некоторой температуре равновесие гомогенной системы
2NО + O2 ↔ 2NO2 установилось при следующих концентрациях реагирующих веществ (молы/л): [NО]p = 0,2; [О2]р = 0,1; [NO2]р = 0,1. Вычислите константу равновесия и исходную концентрацию NO и O2. Ответ: К = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Решение:
Уравнение реакции:
2NО + O2 ↔ 2NO2
Константа равновесия данной реакции выражается уравнением:
Для нахождения исходных концентраций NO и O2 учтём, что согласно уравнению реакции, из 2 моль NO и 1 моль О2 образуется 2 моль NO2, то при этом было затрачено 0,1 моль NO и 0,05 моль О2. Таким образом, исходные концентрации NO и О2 равны:
[NО]исх = NО]p + 0,1 = 0,2 + 0,1 = 0,3 молы/л;
[О2]исх = [О2]р + 0,05 = 0,1 + 0,05 = 0,15 моль/л.
Ответ: Кp = 2,5; [NО]исх = 0,3 молы/л; [О2]исх = 0,15 моль/л.
Смещение равновесия схимической системы
Задание 139.
Почему при изменении давления смещается равновесие системы:
N2 + 3Н2 ↔ 2NH3 и, не смещается равновесие системы N2 + O2 ↔ 2NO? Ответ мотивируйте на основании расчета скорости прямой и обратной реакций в этих системах до и после изменения давления. Напишите выражения для констант равновесия каждой из данных систем.
Решение:
а) Уравнение реакции:
N2 + 3Н2 ↔ 2NH3.
Из уравнения реакции следует, что реакция протекает с уменьшением объёма в системе (из 4 моль газообразных веществ образуется 2 моль газообразного вещества). Поэтому при изменении давления в системе будут наблюдаться смещение равновесия. Если повысить давление в данной системе, то, согласно принципу Ле Шателье, равновесие сместится вправо, в сторону уменьшения объёма. При смещении равновесия в системе вправо скорость прямой реакции будет больше скорости обратной реакции:




Если же давление в системе уменьшить, то равновесие системы сместится влево, в сторону увеличения объёма, то при смещении равновесия влево скорость прямой реакции будет меньше, чем скорость прямой:

обр или (


б) Уравнение реакции:
N2 + O2 ↔ 2NO.
Из уравнения реакции следует, что при протекании реакции не сопровождается изменением объёма, реакция протекает без изменения числа молей газообразных веществ. Поэ му изменение давления в системе не приведёт к смещению равновесия, поэтому скорости прямой и обратной реакции будут равны:




Задание 140.
Исходные концентрации [NО]исх и [С12]исх в гомогенной системе
2NO + Сl2 ↔ 2NOС1 составляют соответственно 0,5 и 0,2 моль/л. Вычислите константу равновесия, если к моменту наступления равновесия прореагировало 20% NО. Ответ: 0,417.
Решение:
Уравнение реакции имеет вид: 2NO + Сl2 ↔ 2NOС1
Согласно условию задачи в реакцию вступило 20% NO, что составляет 0,5 . 0,2 = 0,1 моль, а не прореагировало 0,5 – 0,1 = 0,4 моль NO. Из уравнения реакции следует, что на каждые 2 моль NO расходуется 1 моль Cl2, при этом образуется 2 моль NOCl. Следовательно, c 0,1 моль NO в реакцию вступило 0,05 моль Cl2 и образовалось 0,1 моль NOCl. Осталось не израсходованным 0,15 моль Cl2 (0,2 – 0,05 = 0,15). Таким образом, равновесные концентрации, участвующих веществ равны (моль/л):
[NО]р = 0,4; [Cl2]p = 0,15; [NОCl]р = 0,1.
Константа равновесия данной реакции выражается уравнением:
Подставляя в данное выражение равновесные концентрации веществ, получим:
Ответ: Кр = 4,17.
Как найти константу равновесия
Химическое равновесие — это состояние химической системы, когда скорость протекания прямой и обратной химической реакции равны. То есть состояние, при котором концентрации исходных веществ и продуктов реакции (либо их парциальные давления) не меняется. А константа равновесия Кр — это величина, определяющая соотношение между этими концентрациями, или давлениями.

Инструкция
Допустим, вам нужно рассчитать константу равновесия. Если речь идет о реакции между газами, продуктом которой также является газ, то константа равновесия рассчитывается через парциальные давления компонентов. Например, рассмотрите реакцию каталитического окисления диоксида серы до серного ангидрида (сырья для получения серной кислоты). Она протекает по следующей схеме:2SO2 + O2 = 2SO^3.
С учетом коэффициентов, стоящих перед молекулами диоксида серы и серного ангидрида, формула константы равновесия будет выглядеть следующим образом:P^2 SO3/p^2 SO2 х pO2
Если реакция протекает в каком-либо растворе, и вам известны молярные концентрации исходных веществ и продуктов, то формула, по которой рассчитывается константа равновесия обратимой химической реакции А + Б = В + Г, будет следующей:Кр = [A][Б]/[B][Г].
Вычислите константу равновесия химической реакции, используя известную величину изменения энергии Гиббса (эти данные вы можете найти в химических справочниках). Вычисление производится по следующей формуле:∆G = -RT lnKр, то есть lnKр = -∆G/RT. Вычислив величину натурального логарифма Кр, вы без труда определите и саму величину константы равновесия.
При расчете константы равновесия, помните, что величина изменения энергии Гиббса зависит лишь от конечного и начального состояния системы, а не от промежуточных этапов. Иными словами, вам совершенно безразлично, какими путями было получено конечное вещество из исходного, изменение энергии Гиббса все равно будет одним и тем же. Поэтому, если вы по какой-то причине не можете определить ∆G для конкретной реакции, можно произвести расчеты по промежуточным реакциям (важно лишь, чтобы они в итоге привели к образованию нужного нам конечного вещества).
Источники:
- как определить константу равновесия
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.















![{displaystyle K_{mathrm {eq} }={frac {[C]^{sigma }[D]^{tau }}{[A]^{alpha }[B]^{beta }}}={frac {prod a_{j(t=infty )}^{nu _{j}}}{prod a_{i(t=infty )}^{nu _{i}}}}=prod a_{n(t=infty )}^{nu _{n}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc5a2f2f80438a4b8a7072323eeedbaa7bab18ae)


























![{displaystyle mathrm {H} _{2}mathrm {A} rightleftharpoons mathrm {HA} ^{-}+mathrm {H} ^{+}:K_{1}={frac {[mathrm {HA} ^{-}][mathrm {H} ^{+}]}{[mathrm {H} _{2}mathrm {A} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/143e0b7ec27f2411ba87210539820c138128cb0b)
![{displaystyle mathrm {HA} ^{-}rightleftharpoons mathrm {A} ^{2-}+mathrm {H} ^{+}:K_{2}={frac {[mathrm {A} ^{2-}][mathrm {H} ^{+}]}{[mathrm {HA} ^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2111b38183d19279cd9090c7793ffd68ce588f74)
![{displaystyle mathrm {H} _{2}mathrm {A} rightleftharpoons mathrm {A} ^{2-}+2mathrm {H} ^{+}:K_{1+2}={frac {[mathrm {A} ^{2-}][mathrm {H} ^{+}]^{2}}{[mathrm {H} _{2}mathrm {A} ]}}=K_{1}K_{2}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98c0dfdacfd5dda0925e8f0ddcc7965d7424997f)



![{displaystyle K_{2}={frac {alpha _{mathrm {AgI} }}{alpha _{mathrm {Ag} ^{+}}alpha _{mathrm {I} ^{-}}}}={frac {1}{[mathrm {Ag} ^{+}][mathrm {I} ^{-}]}}={frac {1}{K_{mathrm {sp} }}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b49f9de23845acc735a4c02c2fc69aa94341943c)