Перейти к содержанию
Определение координационного числа в химии
На чтение 3 мин. Просмотров 787 Опубликовано 27.05.2021
Координационное число атома в молекуле – это количество атомов, связанных с этим атомом. В химии и кристаллографии координационное число описывает количество соседних атомов по отношению к центральному атому. Этот термин был первоначально определен в 1893 году швейцарским химиком Альфредом Вернером (1866–1919). Значение координационного числа для кристаллов и молекул определяется по-разному. Координационное число может варьироваться от 2 до 16. Значение зависит от относительных размеров центрального атома и лигандов, а также от заряда электронной конфигурации иона.
Координационное число атома в молекуле или многоатомном ионе определяется путем подсчета количества связанных с ним атомов (примечание: не путем подсчета количества химические связи).
В твердотельных кристаллах определить химическую связь сложнее, поэтому координационное число в кристаллах определяется путем подсчета числа соседних атомов . Чаще всего для определения координационного числа используется атом внутри решетки с соседями, простирающимися во всех направлениях. Однако в определенных контекстах важны поверхности кристаллов (например, гетерогенный катализ и материаловедение), где координационное число для внутреннего атома – это координационное число в объеме , а значение для поверхностного атома – это координационное число поверхности .
В координационных комплексах учитывается только первая (сигма) связь между центральным атомом и лигандами. Связи Pi с лигандами не включаются в расчет.
Содержание
- Примеры координационных чисел
- Расчет координационного числа
- Геометрия координационного числа
Примеры координационных чисел
- Углерод имеет координационное число 4 в молекуле метана (CH 4 ), поскольку с ней связано четыре атома водорода.
- В этилене (H 2 C = CH 2 ), координационное число каждого углерода равно 3, где каждый C связан с 2H + 1C, всего 3 атома.
- Координационное число алмаза равно 4, поскольку каждый атом углерода находится в центре правильного тетраэдра, образованного четырьмя атомами углерода.
Расчет координационного числа
Вот шаги для определения координационного числа координационного соединения.
- Определите центральный атом в химической формуле. Обычно это переходный металл.
- Найдите ближайший к центральному атому металла атом, молекулу или ион. Для этого найдите молекулу или ион непосредственно рядом с символом металла в химической формуле координационного соединения. Если центральный атом находится в середине формулы, с обеих сторон будут соседние атомы/молекулы/ионы.
- Сложите количество атомов ближайшего атома/молекулы/ионов. Центральный атом может быть связан только с одним другим элементом, но вам все равно нужно указать количество атомов этого элемента в формуле.. Если центральный атом находится в середине формулы, вам нужно сложить атомы во всей молекуле.
- Найдите общее количество ближайших атомов. Если металл имеет два связанных атома, сложите оба числа,
Геометрия координационного числа
Есть несколько возможные геометрические конфигурации для большинства координационных чисел.
- Координационное число 2 – линейный
- Координационное число 3 – тригональная плоская (например, CO 3 2- ), тригональная пирамида, T -образный
- Координационное число 4 – тетраэдрический, квадратный плоский
- Координационное число 5 – квадратная пирамида (например, соли оксованадия, ванадил VO 2+ ), тригональная бипирамида,
- Координационное число 6 – гексагональная плоская , тригональная призма, октаэдр
- Координационное число 7 – октаэдр с вершиной, тригональная призма с вершиной, пятиугольная бипирамида.
- Координационное число 8 – додекаэдр, куб, квадратная антипризма, гексагональная бипирамида.
- Координационное число ber 9 – трехгранная тригональная призма с центром в центре.
- Координационное число 10 – квадратная антипризма с перемычкой.
- Координационное число 11 – тригональная призма с закрытой головкой.
- Координационное число 12 – кубооктаэдр (например, нитрат цериевого аммония – (NH 4 ) 2 Ce (NO 3 ) 6 )
Как определить координационное число
Координационное число характеризует, со сколькими частицами связан тот, или иной атом (ион) в молекуле вещества. Само понятие «координационное число» возникло по мере развития раздела химии, изучающего комплексные соединения, многие из которых имеют весьма сложный состав. Потребовался показатель, четко указывающий, какое именно количество частиц входят во внутреннюю («координационную») сферу комплексного вещества. Как определить координационное число?

Инструкция
Прежде всего, составьте точную формулу вещества. Например, возьмите хорошо известную из курса школьной химии желтую кровяную соль. Ее формула К3[Fe(CN)6]. Каково координационное число иона железа в этом соединении? Из формулы легко можно понять, что в первую очередь железо связано с циан-ионами СN-, следовательно, его координационное число равно 6.
Понятие «координационное число» используется не только в химии комплексных соединений, но и в кристаллографии. Давайте рассмотрим еще более знакомую вам поваренную моль – хлористый натрий. Его формула NaCl. Казалось бы, проще некуда – координационное число и натрия, и хлора равно 1. Но не торопитесь с выводами.
Вспомните: ведь в обычном, твердом состоянии хлористый натрий имеет кубическую кристаллическую решетку. В ее узлах попеременно чередуются ионы хлора и натрия, связанные с «соседями». А сколько таких «соседей» у каждого иона? Нетрудно подсчитать, что их 6. (Четыре по «горизонтали», два по «вертикали»). Вот и получается: координационное число и у натрия, и у хлора в этом веществе равно 6.
А как быть, к примеру, с самым известным драгоценным камнем – алмазом? Какое координационное число имеет углерод, входящий в его состав? Вспомните, что алмаз представляет собой углеродную кристаллическую решетку так называемой «тетрагональной» формы. Каждый атом углерода связан в ней с четырьмя другим атомами, следовательно, координационное число равно 4.
Где еще применяется понятие «координационного числа»? Его можно использовать при описании химических свойств жидких и аморфных веществ, в тех случаях, когда фактическое количество химических связей центрального атома не совпадет с его валентностью. Рассмотрите, например, широко применяемое соединение – азотную кислоту. Ее эмпирическая формула HNO3, и из нее следует, что валентность азота явно больше 3.
Написав же структурную формулу, вы увидите, что атом азота связан только с тремя кислородными атомами, следовательно, его координационное число равно 3.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 июня 2017 года; проверки требуют 2 правки.
Координационное число (в химии и кристаллографии) — характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле.
Координационное число в химии[править | править код]
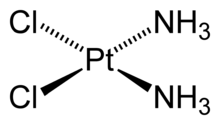
Строение цис-дихлородиамминплатины (II)
В химии понятие координационного числа появилось с развитием химии комплексных соединений. Под ним подразумевается число лигандов (атомов, молекул, ионов), которые образуют первую координационную (внутреннюю) сферу комплексообразователя[1].
Например, в комплексной соли гексацианоферрате(III) калия K3[Fe(CN)6] координационное число иона Fe3+ равно 6, а в цис-дихлородиамминплатине (II) (соли Пейроне) Pt(NH3)2Cl2 центральный атом платины связан с четырьмя лигандами.
Резонансные структуры HNO3
Понятие координационного числа применяется и для характеристики центрального атома в молекулах, преимущественно для тех случаев, когда число химических связанных ближайших атомов не равно численному значению валентности. Например, в молекуле азотной кислоты формальная валентность центрального атома азота равна 4, степень окисления +5, а координационое число 3.
Понятие координационного числа применяется также при описании структуры жидкостей и аморфных тел. В этом случае координационное число — мера ближнего порядка, среднее число ближайших соседей атома. Оно может быть дробным.
Координационное число в кристаллографии[править | править код]
Кристаллическая решётка NaCl (простая кубическая): показаны элементарные ячейки ионов натрия и хлора
В кристаллохимии координационное число — характеристика, которая определяет число ближайших равноудаленных одинаковых частиц (ионов или атомов) в кристаллической решётке. Прямые линии, соединяющие центры ближайших атомов или ионов в кристалле, образуют координационный многогранник, в центре которого находится данный атом.
В решётках Браве для всех узлов координационное число одинаково. Число ближайших соседей отражает плотность упаковки вещества. Чем больше координационное число, тем больше плотность и соответственно свойства вещества ближе к металлическим. Данному параметру решетки соответствует первая, вторая (соседи, следующие за ближайшими), третья и т. д. координационные группы частиц.
Для простой кубической решетки координационное число равно шести, для ОЦК — 8, ГЦК и ГП (гексагональной плотноупакованной) — 12.
Источники[править | править код]
- Координационное число / М. П. Шаскольская // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
Примечания[править | править код]
- ↑ Угай Я. А. Валентность, химическая связь и степень окисления — важнейшие понятия химии Архивная копия от 13 апреля 2014 на Wayback Machine // Соросовский образовательный журнал. — 1997. — №3. — С. 53-57
Важнейшей характеристикой
комплексообразователя является
количество химических связей, которые
он образует с лигандами, или координационное
число (КЧ).
Эта характеристика комплексообразователя
определяется главным образом строением
его электронной оболочки и обусловливается
валентными возможностями
центрального атома или условного
иона-комплексообразователя.
Когда комплексообразователь координирует
монодентатные
лиганды, то координационное число равно
числу присоединяемых лигандов. А число
присоединяемых к комплексообразователю
полидентатных
лигандов всегда меньше значения
координационного числа.
Значение координационного
числа комплексообразователя
зависит от его природы, степени окисления,
природы лигандов и условий (температуры,
природы растворителя, концентрации
комплексообразователя и лигандов и
др.), при которых протекает реакция
комплексообразования. Значение КЧ может
меняться в различных комплексных
соединениях от 2 до 8 и даже выше. Наиболее
распространенными координационными
числами являются 4 и 6.
Между значениями координационного
числа и степенью окисления
элемента-комплексообразователя
существует определенная
зависимость. Так, для
элементов-комплексообразователей,
имеющих степень окисления +I (AgI,
CuI, AuI, II и др.) наиболее
характерно координационное число 2 –
например, в комплексах типа [Ag(NH3)2]+,
[Cu(CN)2]–, [IBr2]–.
Элементы-комплексообразователи
со степенью окисления +II (ZnII, PtII,
PdII, CuII и др.) часто образуют
комплексы, в которых проявляют
координационное число 4, такие как
[Zn(NH3)4]2+, [PtCl4]2-,
[Pd(NH3)2Cl2]0, [ZnI4]2-,
[Cu(NH3)4]2+.
В аквакомплексах
координационное число комплексообразователя
в степени окисления +II чаще всего равно
6: [Fe(H2O)6]2+, [Mg(H2O)6]2+,
[Ni(H2O)6]2+.
Элементы-комплексообразователи,
обладающие степенью окисления +III и +IV
(PtIV, AlIII, CoIII, CrIII,
FeIII), имеют в комплексах, как
правило, КЧ 6.
Например, [Co(NH3)6]3+,
[Cr(OH)6]3-, [PtCl6]2- ,
[AlF6]3-, [Fe(CN)6]3-.
Известны комплексообразователи, которые
обладают практически постоянным
координационным числом в комплексах
разных типов. Таковы кобальт(III), хром(III)
или платина(IV) с КЧ 6 и бор(III), платина(II),
палладий(II), золото(III) с КЧ 4. Тем не менее
большинство комплексообразователей
имеет переменное координационное число.
Например, для алюминия(III) возможны КЧ
4 и КЧ 6 в комплексах [Al(OH)4]–
и [Al(H2O)2(OH)4]–.
Координационные числа 3, 5, 7, 8 и 9 встречаются
сравнительно редко. Есть всего несколько
соединений, в которых КЧ равно 12 –
например, таких как K9[Bi(NCS)12].
5. Внутренняя и внешняя сфера комплексного соединения
Лиганды, непосредственно связанные с
комплексообразователем, образуют вместе
с ним внутреннюю
(координационную) сферу комплекса.
Так, в комплексном катионе [Cu(NH3)4]2+
внутренняя сфера образована атомом
комплексообразователя – меди(II) и
молекулами аммиака, непосредственно с
ним связанными.
Обозначается внутренняя сфера квадратными
скобками: [Fe(CN)6]3-, [HgI4]2-,
[SnCl6]2-.
В зависимости от
соотношения суммарного заряда лигандов
и комплексообразователя внутренняя
сфера может иметь
положительный заряд, например,
[Al(H2O)6]3+, либо
отрицательный,
например, [Ag(SO3S)2]3-, или
нулевой заряд,
например, как для [Cr(NH3)3(NCS)3]0.
Ионы, нейтрализующие заряд внутренней
сферы, но не связанные с комплексообразователем
ковалентно, образуют внешнюю
сферу комплексного соединения.
Например, в комплексном соединении
[Zn(NH3)4]Cl2 два иона Cl–
находятся во внешней сфере:
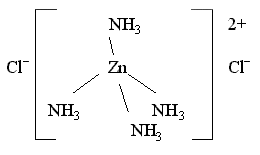
Внешнесферные ионы Cl– находятся
на более значительном
удалении от комплексообразователя,
чем молекулы NH3, иначе говоря,
расстояние Zn – Cl больше, чем длина
химической связи Zn – N. Более того,
химическая связь комплексного катиона
[Zn(NH3)4]2+ и хлорид-ионов
Cl– имеет ионный характер, в то
время как молекулы аммиака NH3,
входящие во внутреннюю сферу, образуют
с комплексообразователем Zn(II) ковалентные
связи по донорно-акцепторному механизму
(донором неподеленных пар электронов
являются атомы азота в NH3). Таким
образом, различие между лигандами
внутренней сферы и
ионами внешней сферы
очень существенно.
Изображая формулу комплексного
соединения, внешнесферные ионы располагают
за квадратными скобками.
Например, в соединениях [Cu(NH3)4](OH)2
и K2[HgI4] внешнесферными ионами
являются соответственно ионы OH–
и K+. Вполне понятно, что в нейтральных
комплексах [Cr(NH3)3(NCS)3]0
и [Pd(NH3)2Cl2]0 внешняя
сфера отсутствует.
Обычно внешнюю сферу составляют простые
одноатомные или
многоатомные ионы.
Однако возможны случаи, когда комплексное
соединение состоит из
двух и более внутренних
сфер, выполняющих функции катионной
и анионной части соединения. Здесь
каждая из внутренних сфер
является внешней по отношению к другой.
Например, в соединениях [Cu(NH3)4][PtCl6]
и [Ni(NH3)6]2[Fe(CN)6]
формально функции внешнесферных ионов
могут выполнять.
Выводы
Комплексное
соединение включает комплексообразователь
и лиганды. По детантности различают
монодетаннтные и бидетантные комплексы.
Жоспар
I.Кіріспе.
II.Негізгі
бөлім.
2.1Комплексті
қосындылар.
2.2
Комплексті қосылыстардың құрылысы.
2.3
Комплексті қосылыстардың магниттік
қасиеттері.
2.4
Комплексті қосылыстардың классификациясы.
2.5
Комплексті қосылыстардың изомериясы.
III.Қорытынды.
КОМПЛЕКСТІ
ҚОСЫЛЫСТАР
Валенттік
жайындағы ілім химияға әбден орныққаннан
кейін химиялық
Біздің
осы уақытқа дейін оқып келген
қосылыстарымыздың басым
Комплексті
қосылыстар туралы ілімнің негізін
жасаған Швейцария ғалымы
Мүндағы
қосылысудың ретін түзілген Н2SіҒб
қасиеттері көрсетеді; бұл
н+Гғ-
ғ- “” Sі4+н+ Іғ+ ғ+
Демек,
SіҒ4 құрамындағы кремний НҒ құрамындағы
Ғ~ ионын
Құрамында
осындай комплекс ионы бар қосылыстар
комплексті қосылыстарға
Комплексті
қосылыстарды ғылыми түрғыдан А л ь ф
XX
ғасырдан бастап комплексті қосылыстарды
жете тексерген теориялар
Лев
Александрович Чугаев Москвада туған.
Москва университетін бітірген.
Л.
А. Чугаевтың платиналық металдардың
химиясы жөнінде істеген
Координациялық
теория бойынша комплексті қосылыста
орталық орын алып
Комплекс
түзушінің айналасына, соның әсері
жететіндей жақындатқанда жиналған,
[Рі(NНз)4],
Сi,- [NН4]С1, [Рі(NНз)2С12]С12 т.б. Комплексті
қосылысты суға
[РІ(NН3)4С12]С12
[Рі(NНз)4С12]” + 2С1
Комплекстің
ішкі сферасында координацияланатын
лигандтар
Комплексті
қосылыстың қүрамы белгілі болса, комплекс
түзушінің зарядын
Осы
уақытқа дейін оқыған және алдымызда
оқитын атомдық
Құрамында
оттек бар қосылыстар —
таллогидраттар
түзеді), спирттер (алкоголяттар түзеді),
қышқылдар (ацидат
түзеді),
альдегидтер мен кетондар да комплекстің
ішкі сферасына
Құрамында
азот бар
органикалық
аминдер (аминат түзеді), нитридтер,
амидтер т. б.
ішкі
сфераға кіре алады.
Құрамында
күкірт бар
эфирлер
т. б. қосылыстар да ішкі сфераға кіріп
Тұздар
және түздардың қос түз типті комплексті
қосылыстары.
Полигалогенид,
полисульфид сияқты комплексті қосылыстар.
6.
Күрделі қышқылдар (изополиқышқылдар,
гетерополиқышқылдар).
Химияда
неше комплекс түзуші элемент болса,
соның әрқайсысы
Комплекс
иондарының беріктігі әр түрлі болады,
мысалы Қ2[РіС1б]
Координациялық
сан 2 бір валентті күміс А§, алтын
Ш~
Орталық атом
о ©
о
Координациялық
сан 3 сирек кездеседі. Мысал ретінде
сынаптың
Комплекс
түзушінің координациялық саны 4 болғанда
комплексті ионның
[ВеҒ4]2~,[ВҒ4Г,„
[ВСI]”, [ВВг4]-,
Жазық
квадратты комплекстерді
[Р1С14]2+,
[Рс1С14]2~, [АиСI]” және т. б.
Координациялық
саны 5 болып келетін комплекстер сонша
көп
Ең
жиі кездесетін координациялық сан 6.
Мұндай комплекстердің
Шынында
да қос тұздар мен комплексті тұздардың
арасында
ал
комплексті тұздар комплекс ион тұзеді.
К2[РіС16]^2ІС +
Сондықтан
қос тұздарды комплексті тұздардан
айырмашы-
лығын
көрсету үшін К2[СиС14] деп жазбайды,
СиС12-2КС1 деп
жазады.
*
Комплексті
қосылыстардың беріктігік сипаттау
үшін, ком-плексті ионның диссоциациялану
[Р14+1
[СГ]6 т
Неғұрлым
Кт мәні кіші болса, соғұрлым комплексті
ионның
Комплексті
ионның диссоциациялануы қайтымды
Қазіргі
кезде комплексті қосылыстардағы
байланыстың табиғатын қарастыратын үш
1)
валенттік байланыс әдісі, 2) кристальдық
өріс теорйясы,
Орталық
атомның бос орбитальдарының саны оның
комплекс-ті қосылыстағы
Кобальт
катионының валенттік қауызында төрт
бос орбиталь бар
Жұлдызша
(*) белгісі кобальт катионының қозған
күйде екенін
Кобальт
катионының аталған алты орбиталі аммиак
молекуласының құрамындағы
Сонымен
валенттік байланыс әдісі бойынша
комплексті қосылыстағы орталық
Валенттік
байланыс әдісі комплексті қосылыстардағы
орталық атом мен
Аталған
орбитальдар гибридтенгенде алты
sр3<і2-орбитальдар
Аммиакты
комплексте кобальт
Қазіргі
заманғы кристалдық өріс теориясы Коссель
(1916 ж.)
Иондық
түрғыдан бір валентті күмістің
дииодокомпексінің [Аg12] түзілуін
22 2
р —
Д
Сонымен
молекулаға қарағанда комплексті ион
[Аg12] ~ түзілгенде
!-а^
Кристалдық
өріс теориясы бойынша комплексті
қосылыстардың магниттік қасиеттерін
байланысты
болады. Егер, лигандтың тудыратын
Комплексті
қосылыстардың түсі. Комплексті
қосылыстардың түсі (бояуы) электронның
Сонымен
кристалдық өріс теориясы комплексті
қосылыстардың көптеген қасиеттерін
Комплекстер
ішкі сферасының зарядына қарай, катионды,
анионды және
Катионды
комплекстер орталық ионның айналасына
бейтарап молекулалар (N2О,
Анионды
комплекстерде комплекс түзушінің ролін
оң зарядталған ион,
Бейтарап
комплекстер атомның айналасына
молекулалар координацияланғанда
(мысалы, [Nі(СО)4]
Комплекс
түзушінің ролін кезкелген элемент
аткаруы мүмкін. Бірақ,
—СН2
2]2+
[Си(еп)
[си(NН3)А]2+
Хелатты
комплекстер өте түрақты болады. Хелатты
комплекстер түзетін
Бірінші
комплексте сульфат ион орталық атоммен
бір оттек
Қомплекстердің
аталуы. Комплексті қосылыстардың аттары
ұзақ уақыт бойы
Жаңа
номеійклатура бойынша комплекс
қүрамындағы теріс зарядталған лигандтардың
Комплексті
катионды атағанда алдымбн саны көрсетіліп
теріс зарядталған
Сонымен
халықаралық номенклатура бойынша
формула «басынан соңына» қарай
К4[Ғе(СN)б]
-гексацианоферрат (II) калия қазақшасы:
калийдің гексацианофеорраты (II).Күрделі
Қөп
ядролы комплекстердің аталуы. Құрамында
екі немесе дан
(III)(I)
комплексте орталық атомдар Со3+
бірімен-бірі гидроксил (ОН),
Құрамдары
бірдей бірақ құрылысы мен қасиеттері
әртүрлі заттар
Гидраттық
изомерия су молекуласының комплекс
қүрамында әртүрлі орналасуынан
[Сг(Н2О)б]
СІз [Сг (Н2О)5С1] С1
Бұл
изомерлердің судағы ерітінділеріне
Аg+ иондарын қосқанда күлгін
Иондық
изомерия аниондардың ішкі сфера мен
сыртқы сфераға
[Со(NНз)5Вг]SО4
[Со(NНз)SО4]Вг
қызыл-күлгін
қызыл
Қызыл-күлгін
түсті изомер ерітінді де [Со(NН3)5Вг]2+
және $О2~
Координациялық
изомерия екі түрлі лигандтардың
екі
комплекс түзушінің айналасына әртүрлі
жолмен
[Со(NН3)6]
[Сг(СN)6] [Сг(NН3)б] [Со(СN)б]
I II
изомерде
Со3+-тың айналасына аммиак молекулалары,
ал
изомерде
СЫ~ аниондары координацияланған.
Геометриялық
изомерия комплекс қүрамында кем дегенде
екі түрлі
Цис-
изомер (сары түсті) транс- изомер (ашық
сары
Әрбір
лиганд өзіне транс- бағытта орналасқан
лиганд пен
Бұған
деңін қарастырылған қосылыстар атомдық
деп аталады, өйткені
Судағы
ерітінділерінде комплекс қосылыстар
комплекс ионына және қарапайым
К4[Ғе(СN)6—4К++
[Ғе(СN)6]4-
[Си
(NH3) 4] (ОН) 2- ± [Си (N)
Н[АиСI]-Н++[АиСI]-
Кристалда
да, ерітіндіде де құрамында комплекс
ионы болатын
Барлық
комплекс қосылыстарын қамтитын толық
анықтама беру үшін
Комплекс
қосылыстарының құрылысы мен қасиеттерін
Щвецария ғалымы Альфред
1.
Комплекс қосылыстардағы басты орый
комплекс түзуші үлесіне
2.
Комплекс түзушінің маңайына теріс
зарядталған аниондар немесе
Комплекс
түзушінің маңайына орналасқан немесе
координацияланған лигандалардың жалпы
динациялық
саны деп аталады.
Комплекс
түзуші мен лигандалар комплекс
қосылысыныку ішкі сферасын
Ішкі
сфераға симай қалған иондар комплекс
қосылысының сыртқы
Комплекс
қосылыстарының формулаларын жазғанда
ішкі сфера квадрат жақшаға
Негізгі
комплекс түзушілерге Д. И. Менделеев
периодтық системасының
Кейбір
көп кездесетін комплекс түзушілер және
олардық координациялық
Си+,
А^+, Аи+ Си2+, Аи3+, Н^2+ А13+, 2п2+,
Маңызды
лигандаларға мына төмендегі полюсті
молекулалар мен аниондар
Полюсті
молекулалар Н2О, NН3, СО, N0, NH20Н т.
Иондар:
Ғ~, С1~, Вг~, I”, 02~, 0Н~, СN~,
Комплекс
қосылысының сыртқы сферасында аниондар
немесе катиондар болуы
Комплекс
қосылысының формуласын құрастыру үшін
комплекс түзушінің координациялық
Мысалы
комплекс түзуші екі оң зарядты темір
ионынан,
Жоғарыда
келтірілген мәліметтерден Ғе2+ ионының
координациялық саны 6
[Ғе(СN6]
Енді
комплекс ионының зарядын табамыз.
Комплекс ионының заряды
+
2+(-1).6=-4
Комплекс
ионының заряды — 4 болғандықтан сыртқы
сферада
НІшкі
сфераның құрамында бір ғана комцлекс
түзуші болатын
Қурамында
комплекс катионы бар қосылыстың
систематикалық аттарын былай
[Аg(NНз)С1
— диаммин күміс (I) хлориды [Си(Н2О)4]SО4
Н2О
К[Ag(СN)2]—калий
дицианоаргентаты (I)
Nа3[СО(NО2)б]
— натрий гексанитриткобальтаты (III)
Кз[Nі
(NОNSгОзN — калий дитиосульфатодинитрозилниколать
(I)
Сыртқы
сферасы жоқ нейтрал’ комплекстердің
аттарын атаe
үшін
алдымен лигандалардың аттарын онан
кейін атау септігіндег
Rи[Н2О)
(NНз)4SОз]—сульфиттетраамминаква рутений
Комплекс
қосылыстар құрамындағы лигандалардың
типтеріне және комплекс түзушінің
І.Құрамында
бір орын алатын лигандаларболатын
комплекс қосылыстар. Бұларға
Ішкі
сферасында лигандалар түрінде су
молекулалары болатын комплекс
[А1(Н2О)б]С1з;
[Ғе(Н2О)6]SО4-Н2О;
[Сг(Н2O)6](N)з)з;
[Со(Н2О)6]СI; [Ni(Н2O4Br2
Лигандалары
тек аммиак молекулаларынан тұратын
комплекс қосылыстарын аммиакаттар
[СгNН3)6]С13;
[Zп(NН8)4]SО4;.[Аи(NН3)4]С1з
Лигандалары
тек көміртегі (II) оксидінен тұратын
комплекс қосылыстарды
2.
Құрамында лигандалар түрінде тек
аниондар болатын комплекс
Кейбір
ацидокомплекстердің мысалдары төменде
келтірілген: К4[Pd(СNS)б]; К2[Нg(NО3)4];
Кз[Ғе(СN)6];
3.
Сақина тәрізді немесе циклды комплекс
қосылыстар. Сақина
СН2-NН2
Си Н2N-СН2 СН2-NН2
Түзілген
комплекс косылыста лиганда — аминсірке
қышқылы-ның қалдығы
Никель
диметилглиоксиматындағы никель мен
екі лиганда арасында екі
4.
Көп ядролы комплекс қосылыстар. Жоғарыда
қарастырылған бір
Комплекс
қосылыстарының изомер л
Комплекс
иондарыньщ диссоциациялары аз мөлшерде
жүретін қайтымды процесс
Тұрақсыздық
константаларының сандық мәндері комплекс
иондарының тұрақтылығын немесе
Комплекс
иондарының тұрақсыздық константалары
оқу құра-лының (III) қосымша
[Аg
(NН3) 2]+ + 2Н+±Аg+ + 2 [NН4]
Тотығу-тотықсыздану
реакцияларының нәтижесінде бір комплекс
косылысын бұзып басқа
.
Комплекс қосылыстарының иондарын
анықтау
Химиялық
реакциялардың жәрдемімен ерітіндідегі
комплекс қосылыстарының сыртқы және
Дегенмен
Кз[Ғе(СN)б] ерітіндісіне екі зарядты
темір тұздарын қосу
[Ғе(СN)б]4″
комплекс ионын анықтау үшін К4[Ғе(СN)6]
ерітіндісіне үш
Комплекс
қосылыстарда химиялық байланыстардың
түзілуі, бүрын қарастырылған атомдық
Қазіргі
кезде комплекс қосылыстардың түзілуін,
қүрылысын, қасиеттерін үш
Валенттік
байланыс теориясы. Валенттік байланыс
теориясының негізі мынадай
Комплекс
түзуші мен лигандалардың арасындағы
байланыс донорлы-акцепторлы болады.
Комплекс
түзушінің химиялық байланысқа қатысатын
орбитальдары алдымен гибридтеледі,
Комплекс
түзушінің орбитальдарының гибридтелу
типі комплекс қосылысының геометриялық
Комплекс
қосылысында дара электрондар болса
парамагнитті яғни магнитке
Енді
валенттік байланыс теориясы тұрғысынан
бірнеше комплекс түзушілер
Екінші
период элементтері комплекс түзуші
ретінде болса
олардың
бір 5-, үш р-орбитальдары гибридтеледі.
Мысал
ретінде аммоний комплекс ионының [МН4]+
түзілу ме-ханизмін
10
В твердом веществе атомы и молекулы образуют различные геометрические структуры в зависимости от того, как они объединяются. В каждой структуре центральный атом делит электроны с другими атомами или ионными молекулами, и форма структуры зависит от того, как электроны делятся. Координационное число для центрального атома является показателем того, сколько атомов или молекул образуют с ним связи, и это является определяющим фактором молекулярной формы и, в конечном счете, свойств твердого тела. Для ковалентно связанных молекул и комплексов переходных металлов химики получают координационное число из химической формулы. Они вычисляют координационное число для металлических твердых тел, исследуя структуру решетки.
Ковалентно связанные молекулы
В ковалентно связанной молекуле химики определяют координационное число центрального атома путем подсчета числа связанных атомов. Например, в молекуле метана центральный атом углерода связан с четырьмя атомами водорода, поэтому его координационное число равно 4. Это число может быть легко определено из химической формулы для метана: СН 4.
Такое же соотношение имеет место для ионных соединений. Например, координационное число молекулы триоксида углерода (CO 3) 2- равно 3, а заряд иона равен -2.
Комплексы переходного металла
Переходные металлы, которые занимают столбцы с 3 по 12 периодической таблицы, образуют комплексы с группами атомов, называемыми лигандами. Координация переходного металла снова определяется числом атомов, с которыми связан центральный атом. Например, координационное число ионного соединения CoCl 2 (NH 3) 4 + равно 6, потому что центральный атом кобальта связан с двумя атомами хлора и четырьмя атомами азота. В FeN 4 2+ координационное число равно 4, потому что это число связей, образованных центральным атомом железа, даже если атомы азота образуют решетчатый комплекс, связываясь друг с другом.
Металлические твердые частицы
В металлических твердых телах нет четкой связи между парами атомов, поэтому химики определяют координацию структуры, выбирая один атом и считая количество атомов, непосредственно окружающих его. Например, атом, который является частью структуры слоя, может иметь три атома под ним, три над ним и шесть, окружающих его в одном слое. Координационное число для этого атома будет 12.
Атомы в твердом кристалле часто формируют себя в геометрические структуры, называемые клетками, и эти клетки повторяются до бесконечности, чтобы создать кристаллическую структуру. Расшифровка формы ячейки позволяет рассчитать координационное число, которое является одинаковым для каждого атома в структуре. Например, кубическая структура имеет один атом в середине, окруженный по одному в каждом углу, всего восемь, поэтому координационное число равно 8.
Ионные Твердые
Хлорид натрия (NaCl) является примером ионного твердого вещества, которое образовано катионом (Na +) и анионом (Cl –). В ионном металле координационное число катиона равно числу анионов, находящихся в непосредственной близости от него. NaCl представляет собой кубическую структуру, и каждый катион натрия окружен четырьмя ионами хлора в одной плоскости, а также одним снизу и одним сверху, поэтому координационное число равно 6. По той же причине координация каждого аниона хлора также 6.