From Wikipedia, the free encyclopedia
In thermodynamics, the cryoscopic constant, Kf, relates molality to freezing point depression (which is a colligative property). It is the ratio of the latter to the former:
- i is the van ‘t Hoff factor, the number of particles the solute splits into or forms when dissolved.
- b is the molality of the solution.
Through cryoscopy, a known constant can be used to calculate an unknown molar mass. The term “cryoscopy” comes from Greek and means “freezing measurement.” Freezing point depression is a colligative property, so ΔT depends only on the number of solute particles dissolved, not the nature of those particles. Cryoscopy is related to ebullioscopy, which determines the same value from the ebullioscopic constant (of boiling point elevation).
The value of Kf, which depends on the nature of the solvent can be found out by the following equation:
- R is the ideal gas constant
- M is the molar mass of the solvent in kg mol−1
- Tf is the freezing point of the pure solvent in kelvins
- ΔfusH represents the molar enthalpy of fusion of the solvent in J mol−1.
The Kf for water is 1.853 K kg mol−1.[1]
See also[edit]
- List of boiling and freezing information of solvents
References[edit]
- ^ Aylward, Gordon; Findlay, Tristan (2002), SI Chemical Data (5 ed.), Sweden: John Wiley & Sons, p. 202, ISBN 0-470-80044-5
Криоскопическая константа воды
Вычислите криоскопическую константу воды, если водный раствор этилового спирта (C2H5OH) с массовой долей этилового спирта (C2H5OH) 11,3 % замерзает при -5 0С.
Решение задачи
Молекулярная масса этилового спирта (C2H5OH) равна 46 (смотри таблицу Менделеева).
Используя формулу нахождения понижение температуры замерзания раствора:
![]()
Где:
Δtзам – понижение температуры замерзания раствора;
KK – криоскопическая константа растворителя;
g – масса растворенного вещества, г;
G – масса растворителя, г;
Mr – молекулярная масса растворенного вещества.
Находим криоскопическую константу воды:
![]()
Получаем:
KK = 5 ⋅ 88,7 ⋅ 46 /1000 ⋅ 11,3 = 1,81 (0С).
Криоскопическая константа воды равна 1,81 0С.
Ответ:
криоскопическая константа воды равна 1,81 0С.
Эбуллиоскопическая и криоскопическая константы
|
Растворитель |
К |
Е |
|
Вода |
1,86 |
0,52 |
|
Бензол |
5,10 |
2,57 |
|
Этиловый |
2,12 |
— |
|
Фенол |
7,3 |
3,60 |
|
Ацетон |
— |
1,80 |
|
Уксусная |
3,9 |
3,1 |
|
ССl4 |
2,98 |
5,3 |
Методы
криоскопии и эбуллиоскопии позволяют
определить молекулярную массу не
диссоциирующих
при растворении веществ (обычно
органических) по понижению температуры
замерзания и повышению температуры
кипения растворов известной концентрации.
Закон
Рауля и следствие в полной мере приложимы
для описания свойств идеальных растворов.
Очевидно, что понятие идеального раствора
не определяется его концентрацией,
достаточно лишь отсутствие взаимодействия
компонентов. Однако на практике
встречаются очень
мало систем, которые в широком интервале
концентраций удовлетворяют условию
идеальности. В то же время существует
категория растворов, для которых законы
идеальных растворов
могут быть использованы с достаточной
точностью. Это так называемые разбавленные
растворы, в которых концентрация
растворенного вещества мала, вследствие
чего
можно пренебречь взаимодействием
растворенных частиц. Термодинамика не
устанавливает
количественного критерия разбавленного
раствора. Единственным критерием
является применимость в данном интервале
концентраций законов идеальных растворов.
Все
приведенные закономерности относятся
к бесконечно разбавленным идеальным
растворам.
Применение их к реальным растворам
ограничено тем в большей степени, чем
выше
концентрация раствора.
Растворы
электролитов и их свойства
В
1887 г. Вант-Гофф установил, что определенное
экспериментально осмотическое давление
в растворах электролитов превышает
вычисленное практически. Подобные
отклонения
измеренных величин от вычисленных
наблюдаются также для температуры
кипения и замерзания растворов
электролитов. Не зная,
как можно объяснить эти отклонения, но
стремясь приспособить уравнения,
описывающие
свойства растворов неэлектролитов, к
растворам электролитов, Вант-Гофф ввел
поправочный множитель i,
названный изотоническим
коэффициентом. Подставляя
коэффициент
i
в уравнения для расчетов он получил
соотношения, пригодные для описания
свойств разбавленных растворов всех
веществ, в том числе и для растворов
электролитов
(Р0
– Р)/Р0
= iХА;
t
= iКст,;
Росм
= iсRТ
Коэффициент
i,
физический смысл которого Вант-Гофф не
выяснил, зависит от природы
раствора и его концентрации, но для
одного и того же раствора значение i
одинаково
во всех трех приведенных уравнениях.
Аррениус установил, что коэффициент i
растет
при разбавлении раствора.
Взаимодействие
с растворителем растворенного вещества
может вызвать распад последнего на
ионы. Распад растворенного вещества на
ионы под действием молекул растворителя
называется электролитической
диссоциацией или
ионизацией веществ в растворах.
Возможность
и степень распада растворенного вещества
на ионы определяется природой
растворенного вещества и растворителя.
Электролитической диссоциации
подвергаются
ионные соединения и молекулярные
соединения с полярным типом связи в
полярных растворителях. Вода является
сильнейшим полярным растворителем.
В
зависимости от структуры растворяющегося
вещества в безводном состоянии его
диссоциация протекает по-разному.
Наиболее типичны при этом два случая.
Один из них – это диссоциация растворяющихся
солей, то есть кристаллов с ионной
структурой, второй – диссоциация при
растворении кислот, то есть веществ
состоящих из полярных молекул.
Когда
кристалл соли, например хлорида калия,
попадает в воду, то расположенные на
его поверхности ионы притягивают к себе
полярные молекулы воды (ион-дипольное
взаимодействие). К ионам калия молекулы
воды притягиваются своими отрицательными
полюсами, а к хлорид-ионам – положительными.
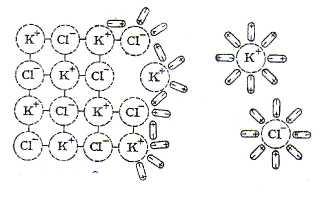
Схема
растворения соли
Но
если ионы притягивают к себе молекулы
воды, то и последние с такой же силой
притягивают к себе ионы. В то же время
притянутые молекулы воды испытывают
толчки со стороны других молекул,
находящихся в движении. Этих толчков
вместе с тепловыми колебаниями ионов
в кристалле оказывается достаточно для
отделения ионов от кристалла и перехода
их в раствор. Вслед за первым слоем ионов
в раствор переходит следующий слой, и
таким образом идет постепенное растворение
кристалла.
Иначе
протекает диссоциация полярных молекул.
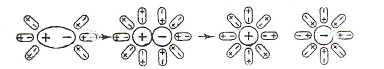
Схема
диссоциации полярных молекул в растворе
Молекулы
воды, притнувшиеся к концам полярной
молекулы (диполь-дипольное взаимодействие),
вызывают расхождение ее полюсов –
поляризуют молекулу. Такая поляризация
в сочетании с колебательным тепловым
движением атомов в рассматриваемой
молекуле, а также с непрерывным тепловым
движением окружающих ее молекул воды,
приводит, в конечном счете, к распаду
полярной молекулы на ионы. Как и в случае
растворенного ионного кристалла, эти
ионы гидратируются. При этом ион водорода
(Н+)
(т.е. протон) оказывается прочно связанным
с молекулой воды в ион гидроксония Н3О+.
Так, при растворении в воде хлороводорода
происходит процесс, который схематически
можно выразить уравнением:
Н2О
+ НСl
= H3O+
+ Cl–
Диссоциацию
молекул кислоты можно объяснить
образованием дополнительной ковалентной
связи (донорно-акцепторной). При этом
общую связывающую электронную пару
представляют не оба атома, а только один
из них.
Диссоциации
веществ как ионного, так и молекулярного
строения способствует полярность
молекул растворителя. Поэтому не только
вода, но и другие жидкости, состоящие
из полярных молекул (муравьиная кислота,
этиловый спирт, аммиак и др.), также
являются ионизирующими растворителями,
а соли, кислоты и основания, растворенные
в этих жидкостях, диссоциируют на ионы.
Вещества,
распадающиеся в растворах или расплавах
на положительно заряженные (катионы)
и отрицательно заряженные (анионы) ионы,
называются электролитами.
Растворы
электролитов способны проводить
электрический ток. Электролитами
являются кислоты,
щелочи, большинство солей.
Отмеченные
выше отклонения свойств растворов,
определенных экспериментально, от
вычисленных нельзя объяснить иным,
кроме как увеличением числа частиц
растворенного вещества,
то есть диссоциацией молекул электролита
в растворе на более мелкие частицы.
Аррениус
пришел к следующему выводу: диссоциация
молекул растворенных электролитов
на ионы происходит не под действием
электрического тока, а уже в процессе
растворения, независимо от того,
пропускают через раствор электрический
ток или нет (электролитическая
диссоциация). В результате этого процесса
в растворе увеличивается число
частиц, поэтому коэффициент i
принимает
значения больше единицы.
Для
количественной характеристики соотношения
диссоциированных и недиссоциированных
молекул электролита при данных условиях
пользуются понятием степени
электролитической диссоциации ().
Степень
электролитической диссоциации
равна
отношению числа молекул, распавшихся
на ионы, к общему числу молекул
растворенного
вещества:
=
Nu/No
где
Nu
– число молекул распавшихся на ионы; No
– общее число молекул растворенного
вещества.
Степень электролитической диссоциации
зависит от:
-
природы
растворенного вещества и растворителя; -
температуры;
-
концентрации.
Роль
растворителя в процессе электролитической
диссоциации велика. Чем больше
диэлектрическая
проницаемость растворителя, тем больше
его ионизирующее действие. Растворитель
уменьшает силу взаимодействия частиц
в полярной молекуле или силу взаимодействия
ионов в кристалле. Она связана с i
соотношением
=
(i-1)/(n-1).
По
степени диссоциации электролиты
разделяются на сильные, слабые и средние.
Принято
считать сильными электролитами те, для
которых
> 30%, слабыми – если
< 3% и средние – если 3%<
< 30%. К сильным электролитам относятся
почти все соли, многие неорганические
кислоты (НNOз,
Н2SО4,
НС1О4,
НС1, НВr,
HI
и др.) и гидроксиды щелочных (
= 90%) и щелочно – земельных металлов (
≈ 60%). Электролитами средней силы являются
некоторые
органические и неорганические кислоты
(Н2С2О4,
НСООН, Н2SО3,
Н3РO4
и др.), к
слабым электролитам – кислоты Н2S,
НСN,
Н2SiOз,
НзВОз, гидроксиды многих d-элементов
(Сu(ОН)2,
Сr(ОН)3
и др.), а также некоторые соли (НgС12,
СdСl2,
Fе(SСN)3)
(
≈ 2%).
Для
описания реальных свойств растворов
сильных электролитов, на которые
значительное
влияние оказывает электростатическое
взаимодействие между ионами, усиливающееся
с увеличением концентрации раствора,
вводится понятие эффективной (кажущейся)
концентрации, или активности
а. Это
понятие ввел Льюис в 1907 г. Активность
(а) связана с истинной концентрацией
растворенного вещества (с) соотношением:
a
= f∙c, (1.12)
где
f
– коэффициент активности. Величина f
рассматривается как кажущаяся степень
диссоциации
сильных электролитов. Она отражает все
имеющие место в данной системе
взаимодействия
силовых полей. Чем слабее межионное
взаимодействие в растворе, тем ближе
значение f
к единице. В сильно разбавленных растворах
f
= 1, а = с. Активность выражается
в тех же единицах, что и концентрация,
поскольку коэффициент активности
-величина
безразмерная.
Диссоциация
воды. Водородный показатель
Вода
служит не только наиболее
распространенным растворителем для
многих веществ,
но и сама является очень слабым амфотерным
электролитом:
Н2О
↔ H+
+
ОH–;
∆Н°298
= 56 кДж /моль,
в
воде присутствуют катионы водорода и
гидроксид – анионы в строго эквивалентных
количествах.
Константа ионизации воды (Кu)
Ku
= [H][OH–]/[H2O],
определена
по электрической проводимости и равна
1,8∙10-16
при 22 °С. Так как вода – очень слабый
электролит, то концентрация
недиссоциированных молекул может быть
принята
равной
общему числу молей в 1 дм3
воды, то есть: [Н2О]
= 1000/18
= 55,56 моль/дм3.
Тогда Ки
[Н20]
=
[H+]
[ОН–]
или
[H+][ОН–]
= 1,8∙10-16
∙55,56 = 10-14
= Кw
Величина
[Н+
][ОН–]
= 10-14
называется ионным
произведением воды. Так
как в воде концентрации
гидратированных ионов равны, то
____
[H+]=
[ОH–]
=
√10-14
=10-7
моль/дм3
При
добавлении кислоты концентрация ионов
водорода увеличивается и соответственно
уменьшается концентрация гидроксид –
ионов, поскольку при данной температуре
ионное произведение воды – величина
постоянная. При добавлении щелочи
наблюдается обратная зависимость. Таким
образом, концентрация ионов водорода
в растворе может служить мерой кислотности
или щелочности среды. В кислых растворах
[Н+]10-7,
в щелочных [Н+]10-7.
В
1909 г. Сёренсен ввел значение отрицательного
десятичного логарифма концентрации
водородных ионов, которое называют
водородным
показателем рН
рН=
– lg[H+].
Тогда
для нейтральной среды рН = – lg10-7
= 7, для кислых растворов рН
7, а для щелочных рН
7. Аналогичным образом реакция среды
может быть охарактеризована так
называемым гидроксильным
показателем рОН
рОН
= -lg[OH–].
Для
воды рН = рОН = 7, а изменение рОН в кислых
и щелочных растворах противоположно
изменению рН. Прологарифмировав ионное
произведение воды, получим
lg[H+]
+ lg[OH–]
= -14.
Заменив
отрицательные логарифмы, получим
соотношение
рН
+ рОН = 14.
Наглядно
зависимость между концентрацией ионов
водорода, значением рН и реакцией
раствора можно выразить схемой:
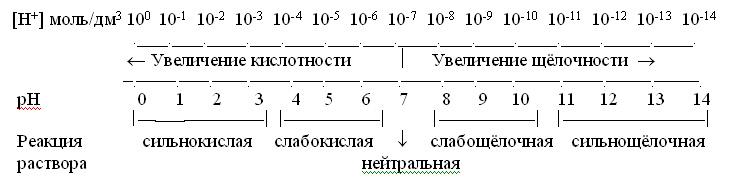
Из
схемы видно, что чем меньше рН, тем больше
концентрация ионов Н+,
т.е. тем выше кислотность среды; и
наоборот, чем больше рН, тем меньше
концентрация ионов Н+,
т.е. тем выше щелочность среды. Исключительно
важна роль реакции среды в самых различных
явлениях и процессах, как в природе, так
и в медицинской практике. Многие процессы,
протекающие в живых организмах, требуют
определенной реакции среды.
Гидролиз
солей
Реакции
обменного разложения между водой и
соответствующими соединениями называются
гидролизом.
Он
является частным случаем сольволиза
–
обменного разложения
растворенного
вещества и растворителя. Наиболее
типичным случаем является гидролиз
солей
в водных растворах. Гидролиз солей,
распадающихся в растворе на ионы, зависит
от природы
катионов и анионов. Чем сильнее
поляризующее действие ионов, тем в
большей степени
протекает гидролиз.
Рассмотрим
гидролиз соли, образованной сильным
гидроксидом и сильной кислотой
Поляризующее
действие невелико у катионов щелочных
и щелочноземельных металлов (Nа+,
К+,
Ва2+),
то есть катионов образующих сильные
гидроксиды – щелочи, и анионов (Сl,–
Вr–,
I–,
N0–3,
СlО–4,
SО2-4),
образующих сильные кислоты. Поэтому
соли, образованные катионами
сильного гидроксида и анионами сильной
кислоты, практически не подвергаются
гидролизу,
рН растворов таких солей 7. Например,
гидролиз NаNО3:
Na+
+ НОН – реакция
практически не идет
N03–
+
НОН – реакция
практически не идет
NaNОз
гидролизу практически не подвергается.
Если
соль при растворении ионизуется на
катионы, образующие сильные основания
(Na+,К+,Ва2+)
и
анионы, образующие слабые кислоты
(СО32-,
РО4-3,
SОз2-,
S2-,СN–),
то
происходит
гидролиз по аниону и в результате
создается щелочная среда (рН > 7)
CO32-
+ HOH
↔ HCO3–;
+ OH–.
Такой
тип гидролиза имеет место у солей сильных
гидроксидов и слабых кислот. Очевидно,
чем слабее кислота, тем гидролиз протекает
интенсивнее. Гидролиз многозарядного
аниона протекает ступенчато в связи со
ступенчатой диссоциацией многоосновных
кислот и при обычных условиях протекает
по первой ступени. Например
К2СО3
+
НОH
↔ КHСO3
+ КОН
СНзСООNа
+ НОН
↔ СН3СООН
+ NаОН
Если
соль при растворении ионизируется на
сильно поляризующие катионы (Zп2+,
Си2+,
Fе3+,
Сr3+,
Аl3+
и
т.п.), образующие слабые гидроксиды и
анионы сильных кислот (Сl–,
Вr–,
I–,
NОз–,
СlО4–,
SО42-),
то
происходит гидролиз по катиону. В
результате в растворе создается
кислая среда (рН < 7)
Си2+
+ НО↔ СиОН+
+ Н+.
Этот
тип гидролиза имеет место у солей слабых
гидроксидов и сильных кислот. Гидролиз
многозарядного
катиона протекает ступенчато в связи
со ступенчатой диссоциацией гидроксидов
и при обычных условиях протекает по
первой ступени (для металлов Ме2+)
и
по 1,2
ступеням (для Ме3+).
Например
ZпС12
+ НОН ↔ Zп(ОН)С1
+
НС1
А12(S04)3
+ 2НОН ↔ 2А1(ОН)SО4
+ Н2SО4
2А1(ОН)SО4
+
2НОH
↔
[А1(ОН)2]2SО4
+ Н2SО4
Если
соль при растворении ионизируется на
катионы, образующие слабые основания
и анионы
слабых кислот, то происходит гидролиз
и по аниону и по катиону. При этом
образуются
малорастворимые слабые гидроксиды и
слабые кислоты
А12(СО3)3
+ ЗНОН =
2А1(ОН)3
+ ЗСО2.
Гидролиз
протекает необратимо и характер среды
определяется относительной силой
образующихся
продуктов.
Если
в раствор гидролизующейся соли ввести
реактив, связывающий образующиеся ионы
H+
и ОH–,
то в соответствии с принципом Ле-Шателье,
равновесие смещается в сторону
усиления гидролиза, в результате гидролиз
может протекать полностью, до образования
его конечных продуктов. При этом ионы
H+
или ОH–
можно связать в молекулы воды,
вводя в раствор не только щелочь или
кислоту, но и другую соль, гидролиз
которой приводит
к накоплению в растворе ионов Н+
или
ОH–.
Эти ионы будут нейтрализовывать друг
друга, что вызовет взаимное усиление
гидролиза обеих солей и в результате –
образование
конечных продуктов гидролиза. Например,
при смешивании растворов Na2S
и
CrCl3,
в которых соответственно имеется избыток
ионов Н+
и
ОH–,
взаимное усиление гидролиза
приводит к выделению газа Н2S
и
образованию осадка Сr(ОН)3
ЗNа2S
+ 2СrС13
+ ЗНОН = ЗН2S
+ 2Сr(ОН)3
+
6NaС1;
3S2-
+ 2Сr3+
+ ЗНОН = ЗН2S
+ 2Сr(ОН)3.
Количественно
гидролиз соли характеризуется степенью
гидролиза h
и
константой гидролиза
Кг,
степень
гидролиза. Чем
слабее кислота (гидроксид), образующая
(образующее) соль, тем сильнее соль
гидролизуется, Кг
ее больше. Гидролиз процесс эндотермический,
поэтому при повышении температуры
константа гидролиза увеличивается.
Буферные
растворы
Если
к разбавленным растворам сильных кислот
или щелочей добавлять воду, кислоты или
щелочи, то происходит резкое изменение
[Н+]
и
[ОН–].
В
смесях водных растворов слабых
кислот и их солей, а также в смесях слабых
гидроксидов и их солей концентрации
ионов
водорода и гидроксида зависят не от
абсолютных количеств, а от соотношений
кислоты
или гидроксида и их солей. Это значит,
что величина [H+]
в
таких смесях не зависит от
умеренного разбавления смеси. Растворы,
рН которых резко не изменяется при
добавлении к ним умеренных количеств
кислот, щелочей, а также при умеренном
разбавлении,
называются буферными
растворами.
Буферные растворы можно рассматривать
как
смеси электролитов, имеющих одноименные
ионы. Такими буферными растворами
являются
следующие смеси
-
СНзСООН
+ СНзСООNа – ацетатная
буферная смесь; -
НСООН
+ НСООNа – формиатная
буферная смесь; -
NH4OH
+ NH4Cl
– аммиачно-аммонийная буферная смесь;
–
Na2СО3
+ NaHCO3
–
карбонатная буферная смесь;
–
Nа2НРО4
+
NaH2PO4
– фосфатная
буферная смесь.
Буферные
растворы, представляющие собой смеси
слабых кислот и их солей, как правило,
имеют кислую реакцию (рН < 7). Например,
буферная смесь
0,1
М раствора СНзСООН
+0,1
М раствора СН3СООNа
имеет
рН = 4,7. Буферные растворы, представляющие
собой смеси слабых гидроксидов и их
солей, как правило, имеют щелочную
реакцию (рН > 7). Например, буферная
смесь 0,1 М раствора NH4OH
+0,1
М раствора
NH4С1
имеет рН = 9,2.
Буферное
действие. Действие
буферных растворов основано на том, что
отдельные компоненты буферных смесей
связывают ионы водорода или гидроксила
при добавлении к ним кислот
или щелочей с образованием слабых
электролитов. Например, если к буферному
раствору, содержащему слабую кислоту
НАn
и соль этой кислоты KtАn,
прибавить щелочь, то
произойдет реакция образования слабого
электролита – воды
Н+
+ ОН
↔ Н2О.
Вместо
израсходованных ионов водорода,
вследствие последующей диссоциации
кислоты НАn,
появляются новые ионы водорода. В
результате прежняя концентрация ионов
Н+-ионов
в буферном растворе восстановится до
ее первоначального значения. Подобным
образом
можно объяснить действие других веществ
на буферные смеси
Буферная
емкость. Способность
буферных растворов поддерживать
постоянство значения
рН не безгранична и зависит от качественного
состава буферного раствора и концентрации
его компонентов. При добавлении к
буферному раствору значительных
количеств
сильной кислоты или щелочи наблюдается
заметное изменение рН. Причем для
различных
буферных смесей буферное действие
неодинаково, то есть буферные смеси
можно различать
по силе оказываемого ими сопротивления
по отношению к действию кислот и щелочей,
вводимых в буферный раствор в одинаковых
количествах и определенной концентрации.
Предельное количество кислоты или
щелочи определенной концентрации,
которое
можно добавить к 1 дм3
буферного раствора, чтобы значение рН
его изменилось только
на единицу, называют буферной
емкостью.
Если
величина [Н+]
одного буферного раствора изменяется
при добавлении сильной кислоты
(щелочи) меньше, чем величина [Н+]
другого буферного раствора при добавлении
того
же количества кислоты (щелочи), то первая
смесь обладает большей буферной емкостью.
Для одного и того же буферного раствора
буферная емкость тем больше, чем выше
концентрация его компонентов.
Водородный
показатель (рН) растворов
В
растворах величина рН может меняться
в широких пределах. Для определения рН
раствора и в реакциях нейтрализации
используют так называемые кислотно-основные
индикаторы,
которые представляют собой слабые
органические кислоты или гидроксиды,
имеющие различную окраску в зависимости
от рН среды. В таблице приведены наиболее
употребительные кислотно-основные
индикаторы и указан интервал рН, в
котором происходит изменение окраски
индикатора.
Свойства
кислотно-основных индикаторов
|
Индикатор |
Интервал перехода |
Изменение |
||
|
нейтральная |
кислая |
щелочн. |
||
|
Метиловый |
3,1 |
оранжевый |
красный |
желтый |
|
Метиловый |
4,2 |
оранжевый |
красный |
желтый |
|
Бромтимоловый |
6,0 |
синий |
желтый |
синий |
|
Лакмус |
5,8 |
фиолетовый |
красный |
синий |
|
Тимоловый |
8,0 |
синий |
желтый |
синий |
|
Фенолфталеин |
8,3 |
бесцветн. |
бесцветн. |
красный |
|
Тимолфталеин |
9,5 |
бесцветн. |
бесцветн. |
синий |
Для
определения концентрации галогенид-ионов,
участвующих в реакциях осаждения,
используют осадительные (К2СrO4),
металлохромные и адсорбционные
индикаторы. Металлоиндикаторы (хромоген
черный, хром темно-синий, мурексид);
используют в комплексонометрии при
определении Са2+,
Mg2+,Zn2+,Al3+
– ионов и т.д.
В
качестве окислительно–восстановительных
индикаторов могут выступать титрант
КMnO4
или дифениламин.
Применение
Широкое
применение в медицинской практике
находят растворы различных лекарственных
форм. В качестве растворителя чаще всего
используют воду или спирт (этанол).
Применение того или другого раствора
зависит от его состава и концентрации.
Например, водный раствор хлорида натрия
(0,9 %) применяется в качестве изотонического
раствора для инъекций, а в концентрациях
3-10 % (гипертонический раствор) для лечения
гнойных ран. Раствор глюкозы (4,5-5 %) –
изотонический раствор – используют для
пополнения организма жидкостью и как
источник легкоусвояемого организмом
ценного питательного материала, а
гипертонический раствор (10-40 %) применяется
для быстрого и полного усвоения глюкозы
иногда с инсулином или аскорбинатом
магния при гипертонической болезни.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 24 сентября 2021 года; проверки требуют 4 правки.
Зако́ны Рау́ля — общее название открытых французским химиком Ф. М. Раулем в 1887 году количественных закономерностей, описывающих некоторые коллигативные (зависящие от концентрации, но не от природы растворённого вещества) свойства растворов.
Первый закон Рауля[править | править код]
Первый закон Рауля связывает давление насыщенного пара над раствором с его составом; он формулируется следующим образом:
- Парциальное давление насыщенного пара компонента раствора прямо пропорционально его мольной доле в растворе, причём коэффициент пропорциональности равен давлению насыщенного пара над чистым компонентом.
Для бинарного раствора, состоящего из компонентов А и В (компонент А считаем растворителем), удобнее использовать другую формулировку:
- Относительное понижение парциального давления пара растворителя над раствором не зависит от природы растворённого вещества и равно его мольной доле в растворе.

На поверхности оказывается меньше молекул растворителя, способных испаряться — ведь часть места занимает растворённое вещество.
Растворы, для которых выполняется закон Рауля, называются идеальными. Идеальными при любых концентрациях являются растворы, компоненты которых очень близки по физическим и химическим свойствам (оптические изомеры, гомологи и т. п.), и образование которых не сопровождается изменением объёма и выделением либо поглощением теплоты. В этом случае силы межмолекулярного взаимодействия между однородными и разнородными частицами примерно одинаковы, и образование раствора обусловлено лишь энтропийным фактором.
Отклонения от закона Рауля[править | править код]
Растворы, компоненты которых существенно различаются по физическим и химическим свойствам, подчиняются закону Рауля лишь в области очень малых концентраций; при больших концентрациях наблюдаются отклонения от закона Рауля. Случай, когда истинные парциальные давления паров над смесью больше, чем вычисленные по закону Рауля, называют положительными отклонениями, а противоположные случаи — отрицательными отклонениями.
Причиной отклонений от закона Рауля является то обстоятельство, что однородные частицы взаимодействуют друг с другом иначе, чем разнородные (сильнее в случае положительных и слабее в случае отрицательных отклонений).
Реальные растворы с положительными отклонениями от закона Рауля образуются из чистых компонентов с поглощением теплоты (ΔНраств > 0); объём раствора оказывается больше, чем сумма исходных объёмов компонентов (ΔV > 0). Растворы с отрицательными отклонениями от закона Рауля образуются с выделением теплоты (ΔНраств < 0); объём раствора в этом случае будет меньше, чем сумма исходных объёмов компонентов (ΔV < 0).
Второй закон Рауля[править | править код]
Отличие давления паров над раствором от давления паров над чистым растворителем существенно влияет на процессы кристаллизации и кипения. Из первого закона Рауля выводятся два следствия, касающиеся понижения температуры замерзания и повышения температуры кипения растворов, которые в объединённом виде известны как второй закон Рауля.
Понижение температуры кристаллизации растворов[править | править код]
См. также: понижение точки замерзания (англ. Freezing-point depression)
Условием кристаллизации является равенство давления насыщенного пара растворителя над раствором давлению пара над твёрдым растворителем. Поскольку давление пара растворителя над раствором всегда ниже, чем над чистым растворителем, это равенство всегда будет достигаться при температуре более низкой, чем температура замерзания растворителя. Так, океанская вода начинает замерзать при температуре около −2 °C.
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
- Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Повышение температуры кипения растворов[править | править код]
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
- Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
Криоскопическая и эбулиоскопическая константы[править | править код]
Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно, криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1,86 и 0,52 K·моль−1·кг, соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получают экстраполяцией зависимости из области малых концентраций до m = 1 моль/кг.
Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. В общем случае такая замена неправомерна, и для растворов, плотность которых отличается от 1 г/см³, может привести к существенным ошибкам.
Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов.
Растворы электролитов[править | править код]
Законы Рауля не выполняются для растворов (даже бесконечно разбавленных), которые проводят электрический ток — растворов электролитов. Для учёта этих отклонений Вант-Гофф внёс в приведённые выше уравнения поправку — изотонический коэффициент i, неявно учитывающий диссоциацию молекул растворённого вещества:
-
-
;
-
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации.
Литература[править | править код]
- Стромберг А. Г., Семченко Д. П. Физическая химия — М. : Высшая школа, 1999. — 527 с.
- Даниэльс Ф., Олберти Р. Физическая химия — М. : Мир, 1978. — 645 с.
Константа замерзания (криоскопическая постоянная) Кзам, или моляльное понижение температуры замерзания, является величи ной, характерной для данного растворителя и независящей от при роды растворенного вещества. Физический смысл ее ясен из при веденного уравнения К зам — ЭТО понижениб температуры замерза ния раствора, содержащего 1 моль вещества в 1000 г растворителя при условии, что раствор этой концентрации обладает свойствами идеального и растворенное вещество не диссоциирует и не ассо циирует. Для экспериментального определения Кзаи следует изме рить понижение температуры замерзания разбавленных растворов а затем пересчитать эти данные на 1 моль. [c.78]
Р е шеи ие, Д аам = аам. растворителя — 1ам. раствора О — (—0,198) = = 0,198, Криоскопическая константа воды зам = 1,86 К/моль. Из уравнения (9) находим выражение для определения мольной массы растворенного вещества и подставляем все известные значения [c.89]
Пример 3.4. Определение криоскопической константы для неводного растворителя. Нафталин плавится при 80,1 °С. При растворении 0,1106 г антраниловой кислоты в 20 г нафталина точка плавления понижается на 0,278 °С. Вычислим величину криоскопической константы, считая, что в растворе не происходит ассоциации. Мол.вес растворенного вещества равен 137,12. [c.146]
Коллигативные свойства можно использовать для определения молекулярной массы вещества. Например, если, зная массу т растворенного вещества, определить температуру замерзания (кипения) раствора, то. найдя понижение, повышение) температуры замерзания (кипения) раствора, можно вычислить число молей п раств оренного вещества, а затем и саму молекулярную массу вещества М = т1п. Таким образом можно определить степень диссоциации или ассоциации вещества в растворе. В этом случае следует умножить правую часть уравнений (355) и (356) на введенный Вант-Гоффом в соответствии с уравнением (322) коэффициент . Понижение температуры замерзания раствора повареной соли примерно в два раза больше, чем для раствора сахарозы той же моляльной концентрации. На практике чаще используют криоскопический метод, так как он более прост в экспериментальном исполнении, а кроме того, как правило, криоскопическая константа для одного и того же растворителя больше, чем эбулиоскопическая. Для растворителя камфары, например, =40 К-кг/моль. [c.281]
Камфора имеет исключительно высокую криоскопическую константу—40, в то время как, например, для бензола эта константа равна лишь 5,2, а для воды 1,9. Поэтому при работе с камфорой в качестве растворителя наблюдаемые понижения температуры плавления весьма значительны и легко отсчитываются по обычному термометру. Кроме того, камфора хорошо растворяет многие органические веш,ества. Оба эти обстоятельства обусловили широкое применение указанного метода определения молекулярной массы погрешность его обычно лежит в пределах – 5—7%. Этот метод был предложен Растом в 1922 г. [c.68]
Криоскопическая константа соответствующего растворителя или ионной среды определяется с помощью вещества, для которого число частиц в растворе известно. Так, трифенилметан использовался для определения значения Я° бензола, так как [c.312]
При определении молекулярного веса криоскопическим методом в качестве растворителя следует применять дифенил (темп. пл. 70°, криоскопическая константа 8,35). [c.207]
Зная массу взятой для опыта соли, ее молекулярный вес, массу растворителя и его криоскопическую константу и величину понижения температуры замерзания раствора, вычисляют коэффициент Вант-Гоффа, а по последнему находят степень диссоциации. Сравнивают полученное значение с теоретическим и находят относительную ошибку определения. [c.121]
Калибровка термистора и прибора проводится по индивидуальному углеводороду с известным молекулярным весом. В результате калибровки находят криоскопическую константу К, представляющую собой изменение сопротивления термистора (в ом), приходящееся на 1 моль вещества, растворенного в определенном объеме растворителя. Для калибровки применялся х. ч. декалин. [c.117]
Свойства и реакции. (-Ь)-Камфора образует мягкие, полупрозрачные кристаллы с т. пл. 178—179° [а]о=-j-44°. Она обладает сильным характерным запахом. Камфора легко возгоняется и перегоняется с водяным паром она нерастворима в воде, но легко растворима в большинстве органических растворителей, а также — без разложения — в концентрированной серной кислоте и в жидкой двуокиси серы. Обращает внимание необычно высокая криоскопическая константа камфоры (40°), вследствие чего это соединение применяется в качестве растворителя при определении молекулярного веса органических соединений (метод Раста). [c.855]
Точность определения составляет около 5%. Основная ошибка состоит в том, что не учитывается количество вымерзающего растворителя. Однако можно получить более точные данные, если ввести поправку, которую можно вычислить по степени переохлаждения, теплоемкости и удельной теплоте плавления растворителя. В таблице приведены криоскопические константы и поправки для большинства жидкостей. Поправка Р умножается на количество вещества и на величину переохлаждения, выраженную в целых градусах Цельсия. [c.138]
Определение молекулярного веса вещества методами криоскопии и эбуллиоскопии. Если криоскопическая константа К данного растворителя известна, то, пользуясь формулой, можно находить опытным путем молекулярные веса растворенных веществ М [c.214]
Из представленных в табл. 12 данных следует определенная закономерность (с некоторыми исключениями) криоскопическая постоянная тем больше, чем ниже энтальпия плавления в расчете на 1 г вещества. Обе константы, /( и , не зависят ог природы растворенного неэлектролита, а характеризуют лишь растворитель. [c.118]
Растворимость асфальтенов в органических веществах, характер взаимодействия в растворах их частиц между собой и с частицами растворителя, способность частиц асфальтенов ассоциировать или, наоборот, диссоциировать — вот основные качественные характеристики асфальтенов, которые определяют все многообразие их свойств. В зависимости от природы растворителя, концентрации асфальтенов в растворе и температуры асфальтены могут образовывать истинные или коллоидные растворы. Еслп криоскопическое определение молекулярных весов производится в условиях, обеспечивающих получение истинного раствора, а криоскопическая константа растворителя достаточно велика, то получаются, как правило, хорошо воспроизводимые значения молекулярных весов. Фундаментальные исследования Нелленштейна [56—57] по растворимости [c.509]
Значения величин А/кип и Аг зам пропорциональны мо-ляльности раствора. Одномоляльиые растворы различных веществ (неэлектролитов) характеризуются определенными для данного растворителя значениями повышения температуры кипения и понижения температуры замерзания. Повышение температуры кипения одномо-ляльного раствора называется эбуллиоскопической константой растворителя кип, а понижение температуры замерзания — криоскопической константой растворителя [c.207]
Значения величин Д/шш и М зам пропорциональны МО-ляльности раствора. Одномоляльные растворы различных веществ (неэлектролитов) характеризуются определенной для данного растворителя величиной повыше- ния температуры кипения, и, соответственно, понижения температуры замерзания. Повышение температуры кипения оДномоля.тьного раствора называется эбуллиоскопической константой растворителя Яюш, а понижение температуры замерзания — криоскопической константой растворителя зам. [c.196]
Изучение температур затвердевания растворов называют крыо-скопией, а метод определения молекулярных весов по уравнению (VII, 25)—криоскопическим. Константа К поэтому называется также криоскопической константой. В табл. VII, 3 приводятся криоскопические константы некоторых растворителей. [c.235]
Подобные растворы кристаллизуются при температуре, которая на определенное число градусов ниже температуры кристаллизации чистых растворителей. Это понижение температуры кристаллизации называется молярным понижением температуры кристаллизации данного растворителя или его криоскапической константой. Криоскопическая константа воды составляет 1,86° это значит, что растворы, содержащие по 1 молю любого неэлектролита на 1000 г воды, кристаллизуются при температуре — 1,86°С. [c.98]
Определение массы моля вещества с достаточно большой точностью можно получить, применяя растворитель с большой криоскопической константой и значительной разницей между температурой замерзания чистого растворителя и раствора. В этом случае в качестве растворителя можно взять камфару (QoHkiO), у которой температура плавления равна я 178 °С и =40. [c.16]
Для того чтобы перейти от эмпирической формулы соединения к его точной молекулярной формуле, достаточно определить его приближенную молекулярную массу. В приведенной ниже задаче молекулярная масса была установлена по методу Раста. Этот метод основан на том, что при добавлении к чистому веществу (растворителю) каких-либо примесей (растворенных веществ) происходит понижение его температуры плавления (точки. замерзания). Уравнение, показанное ниже, используют для расчета приближенной молекулярной массы по понижению точки замерзания. Оно содержит криоскопическую константу, характерную для канодого растворителя (табл. 3-7). Чем больше константа, тем сильнее будет понижаться точка замерзания растворителя при добавлении определенного числа молей растворенного вещества. Следовательно, использование растворителей с большой криоскопической константой позволяет точнее определять молекулярную [c.112]
Методика работы заключалась в следующем. Во внутреннюю пробирку прибора заливали 20 г индивидуального углеводорода (растворителя) и определяли температуру его кристаллизации. При определении криоскопической константы к растворителю добавляли навеску примеси, взятую на аналитических весах с точностью до 0,0005 г в количестве около 1,0 мол. % и вновь определяли температуру кристаллизации. Криоскопическую константу вычисляли как частное от деления количества примеси (в мол. %) на разность температур кристаллизации чистого растворителя и с добавкой примеси [c.69]
Точность определения молекулярного веса обуславливается величиной криоскопической константы и связанной с этим точностью измерения температуры замерзания. Чем ниже значение криоскопической постоянной, тем точнее должно быть измерение температуры. Для таких растворителей, при использовании которых понижение температуры замерзания составляет всего [c.74]
При криоскопическом измерении молекулярной массы фуроксановых изомеров 1—2 и 3—4 (см. табл. 11) в обычных органических растворителях (уксусной кислоте, бензоле, феноле) отклонение найденной величины от действительной не превышало 1—4%, следовательно, взаимодействие с этими растворителями, а также самоассоциацня не происходили. Об этом же свидетельствует практически полное (в пределах 0,2—0,7%) совпадение величин криоскопической константы А криоск при определении ее по столь химически разным соединениям, как бензил и нафталин, для ряда фуроксановых и фуразановых соединений, перечисленных в табл. 11. [c.93]
Специальные исследования зависимости между молекулярными весами и средними температурами кипения сланцевых продуктов не проводились. В литературе имеются определения молекулярных весов, проведенные Когерманом и Кыллом [10] для нахождения скрытых теплот испарения отдельных фракций смолы с вращающейся реторты Давидсона (см. табл. 41). Определения производились криоскопическим методом, причем в качестве растворителя применялась стеариновая кислота. Точность определений 4%. Константа растворителя была определена, как средняя по нафталину и бензольной кислоте. Средняя температура кипения бралась, как средняя арифметическая начала и конца кипения 25 -ной фракции. [c.88]
В работе Э. И. Адировича с соавторами [12] количество исследуемого вещества при определении криоскопических констант было уменьшено до 2 мл и температура кристаллизации измерялась малоинерционными термисторами Т8Е и Т8Д, сопротивление которых в рабочей области температур (О—7°С) было 7—42 ком, а температурный коэффициент достигал 1160 омГС. С такими датчиками схема позволяла чувствовать изменение температуры в 1,6-10 °С, что в случае использования циклогексана в качестве растворителя соответствует 6,10 мол. % растворенного вещества. [c.15]
Полученное значение будет истинной температурой кристаллизации. Использование табличных значений криоскопических (а также эбулиосконических) констант допустимо лишь при применении растворителей высокой степени чистоты. Во избежание ошибок необходимо непосредственно перед определением молекулярного веса устанавливать константу растворителя по двум-трем веш,ествам известного молекулярного веса. Такая проверка желательна, тем более что для одного и того же [c.499]
Если для выбранного растворителя известны как первая, так и вторая криоскопические константы, и если известно, что он удовлетворяет всем-требованиям, упоминавшимся уже в этом разделе, в отношении идеальности жидкого раствора и отсутствия образования твердых растворов с растворенным веществом, можно прямо применять уравнение (1) в следующей форме (в сочетании только с одним или двумя определениями, произведенными при концентпа тшях в несколько молярных пропентов) [c.236]
Как известно, при определении молекулярных весов по методу Раста производится визуальное наблюдение температуры плавления смеси камфары или другого криоскопического растворителя (с высокой криоскопической константой) с исследуемым веществом в капилляре. [c.220]
В табл. 112 приведены криоскопические и эбулиоскоиическпе константы [8] некоторых растворителей, часто применяемых для определения молекулярного веса тяжелых нефтяных остатков. [c.499]
Если криоскопическая константа К растворителя не известна или он не является криоскопически чистым, то предварительно определяют его крпоскопическую константу. Определение проводят, как описано выи , но с веществом известной молекулярной массы, например со свежевозогнанным нафталином. Зная молекулярную массу нафталина, К рассчитывают по формуле [c.33]
Диоксан был предварительно очищен [6], затем был определен молекулярный вес нескольких известных веществ (фенантрена, бензойной и и-аминобензойной кислот). Полученная исправленная криоскопическая константа равна 5. Температура замерзания диоксана определялась в начале и в конце опыта, и было взято среднее значение. Отсчет как для растворителя, так и для раствора был произведен по максимальной температуре. [c.606]
Свойство растворов. Осмос и осмотическос дявлснир. Давление пэра чистого растворителя и раствора. Закон Рауля. Изменение те.мпературы кипения и замерзания растворов в зависимости от концентрации растворенного вещества. Криоскопические и эбулиоскопические константы различных растворителей. Определение молекулярного веса веществ по температурам кипения и замерзания их растворов. Растворение и плавление. Скрытая теплота плавления. Кривые охлаждения. Изменение температуры плавления вещества при введении примесей. Диаграмма плавкости. Двухкомпонентные системы. Вид диаграммы бинарной системы с эвтектической точкой. Эвтектические сплавы и криогидратные смеси. [c.86]
Весьма высокое значение криоскоинческой константы камфоры нозволяет с успехом использовать последнюю в микрометоде по Расту [23]. Определение молекулярного веса микрометодом было использовано некоторыми исследователями при изучении церезинов и основных составляющих битумов [24—26]. Существенное влияние на степень ассоциации веществ в растворе, помимо температуры, оказывает полярность растворителей. Поэтому иногда использовали для криоскопических измерений нитробензол [22], стеариновую кислоту [27 ], фенол и другие полярные растворители. [c.500]







