Металлическая химическая связь характерна для металлов и их сплавов в кристаллическом состоянии. Образуется за счет обобществления валентных электронов. Для этого типа строения вещества не характерно образование направленных структурированных связей.
Следует отличать различные типы связи элементов кристаллов – металлическую, ионную и водородную, свойственную кристаллам льда.
Механизм создания металлической связи предусматривает отрыв частично свободных электронов от атома с образованием катионов с положительным зарядом, формирующих “остов” кристаллической решетки и электронного облака. При этом металлический кристалл не приобретает положительного или отрицательного заряда.
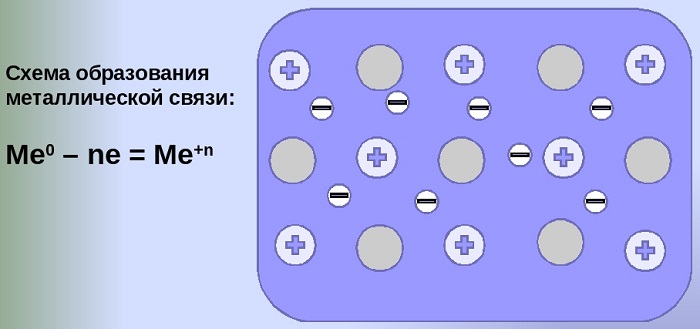
Общий случай формирования связывания металлических атомов в химии, соответствующий данному выше определению:
Me – ne⁻ ⇆ Me,
здесь n – число электронов, участвующих в образовании связи, как правило, от 1 до 3.
В левой части уравнения – атом металла, отдающий электроны, в правой – образовавшийся в результате ион.
Формула показывает, что в кристалле постоянно происходит присоединение и отдача электронов.
Схемы формирования связи на примере атомов различной валентности:
- K – e⁻ ⇆ K;
- Cu – 2e⁻ ⇆ Cu;
- Al – 3e⁻ ⇆ Al.
Отделяющиеся от атома электроны перемещаются на свободные валентные орбитали, которые обобществляются и позволяют всем электронам перемещаться в пределах кристалла. Отделение электронов выгодно атому с точки зрения энергетического баланса, так как позволяет сформировать электронно-стабильную оболочку.
Характерные кристаллические решетки
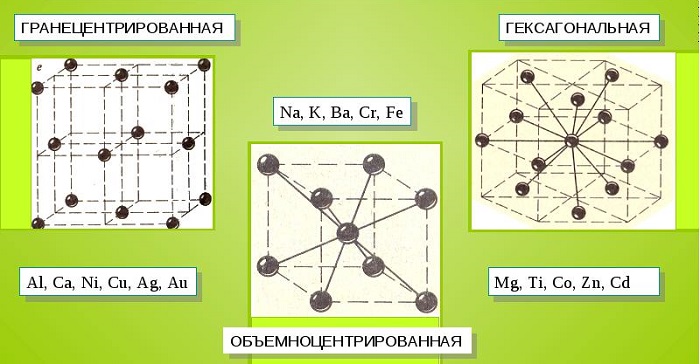
Металлические кристаллы подразделяются на 3 основных типа:
- Объемно-центрированную кубическую решетку, в которой, помимо размещения атомов в четырех вершинах куба, один из них размещается в центре объемной фигуры. Такой тип организации твердого вещества характерен для ряда металлов, включая K, Na и Li, вольфрам, хром, ниобий и др.
- Гранецентрированная кубическая решетка характеризуется расположением атомов в центре граней. Всего в ячейке задействовано 10 атомов, 4 в вершинах и 6 на гранях. Такая решетка встречается у меди, драгметаллов (серебра и золота) и металлов платиновой группы: Pd, Pt.
- Гексагональное строение решетки предполагает размещение атомов в углах и внутри 6-гранной призмы. Ячейка состоит из 15 атомов и свойственна магнию, кальцию, осмию, бериллию и ряду других металлических элементов.
Общими свойствами всех решеток являются высокая симметрия и плотная упаковка составляющих их атомов. Некоторые элементы периодической таблицы формируют уникальную структуру, например, элементарная ячейка In имеет тетрагональное строение.
Для сплавов, являющихся химическими соединениями, также характерно образование кристаллов перечисленных видов, при этом атомы каждого металла занимают определенное место в структуре.
Например, в сплаве никеля и алюминия атомы Al размещаются по углам, а атом Ni – в центре ОЦК ячейки. Свойства сплава и его структура влияют на класс прочности изделия, изготовленного из этого материала.
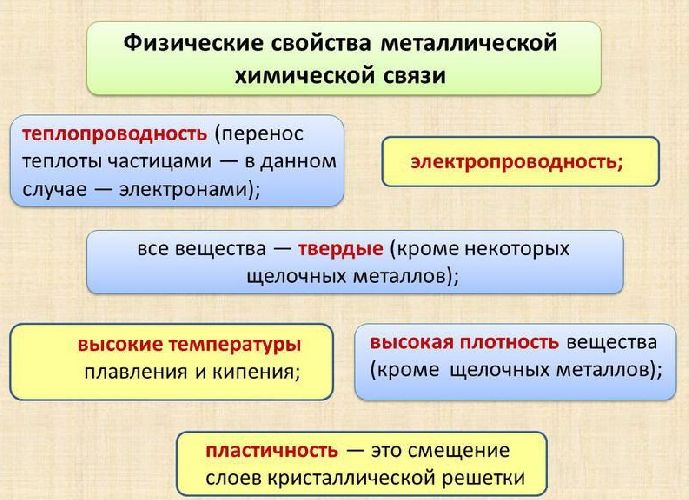
Физические характеристики металлических кристаллов обусловлены способностью обобществленных электронов свободно перемещаться внутри кристалла.

Характеристики, отличающие подобные вещества:
-
хорошая электропроводность, благодаря наличию условно свободного электронного облака;
-
высокая проводимость тепла;
-
низкая реакционная способность или инертность;
-
пластичность – большинство металлов можно гнуть и ковать.
Высокий уровень организации вещества обусловливает металлический блеск. Следует иметь в виду, что повышение прочности при пластической деформации и легировании приводит к образованию частично ковалентной связи.
При деформации могут возникать области повышенной прочности и низкими пластическими свойствами, похожие на вещества с ковалентной связью (например, алмаз).
Помимо рассматриваемой, металлы могут образовывать другие виды связи, включая простую ионную.
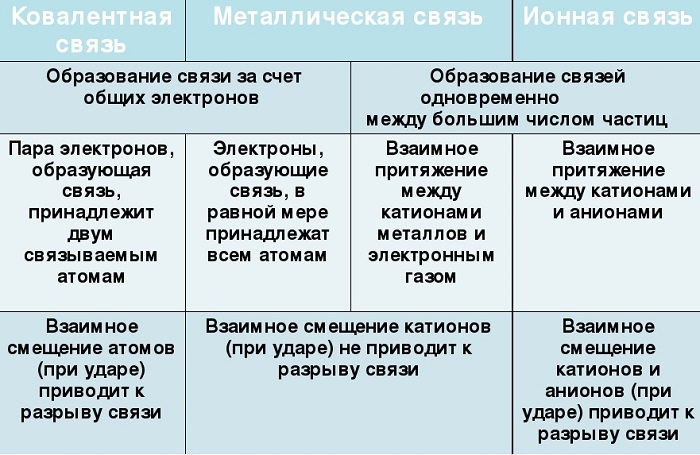
Их общие черты:
-
участие металлов, при этом металлическая связь формируется исключительно атомами металла, а ионная образуется между металлическим и неметаллическим элементами;
-
металл высвобождает электроны и становится катионом;
-
соединения могут существовать в кристаллической форме.
Кристаллы с ионным характером соединения отличают следующие параметры:
- В узлах размещаются как положительно, так и отрицательно заряженные ионы. Каркас металлической решетки формируют исключительно катионы.
- Узлы удерживаются за счет электростатического взаимодействия.
- При низких температурах кристаллические вещества, образованные за счет ионного взаимодействия, проявляют свойства диэлектриков (не проводят ток).
- Переход электронов с атома металла происходит на орбиты атома неметалла.
Характерный пример кристалла с ионной связью – поваренная соль, решетка которой сформирована из ионов Na⁺ и Cl⁻. Такие кристаллические вещества не обладают пластичностью и блеском.
Все металлы имеют сходные свойства: у них характерный металлический блеск, высокая ковкость, хорошая электропроводность и теплопроводность.

Рис. (1). Цинк

Рис. (2). Золото
Эти свойства металлов обусловлены наличием у них особого вида химической связи — металлической связи.
Особенность атомов металлов — небольшое число электронов на внешнем уровне и сравнительно большие радиусы. Поэтому атомы металлов в отличие от атомов неметаллов легко отдают наружные электроны и превращаются в положительные ионы:
Оторвавшиеся от атомов электроны перемещаются от одного иона к другому. Соединяясь с ионами, электроны временно превращают их в атомы:
Потом электроны снова отрываются и присоединяются к другим ионам и так далее.
Эти процессы происходят бесконечно, что можно выразить общей схемой:
Между электронами и положительными ионами возникает электростатическое взаимодействие. Отрицательные электроны и положительно заряженные ионы металла притягиваются.
Суть металлической связи заключается в притяжении положительных ионов металлов и обобществлённых электронов.
Кристаллическая структура металла — это катионы металла, вокруг которых свободно движется обобществлённое электронное облако, принадлежащее всему куску металла.

Рис. (3). Строение кристалла металла
Наличие свободных электронов в металлах обуславливает их общие физические свойства. Металлы хорошо проводят тепло и электрический ток, имеют характерный блеск и ковкость.
Число внешних электронов у атомов металлов различается. Оно равно номеру группы Периодической системы, в которой находится металл. Так, у щелочных металлов способен отрываться от атома один электрон, а у алюминия таких электронов три:
Металлическая связь характерна для чистых металлов и для смесей различных металлов — сплавов (бронза, сталь, чугун, латунь и т. д.), если они находятся в твёрдом или жидком состоянии.

Рис. (4). Сталь

Рис. (5). Изделия из латуни
В парообразном состоянии атомы металлов связаны между собой ковалентной связью. Например, парами натрия заполнены лампы жёлтого цвета для уличных фонарей. Натрий в газообразном состоянии образует двухатомные молекулы. Молекулы натрия неустойчивы, так как при их образовании атомы не получают
восьмиэлектронный внешний слой.
Источники:
Рис. 1. Цинк https://image.shutterstock.com/image-photo/close-zinc-metal-using-be-600w-1496747426.jpg
Рис. 2. Золото https://cdn.pixabay.com/photo/2014/11/01/22/33/gold-513062_960_720.jpg
Рис. 3. Строение кристалла металла © ЯКласс
Рис. 4. Сталь https://cdn.pixabay.com/photo/2020/08/30/04/58/steel-tube-5528518_960_720.jpg
Рис. 5. Изделия из латуни https://cdn.pixabay.com/photo/2016/11/15/18/46/sanitary-engineering-1827125_960_720.jpg
В одной из предыдущих частей мы уже говорили, что металлы характеризуются металлическими свойствами, то есть способностью отдавать электроны, а чуть позднее, это было вот тут, упомянули о том, что говорить о металлической связи мы можем тогда, когда эта самая связь образуется между атомами химических элементов металлов.
Сегодня мы попробуем раскрыть большую часть первоначальных сведений, касающихся металлической связи, что, кстати, позволит понять в том числе и природу физических свойств металлов, поэтому наберитесь терпения, возможно, будет интересно!
Начнём мы несколько издалека, а именно с определения химии (неожиданно). Я не удивлю Вас, если скажу, что
Химия – это наука о веществах, их свойствах и превращениях.
Попробуем коротко раскрыть смысл, заложенный в данном определении. Для этого мы должны прийти к единой точки зрения относительно таких понятий, как вещества и их свойства.
Вещество – это то, из чего состоит физическое тело. И вне всяких сомнений металлы непосредственно относятся к веществам, положенным в основу огромного количества физических тел, так железо (Fe) или медь (Cu) являются веществом для таких физических тел, как гвоздь или проволока. Но мы идём дальше.
А как определить, что такое свойства вещества? Давайте размышлять. Например, у меня есть различные свойства. Рост, вес, возраст и т.д. Совокупность всех моих свойств в конечном итоге отличает меня от Вас. Понимаете? Проводя аналогию с веществами, можно сказать, что
Свойства вещества – это то, что отличает одни вещества от других.
И если физические свойства металлов нам из нашей повседневной практики известны достаточно хорошо, то вопрос о том, чем могут быть обусловлены эти свойства, я думаю, большинству из нас не покажется столь уж простым.
Дело в том, что в химии существует понимание: свойства вещества обусловлены, во-первых, составом вещества, во-вторых, его строением.
И состав и строение в каждом конкретном случае по понятным причинам может значительно изменяться, внося свои существенные коррективы в итоговый результат, но наша задача выделить в этом общее, характерное для металлов!
Общую составляющую состава мы уже коротко обсудили, она включает в себе систему, состоящую из атомов химических элементов металлов, объединённых химической связью, что коротко может быть описано как Ме – Ме.
Чтобы добраться до общего, характеристического для металлов по части строения, нам вновь придётся поразмышлять. Итак, если металлы характеризуются металлическими свойствами, то есть, способностью отдавать электроны, то возникает логичный вопрос: кому они отдают электроны? Представьте, если я хочу отдать электроны, и Вы хотите отдать электроны, как мы можем найти общий язык?
Как выяснилось, атомы химических элементов металлов при образовании химической связи между собой отдают электроны в общее пользование, а в некотором роде освобождают эти электроны, и последние заполняют собой межузловое пространство металлической кристаллической решётки.
Таким образом мы вводим новое для нас понятие:
Кристаллическая решётка – совокупность упорядоченно расположенных в пространстве структурных единиц твёрдого вещества.
Структурные единицы, входящие в состав кристаллической решётки называются узлами. Для удобства работы нашего представления узлы кристаллической решётки соединяют воображаемыми линиями.
В узлах же металлической кристаллической решётки находятся так называемые атом-ионы. Почему?
Дело в том, что освобождая электроны, или отдавая электроны в общее пользование для всей металлической кристаллической решётки, атом металла (Ме) перестаёт быть атомом и приобретает положительный заряд , то есть, становится ионом (катионом).
Данный процесс обратим. (Стрелочка, направленная как в одну сторону, так и в другую, – символ обратимости). То есть, в действительности происходит беспокойный переход атома металла в состояние иона (катиона) с освобождением электронов и наоборот.
Почему же при отдаче электронов атом металла приобретает положительный заряд? Дело в том, что в случае отдачи электронов совокупный отрицательный заряд электронной оболочки уменьшается, а положительный заряд ядра остаётся неизменным и начинает преобладать над отрицательным зарядом электронной оболочки, что приводит к совокупному положительному заряду всей частицы, то есть к состоянию иона (катиона).
Теперь мы наконец-то готовы определить, что же такое металлическая связь:
Металлическая связь – это химическая связь, образованная за счёт обобществлённых (свободных) электронов, между атом-ионами металлов.
Именно наличием в межузловом пространстве металлической кристаллической решётки свободных обобществлённых электронов и объясняются все физические свойства металлов, такие как электропроводность, металлический блеск, ковкость и так далее.
Возможно, поподробнее мы об этом когда-нибудь и поговорим. А на этом у меня всё. Спасибо. Пока.
Металлическая химическая связь


4.3
Средняя оценка: 4.3
Всего получено оценок: 550.
4.3
Средняя оценка: 4.3
Всего получено оценок: 550.
Металлическая связь образуется между атомами в кристалле металла, возникающая за счет перекрытия валентных электронов. Так, что же представляет собой этот вид связи, и в каких соединениях она присутствует?
Что такое металлическая связь?
Металлическая химическая связь существует в металлическом кристалле и в жидком расплавленном состоянии. Ее образуют элементы, атомы которых на внешнем уровне имеют мало электронов (1-3) по сравнению с общим числом внешних, энергетически близких орбиталей.

Валентные электроны из-за небольшой энергии ионизации слабо удерживаются в атоме. Так, у атома натрия на один валентный электрон (3S1) приходится 9 свободных и энергетически близких орбиталей (одна 3s, три 3p и пять 3d).
Из-за малого значения энергии ионизации валентный электрон слабо удерживается и свободно перемещается не только в пределах 9 своих свободных орбиталей, но при плотной упаковке в кристалле и на свободных орбиталях других атомов, осуществляя связь.
Химическая связь сильно делокализована: электроны обобществлены («электронный газ») и перемещаются по всему куску металла, в целом электронейтрального, между положительно заряженными ионами.
Свободное перемещение электронов по кристаллу объясняет ненаправленность и ненасыщенность связи, а также такие физические свойства металлов, как пластичность, блеск, электро- и теплопроводность.
Характерные кристаллические решетки
Металлы почти всегда образуют высокосимметричные решетки с плотно приближенными друг к другу атомами. Выделяют три вида кристаллических решеток:
- кубическая объемно центрированная. В таком виде решетки атомы располагаются на вершине куба и один атом в центре объема куба. Такую решетку имеют следующие металлы: натрий, литий, барий, калий, свинец и многие другие.
- кубическая гранецентрированная. В таком виде решетки атомы располагаются в вершине куба и в центре каждой грани. Такой тип решетки имеют следующие металлы: церий, стронций, никель, серебро, золото, палладий, платина, медь и многие другие.
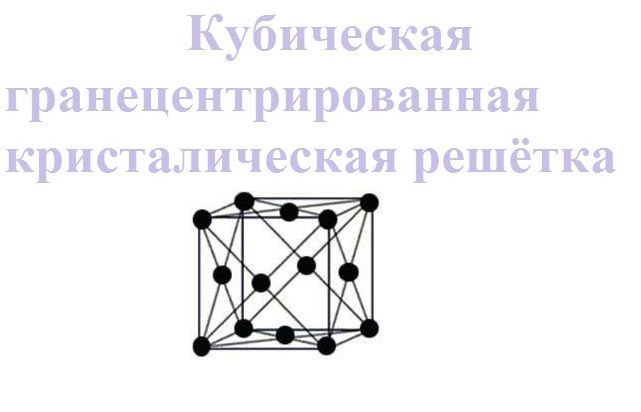
- гексагональная. В таком виде решетки атомы располагаются в вершине и центрах шестигранной оснований призмы, а три атома находятся в средней плоскости этой призмы.
Такой тип кристаллической решетки имеют следующие металлы: магний, кадмий, рений, осмий, рутений, бериллий и многие другие.

Что мы узнали?
Металлическая связь близка по природе к ковалентной, но отличается от нее тем, что обобществление электронов при ее образовании осуществляется сразу многими атомами. В данной статье дается определение понятию «металлическая связь», а также приведены примеры металлической химической связи.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Рамазан Барыктабасов
4/5
-

Евгения Медникова
5/5
-

Артак Саркисян
4/5
Оценка доклада
4.3
Средняя оценка: 4.3
Всего получено оценок: 550.
А какая ваша оценка?
Металлическая
связь возникает между атомами металлов.
Характерной особенностью атомов
металлов является небольшое число
электронов на внешнем энергетическом
уровне, слабо удерживаемых ядром, и
большое число свободных атомных
орбиталей с близкой энергией, поэтому
металлическая связь ненасыщенная.
Валентные
электроны участвуют в образовании
связей сразу с 8-ю или 12-ю атомами (в
соответствии с координационным числом
атомов металлов). В этих условиях
валентные электроны с небольшой энергией
ионизации перемещаются по доступным
орбиталям всех соседних атомов,
обеспечивая связь между ними.
Металлическая
связь
характеризуется слабым взаимодействием
общих электронов с ядрами соединяемых
атомов и полной делокализацией этих
электронов между всеми атомами в
кристалле, что обеспечивает устойчивость
данной связи.
Схема
образования металлической связи (М –
металл):
М
0
– ne
М n+
Металлы
имеют особую кристаллическую решётку,
в узлах которой находятся как нейтральные,
так и положительно заряженные атомы
металла, между которыми свободно
перемещаются (в пределах кристалла)
обобществлённые электроны (“электронный
газ”). Движение общих электронов в
металлах осуществляется по множеству
молекулярных орбиталей, возникших за
счёт слияния большого числа свободных
орбиталей соединяемых атомов и
охватывающих множество атомных ядер.
В случае металлической связи невозможно
говорить о её направленности, так как
общие электроны равномерно делокализованы
по всему кристаллу.
Особенности
строения металлов определяют их
характерные физические свойства:
твёрдость, ковкость, высокую электрическую
проводимость и теплопроводность, а
также особый металлический блеск.
Металлическая
связь характерна для металлов не только
в твёрдом состоянии, но и в жидком, то
есть это свойство агрегатов атомов,
расположенных в непосредственной
близости друг другу. В газообразном
состоянии атомы металлов связаны между
собой одной или несколькими ковалентными
связями в молекулы, например Li2
(Li–Li),
Be2
(Be=Be),
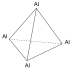
Al4
– каждый атом алюминия соединён с тремя
другими с образованием тетраэдрической
структуры:
4. Водородная связь
Водородная
связь – это особый вид связи, свойственный
только атомам водорода. Она возникает
в тех случаях, когда атом водорода
связан
с атомом наиболее электроотрицательных
элементов, прежде всего фтора, кислорода
и азота. Рассмотрим образование
водородной связи на примере фтороводорода.
У электроотрицательного атома водорода
имеется только один электрон, благодаря
которому он может образовывать
ковалентную связь с атомом фтора. При
этом возникает молекула фтороводорода
Н—F,
в которой общая электронная пара смещена
к атому фтора.
В
результате такого распределения
электронной плотности молекула
фтороводорода представляет собой
диполь, положительным полюсом которого
является атом водорода. Из-за того, что
связывающая электронная пара смещается
к атому фтора, частично освобождается
1s-орбиталь
атома водорода и частично обнажается
его ядро. У любого другого атома
положительный заряд ядра после удаления
валентных электронов экранируется
внутренними электронными оболочками,
которые обеспечивают отталкивание
электронных оболочек других атомов. У
атома водорода таких оболочек нет, его
ядро представляет собой весьма малую
(субатомную) положительно заряженную
частицу – протон (диаметр протона
примерно в 105
раз меньше диаметров атомов, и, вследствие
отсутствия у
него электронов, он притягивается
электронной оболочкой других
электронейтральных или отрицательно
заряженных атомов).
Напряжённость
электрического поля вблизи частично
«обнажённого» атома водорода настолько
велика, что он может активно притягивать
отрицательный полюс соседней молекулы.
Поскольку этим полюсом является атом
фтора, имеющий три несвязывающие
электронные пары, а s–орбиталь
атома водорода частично вакантна, то
между положительно поляризованным
атомом водорода одной молекулы и
отрицательно поляризованным атомом
фтора соседней молекулы возникает
донорно-акцепторное ваимодействие.
Таким
образом, в результате совместного
электростатического и донорно-акцепторного
взаимодействия возникает дополнительно
вторая связь с участием атома водорода.
Это и есть водородная
связь,
…Н–F•••Н–F…
Она
отличается от ковалентной по энергии
и длине. Водородная связь более длинная
и менее прочная, чем ковалентная. Энергия
водородной связи 8–40 кДж/моль, а
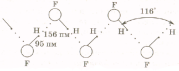
ковалентной 80–400 кДж/моль. В твёрдом
фтороводороде длина ковалентной связи
Н–F
равна 95 пм, длина водородной связи F•••Н
равна 156 пм. Благодаря водородной связи
между молекулами HF
кристаллы твёрдого фтороводорода
состоят из бесконечных плоских
зигзагообразных цепей, так как
образующаяся за счет водородной связи
система из трех атомов, как правило,
линейна.
Водородные
связи между молекулами HF
частично сохраняются в жидком и даже
в газообразном фтороводороде.
Водородная
связь условно записывается в виде трёх
точек и изображается следующим образом:
Y•••H
– X,
где
X, Y – атомы
F, O, N, Cl, S.
Энергия
и длина водородной связи определяются
дипольным моментом связи H–X
и размером атома Y.
Длина водородной связи уменьшается, а
её энергия возрастает с увеличением
разности электроотрицательностей
атомов X
и Y
(и соответственно дипольного момента
связи H–X)
и с уменьшением размера атома Y.
Водородные
связи образуются также между молекулами,
в которых имеются связи О–Н (например,
вода H2O,
хлорная кислота НClO4,
азотная кислота HNO3,
карбоновые кислоты RCOOH,
фенол C6H5OH,
спирты ROH)
и N–Н
(например, аммиак NH3,
тиоциановая кислота HNCS,
органические амиды RCONH2
и амины RNH2
и R2NH).
Вещества,
молекулы которых соединены водородными
связями, отличаются по своим свойствам
от веществ, аналогичных им по строению
молекул, но не образующих водородных
связей. Температуры плавления и кипения
гидридов элементов IVA-группы,
в которых нет водородных связей, плавно
понижаются с уменьшением номера периода
(рис. 15).
У
гидридов элементов групп VA-VIIA
наблюдается нарушение этой зависимости.
Три вещества, молекулы которых соединены
водородными связями (аммиак NH3,
вода Н2О
и фтороводород HF),
имеют гораздо более высокие температуры
плавления и кипения, чем их аналоги
(рис. 15). Кроме того, эти вещества имеют
более широкие температурные интервалы
существования в жидком состоянии, более
высокие теплоты плавления и испарения.
Важную
роль водородная связь играет в процессах
растворения и кристаллизации веществ,
а также при образовании кристаллогидратов.
Водородная
связь может образовываться не только
между молекулами (межмолекулярная
водородная связь, МВС),
как
это имеет место в рассмотренных выше
примерах, но и между атомами одной
и той же молекулы (внутримолекулярная
водородная связь, ВВС).
Например,
благодаря внутримолекулярным водородным
связям между атомами водорода аминогрупп
и атомами кислорода карбонильных групп,
полипептидные цепи, образующие молекулы
белков, имеют спиралеобразную форму.
рисунок??????????????
Огромную
роль водородные связи играют в процессах
редупликации и биосинтеза белков.
Две нити двойной спирали ДНК
(дезоксирибонуклеиновой кислоты)
удерживаются вместе водородными
связями. В процессе редупликации эти
связи разрываются. При транскрипции
синтез РНК (рибонуклеиновой кислоты)
с использованием ДНК в качестве матрицы
происходит также благодаря возникновению
водородных связей. Оба процесса возможны
потому, что водородные связи легко
образуются и легко разрываются.
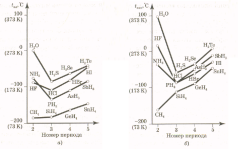
Рис.
15. Температуры
плавления (а)
и кипения (б)
гидридов
элементов групп IVА-VIIА.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
