Коллоидные системы чрезвычайно важны в жизни любого человека. Это связано не только с тем, что практически все биологические жидкости в живом организме образуют коллоиды. Но и многие природные явления (туман, смог), почва, минералы, продукты питания, лекарственные средства тоже являются коллоидными системами.

Единицей таких образований, отражающих их состав и специфические свойства, принято считать макромолекулу, или мицеллу. Строение последней зависит от ряда факторов, но это всегда многослойная частица. Современной молекулярно-кинетической теорией коллоидные растворы рассматриваются в качестве частного случая истинных растворов, с более крупными частицами растворенного вещества.
Способы получения коллоидных растворов
Строение мицеллы, образующейся при возникновении коллоидной системы, отчасти зависит и от механизма этого процесса. Методы получения коллоидов делят на две принципиально разные группы.
Диспергационные методы связаны с измельчением довольно крупных частиц. В зависимости от механизма этого процесса различают следующие способы.
- Размол. Может осуществляться сухим или мокрым способом. В первом случае твердое вещество сначала измельчают, а уже затем прибавляют жидкость. Во втором случае вещество смешивают с жидкостью, и только после этого превращают в однородную смесь. Размол проводят в специальных мельницах.
- Набухание. Измельчение достигается благодаря тому, что частицы растворителя проникают внутрь дисперсной фазы, что сопровождается раздвиганием ее частиц вплоть до отрыва.
- Диспергирование ультразвуком. Материал, подверженный измельчению, помещают в жидкость и действуют на него ультразвуком.
- Диспергирование электрическим током. Востребовано при получении золей металлов. Проводится путем помещения в жидкость электродов из диспергируемого металла с последующей подачей на них высокого напряжения. В результате образуется вольтова дуга, в которой металл распыляется, а затем конденсируется в раствор.
Эти способы подходят для получения как лиофильных, так и лиофобных коллоидных частиц. Строение мицеллы осуществляется одновременно с разрушением исходной структуры твердого вещества.

Конденсационные методы
Вторая группа методов, основанная на укрупнении частиц, называется конденсационными. Этот процесс может основываться на физических или химических явлениях. К методам физической конденсации относят следующие.
- Замена растворителя. Сводится она к переводу вещества из одного растворителя, в котором оно растворяется очень хорошо, в другой, растворимость в котором значительно ниже. В результате этого мелкие частицы объединятся в более крупные агрегаты и возникнет коллоидный раствор.
- Конденсация из паров. В качестве примера можно назвать туманы, частицы которых способны оседать на холодных поверхностях и постепенно укрупняться.
К методам химической конденсации относят некоторые химические реакции, сопровождающиеся выпадением осадков комплексной структуры:
- Ионный обмен: NaCl + AgNO3 = AgCl↓ + NaNO3.
- Окислительно-восстановительные процессы: 2H2S + O2 = 2S↓ + 2H2O.
- Гидролиз: Al2S3 + 6H2O = 2Al(OH)3↓ + 3H2S.
Условия проведения химической конденсации
Строение мицелл, образующихся в ходе этих химических реакций, зависит от избытка или недостатка участвующих в них веществ. Также для появления коллоидных растворов необходимо соблюдать ряд условий, предотвращающих выпадение в осадок труднорастворимого соединения:
- содержание веществ в смешиваемых растворах должно быть низким;
- скорость их смешивания должна быть невысокой;
- один из растворов должен быть взят в избытке.

Строение мицеллы
Основной частью мицеллы является ядро. Оно образовано большим числом атомов, ионов и молекул нерастворимого соединения. Обычно ядро характеризуется кристаллическим строением. Поверхность ядра имеет запас свободной энергии, позволяющей избирательно адсорбировать ионы из окружающей среды. Процесс этот подчиняется правилу Пескова, которое гласит: на поверхности твердого вещества преимущественно адсорбируются те ионы, которые способны достраивать его же кристаллическую решетку. Это возможно в том случае, если эти ионы родственные или сходные по природе и форме (размерам).
В ходе адсорбции на ядре мицеллы образуется слой положительно или отрицательно заряженных ионов, называемых потенциалопределяющими. Благодаря электростатическим силам полученный заряженный агрегат притягивает из раствора противоионы (ионы с противоположным зарядом). Таким образом, коллоидная частица имеет многослойное строение. Мицелла приобретает диэлектрический слой, построенный из двух типов противоположно заряженных ионов.
Гидрозоль BaSO4
В качестве примера удобно рассмотреть строение мицеллы сульфата бария в коллоидном растворе, приготовленном в избытке хлорида бария. Этому процессу соответствует уравнение реакции:
BaCl2(p) + Na2SO4(p) = BaSO4(т) + 2NaCl(p).
Малорастворимый в воде сульфат бария образует микрокристаллический агрегат, построенный из m-ного числа молекул BaSO4. Поверхностью этого агрегата адсорбируется n-ное количество ионов Ва2+. Со слоем потенциалопределяющих ионов связано 2(n – x) ионов Cl–. А остальная же часть противоионов (2x) расположена в диффузном слое. То есть гранула данной мицеллы будет положительно заряженной.

Если же в избытке взят сульфат натрия, то потенциалопределяющими ионами будут ионы SO42-, а противоионами – Na+. В этом случае заряд гранулы будет отрицательным.
Этот пример наглядно демонстрирует, что знак заряда гранулы мицеллы напрямую зависит от условий ее получения.
Запись мицеллы
Предыдущий пример показал, что химическое строение мицелл и формула, его отражающая, определяется тем веществом, которое взято в избытке. Рассмотрим способы записи названия отдельных частей коллоидной частицы на примере гидрозоля сульфида меди. Для его приготовления в избыточное количество раствора хлорида меди медленно приливают раствор сульфида натрия:
CuCl2 + Na2S = CuS↓ + 2NaCl.

Строение мицеллы CuS, полученной в избытке CuCl2, записывается следующим образом:
{[mCuS]·nCu2+·xCl–}+(2n-x) ·(2n-x)Cl–.
Структурные части коллоидной частицы
В квадратных скобках записывают формулу труднорастворимого соединения, являющегося основой всей частицы. Ее принято называть агрегатом. Обычно число молекул, составляющих агрегат, записывают латинской буквой m.
Потенциалопределяющие ионы содержатся в избыточном количестве в растворе. Они располагаются на поверхности агрегата, а в формуле их записывают сразу за квадратными скобками. Число этих ионов обозначают символом n. Название этих ионов говорит о том, что их заряд определяет заряд гранулы мицеллы.
Гранула образована ядром и частью противоионов, находящихся в адсорбционном слое. Величина заряда гранулы равняется сумме зарядов потенциалопределяющих и адсорбированных противоионов: +(2n – x). Оставшаяся часть противоионов находится в диффузном слое и компенсирует заряд гранулы.
Если бы в избытке взяли Na2S, то для образовавшейся коллоидной мицеллы схема строения имела бы вид:
{[m(CuS)]∙nS2–∙xNa+}–(2n – x) ∙(2n – x)Na+.

Мицеллы поверхностно-активных веществ
В том случае если концентрация поверхностно-активных веществ (ПАВ) в воде слишком высока, могут начать формироваться агрегаты из их молекул (или ионов). Эти укрупненные частицы имеют форму сферы и называются мицеллами Гартли – Ребиндера. Стоит отметить, что такой способностью обладают далеко не все ПАВ, а только те, у которых соотношение гидрофобной и гидрофильной частей оптимально. Это соотношение называется гидрофильно-липофильным балансом. Также немалую роль играет способность их полярных групп защищать углеводородное ядро от воды.
Агрегаты молекул ПАВ образуются по определенным законам:
- в отличие от низкомолекулярных веществ, агрегаты которых могут включать различное число молекул m, существование мицелл ПАВ возможно со строго определенным числом молекул;
- если для неорганических веществ старт мицеллообразования обусловлен пределом растворимости, то для органических поверхностно-активных веществ он определяется достижением критических концентраций мицеллообразования;
- сначала в растворе увеличивается число мицелл, а затем происходит увеличение их размеров.
Влияние концентрации на форму мицеллы
На строение мицелл ПАВ оказывает влияние их концентрация в растворе. При достижении некоторых ее значений, коллоидные частицы начинают друг с другом взаимодействовать. Это приводит к изменению их формы следующим образом:
- сфера превращается в эллипсоид, а затем в цилиндр;
- высокая концентрация цилиндров ведет к формированию гексагональной фазы;
- в некоторых случаях возникает ламелярная фаза и твердый кристалл (частицы мыла).

Виды мицелл
По особенностям организации внутренней структуры выделяют три типа коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
Суспензоидами могут быть необратимые коллоиды, а также лиофобные коллоиды. Эта структура характерна для растворов металлов, а также их соединений (различных оксидов и солей). Строение дисперсной фазы, образованной суспензоидами, не отличается от структуры компактного вещества. Она имеет молекулярную или ионную кристаллическую решетку. Отличие от суспензий заключается в более высокой дисперсности. Необратимость проявляется в способности их растворов после выпаривания образовывать сухой осадок, который невозможно превратить в золь простым растворением. Лиофобными их называют из-за слабого взаимодействия между дисперсной фазой и дисперсионной средой.
Мицеллярными коллоидами являются растворы, коллоидные частицы которых возникают при слипании дифильных молекул, содержащих полярные группы атомов и неполярные радикалы. Примером являются мыла и ПАВ. Молекулы в таких мицеллах удерживаются дисперсионными силами. Форма этих коллоидов может быть не только сферической, но и пластинчатой.
Молекулярные коллоиды вполне устойчивы без стабилизаторов. Их структурными единицами являются отдельные макромолекулы. Форма частицы коллоида может варьироваться в зависимости от свойств молекулы и внутримолекулярных взаимодействий. Так линейная молекула может образовывать стержень или клубок.
Правила составления мицелл
-
Основа мицеллы
– агрегат,
нерастворимый в данной дисперсионной
среде, состоящий из множества (m)
молекул (атомов) простого вещества. -
Согласно правилу
Пескова-Фаянса-Панета,
на
поверхности агрегата адсорбируются
ионы электролита-стабилизатора,
входящие в состав агрегата, либо имеющие
общую природу
с ним, либо специфически взаимодействующие
с ним и находящиеся
в избытке.
Ионы, сообщающие агрегату поверхностный
заряд, называются потенциалопределяющими.
Агрегат + потенциалопределяющие ионы
= ядро мицеллы. -
Заряд ядра
компенсируется эквивалентным количеством
противоположно заряженных ионов
электролита-стабилизатора – противоионов.
Часть противоионов, прочно связанных
с ядром, входит в адсорбционный
слой. Агрегат
+ адсорбционный слой = коллоидная
частица (имеет заряд). -
Остальная часть
противоионов образует диффузионный
слой. -
Суммы электрических
зарядов коллоидной частицы и диффузионного
слоя равны друг другу по абсолютной
величине и противоположны по знаку. -
Электрический
заряд коллоидной частицы равен
алгебраической сумме электрических
зарядов потенциалопределяющих ионов
и противоионов адсорбционного слоя. -
Мицелла гидрофобного
золя является электронейтральной,
т.е. алгебраическая сумма электрических
зарядов ионов всех слоев равна нулю
Для
любого типа реакции одно из исходных
веществ берут в избытке по сравнению
со стехиометрически необходимым
соотношением:
Na3AsO3
+ 3AgNO3
→ ↓Ag3AsO3
+ 3NaNO3
избыток
осадок
Электролитическая
диссоциация электролита, взятого в
избытке:
Na3AsO3
3Na+
+ AsO33-
{mAg3AsO3·nAsO33-
3(n–x)Na+}-3x3xNa+
Агрегат
Потенциалоп- Противоионы Ионы
ределяющие адсорбционного
диффузионного
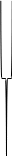
ионы
слоя слоя
Ядро
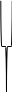
Адсорбционный
слой Диффузионный слой
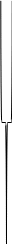
Коллоидная
частица
Здесь
m,
n,
x
– натуральные числа;
m
– число молекул в агрегате;
n
– число потенциалопределяющих ионов;
(n
– x)
– число противоионов адсорбционного
слоя;
x
– число противоионов диффузного слоя.
Численный
коэффициент 3 перед (n
– x)
и х
поставлен ввиду трехосновности аниона
AsO33-.
Определение заряда коллоидной частицы (правило 6)
n(-3)
+ 3(n
– x)(+1)
= -3x
Для проверки
правильности записи формулы мицеллы
подсчитывают алгебраическую сумму
зарядов всех ионов (правило 7):
n(-3)
+ 3(n
– x)(+1)
+ 3х(+1)
= 0
Коллоидная частица
имеет отрицательный заряд, мицелла в
целом электронейтральна.
Работа № 4
МИЦЕЛЛООБРАЗОВАНИЕ
В РАСТВОРАХ
ПОВЕРХНОСТНО-АКТИВНЫХ
ВЕЩЕСТВ
-
Какие
вещества называют поверхностно-активными
(ПАВ)? -
Как
классифицируют ПАВ? -
Чем отличаются
коллоидные ПАВ от истинно растворимых?
Что называется критической
концентрацией мицеллообразования
(ККМ)? -
Что
такое поверхностная
активность
коллоидных ПАВ? -
Как зависит форма
мицелл от концентрации ПАВ в растворе?
Каким образом ориентируются молекулы
ПАВ в мицеллах в полярной
и неполярной
средах? -
Какое явление
называют солюбилизацией?
Чем обусловлено это явление? Каково
практическое
значение
этого явления? -
Факторы, влияющие
на ККМ в растворах ПАВ:
-
влияние длины
углеводородного радикала
на ККМ в разных по полярности
растворителях; -
влияние природы
полярной группы
молекулы ПАВ; -
влияние добавок
индифферентного электролита
на ККМ ионогенных
и неионогенных
ПАВ; -
зависимость
мицеллообразования от температуры,
точка Крафта.
-
Условия образования
мицеллярных
растворов ПАВ. -
Методы определения
ККМ. Почему при концентрации выше ККМ
поверхностное натяжение растворов
ПАВ не изменяется? -
Как влияет явление
мицеллообразования на подвижность
ионов?
Работа №5
-
Что
такое защитное
действие
ВМС? -
Механизм
образования
защитного действия. -
Что
такое флокуляция? -
Что
такое сенсибилизация? -
Действие
стабилизаторов. -
Особенности
белков как
стабилизаторов. Смешанные пленки. -
Влияние
заряда
на прочность
макромолекул. -
Что
такое
осмотическое
расклинивающее
давление?
Работа №6
-
Перечислить три
механизма
образования двойного электрического
слоя (ДЭС). -
Строение
ДЭС. -
Факторы, влияющие
на -потенциал:
а) 0;
б) добавка
индифферентного электролита;
в) добавка
неиндифферентного электролита;
г) рН среды;
д) концентрация
золя;
е) температура;
ж) природа
дисперсионной среды.
-
Особенности
белковых веществ как коллоидов: строение
ДЭС в кислой
и щелочной
средах. -
Обоснование
возможности разделения белков
электрофорезом. -
Изоэлектрическая
точка
белков.
Работа № 7
АДСОРБЦИЯ И
ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ НА ГРАНИЦЕ
«ЖИДКОСТЬ-ГАЗ»
-
Что
называется поверхностным
натяжением?
Единицы измерения? -
Методы измерения
поверхностного натяжения (4 самых
распростра-ненных метода). -
Что лежит в основе
определения поверхностного натяжения
по методу Ребиндера?
Работа установки. Формула
расчета
поверхностного натяжения по методу
наибольшего
давления воздуха в пузырьке. -
Зависимость
поверхностного натяжения жидкости от
температуры. -
Почему
жидкость стремится принять форму шара? -
*Что такое
поверхностно-активные вещества? Их
структура? При-вести примеры. -
Как поверхностное
натяжение зависит от концентрации для
ПАВ
(поверхностно-активных веществ) и ПИВ
(поверхностно-инактивных веществ)? -
Понятие Гиббсовской
адсорбции,
её размерность и физический смысл. -
Зависимость
Гиббсовской адсорбции от концентрации,
от температуры. -
Что такое
поверхностная
активность
вещества? Анализ уравнения Гиббса. -
Как определить
поверхностную активность графическим
методом? -
У какого из этих
веществ поверхностная активность будет
больше: СН3СООН;
С2Н5СООН;
С3Н7СООН
и т.д.? -
Понятие предельной
адсорбции. -
Как определить
площадь, приходящуюся на одну молекулу
в насыщенном
адсорбционном слое? Зависит ли эта
площадь от длины
радикала? -
Как определить
линейные размеры молекулы ПАВ по
величине
адсорбции? -
Какие характеристики
и величины можно рассчитать, исходя из
уравнения
Гиббса?
Работа № 7а
АДГЕЗИЯ, СМАЧИВАНИЕ
И РАСТЕКАНИЕ ЖИДКОСТЕЙ
-
Что такое адгезия?
Определение, единицы измерения. Работа
адгезии. -
Что такое когезия?
Определение, единицы измерения. Работа
когезии. -
Уравнение Дюпре.
Условие растворения. -
Что такое смачивание?
Нарисовать векторы сил, действующих
на каплю жидкости, помещенную на твердую
поверхность. -
Что такое краевой
угол смачивания?
Как по нему оценить гидрофильность/гидрофобность
поверхности? -
Закон Юнга.
-
Уравнение
Дюпре-Юнга. -
Растекание
жидкости. Эффект Марангони.
Работа № 8
МОЛЕКУЛЯРНАЯ
АДСОРБЦИЯ НА ГРАНИЦЕ РАЗДЕЛА
«ЖИДКИЙ РАСТВОР
– ТВЕРДЫЙ АДСОРБЕНТ»
-
Что называется
адсорбцией?
Что такое адсорбент,
адсорбат
и адсорбтив?
Количественные
характеристики
адсорбции (абсолютная
и избыточная
величины). -
Дайте определение
изотермы,
изостеры
и изопикны
адсорбции. Их графическое
построение. -
При каких
условиях
соблюдается при адсорбции закон
Генри?
Физический
смысл константы
Генри? -
Уравнение
изотермы
мономолекулярной адсорбции Ленгмюра.
Анализ
его, физический
смысл
входящих в него величин. При каких
условиях
это уравнение применимо? -
Чем отличаются
константы
адсорбции в уравнениях Ленгмюра
и Генри,
какова взаимосвязь
между ними? -
Уравнение
Фрейндлиха,
физический
смысл входящих в него констант.
Область применения. -
Как определяют
константы
уравнения
Ленгмюра
и Фрейндлиха? -
Какие геометрические
характеристики можно рассчитать, зная
константы уравнения Ленгмюра? -
Какова ориентация
молекул ПАВ на поверхности адсорбента
в случае предельной
адсорбции
(нарисовать)? Чем определяется величина
площади
молекулы в
адсорбционном слое? -
Какие формулы
используют для расчета
величины адсорбции
из экспериментальных данных? -
На чем основано
измерение
удельной поверхности
твердых адсорбентов? -
Чем отличается
адсорбция из растворов
от адсорбции газов
и
паров?
Работа № 9
ОПТИЧЕСКИЕ МЕТОДЫ
АНАЛИЗА ДИСПЕРСНЫХ СИСТЕМ
ТУРБИДИМЕТРИЯ
-
Какие оптические
явления
наблюдаются при падении
луча света
на дисперсную систему? Какие методы
исследования
дисперсных систем основаны на этих
явлениях? -
Какие оптические
методы
используются для определения
размеров частиц
дисперсных систем? Укажите границы
применимости
(по дисперсности) этих методов. -
Чем обусловлено
светорассеяние
в дисперсных
системах и
истинных
растворах?
Какими параметрами
количественно характеризуют рассеяние
света в системе? -
Какова связь между
оптической
плотностью
и мутностью
«белых» золей? Для каких дисперсных
систем применимо уравнение
Рэлея? -
Как влияют размеры
частиц на
зависимость оптической
плотности
«белых» золей от длины
волны
падающего света? -
Чем различаются
методы нефелометрии
и турбидиметрии?
Какие уравнения
используются для определения характеристик
рассеяния света? -
Для каких дисперсных
систем применимо уравнение Дебая?
Какие параметры
дисперсных систем определяют по методу
Дебая? -
В чем заключаются
особенности метода ультрамикроскопии?
Для каких дисперсных систем применим
этот метод? Какие характеристики
дисперсных систем могут быть определены
этим методом?
Лабораторная
работа № 10
СЕДИМЕНТАЦИОННЫЙ
АНАЛИЗ СУСПЕНЗИЙ
-
Понятие
о дисперсных системах, количественные
характеристики
дисперсных систем (Лекция №1). -
Цель седиментационного
анализа. Практическое применение
результатов седиментационного анализа. -
Методика
седиментационного анализа. -
Закон Стокса.
Номограмма
Стокса, её использование. -
Что такое
седиментация?
Какие силы
действуют на частицу? -
Напишите уравнение
Стокса для
скорости
оседания
частиц. Каков физический
смысл
входящих в него величин? Изменением
каких параметров
системы можно изменять скорость
осаждения
частиц? -
Кривая
седиментации полидисперсной
системы. Как определяют размеры
частиц, используя кривую седиментации? -
Определите по
графику массу
фракции,
радиус частиц которой равен или больше
радиуса в данной точке. -
Определите по
графику массу фракции для заданного
интервала размеров (например от радиуса
r3
до r4). -
Что можно определить,
используя дифференциальную
кривую
распределения частиц по размерам? -
Как определить
содержание
частиц для
данного интервала размеров по
дифференциальной кривой распределения? -
Как рассчитать
удельную
поверхность
дисперсной фазы Sуд?
Лабораторная
работа № 11
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Составление формулы мицеллы коллоидного раствора
Методические рекомендации
По решению задач
«Коллоидные растворы»
для специальностей 19.02.03 «Технология хлеба, кондитерских и макаронных изделий»; 19.02.05 «Технология бродильных производств и виноделие»; 19.02.10 «Технология продукции общественного питания»

Коллоидные растворы
Составление формулы мицеллы коллоидного раствора
Теоретические положения
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1.Агрегатом является получающийся в ходе реакции осадок.
2.Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3.Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4.Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
При смешивании разбавленных растворов нитрата серебра и хлорида натрия взятого в избытке, хлорид серебра не выпадает в осадок, а образуется коллоидный раствор.
Сначала составляем уравнение реакции в молекулярном и ионном виде:
AgNO3 + NaCl → NaNO3 + AgCl↓
Ag + + NO3 – + Na + + Cl – → Na + + NO3 – + AgCl↓
Основу коллоидных частиц золя AgCl составляют микрокристаллы малорастворимого хлорида серебра, которые называются агрегатами, обозначаются m (AgCl).
Эта реакция происходит при наличии избытка хлорида натрия, вследствие избирательной адсорбции Сl – , на поверхности агрегата возникает отрицательно заряженный слой из хлорид-ионов.
Cl – называются потенциалопределяющими ионами.
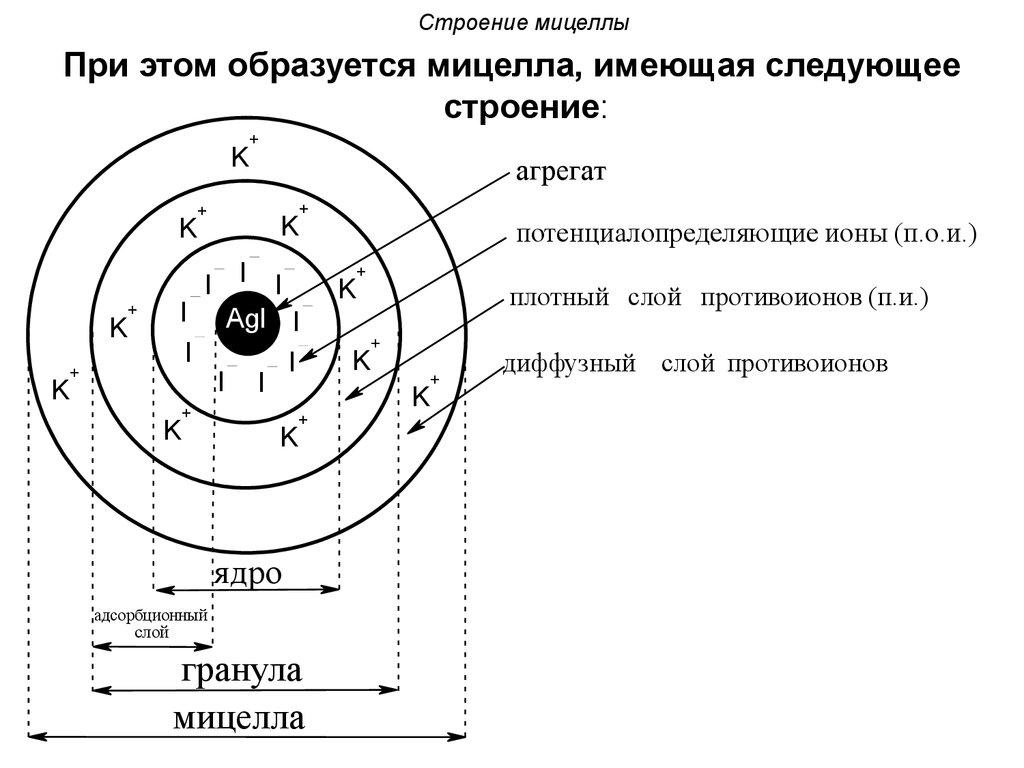
Агрегат вместе с потенциалопределяющими ионами, которые адсорбировались и вошли в кристаллическую решётку агрегата, являются частицами твердой фазы – ядра.
Обратите внимание на то, что потенциалопределяющими ионами могут быть ионы, которые достраивают кристаллическую решетку агрегата или содержатся в составе агрегата.
Под действием электростатических сил к поверхности ядра притягиваются ионы противоположного знака – противоионы. В данном случае – это ионы Na + .
 Адсорбционный слой
Адсорбционный слой
Агрегат, ядро, адсорбционный слой образуют гранулу. Заряд гранулы поределяется знаком заряда потенциалопределяющих ионов (Сl – ), обозначается в правом верхнем углу.
Гранула имеет вид:
Так как концентрация противоионов около поверхности больше, чем в растворе, то остальная часть противоионов Na + слабее связана с ядром и под влиянием теплового движения диффундирует в сторону с меньшей концентрацией, образуя диффузионный слой проивоионов.
 < m (AgC ) n Cl – (n – x) Na + > х- x Na +
< m (AgC ) n Cl – (n – x) Na + > х- x Na +
Гранула вместе с диффузионным слоем образует мицеллу. Мицеллы золей электронейтральны.
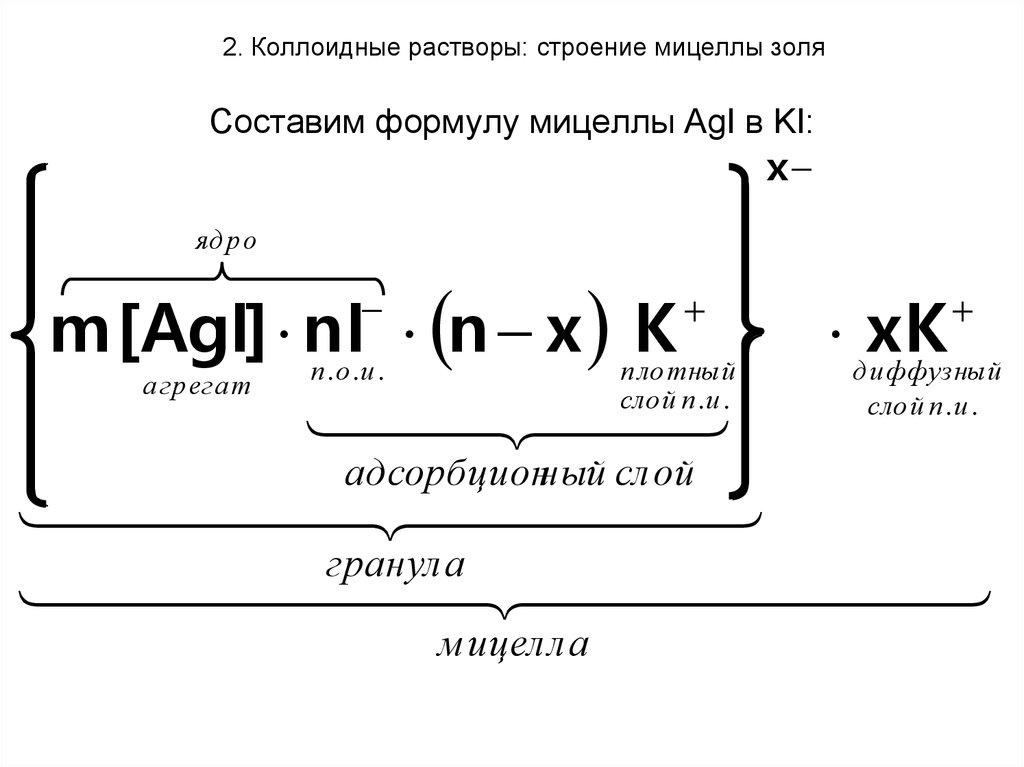
Формула мицеллы:
 < m (AgCl) n Cl – (n – x) Na + > х- x Na +
< m (AgCl) n Cl – (n – x) Na + > х- x Na +


 агрегат адсорбционный слой диффузионный слой
агрегат адсорбционный слой диффузионный слой
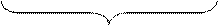 гранула
гранула
m ‑ количество молекул, входящих в состав агрегата;
n – количество потенциалопределяющих ионов;
(n – х) – количество противоионов, входящих в адсорбционный слой;
х – количество противоионов, входящих в диффузионный слой.
Мицелла: строение, схема, описание и химическая формула

Коллоидные системы чрезвычайно важны в жизни любого человека. Это связано не только с тем, что практически все биологические жидкости в живом организме образуют коллоиды. Но и многие природные явления (туман, смог), почва, минералы, продукты питания, лекарственные средства тоже являются коллоидными системами.

Единицей таких образований, отражающих их состав и специфические свойства, принято считать макромолекулу, или мицеллу. Строение последней зависит от ряда факторов, но это всегда многослойная частица. Современной молекулярно-кинетической теорией коллоидные растворы рассматриваются в качестве частного случая истинных растворов, с более крупными частицами растворенного вещества.
Способы получения коллоидных растворов
Строение мицеллы, образующейся при возникновении коллоидной системы, отчасти зависит и от механизма этого процесса. Методы получения коллоидов делят на две принципиально разные группы.
Диспергационные методы связаны с измельчением довольно крупных частиц. В зависимости от механизма этого процесса различают следующие способы.
- Размол. Может осуществляться сухим или мокрым способом. В первом случае твердое вещество сначала измельчают, а уже затем прибавляют жидкость. Во втором случае вещество смешивают с жидкостью, и только после этого превращают в однородную смесь. Размол проводят в специальных мельницах.
- Набухание. Измельчение достигается благодаря тому, что частицы растворителя проникают внутрь дисперсной фазы, что сопровождается раздвиганием ее частиц вплоть до отрыва.
- Диспергирование ультразвуком. Материал, подверженный измельчению, помещают в жидкость и действуют на него ультразвуком.
- Диспергирование электрическим током. Востребовано при получении золей металлов. Проводится путем помещения в жидкость электродов из диспергируемого металла с последующей подачей на них высокого напряжения. В результате образуется вольтова дуга, в которой металл распыляется, а затем конденсируется в раствор.
Эти способы подходят для получения как лиофильных, так и лиофобных коллоидных частиц. Строение мицеллы осуществляется одновременно с разрушением исходной структуры твердого вещества.

Конденсационные методы
Вторая группа методов, основанная на укрупнении частиц, называется конденсационными. Этот процесс может основываться на физических или химических явлениях. К методам физической конденсации относят следующие.
- Замена растворителя. Сводится она к переводу вещества из одного растворителя, в котором оно растворяется очень хорошо, в другой, растворимость в котором значительно ниже. В результате этого мелкие частицы объединятся в более крупные агрегаты и возникнет коллоидный раствор.
- Конденсация из паров. В качестве примера можно назвать туманы, частицы которых способны оседать на холодных поверхностях и постепенно укрупняться.
К методам химической конденсации относят некоторые химические реакции, сопровождающиеся выпадением осадков комплексной структуры:
Условия проведения химической конденсации
Строение мицелл, образующихся в ходе этих химических реакций, зависит от избытка или недостатка участвующих в них веществ. Также для появления коллоидных растворов необходимо соблюдать ряд условий, предотвращающих выпадение в осадок труднорастворимого соединения:
- содержание веществ в смешиваемых растворах должно быть низким;
- скорость их смешивания должна быть невысокой;
- один из растворов должен быть взят в избытке.

Строение мицеллы
Основной частью мицеллы является ядро. Оно образовано большим числом атомов, ионов и молекул нерастворимого соединения. Обычно ядро характеризуется кристаллическим строением. Поверхность ядра имеет запас свободной энергии, позволяющей избирательно адсорбировать ионы из окружающей среды. Процесс этот подчиняется правилу Пескова, которое гласит: на поверхности твердого вещества преимущественно адсорбируются те ионы, которые способны достраивать его же кристаллическую решетку. Это возможно в том случае, если эти ионы родственные или сходные по природе и форме (размерам).
В ходе адсорбции на ядре мицеллы образуется слой положительно или отрицательно заряженных ионов, называемых потенциалопределяющими. Благодаря электростатическим силам полученный заряженный агрегат притягивает из раствора противоионы (ионы с противоположным зарядом). Таким образом, коллоидная частица имеет многослойное строение. Мицелла приобретает диэлектрический слой, построенный из двух типов противоположно заряженных ионов.
Гидрозоль BaSO4
В качестве примера удобно рассмотреть строение мицеллы сульфата бария в коллоидном растворе, приготовленном в избытке хлорида бария. Этому процессу соответствует уравнение реакции:
Малорастворимый в воде сульфат бария образует микрокристаллический агрегат, построенный из m-ного числа молекул BaSO4. Поверхностью этого агрегата адсорбируется n-ное количество ионов Ва 2+ . Со слоем потенциалопределяющих ионов связано 2(n – x) ионов Cl – . А остальная же часть противоионов (2x) расположена в диффузном слое. То есть гранула данной мицеллы будет положительно заряженной.

Если же в избытке взят сульфат натрия, то потенциалопределяющими ионами будут ионы SO4 2- , а противоионами – Na + . В этом случае заряд гранулы будет отрицательным.
Этот пример наглядно демонстрирует, что знак заряда гранулы мицеллы напрямую зависит от условий ее получения.
Запись мицеллы
Предыдущий пример показал, что химическое строение мицелл и формула, его отражающая, определяется тем веществом, которое взято в избытке. Рассмотрим способы записи названия отдельных частей коллоидной частицы на примере гидрозоля сульфида меди. Для его приготовления в избыточное количество раствора хлорида меди медленно приливают раствор сульфида натрия:

Строение мицеллы CuS, полученной в избытке CuCl2, записывается следующим образом:
Структурные части коллоидной частицы
В квадратных скобках записывают формулу труднорастворимого соединения, являющегося основой всей частицы. Ее принято называть агрегатом. Обычно число молекул, составляющих агрегат, записывают латинской буквой m.
Потенциалопределяющие ионы содержатся в избыточном количестве в растворе. Они располагаются на поверхности агрегата, а в формуле их записывают сразу за квадратными скобками. Число этих ионов обозначают символом n. Название этих ионов говорит о том, что их заряд определяет заряд гранулы мицеллы.
Гранула образована ядром и частью противоионов, находящихся в адсорбционном слое. Величина заряда гранулы равняется сумме зарядов потенциалопределяющих и адсорбированных противоионов: +(2n – x). Оставшаяся часть противоионов находится в диффузном слое и компенсирует заряд гранулы.
Если бы в избытке взяли Na2S, то для образовавшейся коллоидной мицеллы схема строения имела бы вид:

Мицеллы поверхностно-активных веществ
В том случае если концентрация поверхностно-активных веществ (ПАВ) в воде слишком высока, могут начать формироваться агрегаты из их молекул (или ионов). Эти укрупненные частицы имеют форму сферы и называются мицеллами Гартли – Ребиндера. Стоит отметить, что такой способностью обладают далеко не все ПАВ, а только те, у которых соотношение гидрофобной и гидрофильной частей оптимально. Это соотношение называется гидрофильно-липофильным балансом. Также немалую роль играет способность их полярных групп защищать углеводородное ядро от воды.
Агрегаты молекул ПАВ образуются по определенным законам:
- в отличие от низкомолекулярных веществ, агрегаты которых могут включать различное число молекул m, существование мицелл ПАВ возможно со строго определенным числом молекул;
- если для неорганических веществ старт мицеллообразования обусловлен пределом растворимости, то для органических поверхностно-активных веществ он определяется достижением критических концентраций мицеллообразования;
- сначала в растворе увеличивается число мицелл, а затем происходит увеличение их размеров.
Влияние концентрации на форму мицеллы
На строение мицелл ПАВ оказывает влияние их концентрация в растворе. При достижении некоторых ее значений, коллоидные частицы начинают друг с другом взаимодействовать. Это приводит к изменению их формы следующим образом:
- сфера превращается в эллипсоид, а затем в цилиндр;
- высокая концентрация цилиндров ведет к формированию гексагональной фазы;
- в некоторых случаях возникает ламелярная фаза и твердый кристалл (частицы мыла).

Виды мицелл
По особенностям организации внутренней структуры выделяют три типа коллоидных систем: суспензоиды, мицеллярные коллоиды, молекулярные коллоиды.
Суспензоидами могут быть необратимые коллоиды, а также лиофобные коллоиды. Эта структура характерна для растворов металлов, а также их соединений (различных оксидов и солей). Строение дисперсной фазы, образованной суспензоидами, не отличается от структуры компактного вещества. Она имеет молекулярную или ионную кристаллическую решетку. Отличие от суспензий заключается в более высокой дисперсности. Необратимость проявляется в способности их растворов после выпаривания образовывать сухой осадок, который невозможно превратить в золь простым растворением. Лиофобными их называют из-за слабого взаимодействия между дисперсной фазой и дисперсионной средой.
Мицеллярными коллоидами являются растворы, коллоидные частицы которых возникают при слипании дифильных молекул, содержащих полярные группы атомов и неполярные радикалы. Примером являются мыла и ПАВ. Молекулы в таких мицеллах удерживаются дисперсионными силами. Форма этих коллоидов может быть не только сферической, но и пластинчатой.
Молекулярные коллоиды вполне устойчивы без стабилизаторов. Их структурными единицами являются отдельные макромолекулы. Форма частицы коллоида может варьироваться в зависимости от свойств молекулы и внутримолекулярных взаимодействий. Так линейная молекула может образовывать стержень или клубок.
Алгоритм составления формулы мицеллы
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1. Агрегатом является получающийся в ходе реакции осадок.
2. Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3. Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4. Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
При смешивании разбавленных растворов нитрата серебра и хлорида натрия взятого в избытке, хлорид серебра не выпадает в осадок, а образуется коллоидный раствор.
Сначала составляем уравнение реакции в молекулярном и ионном виде:
Ag + + NO3 – + Na + + Cl – #8594; Na + + NO3 – + AgCl#8595;
Ag + + Cl – #8594; AgCl#8595;
Основу коллоидных частиц золя AgCl составляют микрокристаллы малорастворимого хлорида серебра, которые называются агрегатами . обозначаются m (AgCl).
Эта реакция происходит при наличии избытка хлорида натрия, вследствие избирательной адсорбции Сl -. на поверхности агрегата возникает отрицательно заряженный слой из хлорид-ионов.
Cl – называются потенциалопределяющими ионами.
Агрегат вместе с потенциалопределяющими ионами, которые адсорбировались и вошли в кристаллическую решётку агрегата, являются частицами твердой фазы – ядра.
Обратите внимание на то, что потенциалопределяющими ионами могут быть ионы, которые достраивают кристаллическую решетку агрегата или содержатся в составе агрегата.
Под действием электростатических сил к поверхности ядра притягиваются ионы противоположного знака – противоионы. В данном случае – это ионы Na + .
Агрегат, ядро, адсорбционный слой образуют гранулу. Заряд гранулы поределяется знаком заряда потенциалопределяющих ионов (Сl – ), обозначается в правом верхнем углу.
Так как концентрация противоионов около поверхности больше, чем в растворе, то остальная часть противоионов Na + слабее связана с ядром и под влиянием теплового движения диффундирует в сторону с меньшей концентрацией, образуя диффузионный слой проивоионов.
Гранула вместе с диффузионным слоем образует мицеллу. Мицеллы золей электронейтральны.
агрегат адсорбционный слой диффузионный слой
m #8209; количество молекул, входящих в состав агрегата;
n – количество потенциалопределяющих ионов;
(n –х) – количество противоионов, входящих в адсорбционный слой;
х – количество противоионов, входящих в диффузионный слой.


Задачи для самостоятельного решения:
1. Составить схему строения мицеллы золя гидроксида меди (II) в растворе хлорида меди.
2.Составить формулу мицеллы по уравнению: FeCL3 +3NaOH=Fe(OH)3+3NaCl
3. Золь иодида серебра получен при добавлении к раствору AgNO3 избытка KI. Определить заряд частиц полученного золя и написать формулу его мицеллы.
4. Напишите формулу мицеллы сульфата бария, полученного сливанием одинакового объема сильно разбавленной серной кислоты и менее разбавленного раствора хлорида бария.
5. Золь сернокислого бария получен смешением равных объемов растворов Ва(NО3)2 иН2SО4. Написать формулу мицеллы.
6. Золь Аl(ОН)3 получен смешением равных объемов растворов АlCl3 и NaОН. Напсать формулу мицеллы золя.
Самостоятельная работа № 8
Тема 2.3. Растворы высокомолекуляр-ных соединений
Задания
1. Выполнение домашних заданий по теме 2.3
2. Составление конспекта по учебнику о высокомолекулярных соединениях. Их роль в природе, технологии пищевых и рыбных продуктов.
Порядок выполнения задания: составление конспекта о высокомолекулярных соединениях. Их роль в природе, технологии пищевых и рыбных продуктов.
Методические рекомендации по написанию конспекта представлены в самостоятельной работе № 4.
Список литературы
1. Белик В.В. Физическая и коллоидная химия: учебник для студ. учреждений сред. проф. образования – М.: «Академия», 2013. – 288 с.
2. Макаров А.Г. Теоретические и практические основы физической химии: учебное пособие/ А.Г. Макаров, М.О. Сагида, Д.А. Раздобреев; Министерство образования и науки Российской Федерации. – Оренбург: Оренбургский государственный университет, 2015. – 172 с. [Электронный ресурс]

3. Органическая и физколлоидная химия: практикум / сост. И.В. Васильцова, Т.И. Бокова, Г.П. Юсупова. – Новосибирск: Новосибирский государственный аграрный университет, 2013. – 155 с. [Электронный ресурс]
[spoiler title=”источники:”]
http://fb.ru/article/379039/mitsella-stroenie-shema-opisanie-i-himicheskaya-formula
http://lektsia.com/8x54ea.html
[/spoiler]
Составление формулы мицеллы коллоидного раствора
Теоретические положения
Мицелла – это структурная коллоидная частица дисперсной фазы.
Правила построения мицеллы:
1.Агрегатом является получающийся в ходе реакции осадок.
2.Потенциалобразующими ионами являются ионы, удовлетворяющие двум условиям:
а) данные ионы должны быть в строении вещества, которое находится в реакции в избытке или является стабилизатором;
б) данные ионы должны быть подобны ионам, находящимся в агрегате (правило Панета-Фаянса: на кристаллической поверхности агрегата адсорбируются те ионы, которые могут достроить её кристаллическую структуру).
3.Противоионами и ионами, образующими диффузионный слой, являются оставшиеся ионы вещества, которое находится в реакции в избытке или является стабилизатором.
4.Коэффициенты m, n, (n-x), x являются постоянными для любой мицеллы и численно не определены.
О.С.ЗАЙЦЕВ
УЧЕБНАЯ КНИГА ПО ХИМИИ
ДЛЯ УЧИТЕЛЕЙ СРЕДНИХ ШКОЛ,
СТУДЕНТОВ ПЕДАГОГИЧЕСКИХ ВУЗОВ И ШКОЛЬНИКОВ 9–10
КЛАССОВ,
РЕШИВШИХ ПОСВЯТИТЬ СЕБЯ ХИМИИ И ЕСТЕСТВОЗНАНИЮ
УЧЕБНИК![]() ЗАДАЧНИК
ЗАДАЧНИК![]() ЛАБОРАТОРНЫЙ ПРАКТИКУМ
ЛАБОРАТОРНЫЙ ПРАКТИКУМ![]() НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
НАУЧНЫЕ РАССКАЗЫ ДЛЯ ЧТЕНИЯ
Продолжение. См. № 4–14, 16–28, 30–34, 37–44, 47,
48/2002;
1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23,
24, 25-26, 27-28, 29, 30, 31, 32, 35, 36, 37, 39, 41, 42, 43, 44, 46, 47/2003;
1, 2, 3, 4, 5, 7, 11, 13, 14, 16, 17, 20, 22, 24, 29, 30, 31, 34, 35, 39, 41, 42, 45/2004;
2, 3, 5, 8, 10, 16, 17/2005;
1, 2, 10, 12, 15/2006
§ 8.4. Дисперсные (коллоидные)
состояния вещества
(продолжение)
Различают лиофильные и лиофобные золи.
Лиофильные золи образуются самопроизвольно и не
разрушаются со временем. Лиофобные золи
постепенно разрушаются вследствие
самопроизвольного слипания твердых частиц
(коагуляция) или слияния жидких частиц
(коалесценция), хотя при наличии стабилизатора
эти процессы могут быть очень длительными.
Имеется много методов лабораторного и
производственного получения коллоидных систем.
Один из них состоит в образовании нерастворимых
веществ в химической реакции (конденсационный
метод). Например, при окислении сероводорода сера
выделяется в коллоидном состоянии:
2H2S + O2 = 2S + 2H2O,
2H2S + SO2 = 3S + 2H2O,
2H2S + SO32– + 2Н+ = 3S +
3H2O.
Распад тиосульфат-иона в кислотной среде также
приводит к образованию золя серы:
S2O32– = S + SO32–.
При гидролизе ионов Fe3+ образуется золь
гидроксида железа:
Fe3+ + 3H2O = Fe(OH)3 + 3H+.
Эти и подобные им реакции проходят в природе
при слиянии природных вод различных составов и
кислотности.
Дисперсные вещества получают в лаборатории
растиранием в ступках пестиком или в мельницах с
шарами. В природе подобное случается при трении
камней в быстрых потоках воды или на каменистых
побережьях морей (вспомните форму гальки).
Процесс химического образования частиц
дисперсной фазы очень сложен, но упрощенно его
можно описать следующим образом. Рассмотрим
образование золя и строение его частиц на
примере хлорида серебра AgCl. Этот золь образуется
при медленном приливании водного раствора
хлорида натрия NaCl к водному раствору нитрата
серебра AgNO3, взятому в избытке (если ввести
сразу большую порцию раствора NaCl, то мгновенно
выпадет осадок хлорида серебра и золь не
получится). Реакция протекает по уравнению:
Ag+ + Cl– = AgCl.
При постепенном приливании раствора NaCl в
раствор AgNO3 в первый момент из ионов Ag+
и Cl– образуется агрегат (AgCl)n, в
котором ионы расположены в том же порядке, что и в
кристаллической решетке AgCl.
Далее агрегат (AgCl)n адсорбирует на
своей поверхности преимущественно те ионы,
которые входят в его состав (или изоморфны по
типу кристаллической решетки) и находятся в
растворе в избытке. Этим условиям в данном случае
отвечают ионы серебра. В результате адсорбции
ионов Ag+ агрегат из хлорида серебра со
слоем ионов серебра приобретает положительный
заряд.
Ионы, адсорбирующиеся на поверхности агрегата,
придают частице заряд и называются потенциалопределяющими.
Наличие одноименных зарядов на агрегатах
препятствует их объединению и росту кристалла
AgCl. Таким образом агрегаты AgCl с адсорбированными
на них ионами приобретают состояние
агрегативной устойчивости.
Агрегат (AgCl)n вместе с
потенциалопределяющими ионами Ag+
составляет ядро. К заряженному ядру
притягиваются ионы противоположного заряда – противоионы.
В данном случае такими ионами будут ионы,
содержащиеся в растворе (но не входящие в состав
агрегата), – нитрат-ионы NO3–.
Противоионы, непосредственно примыкающие к ядру,
образуют адсорбционный слой противоионов.
За адсорбционным слоем противоионов следует диффузный
слой тех же противоионов. Количество
противоионов диффузного слоя постепенно
понижается по мере удаления от ядра. Противоионы
диффузного слоя ориентируют вокруг себя
полярные молекулы растворителя, создавая
дополнительную сольватную (гидратную) оболочку.
Ионы адсорбционного слоя сравнительно прочно
связаны с агрегатом, а противоионы диффузного
слоя находятся под действием двух факторов:
электростатического притяжения ионами
противоположного заряда, которое удерживает их
вблизи ядра, и броуновского движения,
стремящегося распределить их в дисперсионной
среде.
Ядро вместе с противоионами адсорбционного
слоя составляет коллоидную частицу, или гранулу.
Гранула с противоионами диффузного слоя
называется мицеллой. Следует иметь в виду,
что знак заряда гранулы соответствует знаку
заряда потенциалопределяющих ионов. Мицелла в
отличие от гранулы электронейтральна.
Формулу мицеллы гидрозоля хлорида серебра
записывают так:
{n(AgCl), mAg+, (m – x)NO3–}x+xNO3–.
В фигурные скобки заключена гранула. Ионы,
указанные за фигурными скобками, составляют
внешнюю часть мицеллы. Строение мицеллы хлорида
серебра представлено на рис. 8.34. Подобный
механизм мицеллобразования относится к
лиофобным коллоидам.
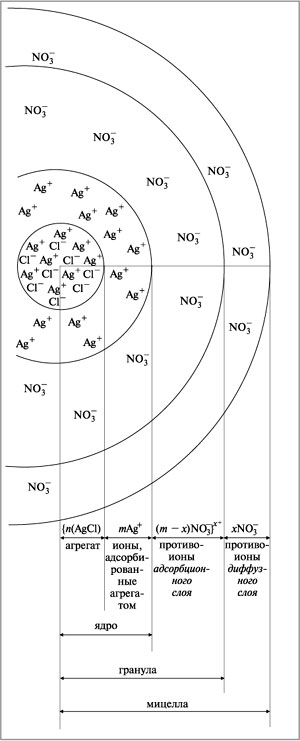 |
Рис. 8.34.
|
Строение мицеллы и заряд гранулы
зависят от способа получения коллоидного
раствора. Если медленно приливать разбавленный
раствор нитрата серебра к раствору хлорида
натрия, взятому в избытке, то на поверхности
агрегата n(AgCl) будут адсорбироваться
хлорид-ионы, имеющиеся в растворе в избытке
(образуется слой потенциалопределяющих ионов), а
в качестве противоионов адсорбционного и
диффузионного слоев будут выступать ионы натрия.
Состав мицеллы полученного гидрозоля
записывается формулой:
{n(AgCl), mCl–, (m – x)Na+}x–xNa+.
Основу мицеллы составляет нерастворимое в
данной среде ядро, микрокристалл или
совокупность микрокристаллов.
Рассмотрим другие наиболее важные для
обсуждения природных процессов примеры
образования дисперсной фазы. Прильем к раствору
хлорида железа FеCl3 по каплям раствор
гидроксида натрия NaОН до помутнения раствора или
образования хлопьев малорастворимого
гидроксида железа
Fe(ОН)3:
Fe3+ + 3OH– = Fe(ОН)3.
Образовавшаяся мицелла имеет такое строение:
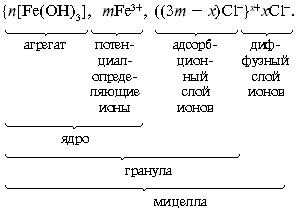
В слой потенциалопределяющих ионов могут
входить не только ионы Fe3+, но и
образующиеся при гидролизе ионы Fe(OH)2+, Fe(OH)2+
и др. Примерно таково же строение мицеллы
гидроксида алюминия.
При медленном приливании раствора хлорида
железа в раствор гидроксида натрия процесс
образования мицеллы протекает намного сложнее,
но теоретически можно предположить, что
гидроксид-ионы могут быть
потенциалопределяющими, а ионы натрия входят в
состав адсорбционного и диффузного слоев.
Состав мицеллы кремниевой кислоты,
образующейся при приливании к раствору силиката
натрия (избыток) сильной кислоты, может быть
выражен такой формулой:
{[nH2SiO3], mHSiO3–,
(m – x)Na+}х–xNa+.
Изучение заряда гранулы имеет большое значение
для объяснения и предсказания поведения
дисперсных систем. Слой ионов вокруг агрегата и
противоинов адсорбционного и диффузного слоев
представляет собой двойной электрический слой.
Число положительных и отрицательных зарядов в
нем одинаково, поэтому мицелла
электронейтральна.
Между ядром и раствором возникает полный
электрический потенциал или термодинамический
![]() (фи)-потенциал.
(фи)-потенциал.
Это – разность потенциалов, созданных всеми
положительными и отрицательными зарядами
мицеллы. Другой потенциал, называемый электрокинетическим,
или
![]() (дзета)-потенциалом,
(дзета)-потенциалом,
существует между слоем ионов адсорбционного
слоя и диффузного слоя. Электрокинетический
потенциал назван так потому, что диффузный слой
подвижен и может смещаться при движении мицеллы.
Этот потенциал составляет часть
термодинамического потенциала и всегда меньше
его (рис. 8.35).
Слой ионов вокруг агрегата образуется
за счет электростатического взаимодействия и
химических связей с ионами агрегата. Это прочный
и плотный слой, сохраняющийся при изменении
условий существования гранулы (если, конечно,
дисперсная система не разрушается).
Адсорбционный слой противоионов вокруг ядра
образуется также за счет электростатического
взаимодействия с ионами потенциалобразующего
слоя и благодаря взаимодействиям типа сил
Ван-дер-Ваальса. Это плотный слой, и ионы в нем
закреплены довольно прочно. Ионы диффузного слоя
не закреплены прочно и могут смещаться и даже
отрываться от гранулы в электрическом поле или
при движении мицеллы.
Электрокинетический потенциал снижается по
мере удаления от поверхности гранулы (или
твердого тела). На ![]() -потенциал
-потенциал
влияет концентрация ионов в растворе. При
увеличении концентрации ионов
![]() -потенциал
-потенциал
уменьшается за счет перехода части ионов
диффузного слоя в адсорбционный слой или
благодаря замене ионов с зарядом одного знака на
ионы с зарядом другого знака.
Добавление ионов, особенно многозарядных,
может привести к их адсорбции в таких
количествах, что произойдет перезарядка гранулы
и изменение знака электрокинетического
потенциала. Когда все противоионы находятся в
адсорбционном слое, ![]() -потенциал становится равным нулю.
-потенциал становится равным нулю.
Подобное состояние называется изоэлектрическим
состоянием (изоэлектрической точкой).
С увеличением концентрации ионов
электрокинетический потенциал уменьшается,
проходит через изоэлектрическую точку, изменяет
знак и снова увеличивается. В изоэлектрическом
состоянии электрокинетический потенциал равен
нулю, и в этом состоянии дисперсные системы
наименее устойчивы, частицы укрупняются,
выпадают в осадок, и из ядра, играющего роль
кристаллического зародыша, вырастает кристалл.
Лиофильные системы в отличие от лиофобных в
изоэлектрическом состоянии устойчивы (кроме
некоторых белков).
Знак заряда гранулы может меняться при смене
растворителя, а также при изменении среды
раствора. У амфотерного гидроксида алюминия знак
заряда гранулы в кислотной и нейтральной средах
положителен и потенциалопределяющими являются
ионы алюминия; в слабощелочной среде знак заряда
гранулы становится отрицательным
(потенциалопределяющие ионы – алюминат- или
гидроксид-ионы, противоионы – катионы). Смена
знака заряда происходит при переходе через
значение рН, соответствующее изоэлектрической
точке.
Знак заряда коллоидной частицы
устанавливается по направлению ее движения к
соответствующему электроду при пропускании
постоянного электрического тока. Знак заряда
может быть определен другим очень простым
способом – по характеру взаимодействия
окрашенных коллоидных частиц с целлюлозой
бумаги. В водной среде капилляры целлюлозы
заряжаются отрицательно, а находящаяся в них
вода – положительно. Вдоль полоски
фильтровальной бумаги (целлюлоза) по ее
капиллярам могут передвигаться частицы, имеющие
тот же заряд, что и целлюлоза, т.е. отрицательно
заряженные частицы. Положительно заряженные
частицы задерживаются на стенках капилляров в
самом начале пути.
При исследовании бесцветного коллоидного
раствора пропитанную раствором бумагу следует
высушить и обработать реактивом, окрашивающим
коллоидные частицы. Подобный анализ
представляет собой вариант хроматографического
анализа на бумаге.
Положительный знак заряда имеют гранулы
гидроксидов Fe(OH)3, Al(OH)3, Cr(OH)3, Ti(OH)3
и др. Отрицательный знак заряда имеют гранулы
некоторых гидроксидов, оксидов MnO2, SnO2,
SiO2, золи кремниевой кислоты, сульфидов As2S3,
PbS и других, коллоиды высокодисперсных металлов
Au, Ag, Pt и серы S, а также глинистые коллоиды и
гуминовые кислоты почвы.
Явления смещения диффузного слоя в мицелле и
даже его отрыва или, наоборот, возникновения
разности потенциалов при движении мицеллы
называют электрокинетическими явлениями.
Все электрокинетические явления связаны с
наличием двойного электрического слоя и
определяются электрокинетическим потенциалом.
Эти явления наблюдаются в дисперсных системах и
в капиллярах и связаны с подвижностью диффузного
слоя ионов. На электрокинетических явлениях
основаны некоторые методы очистки воды. Из этих
явлений наиболее важны электроосмос и
электрофорез.
В плоскую чашку положим влажную глину и воткнем
в нее две стеклянные трубки, в которые нальем
воду с добавкой небольшого количества
электролита для увеличения электропроводности
(рис. 8.36). В воду опустим электроды и соединим их с
источником постоянного тока.
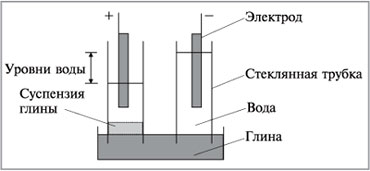 |
Рис. 8.36.
|
Через некоторое время жидкость в
трубке с положительным электродом становится
мутной из-за подъема частиц глины к электроду.
Одновременно уровень жидкости в этой трубке
понизится, а в другой поднимется. Этот опыт
показывает, что частицы глины имеют
отрицательный заряд и перемещаются в
электрическом поле.
Движение дисперсных частиц относительно
дисперсионной среды (жидкой и газообразной) под
действием электрического поля называется электрофорезом.
В водной среде частица двигается к электроду,
знак заряда которого противоположен знаку
электрокинетического потенциала.
Диффузный слой ионов мицеллы непрочен, при
перемещении мицеллы происходит его частичное
разделение, при этом дисперсная фаза и
дисперсионная среда приобретают
противоположные заряды. В электрическом поле
гранула перемещается к одному полюсу, а часть
противоионов диффузного слоя отрывается от
мицеллы и передвигается к противоположному
полюсу (рис. 8.37).
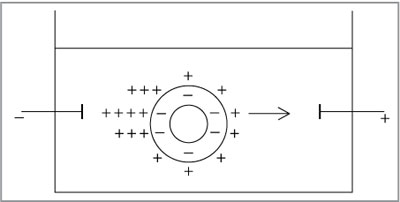 |
Рис. 8.37.
|
В отличие от электролиза при
электрофорезе не происходит выделения
дисперсного вещества, мицеллы не разрушаются, а
наблюдается концентрирование коллоидных
примесей с последующим удалением их из
приэлектродной зоны.
Если в электрическом поле коллоидная частица
не перемещается, то у нее нет заряда, она
электронейтральна, что может указывать на ее
изоэлектрическое состояние.
На электрофорезе основаны очистка воды,
улавливание частиц дыма или пыли, выделение
белков, аминокислот, витаминов и т.п. Поскольку
вместе с гранулами передвигаются молекулы
жидкости, составляющие их сольватные оболочки,
электрофорезом производят частичное
обезвоживание различных материалов (глины,
почвы, мокрого торфа).
В медицине электрофорезом через кожу или
слизистые оболочки вводят лекарственные
вещества. При электрофорезе частицы могут
перезаряжаться и заряжаться. Например, хотя
частицы белка электронейтральны, в кислотной
среде белок передвигается к катоду, а в щелочной
– к аноду.
Если вместо глины взять пористую диафрагму
(мембрану) или перегородку из пористого фарфора
или стекла, плотной или смерзшейся почвы, то
через мембрану в электрическом поле будет
проходить жидкость без дисперсных частиц (рис.
8.38). Это явление называется электроосмосом.
Электроосмос – перемещение дисперсионной среды
под действием электрического поля: противоионы
диффузного слоя притягиваются к
соответствующему электроду и увлекают за собой
жидкость дисперсионной среды. Электроосмос
проявляется также при движении жидкости
дисперсной системы через капилляры или поры
диафрагмы под действием электрического тока.
Электроосмосом можно объяснить некоторые
природные процессы. Электроосмос используют для
обезвоживания древесины, грунта, торфа и других
материалов.
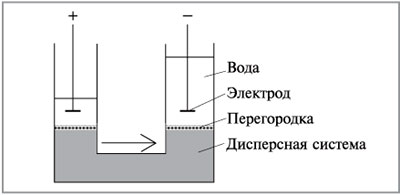 |
Рис. 8.38.
|
Электрокинетические явления
осуществимы только в том случае, если частицы
заряжены. Благодаря электрокинетическим
явлениям может быть определен знак заряда
коллоидной частицы, величина
электрокинетического потенциала и изучены
другие свойства дисперсных систем.
