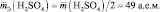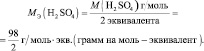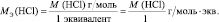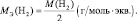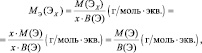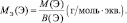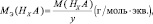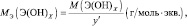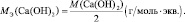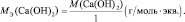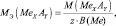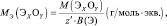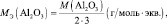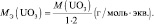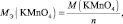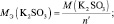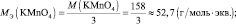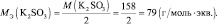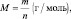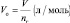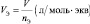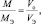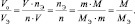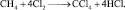Как рассчитать эквивалентную массу
Эквивалентной массой, или молярной массой эквивалента, называется количество вещества, взаимодействующее с одним молем водорода или вытесняющие столько же атомов водорода из его соединений. Обозначается эта величина Mэкв, измеряется в г/моль и вычисляется по формулам или экспериментальным путем.

Вам понадобится
- – периодическая система;
- – калькулятор;
- – химическая посуда;
- – разбавленная соляная кислота;
- – навеска металла.
Инструкция
Чтобы найти эквивалентную массу простого вещества, воспользуйтесь формулой:Mэкв = Mа/B, где Mэкв – масса эквивалента;Mа – атомная масса элемента; B – валентность.Например, согласно формуле эквивалентная масса натрия будет равна 22,99 г/моль, а двухвалентной серы – 32/2 = 16 г/моль и т.д. Для сложных веществ молярной массой эквивалента будет называться количество вещества, прореагировавшего без остатка с одним эквивалентом другого вещества, например, водорода.
Помните, что расчет этой величины для разных химических соединений имеет нюансы. Например, при вычислении эквивалентной массы оксидов – складывайте значения эквивалентных масс, составляющих соединение. Допустим, дан оксид цинка. Сначала считаете Mэкв (Zn) = 65/2 =32,5 г/моль. Потом – Mэкв (O) = 16/2 = 8 г/моль. Таким образом, получите эквивалентную массу ZnO равную 40,5 г/моль. А рассчитать массу эквивалента кислоты можно, разделив ее молекулярную массу на количество атомов водорода, содержащихся в ней: Mэкв (H2SO4) = 98/2 = 49 г/моль и т.д.
Для экспериментального определения эквивалентной массы сначала повторите технику безопасности при работе с кислотами и газами. Затем возьмите бюретку, пробирку и воронку. Соедините их между собой резиновыми трубками. Налейте в бюретку дистиллированной воды, с помощью воронки установите ее уровень на нуле.
В пробирку налейте 5 мл соляной кислоты (постарайтесь не замочить стенки). На сухую стенку поместите навеску металла. Следите за тем, чтобы он не упал в кислоту раньше времени. Закройте пробирку пробкой и встряхните. Водород будет вытеснять воду из бюретки. После завершения реакции выровняйте уровень воды в бюретке и воронке. Запишите конечный результат, температуру и давление при проведении опыта.
Определите вытесненный объем водорода, сравнив начальный и конечный уровень воды в бюретке. Приведите полученный результат к нормальным условиям, используя показания барометра и термометра. И затем только рассчитайте массу эквивалента металла, используя формулу:m (металла)/V (водорода при норм.условиях) = Mэкв.(металла)/Vэкв (водорода).
Источники:
- рассчитать молярную массу эквивалента
- ЭКВИВАЛЕНТНАЯ МАССА
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Эквивале́нт вещества́ или просто эквивале́нт — безразмерная величина, равная количеству одного вещества, реагирующему в конкретной реакции с произвольным (часто – равным 1 моль) количеством другого вещества; общее формальное определение выглядит так:
-
- для реакции аА + bВ –> …
- эквивалент вещества В по веществу А есть отношение а/b (читается: “одна частица В эквивалентна а/b частиц А” или (что то же самое, см. ниже) “одна порция вещества В эквивалентна а/b порций вещества А”)
- (где а и b – коэффициенты перед этими веществами в уравнении реакции, а их отношение – называется также “мольное соотношение” или “мольное отношение”, или “число эквивалентности”;
- отношение b/а (то есть обратное) называется “фактор эквивалентности вещества В по веществу А”, см. ниже; также, b/а – является коэффициентом перед веществом В в приведённом по веществу А уравнении той же самой реакции). Иногда эквивалентном вещества называют непосредственно фактор эквивалентности этого вещества, не проводя между ними различий. [1]
Эквивалент – архаичная величина, которая использовалась в химии и биологии с начала ХIХ до середины ХХ веков (см. ниже раздел “история”). Говорить об эквиваленте вещества имеет смысл только относительно конкретной реакции. Само по себе понятие эквивалента используется редко; чаще встречаются обороты речи “эквивалентное соотношение веществ” и величины: “фактор эквивалентности”, “молярная масса эквивалента”, “эквивалентная масса”, “эквивалентная концентрация” (синоним: “нормальная концентрация”, устаревший синоним: “нормальность”), “количество вещества эквивалентна”.
Более частными определениями являются такие:
1) в окислительно-восстановительной реакции (по определению: в реакции, в которой происходит изменение степеней окисления атомов, то есть происходит обмен электронами) – величина мольного отношения вещества к отдаваемым или принимаемым им в данной реакции электронов (если рассматривать атомы окислителя или восстановителя – то величина изменения степени окисления такого атома в данной реакции); то есть в определении выше, А = 
2) в кислотно-основной реакции (по определению: в реакции, в которой не происходит изменения степеней окисления атомов, то есть обмениваются частицы, отличные от электронов) – величина мольного отношения вещества к отдаваемым или принимаемым им в данной реакции протонам, или гидроксил-ионам; то есть в определении выше, А = 
Фактор эквивалентности был определён выше[1]:
для реакции аА + bВ –> …
-
- фактор эквивалентности f(вещества В по веществу А) = b/а
- f = 1/Z, где Z – число эквивалентности (то есть эквивалент; число, обратное f), изменение степени окисления (количество отданных или принятых электронов), количество протонов или гидроксил-ионов в данной реакции.
Все остальные перечисленные выше “эквивалентные” величины получаются[1] умножением соответствующих не-эквивалентных величин на фактор эквивалентности f:
-
- молярная масса эквивалента вещества = молярная масса вещества * f = молярная масса вещества / Z
-
- нормальная концентрация = молярная концентрация * f
-
- количество вещества эквивалента = количество вещества * f
Кроме указанных выше, встречаются также определения фактора эквивалентности, основанные на отношении молярных масс (и до 1870 года – основанные на “эквивалентных весах элементов”), например:
“Эквивалентный вес кислоты или основания для реакций нейтрализации или любого другого соединения, которое действует путем двойного разложения, представляет собой массу соединения, которое будет давать или вступать в реакцию с 1,008 г иона водорода или 17,0074 г иона гидроксида, например, соляная кислота (HCl), 36,461 г; серная кислота (H2SO4), 98,078 г; гидроксид натрия (NaOH), 40 г; или карбонат натрия (Na2CO3), 105,9892 г.”
Также встречаются устаревшие определения фактора эквивалентности на основе понятия валентности (которое фактически не используется в химии примерно с середина ХХ века).
Также встречаются определения эквивалента с использованием понятия “мнимых” частиц и с использованием (принципиально ложной, физически противоречивой) предпосылки, что уравнение химической реакции описывает поведение неких отдельных частиц вещества, а не порций порядка молей веществ[1]:
“Эквивалентном называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равносильна) в данной реакции одному иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях)”
Примеры использования:
В реакции 
-
- вещество
эквивалентно 1
-иону (число эквивалентности Z = 1), фактор эквивалентности фосфорной кислоты = 1/1; f(NaOH) = 1.
- вещество
В реакции 
-
- вещество
эквивалентно 2
-ионам (Z = 2), фактор эквивалентности фосфорной кислоты = 1/2: f(NaOH) = 1.
- вещество
В реакции 
-
- вещество
эквивалентно 3
-ионам (Z = 3), фактор эквивалентности фосфорной кислоты = 1/3; f(NaOH) = 1.
- вещество
В реакции 
-
- 1 условная единица вещества
эквивалентна 5 электронам (Z = 5, f(перманганата) = 0,2) и 8 порциям HCl (f(перманганата) = 1/8)
- 1 условная единица вещества
В реакции 
-
- f(перманганата по электронам) = 1; f(перманганата по гидроксиду бария) = 0,25.
В реакции 
-
- f(перманганата по электронам) = 1/3; f(перманганата по сероводороду) = 2/3; f(сероводорода по электронам) = 0,5; f(сероводорода по перманганату) = 1,5
История понятия “эквивалентов”[править | править код]
История предпосылок, понятия эквивалентов, эквивалентных масс и смены этих понятий на последующие, более обоснованные физически, сводиться к попыткам химиков ответить на вопрос: “в каком соотношении реагируют вещества?” (актуальный ответ, который мы знаем теперь, но который разработчики понятий эквивалентна не знали: в мольном соотношении; то есть в соотношении количеств частиц (атомов, молекул, электронов, ионов; количество выражается в молях), равным отношению коэффициентов перед веществами в уравнении реакции, так называемый “основной закон химической стехиометрии”[2]) и установить строение веществ, которые реагировали.
Первые эквивалентные массы кислот и оснований были опубликованы Карлом Фридрихом Венцелем в 1777 году [3][4], он же ввёл понятие “эквивалентных количеств веществ” и “эквивалента вещества” (трактат “Учение о химическом сродстве тел”). В результате экспериментов в обменными реакциями солей, Карл Венцель пришёл к выводу, что для нейтрализации одного и того же количества кислоты или основания требуются различные количества других кислот или оснований. Он предложил “закон нейтральности”:
- “Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух или большего числа оснований, то количества последних эквивалентны и нейтрализуются одним и тем же количеством другой кислоты”
Более крупный набор таблиц был подготовлен, с опорой на работу Венцеля, немецким химиком Иеремией Бенджамином Рихтером. Основные выводы и эксперименты он опубликовал в своей книге 1972 г “Стехиометрия, или искусство измерения химических элементов”, и его “закон эквивалентов” является развитием “закона нейтральности” Венцеля.
Рихтер сформилировал закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
Под Э подразумевается элемент или вещество; под m – масса.
Оба автора – Венцель и Рихтер – не признавали атомную теорию, и не смогли развить концепцию стехиометрии дальше. Их концепции для современников прошли незамеченными и далее не были развиты во что-либо; хотя их таблицы соотношений нейтрализации были перепечатаны несколькими известными химиками того времени.
Тем не менее, многие химики сочли эквивалентные веса полезным инструментом, независимо от того, придерживались ли эти химики атомной теории. Эквивалентные веса были полезным обобщением “закона определенных пропорций” (он же – “закон постоянства состава”) Джозефа Пруста (1794 г.), который позволил химии стать количественной наукой. Он развил идею о постоянстве состава веществ и о постоянстве количественных отношений, в которых вещества могут соединяться. Французский химик Жан-Батист Дюма (1800–1884 гг.) стал одним из наиболее влиятельных противников атомной теории после того, как принял ее в начале своей карьеры, но был стойким сторонником эквивалентных весов. Далее Дальтон развил идею, сформулировав”закон кратных отношений”. Дальше понятие о постоянных соотношениях реагентов получило в работах Луи Гей-Люссака и в молекулярной теории А.Авогадро.
Последним смертельным ударом по использованию эквивалентных весов элементов стало представление Дмитрием Менделеевым его периодической таблицы в 1869 году, в которой он связал химические свойства элементов с приблизительным порядком их атомных весов. Однако эквивалентные веса продолжали использоваться для многих соединений еще сто лет, особенно в аналитической химии. Эквивалентные массы обычных реагентов можно было заносить в таблицы, что упрощало аналитические расчеты до того, как электронные калькуляторы стали широко доступны: такие таблицы были обычным явлением в учебниках аналитической химии. После разработки теории строения атомов и молекул, в химии окончательно утвердилось понятие о мольном соотношении.
По состоянию на 2023 год, понятие “фактор эквивалентности” всё ещё печатается в учебниках по общей химии для ВУЗов, а также используется в аналитической химии (в титриметрическом анализе).
См. также[править | править код]
- Электрохимический эквивалент
Примечания[править | править код]
- ↑ 1 2 3 4 Васильев В.П. – “Аналитическая химия”, в 2 томах. – том 1, стр 181-182. – М.: Высшая школа, 1989
- ↑ В.В.Ерёмин, А.Я.Борщевский – “Основы общей и физической химии”. – Долгопрудный: Интеллект, 2012. – стр.28
- ↑ Фигуровский Н.А. “История химии: учебное пособие для студентов пед. ин-тов по хим. и биол. специальностям”. – М.: Просвещение, 1979. – стр. 70-76
- ↑ М.Джуа – “История химии”. – М.: МИР, 1975. – стр.163-218
для
разных веществ:
7.1.Для
простыходноатомных веществ и
дляодного химического элемента в
сложном веществе:МЭ
= М/п = А/п,
где А –
атомная масса,n– валентность химического элемента.
Например, МЭ(Al)
= 27/3 = 9г /моль (эквивалентов), МЭ(О)
= 16/2 = 8 г/моль;
7.2.Дляпростых
многоатомных (из двух и более атомов)
и сложныхвеществ эквивалентную массу
рассчитывают по общей формулеМЭ
= М/ п.k,
где М –
молярная масса вещества,п –
валентность одного, любого, элемента;
k
– количество атомов этого элемента
в молекуле.
Например, МЭ(О2)
=32/2.2 = 8, г /моль (эквивалентов),
МЭ(N2)
= 28/2.2 = 7, г /моль; МЭ(Al2О3)
= (27.2 + 16.3)/3.2 = (54 + 48)/6 = 102/6 = 17, г/моль.
7.3.Эквивалентная массасложного вещества
равна сумме эквивалентных масс образующих
его химических элементов.
Например, МЭ(Al2О3)
= М(Al)/п(Al) +
М(О)/п(О)= 27/3 + 16/2 = 17
г/моль. При этом fЭ(Al2О3)=
МЭ(Al2О3)/М(Al2О3)=
17 г/моль/102 г/моль = 1/6, Э(Al2О3)=
1/6 моль, число эквивалентов пЭ(Al2О3)
= 6 (6Э в 1 моле вещества
Al2О3).
7.4.Для
вычисления эквивалентных масссложных
веществ разных классовможно
использовать следующие формулы (при
условииполногозамещения
соответствующих функциональных групп
или атомов, ионов, количество которых
указано в формуле
индексом; в противном случае, в
реакцияхнеполногозамещения,
следует учитывать количествопрореагировавшихгрупп, атомов,
ионов):
7.4.1. Эквивалентная масса оксида:
МЭ(окс)
= М(окс)/k
. п =М(окс.)/пЭ
= М(окс). fЭ,
где М(окс) –
молярная масса оксида,k
– количество атомов какого-либо
одного элемента в составе молекулы
оксида,n –
валентность этого элемента;пЭ— число эквивалентов,пЭ
= k . п
эквивалентов Э иfЭ
— фактор эквивалентности оксида,fЭ
= 1/ пЭ.
Например, МЭ(Мп2О7)
= (55.2 + 16.7)/7.2 = 222/14 = 15,8 г/моль (эквивалентов).
7.4.2. Эквивалентная масса основания:
МЭ(осн)=М(осн)/k(ОН)
= М(осн)/пЭ ,
где М(осн.)
– молярная масса,k(ОН)
– кислотность основания, т.е. количество
гидроксидных групп ОН–в молекуле
основания, равное числу эквивалентовпЭ в случаеполного замещения групп ОН–;
принеполном замещении, например,
при недостатке кислоты, пЭ
равно числупрореагировавшихОН–-групп.
Например, МЭ
(Са(ОН)2) = 74/2 = 37
г/моль – в случае полного замещения
обеих
групп ОН–, как в химической
реакции: Са(ОН)2 + 2HCl
= СаCl2 +
2Н2О.
При замещении одной
ОН––группы МЭ(Са(ОН)2)
= 74/1 = 74 г/моль–
как, например, в
реакции: Са(ОН)2 + HCl
= СаОНCl + Н2О.
7.4.3. Эквивалентная масса кислоты:
МЭ(кисл)
= М(кисл)/
k(Н)=
М(кисл)/пЭ ,
где М(кисл)
– молярная масса,k(Н)– основность кислоты, т.е. количество
атомовНв молекуле кислоты, равное
числу эквивалентов
пЭкислотыпри полном замещении атомов водорода;
в случае ихчастичного замещения– например,при избытке кислоты–пЭ равно числупрореагировавших атомов
Н).
Например, МЭ(Н2SO4)
= 98/2 = 49г /моль,пЭ=
2Э (эквивалентам) – приполном замещениидвухатомов водорода:2NaCl
+ H2SO4
= Na2SO4
+ 2HCl.
При недостатке соли
(избытке кислоты) возможна реакция
замещения только одного атома
водорода:NaCl + H2SO4
= NaНSO4
+ HCl,
и тогда МЭ(Н2SO4)
= 98/1 = 98г /моль,Э(Н2SO4)
=1 моль,пЭ =
1Э.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Как определить эквивалент вещества?
Ученик
(45),
закрыт
11 лет назад
NN
Мастер
(1513)
12 лет назад
Эквивалентная масса (молярная масса эквивалента вещества) mэкв также является одной из важнейших характеристик вещества. По определению эквивалент вещества – это такое количество химического вещества, которая реагирует с 1 г водорода или вытесняет такое же количество водорода из его соединений. Величина mэкв определяется или экспериментально, или, чаще всего, исходя из химической формулы вещества и его принадлежности к тому или иному классу химических соединений (мы будем рассматривать только неорганические соединения)
mэкв (оксида) = Моксида/(число атомов кислорода·2);
mэкв (основания) = Моснования/кислотность основания;
mэкв (кислоты) = Мкислоты/основность кислоты;
mэкв (соли) = Мсоли/(число атомов металла·валентность металла) .
Можно отметить, что в большинстве случаев кислотность основания равна числу гидроксильных групп в формуле основания, а основность кислоты равна числу атомов водорода в формуле кислоты.
Например: mэкв (Fe2O3) = М (Fe2O3)/(3·2) = 160/6 = 26,7 г/моль;
mэкв (H2SO4) = M(H2SO4)/2 = 98/2 = 49 г/моль;
mэкв (Ca(OH)2) = M(Ca(OH)2)/2 = 74/2 = 37 г/моль;
mэкв (Al2(SO4)3) = M(Al2(SO4)3) = 342/2 = 171 г/моль;
Эквивалентные массы веществ используют для количественных расчетов при химических взаимодействиях между веществами. Огромным преимуществом при этом является то, что для этого не нужно использовать уравнение химической реакции (которое во многих случаях написать затруднительно) , нужно только знать, что данные химические вещества взаимодействуют между собой или вещество является продуктом химической реакции.
Для количественных расчетов используется закон эквивалентов: массы реагирующих и образующихся веществ относятся друг к другу, как их эквивалентные массы.
Математическое выражение закона эквивалентов имеет следующий вид:
m1/m2 = mэкв (1)/mэкв (2)(1.2)
где: m 1 и m 2 – массы реагирующих или образующихся веществ,
mэкв (1) и mэкв (2) – эквивалентные массы этих веществ.
Пример: определить массу соды (карбоната натрия) Na2CO3, необходимую для полной нейтрализации 1,96 кг серной кислоты H2SO4.
Решение:
Воспользуемся законом эквивалентов
m(Na2CO3)/m(H2SO4) = mэкв (Na2CO3)/mэкв ( H2SO4)
Определяем эквивалентные массы веществ, исходя из их химических формул:
m (Na2CO3) = 106 /(2·1) = 53 г/моль;
mэкв (H2SO4) = 98/2·1 = 49 г/моль.
Тогда:
Х / 1,96кг = 53 г/моль / 49 г/моль
Х = 2,12 кг.
Ирина Миняшина
Мудрец
(12270)
12 лет назад
Для щёлочи молярная масса поделить на количество ОН, для кислоты – она же на количество Н, для соли – она же делить на произведение кол-ва атомов металла и валентоности этого металла.
§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 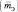
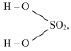
Например, если серная кислота (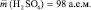
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
А для процесса:
Са(ОН)2 + НСl = СаОНСl + Н2О;
Для солей (МеХАу, где Ме – металл):
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
Для оксидов (ЭХОY):
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al;
а для реакции:
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2;
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
где n – количество электронов, получаемых перманганатом калия
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
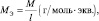
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
из последних двух равенств вытекает соотношение
в котором все величины являются параметрами одного и того же газа.
Действительно:
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
Na2O + Н2О = 2NaOН.
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.