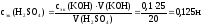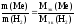Молярная
концентрация эквивалентов.
При
проведении реакции в растворе содержание
растворенного вещества можно рассчитать,
зная объем раствора и молярную концентрацию
эквивалентов растворенного вещества.
Молярная
концентрация эквивалентов равна
количеству вещества эквивалентов
растворенного вещества, содержащемуся
в одном литре раствора.
Обозначение
сэк(В).
Единицы измерения моль-эк/л.
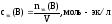
где
nэк(В)
– количество вещества эквивалентов
растворенного
вещества,
моль-эк;
V
– объем раствора, л.
Запись
сэк(Na2SO4)
= 0,1 моль-эк/л следует понимать так: в 1
литре раствора содержится 0,1 моль-эк
Na2SO4
.
Единицы
измерения моль-эк/л можно заменить
буквой “н”.
сэк(H3PO4)
= 0,2 моль-эк/л. или сэк(H3PO4)
= 0,2 н.
Из
уравнения (32) следует, что nэк
растворенного вещества в растворе,
объем которого равен V,
равно:
nэк(В)
= сэк(В)
· V
(33)
Тогда
для реакции (26), записанной в общем виде
и протекающей в растворе, закон
эквивалентов для реагентов будет
записываться в следующем виде:
сэк(А)
· V(A)
= сэк(B)
· V(B),
(34)
где
сэк(А),
сэк(B)
– молярные концентрации эквивалентов
растворов, моль-эк/л;
V(A),
V(B)
– объемы растворов А и В, л или см3.
Пример.
На нейтрализацию 20 см3
раствора H2SO4
израсходовано 25 см3
раствора KOH,
молярная концентрация эквивалентов
которого равна 0,1 н. Рассчитать молярную
концентрацию эквивалентов раствора
кислоты.
Решение.
Согласно закону эквивалентов:
nэк(H2SO4)
= nэк(KOH).
nэк
можно выразить через сэк(B)
и объем раствора (см. уравн. 33):
сэк(H2SO4)
· V(H2SO4)
= сэк(KOH)
· V(KOH)
Отсюда
При
решении задач по закону эквивалентов
следует помнить:
1.
Молярная масса эквивалентов сложного
вещества
может быть рассчитана по правилу сложения
(аддитивности), т.е. равна сумме молярных
масс эквивалентов структурных элементов,
образующих данное вещество.
а)
oксиды
ЭnОm,
где Э – элемент; О – кислород.
Мэк(ЭnОm)
= Мэк(Э)
+ Мэк(О2)
Мэк(О2)
= 8 г/моль (35)
б)
кислоты НnХ,
где Н – водород; Х – кислотный остаток.
Мэк(НnХ)
= Мэк(Н2)
+ Мэк(Х)
Мэк(Н2)
= 1 г/моль (36)
в)
основания
Ме(ОН)n,
где Ме – металл, ОН – гидроксильная
группа
Мэк(Ме(ОН)n)
= Мэк(Ме)
+ Мэк(ОН) Мэк(ОН)
= 17 г/моль (37)
г)
соли МеnXm,
где Ме – металл; Х – кислотный остаток
Мэк(МеnXm)
= Мэк(Ме)
+ Мэк(Х)
(38)
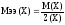
Эквивалентное
число кислотного остатка Х по величине
равно его заряду.
д)
гидриды
МеНn,
где Ме – металл; Н – водород
Мэк(МеНn)
= Мэк(Ме)
+ Мэк(Н2)
Мэк(Н2)
= 1 г/моль (39)
2.
Молярная
масса эквивалентов элемента
связана с абсолютной величиной степени
окисления этого элемента в соединении
соотношением:
,
(40)
где
М(Э) – молярная масса элемента, г/моль;
|С.О.(Э)|
– степень окисления элемента по модулю.
3.
Можно пользоваться схемой химического
процесса,
т.е. указывать только реагенты и продукты,
не расставляя уравнивающие стехиометрические
коэффициенты.
Например:
Ме
+ О2
→МеnОm
(41)
Ме
+ кислота → Н2
+ соль (42)
кислота
+ основание → соль + вода
(43)
Пример.
При окислении 10,8 г металла образовалось
20,4 г оксида металла. Вычислите Мэк(Ме)
и Мэк(МеnОm).
Решение.
Запишем схему процесса:
Ме
+ О2
→ МеnОm
и
закон сохранения массы:
m(O2)
+ m(Me) = m(МеnОm)
Отсюда
m(O2)
= 20,4 – 10,8 =9,6 г
Согласно
закону эквивалентов:
,
учитывая,
что Мэк(О2)
= 8 г/моль-эк (см. табл. 4), находим:
Поскольку
для оксидов Мэк(ЭnОm)
= Мэк(Э)
+ Мэк(О2),
то получаем
Мэк(MenOm)
= 9 + 8 = 17 г/моль-эк.
Пример.
Рассчитать молярную массу эквивалентов
и молярную массу металла, если в гидриде
этого металла на 1 атом металла приходится
2 атома водорода, а массовая доля водорода
в гидриде составляет 4,76 %.
Решение.
Гидрид представляет собой соединение
металла с водородом. Составим схему
образования гидрида:
Ме
+ H2
→ Ме H2
Запишем
закон эквивалентов:
Чтобы
рассчитать Мэк(Ме)
необходимо знать m(Me)
и m(H2),
а Мэк(Н2)
= 1 г/моль-эк (см.табл. 4).
Поскольку
ω%(Ме)
+ ω%(Н2)
= 100%,
то
w
%(Me)
= 100 – 4,74 = 95,24 %.
Если
принять массу гидрида равной 100 г , то
массы составляющих его элементов
численно будут равны их массовым долям
в соединении. Чтобы убедиться в этом,
составим и решим пропорции относительно
m(Me)
и m(H2):
m(MeH2)
– 100%
m(Me)
– w
%(Me)
m(MeH2)
– 100%
m(H2)
– w
%( H2),
Подставляя
в закон эквивалентов соответствующие
значения, получаем:
Т.к.
Мэк(Ме)
и М(Ме) связана соотношением
то
С.О.(Ме)
= +2 поскольку из условия задачи известно,
что на 1 атом металла приходится 2 атома
водорода, а степень окисления водорода
в гидридах равна –1. Рассчитываем
молярную массу металла:
М(Ме)
= 20·2 = 40 г/моль.
ЗАДАЧИ
1.Вычислите:
а) Vэк(N2O5);
б)
Мэк(В): Ni2O3,MnSO4,HCN;
в)
Мэк(Со(ОН)2)
в реакции
2Co(OH)2
+ H2SO4
= (CoOH)2SO4
+ 2H2O.
2.В
какой массе H2SO4
содержится столько же nэк
(H2SO4),
сколько в 140 г Cr(OH)3?
3.
Определите степень окисления железа в
сульфиде (FexSy),
содержащим 53,85 % железа. C.O.(S)
= –2.
4..Молярная
масса эквивалентов некоторого металла
равна
9,0
г/моль-эк. Определите объем кислорода
(н.у.), необходимый для окисления 15,2 г
этого металла. Рассчитайте массовую
долю этого металла в его оксиде.
5.Оксид
пятивалентного элемента содержит 43,67
% элемента. Определите атомную массу и
назовите элемент.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
…
Существует множество способов измерить концентрацию раствора. Это так называемые способы выражения концентрации раствора.
Концентрация раствора — это количество вещества, находящегося в единице объема или массы раствора.
Что такое раствор
Среди окружающих нас веществ, лишь немногие представляют собой чистые вещества. Большинство являются смесями, состоящими из нескольких компонентов, которые могут находиться в одном или различных фазовых состояниях.
Смеси, имеющие однородный состав являются гомогенными, неоднородный состав – гетерогенными.
Иначе, гомогенные смеси, называют растворами, в которых одно вещество полностью растворяется в другом (растворителе). Растворитель – это тот компонент раствора, который при образовании раствора сохраняет свое фазовое состояние. Он обычно находится в наибольшем количестве.
Существуют растворы газовые, жидкие и твердые. Но более всего распространены жидкие растворы, поэтому, в данном разделе, именно на них мы сосредоточим свое внимание.
Концентрацию раствора можно охарактеризовать как:
- качественную
- количественную.
Качественная концентрация характеризуется такими понятиями, как разбавленный и концентрированный раствор.
С этой точки зрения растворы можно классифицировать на:
- Насыщенные – растворы с максимально возможным количеством растворенного вещества. Количество растворяемого вещества, необходимое для получения насыщенного раствора определяет растворимость этого вещества.
- Ненасыщенные – любые растворы, которые все еще могут растворять введенное вещество.
- Пересыщенные – растворы, в которых растворено больше вещества, чем максимально возможное. Такие растворы очень нестабильны и в определенных условиях растворенное вещество будет выкристаллизовываться из него, до тех пор, пока не образуется насыщенный раствор.
Количественная концентрация выражается через молярную, нормальную (молярную концентрацию эквивалента), процентную, моляльную концентрации, титр и мольную долю.
Способы выражения концентрации растворов
Молярная концентрация растворов (молярность)
Наиболее распространенный способ выражения концентрации растворов – молярная концентрация или молярность. Она определяется как количество молей n растворенного вещества в одном литре раствора V. Единица измерения молярной концентрации моль/л или моль ·л-1:
См = n/V
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным — растворено 0,01 моля вещества, миллимолярным — растворено 0,001 моля вещества.
Термин «молярная концентрация» распространяется на любой вид частиц.
Вместо обозначения единицы измерения — моль/л, возможно такое ее обозначение – М, например, 0,2 М HCl.
Молярная концентрация эквивалента или нормальная концентрация растворов (нормальность).
Понятие эквивалентности мы уже вводили. Напомним, что эквивалент – это условная частица, которая равноценна по химическому действию одному иону водорода в кислотоно-основных реакциях или одному электрону в окислительно – восстановительных реакциях.
Например, эквивалент KMnO4 в окислительно – восстановительной реакции в кислой среде равен 1/5 (KMnO4).
Еще одно необходимое понятие — фактор эквивалентности – это число, обозначающее, какая доля условной частицы реагирует с 1 ионом водорода в данной кислотоно-основной реакции или с одним электроном в данной окислительно – восстановительной реакции.
Он может быть равен 1 или быть меньше 1. Фактор эквивалентности, например, для KMnO4 в окислительно – восстановительной реакции в кислой среде составляет fэкв(KMnO4) = 1/5.
Следующее понятие – молярная масса эквивалента вещества х. Это масса 1 моля эквивалента этого вещества, равная произведению фактора эквивалентности на молярную массу вещества х:
Мэ = fэкв· М(х)
Молярная концентрация эквивалента (нормальность) определяется числом молярных масс эквивалентов на 1 литр раствора.
Эквивалент определяется в соответствии с типом рассматриваемой реакции. Единица измерения нормальной концентрации такая же как и у молярной концентрации — моль/л или моль·л-1
Сн = nэ/V
Для обозначения нормальной концентрации допускается сокращение «н» вместо «моль/л».
Процентная концентрация раствора или массовая доля
Массовая концентрация показывает сколько единиц массы растворенного вещества содержится в 100 единицах массы раствора.
Это отношение массы m(х) вещества x к общей массе m раствора или смеси веществ:
ω(х) = m(х)/m
Массовую долю выражают в долях от единицы или процентах.
Моляльная концентрация раствора
Моляльная концентрация раствора b(x) показывает количество молей n растворенного вещества х в 1 кг. растворителя m. Единица измерения моляльной концентрации — моль/кг :
b(x) = n(x)/m
Титр раствора
Титр раствора показывает массу растворенного вещества х, содержащуюся в 1 мл. раствора. Единица измерения титра — г/мл:
Т(х) = m(х)/V,
Мольная или молярная доля
Мольная или молярная доля α(х) вещества х в растворе равна отношению количества данного вещества n(х) к общему количеству всех веществ, содержащихся в растворе Σn:
α(х) = n(х)/Σn
Между приведенными способами выражения концентраций существует взаимосвязь, которая позволяет, зная одну единицу измерения концентрации найти (пересчитать) ее в другие единицы. Существуют формулы, позволяющие провести такой пересчет, которые, в случае необходимости, вы сможете найти в сети. В разделе задач показано, как произвести такой пересчет, не зная формул.
Пример перевода процентной концентрации в молярную, нормальную концентрацию, моляльность, титр
Дан раствор объемом 2 л с массовой долей FeSO4 2% и плотностью 1029 кг/м3. Определить молярность, нормальность, моляльность и титр этого раствора раствора.
Решение.
1. Рассчитать молярную массу FeSO4:
M (FeSO4) =
56+32+16·4 = 152 г/моль
2. Рассчитать молярную массу эквивалента:
Мэ = fэкв·
М(FeSO4) = 1/2·152
= 76 г/моль
3. Найдем m раствора объемом 2 л
m = V·ρ = 2·10-3 ·1029
= 2,06 кг
4. Найдем массу 2 % раствора по формуле:
m(FeSO4) = ω(FeSO4) · mр-ра
m(FeSO4) =
0,02·2,06 = 0,0412 кг = 41,2 г
5. Найдем молярность, которая определяется как количество молей растворенного вещества в одном литре раствора:
n = m/М
n = 41,2/152 = 0,27 моль
См = n/V
См = 0,27/2 = 0,135 моль/л
6. Найдем нормальность:
nэ = m/Мэ
nэ = 41,2/76 = 0,54 моль
Сн = nэ/V
Сн = 0,54/2 = 0,27 моль/л
7. Найдем моляльность раствора. Моляльная концентрация равна:
b (x) = n(x)/m
Масса растворителя, т.е.
воды в растворе равна:
mH2O = 2,06-0,0412
= 2,02 кг
b
(FeSO4) = n(FeSO4)/m = 0,27/2,02 = 0,13 моль/кг
8. Найдем титр раствора, который показывает какая масса вещества содержится в 1 мл раствора:
Т(х) = m (х)/V
Т(FeSO4) = m (FeSO4)/V = 41,2/2000 = 0,0021 г/мл
Еще больше задач приведены в разделе Задачи: Концентрация растворов, Правило креста
Растворы. Способы выражения концентрации растворов
Важной
характеристикой раствора является концентрация.
Концентрация – это величина, измеряемая количеством растворенного
вещества, содержащегося в определенной массе или объеме раствора или
растворителя.
Наиболее
часто применяемые способы выражения концентрации: массовая доля,
молярная концентрация, молярная концентрация эквивалента, моляльность,
молярная доля, объемная доля, титр.
Массовую
долю w(X) выражают в долях единицы, процентах (%), промилле (тысячная
часть процента) и в миллионных долях (млн–1) . Массовую долю
рассчитывают по формулам:
,
где m(X) – масса растворенного
вещества Х, кг (г);
mр-ра – масса
раствора, кг (г).
Например:
дан 0.85% раствор хлорида натрия. Это означает, что в 100 г раствора содержится
0.85 г NaCl.
Молярную
концентрацию с(Х) выражают в моль/л. Молярную концентрацию находят
по формуле:
,
где n(X) – количество
растворенного вещества, моль;
M(X) – молярная
масса растворенного вещества, кг/моль, или г/моль;
m(X) – масса
растворенного вещества, соответственно, кг или г;
Vр-ра – объем
раствора, л.
Например:
дан 0.2 М раствор BaCl2. Это означает, что в 1 л (1000 мл) раствора содержится 0.2
моль BaCl2 и масса хлорида бария m (BaCl2) = с·M·V = 0.2 моль/л·208
г/моль·1 л = 41.6 г.
Моляльность
сm(X) или b(X) выражают в единицах моль/кг. Рассчитываем моляльность по
формуле:
,
где m (р-ль) – масса
растворителя, кг.
Моляльность
показывает, сколько моль растворенного вещества Х приходится на 1 кг
растворителя.
В
химии широко используют понятие эквивалента и фактора
эквивалентности.
Эквивалентом называют реальную или условную частицу вещества Х, которая в
данной обменной реакции обменивает один однозарядный ион или в данной
окислительно–восстановительной реакции переносит один электрон.
Фактор эквивалентности fэкв(Х) – число, обозначающее, какая доля реальной частицы
вещества Х эквивалентна одному иону водорода в данной кислотно–основной реакции
или одному электрону в данной окислительно-восстановительной реакции.
Фактор
эквивалентности рассчитывают на основе стехиометрии данной реакции из
равенства:
fэкв(Х) = 1/z,
где z – основность кислоты или
кислотность основания данной кислотно-основной реакции, или число электронов,
присоединяемых или теряемых частицей в данной окислительно-восстановительной
реакции.
Фактор
эквивалентности зависит от реакции, в которой участвует данное вещество; так
для фосфорной кислоты в реакциях:
H3PO4 + NaOH → NaH2PO4 + H2O; fэкв = 1/1.
H3PO4 + 2 NaOH → Na2HPO4
+ 2H2O; fэкв = 1/2.
H3PO4 + 3 NaOH → Na3PO4
+ 3H2O; fэкв = 1/3.
Для
перманганата калия в реакциях:
MnO4– + 8H+ + 5ē → Mn2+ + 4 H2O; fэкв = 1/5.
MnO4– + 2 H2O + 3ē → Mno2 + 4 OH–; fэкв = 1/3.
MnO4– + 1ē → MnO42-; fэкв = 1/1.
Для
иодид-иона и иода в реакции:
2I–
– 2ē → I20; fэкв(I–) = 1/1; fэкв(I2) = 1/2.
Молярной массой эквивалента
вещества Х (масса одного моль эквивалента вещества) называют величину,
измеряемую произведением фактора эквивалентности на молярную массу вещества Х.
М(fэкв(Х)) = fэкв·М(Х),
где М(fэкв(Х)) – молярная масса эквивалента.
Единица
измерения молярной массы эквивалента – г/моль.
Соответственно
для растворов используют понятие молярной концентрации эквивалента (нормальная
концентрация).
Молярную
концентрацию эквивалента (нормальность) с(fэкв(Х)) рассчитывают
по формуле:
,
где n (fэкв (Х)) – количество
вещества эквивалента, моль;
Vр-ра – объем
раствора, л;
M (fэкв(Х)) – молярная масса эквивалента.
Молярную
концентрацию эквивалента (нормальную концентрацию) обозначают c(fэкв(Х)). Единицы ее измерения – моль/м3, моль/дм3,
моль/л. В медицине чаще используют единицу моль/л. Форма записи, например,
с KMnO4 (1/5) = 0.1 моль/л или 0.1 н. KMnO4. Это означает, что в 1 л раствора содержится 0.1 моль
эквивалента перманганата калия.
Молярная
концентрация эквивалента (нормальность) связана с молярной концентрацией
(молярностью) следующим выражением:
.
Молярную
долю x(Xi) выражают в
долях единицы или в процентах. Молярную долю рассчитывают по формуле:

где n(Xi)– количество вещества данного компонента, моль;
– суммарное количество всех компонентов раствора, моль.
Объемную
долю φ(Х) выражают в долях единицы или в процентах, ее рассчитывают
по формуле
,
где V(Х)– объем данного
компонента Х, л;
Vр-ра – общий
объем раствора, л.
Титр
раствора обозначают T(X), единица
измерения – г/см3, г/мл. Титр раствора можно рассчитать по формуле:
,
где m(Х) – масса вещества,
обычно г;
Vр-ра – объем
раствора, мл.
Титр
показывает, какая масса вещества содержится в 1 мл его раствора.
В клинической практике нередко выражают концентрацию
ионов в миллиграмм–процентах (мг %). Это масса вещества, выраженная в
миллиграммах на 100 мл раствора.
Формулы перехода от одних способов выражения
концентрации к другим см. прил., табл. №2.
Задача 1.
В 180 г воды растворили H3PO4 массой 9.8 г. Определите молярную долю (Х) и моляльную
концентрацию (Сm)
ортофосфорной кислоты.
Решение:
;
n (H3PO4)= = 0.1 моль;
n (H2O) = = 10 моль;
Х (H3PO4) = = 0.0099;
Сm (H3PO4) = = 0.556 моль/кг.
Ответ: Х (H3PO4) = 0.0099; Сm (H3PO4) = 0.0566 моль/кг.
Задача 2.
Массовая доля хлорида натрия в физиологическом растворе 0.9%
(ρ = 1 г/мл). Вычислите: а) молярную концентрацию и титр NaCl в этом растворе; б)
массу соли, веденной в организм при вливании 500 мл данного раствора.
Решение:
с(X) = ; T =
; Т =
;
с(NaCl) = = 0.154 моль/л;
Т (NaCl) = = 0.00900 г/мл;
m(NaCl) = 0.00900 г/мл · 500
мл = 4.5 г.
Ответ: с(NaCl) = 0.154 моль/л; Т(NaCl) = 0.00900 г/мл.
Задача 3.
Сколько мл
80% раствора CH3COOH (ρ = 1.070 г/см3)
необходимо для приготовления 500 мл 0.1 М раствора?
Решение:
Найдем, сколько граммов уксусной кислоты содержится в 500 мл
раствора:
.
Определим, в какой массе 80% раствора уксусной кислоты
содержится 3.0 г CH3COOH:
.
Найдем объем 80% раствора CH3COOH:
.
Ответ:
V = 3.5 мл.
Количество и концентрация вещества. Выражение и пересчеты из одних единиц в другие. Концентрации растворов. Массовая и молярная концентрация, Титр, Моляльность, Мольная, массовая, объемная доли. Нормальная (эквивалентная) концентрация, Фактор эквивалентности, Молярная масса эквивалента вещества.
Масса и количество вещества. Массу вещества (m) измеряют в граммах, а количество вещества (n) в молях. Если обозначить вещество буквой Х, то тогда его масса может быть обозначена как m (X), а количество – n (X).
- Моль–количество вещества, которое содержит столько определенных структурных единиц (молекул, атомов, ионов и т.д.), сколько атомов содержится в 0,012 кг изотопа углерода-12.
- При использовании термина моль следует указывать частицы, к которым относится этот термин. Соответственно, можно говорить «моль молекул», «моль атомов», «моль ионов» и т.д. (например, моль молекул водорода, моль атомов водорода, моль ионов водорода). Так как 0,012 кг углерода-12 содержит ~ 6,022х1023атомов углерода (постоянная Авогадро = число Авогадро), то моль– такое количество вещества, которое содержит 6,022х1023структурных элементов (молекул, атомов, ионов и др.).
- Отношение массы вещества к количеству вещества называют молярной массой.
- M (X) = m (X) / n(X)
- То есть, молярная масса (М) – это масса одного моля вещества. Основной системной (в международной системе единиц СИ) единицей молярной массы является кг/моль, а на практике – г/моль. Например, молярная масса самого легкого металла лития М (Li) = 6,939 г/моль, молярная масса газа метана М (СН4) = 16,043 г/моль. Молярная масса серной кислоты рассчитывается следующим образом M (Н2SО4) = 196 г / 2 моль = 96 г/моль.
- Молярная масса М (Х) — масса одного моля молекул вещества (г/моль). M(X)=mx/n (X), где mx – масса вещества, г; n (X) – количество вещества, моль. Молярная масса вещества Х численно равна относительной молекулярной массе Mr (в случае молекул) или относительной атомной массе (в случае атомов).
- Любое соединение (вещество), кроме молярной массы, характеризуется относительной молекулярной или атомной массой. Существует и эквивалентная масса Е, равная молекулярной, умноженной на фактор эквивалентности (см. далее).
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
- Например,Мr(СН4) = 16,043. Относительная молекулярная масса – величина безразмерная.
- Относительная атомная масса (Ar) –это молярная масса атома вещества, отнесенная к 1/12 молярной массы атома углерода-12.
- Например, Ar(Li) = 6,039.
- Относительная молекулярная масса (Mr) –это молярная масса соединения, отнесенная к 1/12 молярной массы атома углерода-12.
Концентрация. Отношение количества или массы вещества, содержащегося в системе, к объему или массе этой системы называют концентрацией. Известно несколько способов выражения концентрации. В России чаще всего концентрацию обозначают заглавной буквой С, имея в виду прежде всего массовую концентрацию, которая по праву считается наиболее часто применяемой в экологическом мониторинге форма выражения концентрации (именно в ней измеряют величины ПДК).
- Массовая концентрация (С или β) –отношение массы компонента, содержащегося в системе (растворе), к объему этой системы (V). Это самая распространенная у российских аналитиков форма выражения концентрации.
- β(Х) =m (X) / V(смеси)
- Единица измерения массовой концентрации – кг/м3 или г/м3, кг/дм3или г/дм3(г/л), кг/см3, или г/см3 (г/мл), мкг/л или мкг/мл и т.д. Арифметические пересчеты из одних размерностей в другие не представляет большой сложности, но требуют внимательности. Например, массовая концентрация хлористоводородной (соляной) кислотыС(HCl) = 40 г / 1 л = 40 г/л = 0,04 г/мл = 4·10–5мкг/л и т.д. Обозначение массовой концентрации С нельзя путать с обозначением мольной концентрации (с), которая рассматривается далее.
- Типичными являются соотношения β(Х): 1000 мкг/л = 1 мкг/мл = 0,001 мг/мл.
- Массовая концентрация – это отношение массы к объему системы !!!! а отношение массы к массе это – массовая доля 🙂
Титр (Т) В объемном анализе (титриметрии) употребляется одна из форм массовой концентрации – титр. Титр раствора (Т) –это масса вещества, содержащегося в одном кубическом сантиметре = в одном миллилитре раствора.
- Единицы измерения титра — кг/см3, г/см3, г/мл и др.
Моляльность (b) –отношение количества растворенного вещества (в молях) к массе растворителя (в кг).
- b(Х) = n(X) / m (растворителя) = n(X) / m (R)
- Единица измерения моляльности —моль/кг. Например,b (HCl/H2O) = 2 моль/кг. Моляльная концентрация применяется в основном для концентрированных растворов.
Мольная (! )доля (х) –отношение количества вещества данного компонента (в молях), содержащегося в системе, к общему количеству вещества (в молях).
- х(Х) =n(X) / n(X) + n(Y)
- Мольнаядоля может быть выражена в долях единицы, процентах (%), промилле (тысячная часть %) и в миллионных (млн–1,ppm), миллиардных (млрд–1,ppb), триллионных (трлн–1,ppt) и др. долях, но единицей измерения все равно является отношение –моль/моль. Например,х(С2Н6) = 2 моль / 2 моль + 3 моль = 0,4 (40 %).
Массовая доля (ω) –отношение массы данного компонента, содержащегося в системе, к общей массе этой системы.
- ω (Х) = m(X) / m(смеси)
- Массовая доля измеряется в отношениях кг/кг (г/г). При этом она может быть выражена в долях единицы, процентах (%), промилле, миллионных, миллиардных и т.д. долях. Массовая доля данного компонента, выраженная в процентах, показывает, сколько граммов данного компонента содержится в 100 г раствора.
- Например, условно ω (KCl) = 12 г / 12 г + 28 г = 0,3 (30%).
Объемная доля (φ) –отношение объема компонента, содержащегося в системе, к общему объему системы.
- φ (Х)=v(X) /v(X)+v(Y)
- Объемная доля измеряется в отношениях л/л или мл/мл и тоже может быть выражена в долях единицы, процентах, промилле, миллионных и т.д. долях. Например, объемная доля кислорода газовой смеси составляет φ (О2)=0,15 л / 0,15 л + 0,56 л.
Молярная (мольная) концентрация (с) –отношение количества вещества (в молях), содержащегося в системе (например, в растворе), к объему V этой системы.
- с(Х) = n(X)/ V(смеси)
- Единица измерения молярной концентрации моль/м3(дольная производная, СИ – моль/л).
- Например,c (H2S04) = 1 моль/л,с(КОН) = 0,5 моль/л.
- Раствор, имеющий концентрацию 1 моль/л, называют молярным раствором и обозначают как 1 М раствор (не надо путать эту букву М, стоящую после цифры, с ранее указанным обозначением молярной массы, т.е. количества вещества М). Соответственно раствор, имеющий концентрацию 0,5 моль/л, обозначают 0,5 М (полумолярный р-р); 0,1 моль/л – 0,1 М (децимолярный р.р); 0,01 моль/л – 0,01 М (сантимолярный р-р) и т.д.
- Эта форма выражения концентрации также очень часто применяется в аналитике.
Нормальная (эквивалентная) концентрация (N), молярная концентрация эквивалента(Сэкв.)– это отношение количества вещества эквивалента в растворе (моль) к объему этого раствора (л).
- N = Сэкв (Х) = n (1/Z X) / V (смеси)
- Количество вещества (в молях), в котором реагирующими частицами являются эквиваленты, называется количеством вещества эквивалента nэ (1/Z X) = nэ (Х).
- Единица измерения нормальной концентрации («нормальности») тоже моль/л (дольная производная, СИ).
- Например, Сэкв.(1/3 АlCl3) = 1 моль/л.
- Раствор, в одном литре которого содержится 1 моль вещества эквивалентов, называют нормальным и обозначают 1 н. Соответственно могут быть 0,5 н («пятидецинормальный»); 0,01 н (сантинормальный») и т.п. растворы.
- Следует отметить, что понятие эквивалентностиреагирующих веществ в химических реакциях является одним из базовых для аналитической химии. Именно на эквивалентности как правило основаны вычисления результатов химического анализа (особенно в титриметрии). Рассмотрим несколько связанных с этим базовых с т.з. теории аналитики понятий.
Фактор эквивалентности (fэкв )– число, обозначающее, какая доля реальной частицы веществ Х (например, молекулы вещества X) эквивалентна одному иону водорода (в данной кислотно-основной реакции) или одному электрону (в данной окислительно-восстановнтельной реакции) Фактор эквивалентности fэкв (Х) рассчитывают на основании стехиометрии (соотношении участвующих частиц) в конкретном химическом процессе:
- fэкв (Х) = 1/Zx
- где Zx.— число замещенных или присоединенных ионов водорода (для кислотно-основных реакций) или число отданных или принятых электронов (для окислительно-восстановительных реакций);
- Х — химическая формула вещества.
- Фактор эквивалентности всегда равен или меньше единицы. Будучи умноженным на относительную молекулярную массу, он дает значение эквивалентной массы (Е).
- Для реакции:
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- fэкв (H2SО4) = 1/2,fэкв (NaOH) = 1
- fэкв (H2SО4) = 1/2, т.е. это означает, что ½ молекулы серной кислоты дает для данной реакции 1 ион водорода (Н+), а соответственноfэкв (NaOH) = 1 означает, что одна молекулаNaOHсоединяется в данной реакции с одним ионом водорода.
- H2SО4 + 2 NaOH = Na2SО4 + 2 H2
- Для реакции:
- 10 FeSО4 + 2 KMnО4 + 8 H2SО4 = 5 Fe2(SО4)3 + 2 MnSО4 + K2SО4 + 8 H2О
- 2МпО4– + 8Н++5е–→ Мп2+– 2e–+ 4 Н2О
- 5 Fe2+ – 2e– → Fe3+
- fэкв (KMnО4) = 1/5 (кислая среда), т.е. 1/5 молекулы KMnО4 в данной реакции эквивалентна 1 электрону. При этом fэкв (Fe2+) = 1, т.е. один ион железа (II) также эквивалентен 1 электрону.
- Для реакции:
Эквивалент вещества Х –реальная или условная частица, которая в данной кислотно-основной реакции эквивалентна одному нону водорода или в данной окислительно-восстановительной реакции – одному электрону.
- Форма записи эквивалента: fэкв(Х) Х (см. табл.), или упрощенно Эх, где Х –химическая формула вещества, т.е. [Эх =fэкв(Х) Х]. Эквивалент безразмерен.
- Эквивалент кислоты(или основания) – такая условная частица данного вещества, которая в данной реакции титрования высвобождает один ион водорода или соединяется с ним, или каким-либо другим образом эквивалентна ему.
- Например, для первой из вышеуказанных реакций эквивалент серной кислоты — это условная частица вида ½ H2SО4 т.е. fэкв (H2SО4) = 1/Z= ½; ЭH2SО4 = ½ H2SО4.
- Эквивалент окисляющегося(или восстанавливающегося)вещества— это такая условная частица данного вещества, которая в данной химической реакции может присоединять один электрон или высвобождать его, или быть каким-либо другим образом эквивалентна этому одному электрону.
- Например, при окислении перманганатом в кислой среде эквивалент марганцевокислого калия – это условная частица вида 1/5 КМпО4, т.е. ЭКМпО4 =1/5КМпО4.
- Так как эквивалент вещества может меняться в зависимости от реакции, в которой это вещество участвует, необходимо указывать соответствующую реакцию.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- эквивалент фосфорной кислоты Э Н3РО4 == 1 Н3РО4.
- Для реакции Н3РО4+ 2NaOH=Na2HPО4+ 2H2O
- ее эквивалент Э Н3РО4 == ½ Н3РО4,.
- Например, для реакции Н3РО4+NaOH=NaH2PО4+H2O
- Принимая во внимание, что понятие моля позволяет пользоваться любыми видами условных частиц, можно дать понятиемолярной массы эквивалента вещества X. Напомним, что моль– это количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 12 г изотопа углерода12 С (6,02 1023). Под реальными частицами следует понимать атомы, ионы, молекулы, электроны и т.п., а под условными – такие как, например, 1/5 молекулы КМпО4в случае О/В реакции в кислой среде или ½ молекулы H2SО4 в реакции с гидроксидом натрия.
Молярная масса эквивалента вещества – масса одного моля эквивалентов этого вещества, равная произведению фактора эквивалентности fэкв (Х) на молярную массу вещества М (Х)1.
- Молярную массу эквивалента обозначают как М [fэкв (Х) Х] или с учетом равенства Эх = fэкв (Х) Х ее обозначают М [Эх]:
- М (Эх)= fэкв (Х) М (Х); М [Эх] = М (Х) /Z
- Например, молярная масса эквивалента КМпО4
- М (ЭКМпО4) =1/5КМпО4 = М 1/5 КМпО4 = 31,6 г/моль.
- Это означает, что масса одного моля условных частиц вида 1/5КМпО4 составляет 31,6 г/моль. По аналогии молярная масса эквивалента серной кислоты М ½ H2SО4 = 49 г/моль; фосфорной кислоты М ½ H3 РО4 = 49 г/моль и т.д.
- В соответствии с требованиями Международной системы (СИ) именно молярная концентрацияя вляется основным способом выражения концентрации растворов, но как уже отмечалось, на практике чаще применяетсямассовая концентрация.
- Рассмотрим основные формулы и соотношения между способами выражения концентрации растворов (см. табл. 1 и 2).
Таблица 1 Основные способы выражения концентрации растворов
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 1. Массовая концентрация (С или β) | кг/м3 | Производная (СИ) |
|
| кг/дм3 | Дольная производная (СИ) | ||
| кг/л | Производная (внесистемная) | ||
| 2. Титр раствора (Т) | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 3. Титр раствора А по определяемому компоненту Х | г/см3 | Дольная, производная (СИ) |
|
| г/мл | Дольная, производная (внесистемная) | ||
| 4. Молярная концентрация, молярность(с) | моль/м3 | Производная (СИ) |
|
| моль/дм3 | Дольная производная (СИ) | ||
| моль/л | Производная (внесистемная) | ||
| 5. Молярная концентрация эквивалента (N), нормальность | моль/дм3 | Производная (СИ) |
|
| моль/л | Производная (внесистемная) | ||
| 6. Моляльная концентрация, моляльность (b) | моль/кг | Производная (СИ) |
|
| Термин концентрации (см. выше) | Единица измерения концентрации | Тип единицы концентрации | Формула, виды записи, примеры |
| 7. Мольная доля(х) | Относительная = моль/моль. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,pptили в др. ед. | Безразмерная = 1 моль/моль = 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 8. Массовая доля (ω) | Относительная = кг / кг. (или в %, или в млн–1,ppm, в млрд–1 ,ppb, трлн–1,ppt или в др. ед. |
Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
| 9. Объемная доля (φ) | Относительная = м3/м3(илил/л, илимл/мл, или в %, или в млн–1,ppm, в млрд–1 ,ppb, или в др. ед. | Безразмерная = 1 кг/кг =1 г/г= 1 = 100% = 106млн-1 = 109млрд-1 = 1012трлн-1 |
|
* В расчетных уравнениях химическую формулу обычно ставят в индексе.
Пересчеты из одной формы выражения концентрации в другую являются достаточно простыми арифметическими задачами, с решениями которых аналитику приходится сталкиваться очень часто – при приготовлении аналитических растворов, при пробоотборе и пробоподготовке, при смешении пробы с аналитическими растворами, а также при статистической обработке и представлении получившихся результатов в цифровой и графической форме. Рассмотрим формулы для пересчета шести наиболее часто применяемых форм выражения концентраций (см. табл. 2).
Таблица 2 Формулы перехода от одних выражений концентраций растворов к другим (процентная, в граммах на грамм растворителя, в граммах на грамм раствора, нормальная, молярная, моляльная) 6
- Обозначения:
- d-плотность раствора,
- W- молекулярный вес (масса) растворенного вещества,
- E- грамм-эквивалентный вес растворенного вещества
- Коровин Н.В., Мингулина Э.И., Рыжова Н.Г.Лабораторные работы по химии.Учеб. пособие для техн. направ. и спец. вузов. /Под ред. Н.В. Коровина. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1998. – с. 21–39.
- Жарский И.М., Кузьменко А.Л., Орехова С.Е.Лабораторный практикум по общей и неорганической химии./Под ред. Г.И. Новикова. – Мн.: Дизайн ПРО, 1998. – с. 3-27 и 46-56.
- Попадич И.А., Траубенберг С.Е, Осташенкова Н.В. и др.. Аналитическая химия.Учебное пособие для техникумов. М.: Химия, 1989. – с. 91-98.
- Зайцев О.С.Исследовательский практикум по общей химии.Учебное пособие. М.: Изд-во МГУ, 1994. – с. 91-98.
- Лурье Ю.Ю.Справочник по аналитической химии.Справ. Изд. – 6-е изд., перераб. и доп. – М.: Химия, 1989. – с. 172-173.