Каждый, кто уже немного продвинулся в изучении химии, сталкивается с понятием «моль». Правда, большинство сразу думает о моли, которая съела за лето шубу в шкафу, но моль в химии – это совсем другая история. И вот сейчас мы в этом разберёмся.
Итак, давайте посмотрим на какую-нибудь химическую реакцию. Например, такую:
Н2+F2=2HF
Здесь 1 молекула водорода H2 реагирует с одной молекулой фтора F2 и получается две молекулы фторида водорода. Напомню, то число молекул или атомов, вступающих в реакцию или получающихся в реакции, определяется коэффициентом, то есть цифрой, стоящей перед формулой вещества. В нашем примере перед водородом не стоит ничего, но на самом деле мы можем поставить здесь единицу, то есть нам нужна 1 молекула водорода. Перед фтором тоже не стоит ничего, значит, нам нужна 1 молекула фтора. А вот перед фторидом водорода HF стоит двойка. Это означает, что у нас получилось 2 молекула фторида водорода. То есть:
Н2 + F2 = 2HF – это то же самое, что и
1 молекула H2 + 1 молекула F2 = 2 молекулы HF.
Но вы знаете, что молекулы так малы, что мы их увидеть не можем. Как же нам считать эти молекулы, вступающие в реакцию? Для этого и ввели понятие МОЛЬ.
Моль – это количество вещества, в котором содержится столько же частиц, сколько атомов содержится в 12 граммах углерода с атомной единицей массы 12.
Это довольно мудрёное определение, но его нужно запомнить. Есть и приятный момент: в одном моле любого вещества содержится число Авогадро частиц. Вот оно, это число:
Такое число представить сложно. Вы только подумайте, миллиард – это 1 000 000 000. А в одном моле частиц 6,02*100 000 000 000 000 000 000 000! (Но чтобы не видеть по ночам кошмаров, просто запомните 6,02*10 в двадцать третьей степени).
Итак, в одном моле любого вещества содержится 6,02*10 в двадцать третьей степени частиц. Но мы же знаем, что атомы разных веществ имеют разное строение, а поэтому и разную массу. Поэтому и массы одного моля у разных веществ различаются. Чтобы разобраться в этом, давайте поедем на дачу и проведём эксперимент.
Мы точно помним, что 1 моль – это всегда одинаковое число частиц (6,02*10 в двадцать третьей степени ). Но в обычной жизни таких чисел нет, поэтому возьмём число поменьше, например, 100. Это будет наш условный экспериментальный моль. Теперь в одну кучу складываем 100 вишен, в другую кучу – 100 груш, в третью – 100 арбузов. Куча – это 1 моль. В каждую кучу мы добросовестно сложили одинаковое число частиц, верно? Но частицы эти разного вида: в одной куче вишни, в другой – груши, в третьей – арбузы. А теперь будем взвешивать. Как вы думаете, будет ли различаться масса 100 вишен, 100 груш и 100 арбузов? Конечно же, будет. При этом обратите внимание: число частиц в каждой куче одинаково, но весят эти кучи по-разному. Почему? Потому что частицы разные!
В химии всё точно так же. Если взять 1 моль водорода, 1 моль кислорода и 1 моль натрия, то масса их будет разной (вспоминаем поездку на дачу). И это важно. Но теперь возникает закономерный вопрос: а как же узнать, какова масса 1 моль водорода, 1 моль кислорода и 1 моль натрия и вообще любого вещества? Для этого вводится понятие молярная масса.
Молярная масса и есть масса 1 моля вещества.
Как её определить? Просто. Это атомная масса или молекулярная масса вещества, которую мы рассчитываем, пользуясь таблицей Менделеева. Молярная масса обозначается буквой М и выражается в г/моль (просто потому, что она показывает сколько граммов вести 1 моль). Примеры из учебника химии.
Пример 1.
Найдите массу одного моля (она же молярная масса) алюминия.
Решаем химию и смотрим в таблицу Менделеева. Видим, что атомная масса алюминия 27. Формула просто вещества алюминия – Al, то есть атом здесь один. Следовательно, молярная масса алюминия совпадает с атомной и равна 27 г/моль.
Пример 2.
Найдите молярную массу фтора.
Фтор у нас в обычных условиях – газ, поэтому молекула фтора состоит из двух атомов и выглядит так: F2. В периодической таблице находим фтор и видим, что его атомная масса 19. Следовательно, молярная масса фтора 2*19=38 г/моль.
Пример 3.
Найдите молярную массу оксида кальция.
Формула оксида кальция СаО. Опять смотрим в таблицу: атомная масса кальция 40, атомная масса кислорода 16. Молярная масса оксида кальция 40+16=56 г/моль.
Пример 4.
Найдите молярную массу оксида кремния.
Формула оксида кремния SiO2. Таблица Менделеева сообщает, что атомная масса кремния 28, кислорода – 16. Будьте внимательны, в этом вопросе подвох! В формуле оксида два атома кислорода, обязательно учтите это, чтобы ответ был верным. И он будет таким: молярная масса оксида кремния 28+16*2=60 г/моль. (16 – масса одного атома кислорода, у нас в формуле их два, поэтому мы и умножили 16 на 2!).
Пример 5.
Сложный пример от репетитора по химии. Но я рекомендую всё-таки вникнуть и разобраться, чтобы прояснить всё окончательно. Итак, ответьте, какова молярная масса серной кислоты.
Здесь придётся сосредоточиться, чтобы не запутаться. Формула серной кислоты H2SO4, то есть у нас имеется:
· 2 атома водорода
· 1 атом серы
· 4 атома кислорода.
Смотрим в периодическую таблицу и определяем атомные массы:
· атомная масса водорода – 1
· атомная масса серы – 32
· атомная масса кислорода – 16.
Переходим к расчёту:
2 атома водорода + 1 атом серы + 4 атома кислорода
2*1 + 1*32 + 4*16
В этом выражении в каждом слагаемом первый множитель – число атомов элемента, второй множитель – атомная масса. Дальше просто математика: 2*1+1*32+4*16=98. И да, молярная масса серной кислоты 98 г/моль.
Уверена, теперь вы различите моль в шкафу и моль в химии. А дальше мы будем разбираться, как взвесить на обычных весах эти моли.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Эта статья — о химическом элементе. О романе Пирса Энтони см. Фтор (роман).
| Фтор | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Кислород | Неон → | ||||||||||||||
|
||||||||||||||
| Внешний вид простого вещества | ||||||||||||||

Жидкий фтор |
||||||||||||||
| Свойства атома | ||||||||||||||
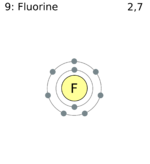
| Название, символ, номер | Фтор/Fluorum (F), 9 | |||||||||||||
| Группа, период, блок |
17 (устар. 7), 2, p-элемент |
|||||||||||||
| Атомная масса (молярная масса) |
18,998403163(6)[1] а. е. м. (г/моль) | |||||||||||||
| Электронная конфигурация |
[He] 2s22p5 1s22s22p5 |
|||||||||||||
| Радиус атома | 73 пм | |||||||||||||
| Химические свойства | ||||||||||||||
| Ковалентный радиус | 72 пм | |||||||||||||
| Радиус иона | (−1e)133 пм | |||||||||||||
| Электроотрицательность | 3,98 (шкала Полинга) | |||||||||||||
| Электродный потенциал | 2,87 В | |||||||||||||
| Степени окисления | −1, 0 | |||||||||||||
| Энергия ионизации (первый электрон) |
1680,0 (17,41) кДж/моль (эВ) | |||||||||||||
| Термодинамические свойства простого вещества | ||||||||||||||
| Плотность (при н. у.) |
Газ: 1,6960 г/л Жидкость.: 1,516−188 г/см3, Твердая фаза: 1,7−228 г/см3[2] или 1,810−225[3] г/см³ |
|||||||||||||
| Температура плавления | 53,53 К (−219,70 °C)[2] | |||||||||||||
| Температура кипения | 85,03 К (−188,12 °C)[2] | |||||||||||||
| Тройная точка | 53,48 К (−219,67°C), 90 кПа | |||||||||||||
| Критическая точка | 144,4 К, 5,215 МПа | |||||||||||||
| Уд. теплота плавления | (F—F) 0,5104 кДж/моль | |||||||||||||
| Уд. теплота испарения | (F—F) 6,544 кДж/моль | |||||||||||||
| Молярная теплоёмкость | 31,34[2] Дж/(K·моль) | |||||||||||||
| Молярный объём | 22,4⋅103 см³/моль | |||||||||||||
|
||||||||||||||
| Кристаллическая решётка простого вещества | ||||||||||||||
| Структура решётки |
Моноклинная (α-фтор); Кубическая (β-фтор)[3] |
|||||||||||||
| Параметры решётки |
α-фтор: β = 102,088(18)°; a = 5,4780(12) Å; b = 3,2701(7) Å; c = 7,2651(17) Å[3]. β-фтор: a = 5,5314(15)[3] |
|||||||||||||
| Прочие характеристики | ||||||||||||||
| Теплопроводность | (300 K) 0,028 Вт/(м·К) | |||||||||||||
| Номер CAS | 7782-41-4 |
Фто́р (химический символ — F, устар. «флюор»; от лат. Fluorum) — химический элемент 17-й группы (по устаревшей классификации — главной подгруппы седьмой группы, VIIA) второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 9.
Является самым химически активным неметаллом и сильнейшим окислителем. Фтор относится к группе галогенов и является самым лёгким элементом из этой группы.
Как простое вещество (при нормальных условиях) фтор — это двухатомный газ (формула — F2) бледно-жёлтого цвета с резким запахом, напоминающим озон или хлор. При криогенных температурах представляет собой жёлтую жидкость, бесцветный газ (в толстых слоях — зеленовато-жёлтый, н. у.).
Чрезвычайно токсичен. Обладает исключительно высокой коррозионной активностью.
История[править | править код]
Первое соединение фтора — флюорит (плавиковый шпат) CaF2 — описано в конце XV века под названием «флюор». В 1771 году Карл Шееле получил плавиковую кислоту. При обработке минерала флюорита CaF2 серной кислотой он выделил HF в виде водного раствора. Это событие рассматривается в истории химии как открытие фтора. Аналогию с хлором предложил в 1810 году Андре Ампер, его поддержал Гемфри Дэви. Дэви изучил растворения стекла в плавиковой кислоте.
Как химический элемент, входящий в состав плавиковой кислоты, фтор был предсказан в 1810 году, а выделен в свободном виде лишь 76 лет спустя Анри Муассаном в 1886 году электролизом жидкого безводного фтористого водорода, содержащего примесь кислого фторида калия KHF2.
Происхождение названия[править | править код]
Название «фтор» (от др.-греч. φθόριος ‘разрушительный’), предложенное Андре Ампером в 1816 году[4], употребляется в русском, греческом и некоторых других языках. Во многих же других странах приняты названия, производные от старинных названий минерала флюорита CaF2, которые в свою очередь происходят от его способности понижать температуру плавления металлургического шлака, образующегося при восстановлении металлов из руд, и увеличивать его текучесть (лат. fluere ‘течь’): например, тот же Ампер в письме Дэви от 26 августа 1812 предложил слово fluorine, благодаря адресату письма прочно вошедшее в английский язык.
Распространение в природе[править | править код]
Содержание фтора в атомных процентах в природе показано в таблице:
| Объект | Содержание, % |
|---|---|
| Почва | 0,02 |
| Воды рек | 0,00002 |
| Воды океана | 0,0001 |
| Зубы человека[5] | 0,01 |
В природе значительные скопления фтора содержатся, в основном, в минерале флюорите (CaF2), содержащем по массе 51,2 % Ca и 48,8 % F. Кларк в земной коре 650 г/т.
Из растений относительно богаты фтором чечевица и лук.
В почве фтор накапливается в результате вулканической деятельности, в составе вулканических газов обычно содержится большое количество фтороводорода.
Физические свойства[править | править код]
При нормальных условиях представляет собой бледно-жёлтый газ. В малых концентрациях в воздухе его запах напоминает одновременно озон и хлор. Очень агрессивен и сильно ядовит.
Фтор имеет аномально низкую температуру кипения (85,03 К, −188,12 °C) и плавления (53,53 К, −219,70 °C)[2]. Это связано с тем, что фтор не имеет d-подуровня и не способен образовывать полуторные связи[en], в отличие от остальных галогенов (кратность связи в остальных галогенах примерно 1,1)[6].
Ниже температуры плавления образует кристаллы бледно-жёлтого цвета[7][8].
Электронное строение[править | править код]
Электронная конфигурация внешнего электронного уровня атома фтора
Электронная конфигурация атома фтора: 1s22s22p5.
Атомы фтора в соединениях могут проявлять степень окисления, равную −1. Положительные степени окисления в соединениях неизвестны, так как фтор является самым электроотрицательным элементом.
Квантовохимический терм атома фтора — 2P3/2.
Строение молекулы[править | править код]
Применение метода МО для молекулы F2
С точки зрения теории молекулярных орбиталей, строение двухатомной молекулы фтора можно охарактеризовать следующей диаграммой. В молекуле присутствует 4 связывающих орбитали и 3 разрыхляющих. Порядок связи в молекуле равен 1.
Кристаллы[править | править код]
Кристаллическая структура
α-фтора (стабильная при атмосферном давлении)
Фтор образует молекулярные кристаллы с двумя кристаллическими модификациями, стабильными при атмосферном давлении:
- α-фтор, непрозрачный, твёрдый и хрупкий[8], существует при температуре ниже 45,6 K, кристаллическая решётка моноклинной сингонии, пространственная группа C 2/c, параметры ячейки a = 0,54780(12) нм, b = 0,32701(7) нм, c = 0,72651(17) нм, β = 102,088(18)°, Z = 4, d = 1,98 г/см3 с объёмом элементарной ячейки 0,12726(5) нм3 (при 10 К)[2][3][8][9];
- β-фтор, прозрачный, менее плотный и твёрдый[8], существует в интервале температур от 45,6 К до точки плавления 53,53 K, кристаллическая решётка кубической сингонии (примитивная решётка), пространственная группа Pm3n, параметры ячейки a = 0,65314(15) нм, Z = 8, d = 1,81 г/см3 с объёмом элементарной ячейки 0,27862(11) нм3 (при 48 К), решётка изотипична γ-фазе O2 и δ-фазе N2[2][3]. В раннем (но единственном проведённом до 2019 года) эксперименте по изучению структуры β-фтора рентгенографическая плотность кристалла была оценена как 1,70(5) г/см3[7][10], и эта плотность твёрдого фтора цитируется в большинстве справочников. Более точное современное измерение даёт 1,8104(12) г/см3[3].
Фазовый переход между этими кристаллическими фазами фтора более экзотермичен, чем затвердевание жидкого фтора. Фаза ромбической сингонии у твёрдого фтора не обнаружена, в отличие от всех прочих галогенов. Молекулы α-фтора разупорядочены по направлению. Длина связи F—F в молекулах составляет 0,1404(12) нм[3].
Даже при столь низких температурах взаимодействие кристаллов фтора со многими веществами приводит к взрыву[8].
Изотопный состав[править | править код]
Фтор является моноизотопным элементом: в природе существует только один стабильный изотоп фтора 19F. Известны ещё 17 радиоактивных изотопов фтора с массовым числом от 14 до 31 и один ядерный изомер — 18mF. Самым долгоживущим из радиоактивных изотопов фтора является 18F с периодом полураспада 109,771 минуты, важный источник позитронов, использующийся в позитрон-эмиссионной томографии.
Ядерные свойства изотопов фтора[править | править код]
| Изотоп | Относительная масса, а. е. м. | Период полураспада | Тип распада | Ядерный спин | Ядерный магнитный момент |
|---|---|---|---|---|---|
| 17F | 17,0020952 | 64,5 c | β+-распад в 17O | 5/2 | 4,722 |
| 18F | 18,000938 | 1,83 часа | β+-распад в 18O | 1 | |
| 19F | 18,99840322 | Стабилен | — | 1/2 | 2,629 |
| 20F | 19,9999813 | 11 c | β−-распад в 20Ne | 2 | 2,094 |
| 21F | 20,999949 | 4,2 c | β−-распад в 21Ne | 5/2 | |
| 22F | 22,00300 | 4,23 c | β−-распад в 22Ne | 4 | |
| 23F | 23,00357 | 2,2 c | β−-распад в 23Ne | 5/2 |
Магнитные свойства ядер[править | править код]
Ядра изотопа 19F имеют полуцелый спин, поэтому возможно применение этих ядер для ЯМР-исследований молекул. Спектры ЯМР-19F являются достаточно характеристичными для фторорганических соединений.
Химические свойства[править | править код]
Самый активный неметалл, бурно взаимодействует почти со всеми веществами (кроме фторидов в высших степенях окисления и редких исключений — фторопластов) и с большинством из них — с горением и взрывом.
Образует соединения со всеми химическими элементами, кроме гелия и неона. Известно лишь два соединения с аргоном, существующих только при температуре ниже температуры кипения водорода, и только одно из них содержит фтор — гидрофторид аргона HArF[11].
К воздействию фтора при комнатной температуре устойчивы некоторые металлы за счёт образования на их поверхности плотной плёнки фторида, тормозящей реакцию со фтором, например, Al, Mg, Cu, Ni. Контакт фтора с водородом приводит к воспламенению и взрыву в кварцевых сосудах даже при очень низких температурах (до −252 °C), в магниевых сосудах для начала реакции нужен небольшой нагрев.
Не реагирует с гелием, неоном, аргоном, азотом, кислородом, тетрафторметаном. При комнатной температуре не реагирует с сухим сульфатом калия, углекислым газом и закисью азота. Без примеси фтороводорода при комнатной температуре не действует на стекло.
В атмосфере фтора горит даже вода и платина.
Фтор способен вытеснять другие галогены из своей группы из их солей:
,
.
Реакция между щелочами и фтором:
.
Продукты реакции фтора с водой, в зависимости от условий её протекания, могут различаться:
,
К реакциям, в которых фтор формально является восстановителем, относятся реакции разложения высших фторидов, например:
,
.
Фтор также способен окислять в электрическом разряде кислород, образуя дифторид кислорода OF2 и диоксидифторид O2F2. Под давлением или при облучении ультрафиолетом реагирует с криптоном и ксеноном с образованием фторидов благородных газов.
Во всех соединениях фтор проявляет степень окисления −1. Чтобы фтор проявлял положительную степень окисления, требуется создание эксимерных молекул или иные экстремальные условия. Это требует искусственной ионизации атомов фтора[12].
Получение[править | править код]
Лабораторный метод получения фтора
Промышленный способ получения фтора включает добычу и обогащение флюоритовых руд, сернокислотное разложение их концентрата с образованием безводного HF и его электролитическое разложение.
Для лабораторного получения фтора используют разложение некоторых соединений, но все они не встречаются в природе в достаточном количестве, и их получают с помощью свободного фтора.
Лабораторный метод[править | править код]
- В лабораторных условиях фтор можно получать с помощью показанной установки. В медный сосуд 1, заполненный расплавом KF·3HF, помещают медный сосуд 2, имеющий отверстия в дне. В сосуд 2 помещают толстый никелевый анод. Катод помещается в сосуд 1. Таким образом, в процессе электролиза газообразный фтор выделяется из трубки 3, а водород — из трубки 4. Важным требованием является обеспечение герметичности системы, для этого используют пробки из фторида кальция со смазкой из оксида свинца(II) и глицерина.
- В 1986 году, во время подготовки к конференции по поводу празднования 100-летия открытия фтора, Карл Кристе открыл способ чисто химического получения фтора с использованием реакции во фтороводородном растворе K2MnF6 и SbF5 при 150 °C[13]:
- Хотя этот метод не имеет практического применения, он демонстрирует, что электролиз необязателен; кроме того, все компоненты для данных реакций могут быть получены без использования газообразного фтора.
- Также для лабораторного получения фтора можно использовать нагрев фторида кобальта(III) до 300 °C, разложение фторидов серебра и некоторые другие способы.
Промышленный метод[править | править код]
Промышленное производство фтора осуществляется электролизом расплава кислого фторида калия KF·2HF (часто с добавлениями фторида лития), который образуется при насыщении расплава KF фтористым водородом до содержания 40—41 % HF. Процесс электролиза проводят при температурах около 100 °C в стальных электролизёрах со стальным катодом и угольным анодом.
Хранение[править | править код]
Фтор хранят в газообразном состоянии (под давлением) и в жидком виде (при охлаждении жидким азотом) в аппаратах из никеля и сплавов на его основе (монель-металл), из меди, алюминия и его сплавов, латуни, нержавеющей стали (это возможно, потому что эти металлы и сплавы покрываются плёнкой фторидов, которая защищает от дальнейшей реакции со фтором[14]).
Применение[править | править код]
Фтор используется для получения:
- фреонов — широко распространённых хладагентов;
- фторопластов — химически инертных и негорючих полимеров;
- фторкаучуков — химически инертных и негорючих эластомеров;
- элегаза SF6 — газообразного изолятора, применяемого в высоковольтной электротехнике;
- гексафторида урана UF6, применяемого для разделения изотопов урана в ядерной промышленности;
- гексафтороалюмината натрия — электролита для получения алюминия путём электролиза;
- фторидов металлов (например, W и V), которые обладают некоторыми полезными свойствами.
- Фтористые соединения используются в электролитах литиевых аккумуляторов для создания диэлектрического слоя между катодом и анодом.
Ракетная техника[править | править код]
Фтор и некоторые его соединения являются сильными окислителями, поэтому могут применяться в качестве окислителя в ракетных топливах. Очень высокая эффективность фтора вызывала значительный интерес к нему и его соединениям. На заре космической эры в СССР и других странах существовали программы исследования фторсодержащих видов ракетного топлива. Однако продукты горения с фторсодержащими окислителями токсичны. Поэтому топлива на основе фтора не получили распространения в современной ракетной технике.
Применение в медицине[править | править код]
Фторированные углеводороды (например перфтордекалин) применяются в медицине как кровезаменители. Существует множество медицинских препаратов, содержащих фтор в структуре (фторотан, фторурацил, флуоксетин, галоперидол и др.). Фториды натрия, калия и др. в строго дозированных микроколичествах применяются для профилактики кариеса (см. ниже).
Биологическая и физиологическая роль[править | править код]
Фтор является жизненно необходимым для организма элементом[15][16]. Основным источником поступления фтора в организм человека является питьевая вода[17]. В организме человека преобладающая концентрация фтора содержится в эмали зубов в составе фторапатита — Ca5F(PO4)3 — и в костях. Общее содержание составляет 2,6 г, в том числе в костях 2,5 г[2]. Нормальное суточное поступление фтора в организм человека равно 2,5—3,5 мг[2]. При недостаточном (менее 0,5 мг/литр питьевой воды) или избыточном (более 1 мг/литр) потреблении фтора организмом могут развиваться заболевания зубов: кариес, пародонтоз, флюороз (крапчатость эмали) и остеосаркома. Также избыточное потребление фтора может приводить к поражениям костной системы[18][19].
Малое содержание фтора разрушает эмаль за счёт вымывания фтора из фторапатита с образованием гидроксоапатита, и наоборот.
Для профилактики кариеса рекомендуется использовать зубные пасты с добавками фторидов (натрия и/или олова), употреблять фторированную воду (до концентрации 1 мг/л) или применять местные аппликации 1—2 % раствором фторида натрия или фторида олова. Такие действия могут сократить вероятность появления кариеса на 30—50 %[20].
Предельно допустимая концентрация связанного фтора (в виде фторидов и фторорганических соединений) в воздухе промышленных помещений равна 0,0005 мг/литр воздуха.
Токсикология[править | править код]
Фтор представляет собой чрезвычайно агрессивное химическое вещество. Сильно ядовит, является сильным окислителем. Раздражающие свойства в несколько раз сильнее, чем у фтороводорода. Фтор — «судорожный яд», как и значительное число его соединений. Обладает кумулятивным действием. В организм проникает главным образом ингаляционным и пероральным путями. Характерные проявления интоксикации при ингаляционном воздействии сводятся к болезненности и жжению в области носа, глотки, за грудиной, кровотечению из носа, сухому кашлю. Возможен спазм гортани и бронхиальной мускулатуры. При осмотре обнаруживаются гиперемия, отёчность и некрозы слизистых оболочек носоглотки, изъязвления и даже прободения носовой перегородки. Слизистые дыхательных путей также некротизируются и покрываются жёлтыми корочками.
При лёгких ингаляционных отравлениях фтором и его соединениями, как правило, ограничиваются развитием ринофаринголарингита и трахеобронхита на фоне общей слабости, утомляемости, лабильности пульса и АД. — отравление «маскируется» под «простуду», что затрудняет своевременную диагностику и лечение.
При поражениях фтором и его соединениями средней тяжести диагностируются глубокие бронхиты, и, с задержкой, пневмонии; а также судороги и гепатиты.
В случае тяжёлых отравлений развиваются поражение тканей и токсический отёк лёгких, коматозное состояние, судороги.
Резорбтивное действие объясняется возможностью фтора вступать в свободно-радикальные реакции с тканями организма — осаждение кальция из сыворотки крови и тканевой жидкости в форме фторида, приводящие к глубоким нарушениям в обмене веществ, замедлению свёртываемости крови, нарушению кислотно-основного соотношения крови, нарушению нервно-мышечной проводимости, увеличению проницаемости сосудистых стенок. Кроме того, фтор нарушает функционирование ряда ферментных систем, взаимодействуя с магнием, марганцем, железом, цинком, входящих, как и кальция, в состав энзимов, являясь их активаторами или ингибиторами. Отравления фтором нарушает активность ферментов, использующих микроэлементы в качестве кофакторов, например снижается активность Энолазы (нарушение гликолиза и синтеза макроэргов), аденозинтрифосфатазы, глутаминсинтетазы.
Ожоги глаз и кожных покровов наблюдаются при непосредственном контакте с фтором. Контакт кожи с газом в течение 2 секунд вызывает термический ожог II степени; воздействие в концентрации 0,15-0,30 мг/л приводит к раздражению открытых участков кожи. При обследовании 252 человек, подвергающихся воздействию фтора, у 57 обнаружены конъюнктивиты или экзема век[21].
Фтор депонируется в костях и медленно, в течение нескольких лет, выводится из организма почками и кишечником.
См. также[править | править код]
- Соединения фтора в ракетной технике
Литература[править | править код]
- Рысс И. Г. Химия фтора и его неорганических соединений. М. Госхимиздат, 1966 г. — 718 с.
- Некрасов Б. В. Основы общей химии. (издание третье, том 1) М. Химия, 1973 г. — 656 с.
- Военная Токсикология, Радиология и Медицинская Защита. Учебник. ВМА им. С. М. Кирова. Ленинград, 1987 г. — 356с.
Примечания[править | править код]
- ↑ Meija J. et al. Atomic weights of the elements 2013 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2016. — Vol. 88, no. 3. — P. 265–291. — doi:10.1515/pac-2015-0305. Архивировано 31 марта 2016 года.
- ↑ 1 2 3 4 5 6 7 8 9 Раков Э. Г. Фтор // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 197—199. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ 1 2 3 4 5 6 7 8 Ivlev S. I. et al. The Crystal Structures of α‐ and β‐F2 Revisited (англ.) // Chemistry – A European Journal. — 2019. — Vol. 25. — Iss. 13. — P. 3310—3317. — doi:10.1002/chem.201805298. [исправить]
- ↑ Annales de chimie et de physique | 1816 | Gallica
- ↑ Главным образом в эмали зубов.
- ↑ Ахметов Н. С. Общая и неорганическая химия.
- ↑ 1 2 Jordan T. H., Streib W. D., Smith H. W., Lipscomb W. N. Single-crystal studies of β-F2 and of γ-O2 (англ.) // Acta Crystallographica. — 1964. — Vol. 17, no. 6. — P. 777—778. — ISSN 0365-110X. — doi:10.1107/S0365110X6400202X. [исправить]
- ↑ 1 2 3 4 5 Meyer L., Barrett C. S., Greer S. C. Crystal Structure of α‐Fluorine (англ.) // The Journal of Chemical Physics. — 1968. — Vol. 49, no. 4. — P. 1902—1907. — ISSN 0021-9606. — doi:10.1063/1.1670323. [исправить]
- ↑ Pauling L., Keaveny I., Robinson A. B. The crystal structure of α-fluorine (англ.) // Journal of Solid State Chemistry. — 1970. — Vol. 2, no. 2. — P. 225—227. — ISSN 0022-4596. — doi:10.1016/0022-4596(70)90074-5. [исправить]
- ↑ Jordan T. H., Streib W. E., Lipscomb W. N. Single‐Crystal X‐Ray Diffraction Study of β‐Fluorine (англ.) // The Journal of Chemical Physics. — 1964. — Vol. 41, no. 3. — P. 760—764. — ISSN 0021-9606. — doi:10.1063/1.1725957. [исправить]
- ↑ Science Magazine: Sign In | Science/AAAS
- ↑ Энциклопедический словарь юного химика. Для среднего и старшего возраста. Москва, Педагогика-Пресс. 1999 год.
- ↑ Гринвуд Н., Эрншо А. Химия элементов. — М.: БИНОМ. Лаборатория знаний, 2008. — Т. 2. — С. 147—148, 169 — химический синтез фтора.
- ↑ Фтор в Популярной библиотеке химических элементов. Дата обращения: 25 марта 2007. Архивировано 30 сентября 2007 года.
- ↑ Янин Е.П. Биогеохимическая роль и эколого-гигиеническое значение фтора. — Журнал «Проблемы окружающей среды и природных ресурсов» Всероссийского института научной и технической информации РАН (Москва), номер 4, С. 20-108, 2009.
- ↑ Wada Osamu. What are Trace Elements? Their deficiency and excess states. med.or.jp. JMAJ, Vol. 47, No. 8 (2004). Дата обращения: 28 марта 2021. Архивировано 29 марта 2017 года.
- ↑ Канатникова Н.В., Захарченко Г.Л. Физиологическая роль фтора и его содержание в питьевой воде Орловской области. cyberleninka.ru. Журанал «Здоровье населения и среда обитания», номер 5(206), С. 40-43 (2010). Дата обращения: 28 марта 2021.
- ↑ По данным National Toxicology Program
- ↑ Синицына О.О., Плитман С.И., Амплеева Г.П., Гильденскиольд О.А., Ряшенцева Т.М. Эссенциальные элементы и их нормирование в питьевой воде. cyberleninka.ru. Журнал Анализ риска здоровью, номер 3, С. 30-36 (2020). Дата обращения: 28 марта 2021.
- ↑ Справочник потребителя. Дата обращения: 29 апреля 2020. Архивировано 26 февраля 2021 года.
- ↑ Н. В. Лазарев, И. Д. Гадаскина. «Вредные вещества в промышленности». Том 3, страница 19.
Ссылки[править | править код]
- Информация о Перфторане
- Кровезаменитель Перфторан // Вестник РАН, 1997, том 67, N 11, с. 998—1013.
← Молярная и молекулярная масса
- Относительная молекулярная масса F: 18.9984032
- Молярная масса F: 18.9984032 г/моль (0.019 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| F (фтор) | 1 | 18.9984032 | 18.9984032 |
| 18.9984032 |
Расчёт молярной и относительной молекулярной массы F
- Mr[F] = Ar[F] = 18.9984032 = 18.9984032
- Молярная масса (в кг/моль) = Mr[F] : 1000 = 18.9984032 : 1000 = 0.019 кг/моль
Электронная конфигурация атома фтора
Калькулятор массы
Химическая формула соединения
Рассчитать
Поделитесь информацией с друзьями
Скачать перечень калькуляторов
Относительные молекулярные массы других соединений
C2N2O4S [148.0974]
AlO [42.9809386]
Калькулятор молекулярной массы


Молярная масса фтора.
Молярная масса фтора:
Молярная масса – это характеристика вещества, отношение массы вещества к его количеству.
В Международной системе единиц (СИ) единицей измерения молярной массы является килограмм на моль (русское обозначение: кг/моль; международное: kg/mol). Исторически сложилось, что молярную массу, как правило, выражают в г/моль.
Молярная масса численно равна массе одного моля вещества, то есть массе вещества, содержащего число частиц, равное числу Авогадро (NA = 6,022 140 76⋅1023 моль−1).
Молярная масса, выраженная в г/моль, численно совпадает с молекулярной массой (абсолютной молекулярной массой), выраженной в а. е. м., и относительной молекулярной массой.
В свою очередь, молекулярная масса – масса молекулы. Различают абсолютную молекулярную массу (обычно выражается в атомных единицах массы, а. е. м.) и относительную молекулярную массу – безразмерную величину, равную отношению массы молекулы к 1/12 массы атома углерода 12C.
Молярную массу обозначают M.
Молекула фтора двухатомна – F2.
Молярная масса фтора (M (F)) составляет 18,998403163(6) г/моль.
Молярная масса молекулы фтора (M (F2)) составляет 37,996806327(3) г/моль.
Необходимо иметь в виду, что молярные массы химических элементов и простых веществ, которые они образуют – не одно и то же. Например, молярная масса кислорода как химического элемента (атома) ≈ 16 г/моль, а вещества (O2) ≈ 32 г/моль.
Все свойства атома фтора
Источник: https://en.wikipedia.org
Примечание: © Фото https://www.pexels.com, https://pixabay.com
Коэффициент востребованности
149
Molar mass of F = 18.9984032 g/mol
Convert grams fluorine to moles
or
moles fluorine to grams
Percent composition by element
Element: Fluorine
Symbol: F
Atomic Mass: 18.9984032
# of Atoms: 1
Mass Percent: 100.000%
Calculate the
molecular weight of a chemical compound
More information
on molar mass and molecular weight
In chemistry, the formula weight is a quantity computed by multiplying the atomic weight (in atomic mass units) of each element in a chemical formula by the number of atoms of that element present in the formula, then adding all of these products together.
A common request on this site is to convert grams to moles. To complete this calculation, you have to know what substance you are trying to convert. The reason is that the molar mass of the substance affects the conversion. This site explains how to find molar mass.
If the formula used in calculating molar mass is the molecular formula, the formula weight computed is the molecular weight. The percentage by weight of any atom or group of atoms in a compound can be computed by dividing the total weight of the atom (or group of atoms) in the formula by the formula weight and multiplying by 100.
The atomic weights used on this site come from NIST, the National Institute of Standards and Technology. We use the most common isotopes. This is how to calculate molar mass (average molecular weight), which is based on isotropically weighted averages. This is not the same as molecular mass, which is the mass of a single molecule of well-defined isotopes. For bulk stoichiometric calculations, we are usually determining molar mass, which may also be called standard atomic weight or average atomic mass.
Finding molar mass starts with units of grams per mole (g/mol). When calculating molecular weight of a chemical compound, it tells us how many grams are in one mole of that substance. The formula weight is simply the weight in atomic mass units of all the atoms in a given formula.
Formula weights are especially useful in determining the relative weights of reagents and products in a chemical reaction. These relative weights computed from the chemical equation are sometimes called equation weights.
Using the chemical formula of the compound and the periodic table of elements, we can add up the atomic weights and calculate molecular weight of the substance.