- Формула: O2S или SO2
- Относительная молекулярная масса O2S: 64.0638
- Молярная масса O2S: 64.0638 г/моль (0.06406 кг/моль)
| Элемент | Всего атомов | Атомная масса, а.е.м. | Общая масса атомов, а.е.м. |
|---|---|---|---|
| O (кислород) | 2 | 15.9994 | 31.9988 |
| S (сера) | 1 | 32.065 | 32.065 |
| 64.0638 |
Расчёт молярной и относительной молекулярной массы O2S
- Mr[O2S] = Ar[O] * 2 + Ar[S] = 15.9994 * 2 + 32.065 = 64.0638
- Молярная масса (в кг/моль) = Mr[O2S] : 1000 = 64.0638 : 1000 = 0.06406 кг/моль
Расчёт массовых долей элементов в O2S
- Массовая доля кислорода (O) = 31.9988 : 64.0638 * 100 = 49.948 %
- Массовая доля серы (S) = 32.065 : 64.0638 * 100 = 50.052 %
Калькулятор массы
👋 Привет Лёва
Середнячок
40/250
Задать вопрос

Анна230801
+10
Решено
5 лет назад
Химия
10 – 11 классы
Вычислите относительную молекулярную массу и молярную массу сернистого газа ( SO2 )
Смотреть ответ
1
Ответ проверен экспертом
3
(12 оценок)
13
nikolaygr
5 лет назад
Светило науки – 4530 ответов – 11976 раз оказано помощи
относительная молекулярная масса=32+2*16=64
молярная масса М =64г/моль
(12 оценок)
https://vashotvet.com/task/5878243
У этого термина существуют и другие значения, см. Оксид серы.
| Оксид серы(IV) | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Оксид серы(IV) | |
| Хим. формула | SO2 | |
| Рац. формула | SO2 | |
| Физические свойства | ||
| Состояние | бесцветный газ | |
| Молярная масса | 64,054 г/моль | |
| Плотность | 0,002927 г/см³ | |
| Энергия ионизации | 12,3 ± 0,1 эВ[6] | |
| Термические свойства | ||
| Температура | ||
| • плавления | −75,5 °C | |
| • кипения | −10,01 °C | |
| Тройная точка | 197,69 К (—75,46 °C), 0,0157 МПа[1] | |
| Критическая точка | 430,7 (157,55 °C), 7,88 МПа, 122 см3/моль[2] | |
| Энтальпия | ||
| • образования | —296,90[3][4]; —297,05[5] кДж/моль | |
| Давление пара | 3,2 ± 0,1 атм[6] | |
| Химические свойства | ||
| Растворимость | ||
| • в воде | 11,5 г/100 мл | |
| Классификация | ||
| Рег. номер CAS | [7446-09-5] | |
| PubChem | 1119 | |
| Рег. номер EINECS | 231-195-2 | |
| SMILES |
O=S=O |
|
| InChI |
InChI=1S/O2S/c1-3-2 RAHZWNYVWXNFOC-UHFFFAOYSA-N |
|
| Кодекс Алиментариус | E220 | |
| RTECS | WS4550000 | |
| ChEBI | 18422 | |
| ChemSpider | 1087 | |
| Безопасность | ||
| Предельная концентрация | 10 мг/м³ | |
| Токсичность | Класс опасности III | |
| Пиктограммы ECB |
|
|
| NFPA 704 |
0 3 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Окси́д се́ры(IV) (диокси́д се́ры, двуокись серы, серни́стый газ, серни́стый ангидри́д) — соединение серы с кислородом состава SO2. В нормальных условиях представляет собой бесцветный газ с характерным резким запахом (запах загорающейся спички). В высоких концентрациях токсичен. Под давлением сжижается при комнатной температуре. Растворяется в воде с образованием нестойкой серни́стой кислоты; растворимость 11,5 г/100 г воды при 20 °C, снижается с ростом температуры. Растворяется также в этаноле и се́рной кислоте. Один из основных компонентов вулканических газов. Зарегистрирован в качестве пищевой добавки с номером Е220.
Получение[править | править код]
Промышленный способ получения — сжигание серы или обжиг сульфидов, в основном — пирита.
В лабораторных условиях и в природе SO2 получают воздействием сильных кислот на сульфиты и гидросульфиты. Образующаяся сернистая кислота H2SO3 сразу разлагается на SO2 и H2O:
Химические свойства[править | править код]
Спектр поглощения SO2 в ультрафиолетовом диапазоне
Относится к кислотным оксидам. Растворяется в воде с образованием сернистой кислоты (при обычных условиях реакция обратима):
С щелочами образует сульфиты:
Химическая активность SO2 весьма велика. Наиболее ярко выражены восстановительные свойства SO2, степень окисления серы в таких реакциях повышается:
Предпоследняя реакция является качественной реакцией на сульфит-ион SO32− и на SO2 (обесцвечивание фиолетового раствора).
В присутствии сильных восстановителей SO2 способен проявлять окислительные свойства. Например, для извлечения серы из отходящих газов металлургической промышленности используют восстановление SO2 оксидом углерода(II):
Или для получения фосфорноватистой кислоты:
Применение[править | править код]
Большая часть оксида серы(IV) используется для производства сернистой кислоты. Используется также в виноделии в качестве консерванта (пищевая добавка E220). Газ убивает микроорганизмы, поэтому им окуривают овощехранилища и склады. Оксид серы(IV) используется для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором. Применяется он также и в качестве растворителя в лабораториях[7]. Оксид серы(IV) применяется также для получения различных солей сернистой кислоты.
Токсичность и безопасность[править | править код]
Оксид серы(IV) SO2 (диоксид серы) в высоких дозах очень токсичен. Симптомы при отравлении сернистым газом — насморк, кашель, охриплость, сильное першение в горле и своеобразный привкус. При вдыхании сернистого газа более высокой концентрации — удушье, расстройство речи, затруднение глотания, рвота, возможен острый отёк лёгких.
При кратковременном вдыхании оказывает сильное раздражающее действие, вызывает кашель и першение в горле.
ПДК (предельно допустимая концентрация):
- в атмосферном воздухе максимально-разовая — 0,5 мг/м³, среднесуточная — 0,05 мг/м³;
- в помещении (рабочая зона) — 10 мг/м³.
По степени воздействия на человеческий организм сернистый ангидрид относится к III классу опасности («умеренно-опасное химическое вещество») согласно ГОСТ 12.1.007-76.
Интересно, что чувствительность по отношению к SO2 весьма различна у отдельных людей, животных и растений. Так, среди растений наиболее устойчивы по отношению к сернистому газу берёза и дуб, наименее — роза, сосна и ель.
По данным исследования[8] средний порог восприятия запаха может превышать ПДК (21 мг/м3), а у части людей порог был значительно выше среднего значения.
В качестве пищевой добавки оксид серы признан безопасным для потребления, однако у астматиков он может вызвать аллергические реакции[9]. Уровень, не вызывающий видимых отрицательных эффектов (УНВОЭ) составляет 70 мг/кг массы тела у животных, допустимое суточное потребление (ДСП) составляет 0,7 мг/кг массы тела человека, по данным Европейского агентства по безопасности продуктов питания (EFSA)[9]. Это количество совпадает с мнением Объединённого экспертного комитета ФАО/ВОЗ по пищевым добавкам (JECFA), установившего аналогичный уровень ДСП в 1998 году[10].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в США признаёт оксид серы как «общепризнанную безопасную» (GRAS) пищевую добавку, за исключением его использования в продуктах, признанных источником витамина B1 (тиамина), поскольку оксид серы (наряду с добавками Е220-Е228, выделяющими оксид серы) разлагает этот микронутриент и его использование в перечне богатых витамином B1 продуктов, а также во фруктах и овощах запрещено[11].
Биологическая роль[править | править код]
Роль эндогенного сернистого газа в физиологии организма млекопитающих ещё окончательно не выяснена[12]. Сернистый газ блокирует нервные импульсы от рецепторов растяжения лёгких и устраняет рефлекс, возникающий в ответ на перерастяжение лёгких, стимулируя тем самым более глубокое дыхание.
Показано, что эндогенный сернистый газ играет роль в предотвращении повреждения лёгких, уменьшает образование свободных радикалов, оксидативный стресс и воспаление в лёгочной ткани, в то время как экспериментальное повреждение лёгких, вызываемое олеиновой кислотой, сопровождается, наоборот, снижением образования сернистого газа и активности опосредуемых им внутриклеточных путей и повышением образования свободных радикалов и уровня оксидативного стресса. Что ещё более важно, блокада фермента, способствующего образованию эндогенного сернистого газа, в эксперименте способствовала усилению повреждения лёгких, оксидативного стресса и воспаления и активации апоптоза клеток лёгочной ткани. И напротив, обогащение организма подопытных животных серосодержащими соединениями, такими, как глютатион и ацетилцистеин, служащими источниками эндогенного сернистого газа, приводило не только к повышению содержания эндогенного сернистого газа, но и к уменьшению образования свободных радикалов, оксидативного стресса, воспаления и апоптоза клеток лёгочной ткани[13].
Считают, что эндогенный сернистый газ играет важную физиологическую роль в регуляции функций сердечно-сосудистой системы, а нарушения в его метаболизме могут играть важную роль в развитии таких патологических состояний, как лёгочная гипертензия, гипертоническая болезнь, атеросклероз сосудов, ишемическая болезнь сердца, ишемия-реперфузия и др.[14].
Показано, что у детей с врождёнными пороками сердца и лёгочной гипертензией повышен уровень гомоцистеина (вредного токсичного метаболита цистеина) и снижен уровень эндогенного сернистого газа, причём степень повышения уровня гомоцистеина и степень снижения выработки эндогенного сернистого газа коррелировала со степенью выраженности лёгочной гипертензии. Предложено использовать гомоцистеин как маркер степени тяжести состояния этих больных и указано, что метаболизм эндогенного сернистого газа может быть важной терапевтической мишенью у этих больных[15].
Также показано, что эндогенный сернистый газ понижает пролиферативную активность клеток гладких мышц эндотелия сосудов, угнетая активность MAPK-сигнального пути и одновременно активируя аденилатциклазный путь и протеинкиназу A[16]. А пролиферация гладкомышечных клеток стенок сосудов считается одним из механизмов гипертензивного ремоделирования сосудов и важным звеном патогенеза артериальной гипертензии, а также играет роль в развитии стеноза (сужения просвета) сосудов, предрасполагающего к развитию в них атеросклеротических бляшек.
Эндогенный сернистый газ оказывает эндотелий-зависимое вазодилатирующее действие в низких концентрациях, а в более высоких концентрациях становится эндотелий-независимым вазодилататором, а также оказывает отрицательное инотропное действие на миокард (понижает сократительную функцию и сердечный выброс, способствуя снижению артериального давления). Этот вазодилатирующий эффект сернистого газа опосредуется через АТФ-чувствительные кальциевые каналы и кальциевые каналы L-типа («дигидропиридиновые»). В патофизиологических условиях эндогенный сернистый газ оказывает противовоспалительное действие и повышает антиоксидантный резерв крови и тканей, например при экспериментальной лёгочной гипертензии у крыс. Эндогенный сернистый газ также снижает повышенное артериальное давление и тормозит гипертензивное ремоделирование сосудов у крыс в экспериментальных моделях гипертонической болезни и лёгочной гипертензии. Последние (на 2015 год) исследования показывают также, что эндогенный сернистый газ вовлечён в регуляцию липидного метаболизма и в процессы ишемии-реперфузии[17].
Эндогенный сернистый газ также уменьшает повреждение миокарда, вызванное экспериментальной гиперстимуляцией адренорецепторов изопротеренолом, и повышает антиоксидантный резерв миокарда[18].
Воздействие на атмосферу[править | править код]
Из-за образования в больших количествах в качестве отходов диоксид серы является одним из основных газов, загрязняющих атмосферу.
Наибольшую опасность представляет собой загрязнение соединениями серы, которые выбрасываются в атмосферу при сжигании угольного топлива, нефти и природного газа, а также при выплавке металлов и производстве серной кислоты.
Антропогенное загрязнение серой в два раза превосходит природное[19][20]. Серный ангидрид образуется при постепенном окислении сернистого ангидрида кислородом воздуха с участием света. Конечным продуктом реакции является аэрозоль серной кислоты в воздухе, раствор в дождевой воде (в облаках). Выпадая с осадками, она подкисляет почву, обостряет заболевания дыхательных путей, скрыто угнетающе воздействует на здоровье человека. Выпадение аэрозоля серной кислоты из дымовых факелов химических предприятий чаще отмечается при низкой облачности и высокой влажности воздуха. Растения около таких предприятий обычно бывают густо усеяны мелкими некротическими пятнами, образовавшимися в местах оседания капель серной кислоты, что доказывает присутствие её в окружающей среде в существенных количествах. Пирометаллургические предприятия цветной и чёрной металлургии, а также ТЭЦ ежегодно выбрасывают в атмосферу десятки миллионов тонн серного ангидрида.
Необходимо отметить также, что диоксид серы имеет максимум в спектре поглощения света в ультрафиолетовой области (190—220 нм), что совпадает с максимумом в спектре поглощения озона. Это свойство диоксида серы позволяет утверждать, что наличие этого газа в атмосфере имеет также положительный эффект, предотвращая возникновение и развитие онкологических заболеваний кожи человека. Диоксид серы в атмосфере Земли существенно ослабляет влияние парниковых газов (диоксид углерода, метан) на рост температуры атмосферы[21].
Наибольших концентраций сернистый газ достигает в северном полушарии, особенно над территорией США, Европы, Китая, европейской части России и Украины. В южном полушарии содержание его значительно ниже[22].
Примечания[править | править код]
- ↑ Фёдоров П. И., Тройная точка, 1998, с. 12.
- ↑ Хазанова Н. Е., Критическое состояние, 1990, с. 543.
- ↑ Карапетьянц М. Х.,, Дракин С. И., Общая и неорганическая химия, 2000, с. 181.
- ↑ Стандартные энтальпии образования, стандартные энергии Гиббса образования неорганических веществ и их стандартные энтропии при 298,15 К. Дата обращения: 22 декабря 2020. Архивировано 27 июля 2020 года.
- ↑ Киреев В. А., Краткий курс физической химии, 1978, с. 179.
- ↑ 1 2 http://www.cdc.gov/niosh/npg/npgd0575.html
- ↑ Гордон А., Форд Р. Спутник химика / Пер. на русск. Е. Л. Розенберга, С. И. Коппель. — М.: Мир, 1976. — 544 с.
- ↑ Mary O. Amdur, Walter W. Melvin, Philip Drinker. Effects of Inhalation of Sulphur Dioxide by Man (англ.) // The Lancet. — Elsevier B.V, 1953. — 1 October (vol. 262 (iss. 6789). — P. 758—759. — ISSN 0140-6736. — doi:10.1016/S0140-6736(53)91455-X. Архивировано 9 ноября 2019 года.
- ↑ 1 2 EFSA Panel on Food additives and Nutrient Sources added to Food (ANS). Scientific Opinion on the re‐evaluation of sulfur dioxide (E 220), sodium sulfite (E 221), sodium bisulfite (E 222), sodium metabisulfite (E 223), potassium metabisulfite (E 224), calcium sulfite (E 226), calcium bisulfite (E 227) and potassium bisulfite (E 228) as food additives // EFSA Journal. — 2016-04. — Т. 14, вып. 4. — doi:10.2903/j.efsa.2016.4438.
- ↑ World Health Organization. SULFUR DIOXIDE // Joint FAO/WHO Expert Committee on Food Additives.
- ↑ CFR – Code of Federal Regulations Title 21 (англ.). FDA. Дата обращения: 16 октября 2022.
- ↑ Liu, D.; Jin, H; Tang, C; Du, J. Sulfur dioxide: a novel gaseous signal in the regulation of cardiovascular functions (англ.) // Mini-Reviews in Medicinal Chemistry (англ.) (рус. : journal. — 2010. — Vol. 10, no. 11. — P. 1039—1045. — PMID 20540708. Архивировано 26 апреля 2013 года.
- ↑ Chen S, Zheng S, Liu Z, Tang C, Zhao B, Du J, Jin H. Endogenous sulfur dioxide protects against oleic acid-induced acute lung injury in association with inhibition of oxidative stress in rats. // Lab Invest.. — Feb 2015. — Т. 95, вып. 95(2), № 2. — С. 142—156. — doi:10.1038/labinvest.2014.147. — PMID 25581610.
- ↑ Tian H. Advances in the study on endogenous sulfur dioxide in the cardiovascular system. // Chin Med J. — Nov 2014. — Т. 127, вып. 127(21), № 21. — С. 3803—3807. — PMID 25382339.
- ↑ Yang R, Yang Y, Dong X, Wu X, Wei Y. Correlation between endogenous sulfur dioxide and homocysteine in children with pulmonary arterial hypertension associated with congenital heart disease (кит.) // Zhonghua Er Ke Za Zhi. — Aug 2014. — 第52卷, 第52(8)期, 第8数. — 第625—629 页. — PMID 25224243.
- ↑ Liu D, Huang Y, Bu D, Liu AD, Holmberg L, Jia Y, Tang C, Du J, Jin H. Sulfur dioxide inhibits vascular smooth muscle cell proliferation via suppressing the Erk/MAP kinase pathway mediated by cAMP/PKA signaling. // Cell Death Dis.. — May 2014. — Т. 5, вып. 5(5), № 5. — С. e1251. — doi:10.1038/cddis.2014.229.. — PMID 24853429.
- ↑ Wang XB, Jin HF, Tang CS, Du JB. The biological effect of endogenous sulfur dioxide in the cardiovascular system. // Eur J Pharmacol.. — 16 Nov 2011. — Т. 670, вып. 670(1), № 1. — doi:10.1016/j.ejphar.2011.08.031. — PMID 21925165.
- ↑ Liang Y, Liu D, Ochs T, Tang C, Chen S, Zhang S, Geng B, Jin H, Du J. Endogenous sulfur dioxide protects against isoproterenol-induced myocardial injury and increases myocardial antioxidant capacity in rats. // Lab Invest.. — Jan 2011. — Т. 91, вып. 91(1), № 1. — С. 12—23. — doi:10.1038/labinvest.2010.156. — PMID 20733562.
- ↑ Серный ангидрид, его воздействие на окружающую среду. Дата обращения: 21 ноября 2013. Архивировано 23 ноября 2014 года.
- ↑ Основы расчета нормативов пдв. Дата обращения: 21 ноября 2013. Архивировано 20 апреля 2015 года.
- ↑ Проблемы загрязнения атмосферы. Парниковый эффект. Дата обращения: 21 ноября 2013. Архивировано 3 декабря 2013 года.
- ↑ Экологические кризисы. Дата обращения: 21 ноября 2013. Архивировано 10 июня 2015 года.
Литература[править | править код]
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — 4-е изд., стер. — М.: Химия, 2000. — 592 с.
- Киреев В. А. Краткий курс физической химии. — 5-е изд., стер. — М.: Химия, 1978. — 621 с.
- Фёдоров П. И. Тройная точка // Химическая энциклопедия. — Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 12.
- Хазанова Н. Е. Критическое состояние // Химическая энциклопедия. — Советская энциклопедия, 1990. — Т. 2: Даф — Мед. — С. 541—543.
Ссылки[править | править код]
- Global map of sulfur dioxide distribution Архивная копия от 8 февраля 2017 на Wayback Machine (англ.)
- United States Environmental Protection Agency Sulfur Dioxide page Архивная копия от 25 декабря 2008 на Wayback Machine (англ.)
- International Chemical Safety Card 0074 Архивная копия от 7 августа 2019 на Wayback Machine (англ.)
- IARC Monographs. «Sulfur Dioxide and some Sulfites, Bisulfites and Metabisulfites» v54. 1992. p131. (англ.)
- Sulfur Dioxide, Molecule of the Month Архивная копия от 3 августа 2019 на Wayback Machine (англ.)
| п • о • р Оксиды | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H2O | ||||||||||||||||
| Li2O LiCoO2 Li3PaO4 Li5PuO6 Ba2LiNpO6 LiAlO2 Li3NpO4 Li2NpO4 Li5NpO6 LiNbO3 |
BeO | B2O3 | С3О2 C12O9 CO C12O12 C4O6 CO2 |
N2O NO N2O3 N4O6 NO2 N2O4 N2O5 |
O | F | ||||||||||
| Na2O NaPaO3 NaAlO2 Na2PtO3 |
MgO | AlO Al2O3 NaAlO2 LiAlO2 AlO(OH) |
SiO SiO2 |
P4O P4O2 P2O3 P4O8 P2O5 |
S2O SO SO2 SO3 |
Cl2O ClO2 Cl2O6 Cl2O7 |
||||||||||
| K2O K2PtO3 KPaO3 |
CaO Ca3OSiO4 CaTiO3 |
Sc2O3 | TiO Ti2O3 TiO2 TiOSO4 CaTiO3 BaTiO3 |
VO V2O3 V3O5 VO2 V2O5 |
FeCr2O4 CrO Cr2O3 CrO2 CrO3 MgCr2O4 |
MnO Mn3O4 Mn2O3 MnO(OH) Mn5O8 MnO2 MnO3 Mn2O7 |
FeCr2O4 FeO Fe3O4 Fe2O3 |
CoFe2O4 CoO Co3O4 CoO(OH) Co2O3 CoO2 |
NiO NiFe2O4 Ni3O4 NiO(OH) Ni2O3 |
Cu2O CuO CuFe2O4 Cu2O3 CuO2 |
ZnO | Ga2O Ga2O3 |
GeO GeO2 |
As2O3 As2O4 As2O5 |
SeOCl2 SeOBr2 SeO2 Se2O5 SeO3 |
Br2O Br2O3 BrO2 |
| Rb2O RbPaO3 Rb4O6 |
SrO | Y2O3 YOF YOCl |
ZrO(OH)2 ZrO2 ZrOS Zr2О3Сl2 |
NbO Nb2O3 NbO2 Nb2O5 Nb2O3(SO4)2 LiNbO3 |
Mo2O3 Mo4O11 MoO2 Mo2O5 MoO3 |
TcO2 Tc2O7 |
Ru2O3 RuO2 Ru2O5 RuO4 |
RhO Rh2O3 RhO2 |
PdO Pd2O3 PdO2 |
Ag2O Ag2O2 |
Cd2O CdO |
In2O InO In2O3 |
SnO SnO2 |
Sb2O3 Sb2O4 Hg2Sb2O7 Sb2O5 |
TeO2 TeO3 |
I2O4 I4O9 I2O5 |
| Cs2O Cs2ReCl5O |
BaO BaPaO3 BaTiO3 BaPtO3 |
HfO(OH)2 HfO2 |
Ta2O TaO TaO2 Ta2O5 |
WO2Br2 WO2 WO2Cl2 WOBr4 WOF4 WOCl4 WO3 |
Re2O ReO Re2O3 ReO2 Re2O5 ReO3 Re2O7 |
OsO Os2O3 OsO2 OsO4 |
Ir2O3 IrO2 |
PtO Pt3O4 Pt2O3 PtO2 K2PtO3 Na2PtO3 PtO3 |
Au2O AuO Au2O3 |
Hg2O HgO (Hg3O2)SO4 Hg2O(CN)2 Hg2Sb2O7 Hg3O2Cl2 Hg5O4Cl2 |
Tl2O Tl2O3 |
Pb2O PbO Pb3O4 Pb2O3 PbO2 |
BiO Bi2O3 Bi2O4 Bi2O5 |
PoO PoO2 PoO3 |
At | |
| Fr | Ra | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | |
| ↓ | ||||||||||||||||
| La2O2S La2O3 |
Ce2O3 CeO2 |
PrO Pr2O2S Pr2O3 Pr6O11 PrO2 |
NdO Nd2O2S Nd2O3 NdHO |
Pm2O3 | SmO Sm2O3 |
EuO Eu3O4 Eu2O3 EuO(OH) Eu2O2S |
Gd2O3 | Tb | Dy2O3 | Ho2O3 Ho2O2S |
Er2O3 | Tm2O3 | YbO Yb2O3 |
Lu2O2S Lu2O3 LuO(OH) |
||
| Ac2O3 | UO2 UO3 U3O8 |
PaO PaO2 Pa2O5 PaOS |
ThO2 | NpO NpO2 Np2O5 Np3O8 NpO3 |
PuO Pu2O3 PuO2 PuO3 PuO2F2 |
AmO2 | Cm2O3 CmO2 |
Bk2O3 | Cf2O3 | Es | Fm | Md | No | Lr |
zethas
Вопрос по химии:
Вычислите относительную молекулярную массу и молярную массу сернистого газа ( SO2 )
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок – бесплатно!
Ответы и объяснения 1
thangis152
Относительная молекулярная масса=32+2*16=64
молярная масса М =64г/моль
Знаете ответ? Поделитесь им!
Гость ?
Как написать хороший ответ?
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете
правильный ответ; - Писать подробно, чтобы ответ был исчерпывающий и не
побуждал на дополнительные вопросы к нему; - Писать без грамматических, орфографических и
пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся
уникальные и личные объяснения; - Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не
знаю» и так далее; - Использовать мат – это неуважительно по отношению к
пользователям; - Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует?
Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие
вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи –
смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
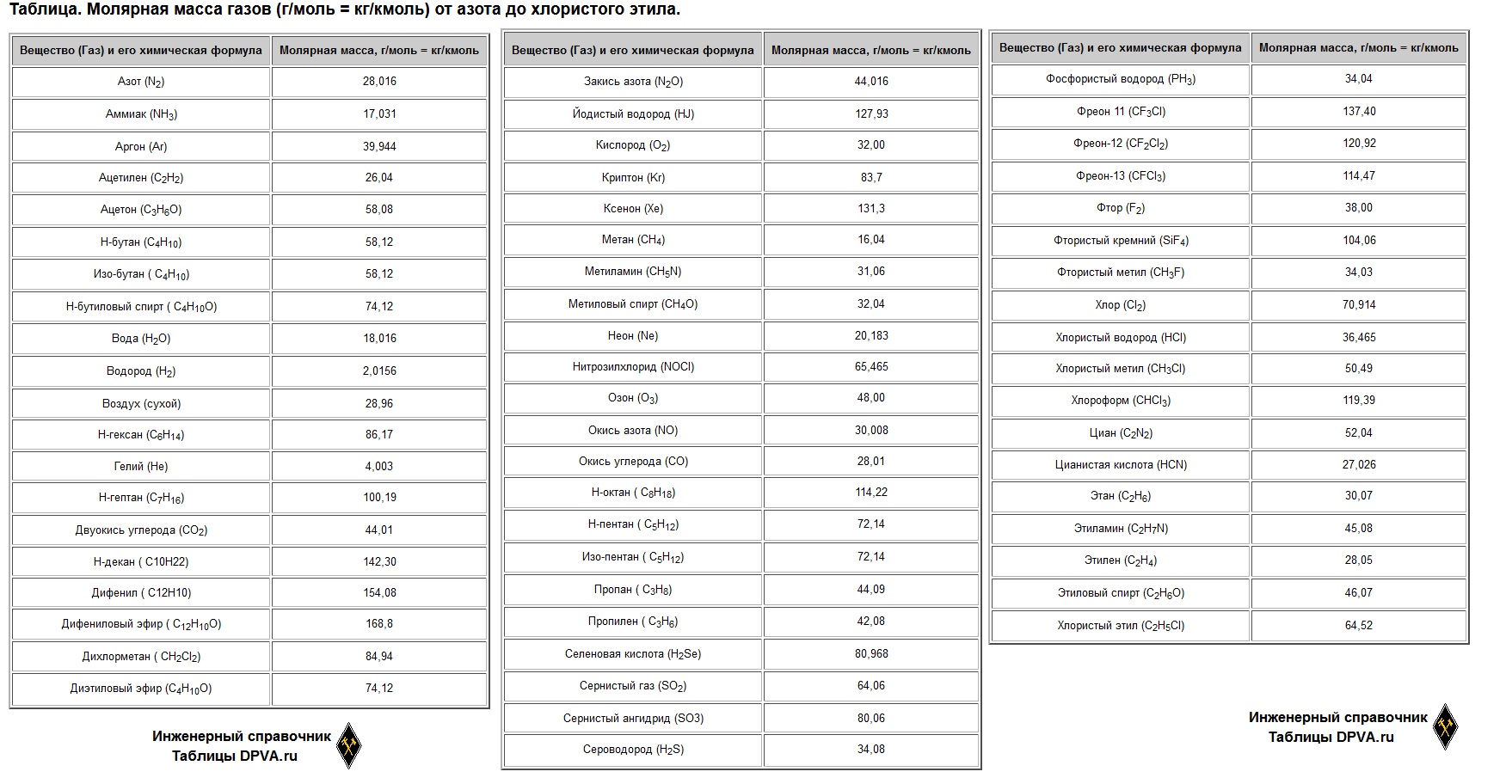
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Азот (N2) | 28,016 |
| Аммиак (NH3) | 17,031 |
| Аргон (Ar) | 39,944 |
| Ацетилен (C2H2) | 26,04 |
| Ацетон (C3H6O) | 58,08 |
| Н-бутан (C4H10) | 58,12 |
| Изо-бутан ( C4H10) | 58,12 |
| Н-бутиловый спирт ( C4H10O) | 74,12 |
| Вода (H2O) | 18,016 |
| Водород (H2) | 2,0156 |
| Воздух (сухой) | 28,96 |
| Н-гексан (C6H14) | 86,17 |
| Гелий (He) | 4,003 |
| Н-гептан (C7H16) | 100,19 |
| Двуокись углерода (CO2) | 44,01 |
| Н-декан ( C10H22) | 142,30 |
| Дифенил ( C12H10) | 154,08 |
| Дифениловый эфир ( C12H10O) | 168,8 |
| Дихлорметан ( CH2Cl2) | 84,94 |
| Диэтиловый эфир (C4H10O) | 74,12 |
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Закись азота (N2O) | 44,016 |
| Йодистый водород (HJ) | 127,93 |
| Кислород (O2) | 32,00 |
| Криптон (Kr) | 83,7 |
| Ксенон (Xe) | 131,3 |
| Метан (CH4) | 16,04 |
| Метиламин (CH5N) | 31,06 |
| Метиловый спирт (CH4O) | 32,04 |
| Неон (Ne) | 20,183 |
| Нитрозилхлорид (NOCl) | 65,465 |
| Озон (O3) | 48,00 |
| Окись азота (NO) | 30,008 |
| Окись углерода (CO) | 28,01 |
| Н-октан ( C8H18) | 114,22 |
| Н-пентан ( C5H12) | 72,14 |
| Изо-пентан ( C5H12) | 72,14 |
| Пропан ( C3H8) | 44,09 |
| Пропилен ( C3H6) | 42,08 |
| Селеновая кислота (H2Se) | 80,968 |
| Сернистый газ (SO2) | 64,06 |
| Сернистый ангидрид (SO3) | 80,06 |
| Сероводород (H2S) | 34,08 |
| Вещество (Газ) и его химическая формула | Молярная масса, г/моль = кг/кмоль |
| Фосфористый водород (PH3) | 34,04 |
| Фреон 11 (CF3CI) | 137,40 |
| Фреон-12 (CF2CI2) | 120,92 |
| Фреон-13 (CFCI3) | 114,47 |
| Фтор (F2) | 38,00 |
| Фтористый кремний (SiF4) | 104,06 |
| Фтористый метил (CH3F) | 34,03 |
| Хлор (Cl2) | 70,914 |
| Хлористый водород (HCl) | 36,465 |
| Хлористый метил (CH3Cl) | 50,49 |
| Хлороформ (CHCl3) | 119,39 |
| Циан (C2N2) | 52,04 |
| Цианистая кислота (HCN) | 27,026 |
| Этан (C2H6) | 30,07 |
| Этиламин (C2H7N) | 45,08 |
| Этилен (C2H4) | 28,05 |
| Этиловый спирт (C2H6O) | 46,07 |
| Хлористый этил (C2H5Cl) | 64,52 |












![{displaystyle {mathsf {2SO_{2}+O_{2}{xrightarrow[{Pt}]{450^{o}C}}2SO_{3}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/eb2802a01539be827b772f6db4a2f3fb78ef3c80)





