Как правильно рассчитать константу диссоциации слабого электролита
Задача 94.
Концентрация ионов Н+ в 0,1 М растворе СН3СООН равна 1,3 · 10–3 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(СН3СООН) = 0,1 моль/дм3;
[H+] = 1,3 · 10–3 моль/дм3;
KD(CH3COOH) = ?
α = ?
1. Вычисление степень диссоциации уксусной кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(CH3COOH) = (1,3 · 10–3)/0,1 = 1,3 · 10–2 или 1,3%.
2. Вычисление константы диссоциации уксусной кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 – α) = α2CM/(1 – α).
Тогда
KD(СН3СООН) = [(α)2 · СМ(СН3СООН)]/(1 – α) = [(1,3 · 10–2)2 · 0,1]/(1 – 1,3 · 10–2) =
= 0,0000169/0,987 = 0,0000171 = 1,71 · 10–5.
Ответ: KD(СН3СООН) = 1,71 · 10–5; альфа = 1,3%.
Задача 95.
Вычислите константу диссоциации НСООН, если в растворе w% = 0,46% и она диссоциирована на 4,2%.
Решение:
М(НСООН) = 46 г/моль;
w% = 0,46%;
α = 4,2% или 0,042
KD(НСООН) = ?
1. Вычисление концентрацию муравьиной кислоты
Концентрацию кислоты находим из вычисления:
СМ(НСООН) = [(w% · 1000г)/100%]/M(НСООН); СМ(НСООН) = [(0,46% · 1000г)/100%]/46 г/моль = 0,1 моль/дм3.
2. Вычисление константы диссоциации НСООН
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 – α) = α2CM/(1 – α).
Тогда
KD(НСООН) = [(0,042)2 · 0,1]/(1 – 0,042) = 0,0001764/0,958 = 0,000184 или 1,84 · 10–4.
Ответ: KD(НСООН) = 1,84 · 10–4.
Задача 96.
Вычислите константу диссоциации диметиламина, если в 0,2 М растворе он диссоциирован на 7,42%.
Решение:
M[(CH3)2NH] = 45,08 г/моль;
CM[(CH3)2NH] = 0,2 М;
α = 7,42% или 0,0742.
1. Вычисление константы диссоциации (CH3)2NH
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 – α) = α2CM/(1 – α).
Тогда
KD[(CH3)2NH] = [(0,0742)2 · 0,2]/(1 – 0,0742) = 0,0011/0,9258 = 0,0012 или 1,20 · 10–3.
Ответ: KD[(CH3)2NH] = 1,20 · 10–3.
Задача 97.
Концентрация ионов Н+ в 0,2 М растворе C2H5COOH равна 1,2 · 10–2 моль/дм3. Вычислите константу и степень диссоциации кислоты.
Решение:
СМ(C2H5COOH) = 0,2 моль/дм3;
[H+] = 1,2 · 10–2 моль/дм3;
KD(C2H5COOH) = ?
α = ?
1. Вычисление степень диссоциации этановой кислоты
Для расчета будем использовать формулу: [H+] = СМ · α
Тогда
α = [H+]/CM(C2H5COOH) = (1,2 · 10–2)/0,2 = 6,0 · 10–2 или 6%.
2. Вычисление константы диссоциации этановой кислоты
В случае слабых электролитов константа диссоциации определяется по формуле:
KD = (αCM · αCM)/CM(1 – α) = α2CM/(1 – α).
Тогда
KD(C2H5COOH) = [(α)2 · СМ(СН3СООН)]/(1 – α) = [(6,0 · 10–2)2 · 0,2]/(1 – 6,0 · 10–2) = 0,00072/0,94 = 0,0000171 = 7,7 · 10-4.
Ответ: KD(C2H5COOH) = 7,7 · 10-4; α = 0,06%.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Степень диссоциации
Классификация электролитов
Диссоциация электролитов
Константа диссоциации
Примеры решения задач
Задачи для самостоятельного решения
Степень диссоциации
Вещества, которые в растворах или расплавах полностью или частично распадаются на ионы, называются электролитами.
Степень диссоциации α — это отношение числа молекул, распавшихся на ионы N′ к общему числу растворенных молекул N:
α = N′/N
Степень диссоциации выражают в процентах или в долях единицы. Если α =0, то диссоциация отсутствует и вещество не является электролитом. В случае если α =1, то электролит полностью распадается на ионы.
Классификация электролитов
Согласно современным представлениям теории растворов все электролиты делятся на два класса: ассоциированные (слабые) и неассоциированные (сильные). Неассоциированные электролиты в разбавленных растворах практически полностью диссоциированы на ионы. Для этого класса электролитов a близко к единице (к 100 %). Неассоциированными электролитами являются, например, HCl, NaOH, K2SO4 в разбавленных водных растворах.
Ассоциированные электролиты подразделяются на три типа:
-
-
- Слабые электролиты существуют в растворах как в виде ионов, так и в виде недиссоциированных молекул. Примерами ассоциированных электролитов этой группы являются, в частности, Н2S, Н2SO3, СН3СOОН в водных растворах.
- Ионные ассоциатыобразуются в растворах путем ассоциации простых ионов за счет электростатического взаимодействия. Ионные ассоциаты возникают в концентрированных растворах хорошо растворимых электролитов. В результате в растворе находятся как простые ионы, так и ионные ассоциаты. Например, в концентрированном водном растворе КCl образуются простые ионы К+, Cl— , а также возможно образование ионных пар (К+Cl— ), ионных тройников (K2Cl+, KCl2— ) и ионных квадруполей (K2Cl2, KCl32- , K3Cl2+).
- Комплексные соединения(как ионные, так и молекулярные), внутренняя сфера которых ступенчато диссоциирует на ионные и (или) молекулярные частицы.
Примеры комплексных ионов: [Cu(NH3)4]2+, [Fe(CN)6]3+, [Cr(H2O)3Cl2]+.
-
При таком подходе один и тот же электролит может относиться к различным типам в зависимости от концентрации раствора, вида растворителя и температуры. Подтверждением этому являются данные, приведенные в таблице.
Таблица. Характеристика растворов KI в различных растворителях
| Концентрация электролита, С, моль/л | Температура
t,оС |
Растворитель | Тип электролита |
| 0,01 | 25 | Н2О | Неассоциированный (сильный) |
| 5 | 25 | Н2О | Ионный ассоциат |
| 0,001 | 25 | С6Н6 | Ассоциированный (слабый) |
Приближенно, для качественных рассуждений можно пользоваться устаревшим делением электролитов на сильные и слабые. Выделение группы электролитов “средней силы” не имеет смысла. Эти электролиты являются ассоциированными. К слабым электролитам обычно относят электролиты, степень диссоцииации которых мала α<<1.
Таким образом, к сильным электролитам относятся разбавленные водные растворы почти всех хорошо растворимых в воде солей, многие разбавленные водные растворы минеральных кислот (НСl, HBr, НNО3, НСlO4 и др.), разбавленные водные растворы гидроксидов щелочных металлов. К слабым электролитам принадлежат все органические кислоты в водных растворах, некоторые водные растворы неорганических кислот, например, H2S, HCN, H2CO3, HNO2, HСlO и др. К слабым электролитам относится и вода.
Диссоциация электролитов
Уравнение реакции диссоциации сильного электролита можно представить следующим образом. Между правой и левой частями уравнения реакции диссоциации сильного электролита ставится стрелка или знак равенства:
HCl → H+ + Cl—
Na2SO3 = 2Na+ + SO32-
Допускается также ставить знак обратимости, однако в этом случае указывается направление, в котором смещается равновесие диссоциации, или указывается, что α≈1. Например:
NaOH → Na+ + OH—
Диссоциация кислых и основных солей в разбавленных водных растворах протекает следующим образом:
NaHSO3 → Na+ + HSO3—
Анион кислой соли будет диссоциировать в незначительной степени, поскольку является ассоциированным электролитом:
HSO3— → H+ + SO32-
Аналогичным образом происходит диссоциация основных солей:
Mg(OH)Cl → MgOH+ + Cl—
Катион основной соли подвергается дальнейшей диссоциации как слабый электролит:
MgOH+ → Mg2+ + OH—
Двойные соли в разбавленных водных растворах рассматриваются как неассоциированные электролиты:
KAl(SO4)2 → K+ + Al3+ + 2SO42-
Комплексные соединения в разбавленных водных растворах практически полностью диссоциируют на внешнюю и внутреннюю сферы:
K3[Fe(CN)6] → 3K+ + [Fe(CN)6]3-
В свою очередь, комплексный ион в незначительной степени подвергается дальнейшей диссоциации:
[Fe(CN)6]3- → Fe3+ + 6CN—
Константа диссоциации
При растворении слабого электролита КА в растворе установится равновесие:
КА ↔ К+ + А—
которое количественно описывается величиной константы равновесия Кд, называемой константой диссоциации:
Kд = [К+] · [А—] /[КА] (2)
Константа диссоциации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем больше ионов в растворе слабого электролита. Например, в растворе азотистой кислоты HNO2 ионов Н+ больше, чем в растворе синильной кислоты HCN, поскольку К(HNO2) = 4,6·10— 4, а К(HCN) = 4,9·10— 10.
Для слабых I-I электролитов (HCN, HNO2, CH3COOH) величина константы диссоциации Кд связана со степенью диссоциации α и концентрацией электролита c уравнением Оствальда:
Кд = (α2·с)/(1-α) (3)
Для практических расчетов при условии, что α<<1 используется приближенное уравнение:
Кд = α2·с (4)
Поскольку процесс диссоциации слабого электролита обратим, то к нему применим принцип Ле Шателье. В частности, добавление CH3COONa к водному раствору CH3COOH вызовет подавление собственной диссоциации уксусной кислоты и уменьшение концентрации протонов. Таким образом, добавление в раствор ассоциированного электролита веществ, содержащих одноименные ионы, уменьшает его степень диссоциации.
Следует отметить, что константа диссоциации слабого электролита связана с изменением энергии Гиббса в процессе диссоциации этого электролита соотношением:
ΔGT0 = — RTlnKд (5)
Уравнение (5) используется для расчета констант диссоциации слабых электролитов по термодинамическим данным.
Примеры решения задач
Задача 1. Определите концентрацию ионов калия и фосфат-ионов в 0,025 М растворе K3PO4.
Решение. K3PO4 – сильный электролит и в водном растворе диссоциирует полностью:
K3PO4 → 3К+ + РО43-
Следовательно, концентрации ионов К+ и РО43- равны соответственно 0,075М и 0,025М.
Задача 2. Определите степень диссоциации αд и концентрацию ионов ОН— (моль/л) в 0,03 М растворе NH3·H2О при 298 К, если при указанной температуре Кд(NH3·H2О) = 1,76× 10— 5.
Решение. Уравнение диссоциации электролита:
NH3·H2О → NH4+ + OH—
Концентрации ионов: [NH4+] = αС ; [OH—] = αС , где С – исходная концентрация NH3·H2О моль/л. Следовательно:
Kд = αС · αС /(1 — αС)
Поскольку α << 1, то:
Кд ≈ α 2С
Константа диссоциации зависит от температуры и от природы растворителя, но не зависит от концентрации растворов NH3·H2О. Закон разбавления Оствальда выражает зависимость α слабого электролита от концентрации.
α = √(Кд / С) = √(1,76× 10— 5 / 0,03) = 0,024 или 2,4 %
[OH—] = αС, откуда [OH— ] = 2,4·10— 2·0,03 = 7,2·10-4 моль/л.
Задача 3. Определите константу диссоциации уксусной кислоты, если степень диссоциации CH3CОOH в 0,002 М растворе равна 9,4 %.
Решение. Уравнение диссоциации кислоты:
CH3CОOH → СН3СОО— + Н+.
α = [Н+] / Сисх(CH3CОOH)
откуда [Н+] = 9,4·10—2·0,002 = 1,88·10-4 М.
Так как [CH3CОO—] = [Н+] и [CH3CОOH] ≈ Сисх(CH3CОOH), то:
Kд = [Н+]2 / Сисх(CH3CОOH)
Константу диссоциации можно также найти по формуле: Кд ≈ α 2С.
Задача 4. Константа диссоциации HNO2 при 298К равна 4,6× 10— 4. Найдите концентрацию азотистой кислоты, при которой степень диссоциации HNO2 равна 5 %.
Решение.
Кд =α 2С , откуда получаем Сисх(HNO2) = 4,6·10— 4/(5·10— 2)2 = 0,184 М.
Задача 5. На основе справочных данных рассчитайте константу диссоциации муравьиной кислоты при 298 К.
Решение. Уравнение диссоциации муравьиной кислоты
НСООН →Н+ + СООН—
В “Кратком справочнике физико–химических величин” под редакцией А.А. Равделя и А.М. Пономаревой приведены значения энергий Гиббса образований ионов в растворе, а также гипотетически недиссоциированных молекул. Значения энергий Гиббса для муравьиной кислоты и ионов Н+ и СООН— в водном растворе приведены ниже:
| Вещество, ион | НСООН | Н+ | СООН— |
| ΔGT0, кДж/моль | — 373,0 | 0 | — 351,5 |
Изменение энергии Гиббса процесса диссоциации равно:
ΔGT0 = — 351,5- (- 373,0) = 21,5 кДж/моль.
Для расчета константы диссоциации используем уравнение (5). Из этого уравнения получаем:
lnKд = — Δ GT0/RT= — 21500/(8,31 298) = — 8,68
Откуда находим: Kд = 1,7× 10— 4.
Задачи для самостоятельного решения
1. К сильным электролитам в разбавленных водных растворах относятся:
- СН3СOOH
- Na3PO4
- NaCN
- NH3
- C2H5OH
- HNO2
- HNO3
13.2. К слабым электролитам в водных растворах относятся:
- KAl(SO4)2
- NaNO3
- HCN
- NH4Cl
- C2H5OH
- H2SO3
- H2SO4
3. Определите концентрацию ионов NH4+ в 0,03 М растворе (NH4)2Fe(SO4)2;
4. Определите концентрацию ионов водорода в 6 мас.% растворе H2SO4, плотность которого составляет 1,038 г/мл. Принять степень диссоциации кислоты по первой и второй ступеням равной 100 %.
5. Определите концентрацию гидроксид-ионов в 0,15 М растворе Ba(OH)2.
6. Степень диссоциации муравьиной кислоты в 0,1 М растворе равна 4 %. Рассчитайте Концентрацию ионов водорода в этом растворе и константу диссоциации НСООН.
7. Степень диссоциации муравьиной кислоты в водном растворе увеличится при:
а) уменьшении концентрации HCOOH;
б) увеличении концентрации HCOOH;
в) добавлении в раствор муравьиной кислоты HCOONa;
г) добавлении в раствор муравьиной кислоты НCl.
8. Константа диссоциации хлорноватистой кислоты равна 5× 10— 8. Определите концентрацию HClO, при которой степень диссоциации HClO равна 0,5 %, и концентрацию ионов Н+ в этом растворе.
9. Вычислите объем воды, который необходимо добавить к 50 мл 0,02 М раствора NH3·H2О, чтобы степень диссоциации NH3·H2О увеличилась в 10 раз, если Кд(NH4OH) = 1,76·10— 5.
10. Определите степень диссоциации азотистой кислоты в 0,25 М растворе при 298 К, если при указанной температуре Кд(HNO2) = 4,6× 10— 4.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 31 августа 2021 года; проверки требует 71 правка.
У этого термина существуют и другие значения, см. Константа.
Константа диссоциации кислоты Ka (также известная как константа кислотности) — константа равновесия реакции диссоциации кислоты на катион водорода и анион кислотного остатка. Для многоосновных кислот, диссоциация которых проходит в несколько стадий, оперируют отдельными константами для разных стадий диссоциации, обозначая их как Ka1, Ka2 и т. д. Чем больше значение Ka, тем больше молекул диссоциирует в растворе и, следовательно кислота более сильная.
Примеры расчета[править | править код]
Одноосновная кислота[править | править код]
| Реакция | Ka |
|---|---|

|
![{displaystyle K_{{ce {a}}}={frac {[{ce {A^-}}][{ce {H+}}]}{{ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c21fe924187bc7d37588add5f341b1078833e09)
|
где A– — условное обозначение аниона кислоты, [HA] — равновесная концентрация в растворе частицы HA.
Двухосновная кислота[править | править код]
| Реакция | Ka |
|---|---|

|
![K_{a1} = {left[ H^+ right] left[ HA^- right] over left[ H_2A right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2e863392d0d4cee771806c0c9d92a889419809ce)
|

|
![K_{a2} = {left[ H^+ right] left[ A^{2-} right] over left[ HA^- right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a8164a0d8570fb170ab8dc3ec9f1fdea61fdb28)
|
Фигурирующая в выражениях концентрация [H2A] — это равновесная концентрация недиссоциировавшей кислоты, а не изначальная концентрация кислоты до её диссоциации.
Величины pKa и pH[править | править код]
Чаще вместо самой константы диссоциации 


.
Величины pKa и pH связаны уравнением Гендерсона — Хассельбаха.
Уравнение Гендерсона — Хассельбаха[править | править код]
Преобразование уравнения[править | править код]
Пусть



|

|

|

|

|

|

|

|
Преобразуем уравнение
![{displaystyle {ce {pH}}=mathrm {p} K_{mathrm {a} }+lg left(mathrm {frac {[A^{-}]}{[HA]}} right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9629f69c46b4bc19ae8dc5247fdebd352c49a47e)


Можно заметить, что при 




|

|
В более кислой среде диссоциация кислоты уменьшается | ![{displaystyle [A^{-}]<[HA]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/201d1def47ab475d61324c303a92a7ebc3250a44)
|

|

|
Равновесие концентраций кислоты и её соли | ![{displaystyle [A^{-}]=[HA]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/031203f1a841069368f93efd675de837ca6ce1b6)
|

|

|
В более щелочной среде диссоциация кислоты увеличивается | ![{displaystyle [A^{-}]>[HA]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9ea7c1e23781e8480fab99ad497f97693b3ed434)
|
Другая связь pKa и pH[править | править код]

|

|

|

|

|

|

|

|
![{displaystyle K={[A^{-}][H^{+}] over [HA]}={[H^{+}]^{2} over [HA]}, [H^{+}]={sqrt {mathrm {K_{a}c} }}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/edbd927f4effa53ebcf3d228cb33b71ea5379589)

пример нахождения pH[править | править код]
Найти pH раствора 0,1 M Na2CO3
pKa1(H2CO3) = 6.3696
pKa2(H2CO3) = 10.3298
Решение:
Na2CO3 + H2O = NaOH + NaHCO3

откуда получаем


Значение pH > 7 означает, что соль Na2CO3 даёт щелочную среду
Константа диссоциации основания Kb[править | править код]


| Реакция | K |
|---|---|

|
![{displaystyle K_{{ce {a}}}={frac {[{ce {A^-}}][{ce {H+}}]}{{ce {[HA]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1c21fe924187bc7d37588add5f341b1078833e09)
|

|
![{displaystyle K_{b}={frac {[{mathsf {BH^{+}}}]cdot [{mathsf {OH^{-}}}]}{[{mathsf {B}}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/51e04dfbb17bc371ca2e05d7fe7a1e5be4cd9dae)
|



Константы диссоциации некоторых соединений[править | править код]
Кислотность воды pKa (H2O) = 15,74
Чем больше pKa , тем более основное соединение; чем меньше pKa , тем соединение более кислотное.
Например, по значению pKa можно понять, что спирты проявляют основные свойства (их pKa больше, чем у воды), а фенолы проявляют кислотные свойства.
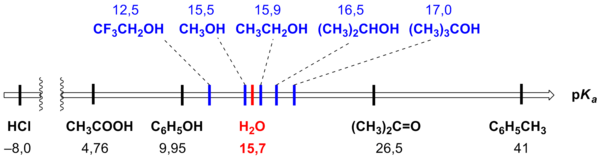
Также по pKa можно установить ряд сил кислот, приведённый в российских школьных учебниках
| Название | Кислота | pKa1 | pKa2 | pKa3 |  при С = 1 моль/л, % при С = 1 моль/л, %
|
|
|---|---|---|---|---|---|---|
| Сильные
кислоты |
Йодоводородная | HI | -10 | 100 | ||
| Хлорная | HClO4 | -10 | 100 | |||
| Бромоводородная | HBr | -9 | 100 | |||
| Соляная (хлороводородная) | HCl | -7 | 100 | |||
| Серная | H2SO4 | -3 | 1.92 | 99,90 | ||
| Селеновая | H2SeO4 | -3 | 1.9 | 99,90 | ||
| Гидроксоний | H3O+ | -1.74 | 15.74 | 21 | 98,24 | |
| Азотная | HNO3 | -1.4 | 96,31 | |||
| Хлорноватая | HClO3 | -1 | 91,61 | |||
| Иодноватая | HIO3 | 0.8 | 32,67 | |||
| Средние
кислоты |
Сульфаминовая | NH2SO3H | 0.99 | 27,28 | ||
| Щавелевая | H2C2O4 | 1.42 | 4.27 | 17,69 | ||
| Йодная | H5IO6 | 1.6 | 14,64 | |||
| Фосфористая | H3PO3 | 1.8 | 6.5 | 11,82 | ||
| Сернистая | H2SO3 | 1.92 | 7.20 | 10,38 | ||
| Гидросульфат | HSO4– | 1.92 | 10,38 | |||
| Фосфорноватистая | H3PO2 | 2.0 | 9,51 | |||
| Хлористая | HClO2 | 2.0 | 9,51 | |||
| Фосфорная | H3PO4 | 2.1 | 7.12 | 12.4 | 8,52 | |
| Гексаакважелеза (III) катион | [Fe(H2O)6]3+ | 2.22 | 7,47 | |||
| Мышьяковая | H3AsO4 | 2.32 | 6.85 | 11.5 | 6,68 | |
| Селенистая | H2SeO3 | 2.6 | 7.5 | 4,89 | ||
| Теллуристая | H2TeO3 | 2.7 | 7.7 | 4,37 | ||
| Фтороводородная (плавиковая) | HF | 3 | 3,11 | |||
| Теллуроводородная | H2Te | 3 | 12.16 | 3,11 | ||
| Слабые
кислоты |
Азотистая | HNO2 | 3.35 | 2,09 | ||
| Уксусная | CH3COOH | 4.76 | 0,4160 | |||
| Гексаакваалюминия (III) катион | [Al(H2O)6]3+ | 4.85 | 0,3751 | |||
| Угольная | H2CO3 | 6.37 | 10.33 | 0,0653 | ||
| Сероводородная | H2S | 6.92 | 13 | 0,0347 | ||
| Дигидрофосфат | H2PO4– | 7.12 | 12.4 | 0,0275 | ||
| Хлорноватистая | HClO | 7.25 | 0,0237 | |||
| Ортогерманиевая | H4GeO4 | 8.6 | 12.7 | 0,0050 | ||
| Бромноватистая | HBrO | 8.7 | 0,0045 | |||
| Ортотеллуровая | H6TeO6 | 8.8 | 11 | 15 | 0,0040 | |
| Мышьяковистая | H3AsO3 | 9.2 | 0,0025 | |||
| Синильная (циановодородная) | HCN | 9.21 | 0,0025 | |||
| Ортоборная | H3BO3 | 9.24 | 0,0024 | |||
| Аммоний | NH4+ | 9.25 | 0,0024 | |||
| Ортокремниевая | H4SiO4 | 9.5 | 11.7 | 12 | 0,0018 | |
| Гидрокарбонат | HCO3– | 10.4 | 6,31*10^-4 | |||
| Иодноватистая | HIO | 11.0 | 3,16*10^-4 | |||
| Пероксид водорода | H2O2 | 11.7 | 1,41*10^-4 | |||
| Гидрофосфат | HPO42- | 12.4 | 6,31*10^-5 | |||
| Гидросульфат | HS– | 14.0 | 1,00*10^-5 | |||
| Вода | H2O | 15.7 | 21 | 1,41*10^-6 | ||
| Основания | Гидроксид | OH– | 21 | 3,16*10^-9 | ||
| Фосфин | PH3 | 27 | 0 | |||
| Аммиак | NH3 | 33 | 0 | |||
| Метан | CH4 | 34 | 0 | |||
| Водород | H2 | 38.6 | 0 |
См. также[править | править код]
- Буферные растворы
- Титрование
- Степень диссоциации
- Изоэлектрическая точка
- pH
Примечания[править | править код]
- ↑ Primchem 2002. Дата обращения: 14 октября 2021. Архивировано 23 октября 2021 года.
На чтение 4 мин. Просмотров 270 Опубликовано 19.05.2021
Константа диссоциации кислоты является константой равновесия реакции диссоциации кислоты и обозначается K a . Эта константа равновесия является количественной мерой силы кислоты в растворе. K a обычно выражается в моль/л. Для удобства имеются таблицы констант диссоциации кислоты. Для водного раствора общая форма равновесной реакции:
HA + H 2 O ⇆ A – + H 3 O +
где НА представляет собой кислоту, которая диссоциирует в сопряженном основании кислоты A – и иона водорода, который объединяется с водой с образованием иона гидроксония H 3 O + . Когда концентрации HA, A – и H 3 O + больше не изменяются со временем, реакция в состоянии равновесия и константу диссоциации можно рассчитать:
K a = [A – ] [H 3 O + ]/[HA] [H 2 O]
где квадратные скобки обозначают концентрацию. Если кислота не очень концентрированная, уравнение упрощается, если концентрация воды остается постоянной:
HA ⇆ A – + H +
K a = [A – ] [H + ]/[HA]
Константа кислотной диссоциации также известна как константа кислотности или константа кислотной ионизации .
Содержание
- Связь Ka и pKa
- Использование Ka и pKa для прогнозирования равновесия и силы Кислоты
- Пример Ka
- Константа диссоциации кислоты от pH
Связь Ka и pKa
Связанное значение – pK a , который представляет собой логарифмическую константу диссоциации кислоты:
pK a = – log 10 K a
Использование Ka и pKa для прогнозирования равновесия и силы Кислоты
K a могут использоваться для измерения положения равновесия:
- Если K a велико, образование продуктов диссоциации благоприятно.
- Если K a мало, предпочтение отдается нерастворенной кислоте.
K a может использоваться для прогнозирования силы кислоты:
- Если K a велико (pK a мало), это означает, что кислота в основном диссоциирована, поэтому кислота сильная. Кислоты с pK a менее примерно -2 являются сильными кислотами.
- Если K a мало (pK a большой), диссоциация небольшая, поэтому кислота слабая. Кислоты с pK a в диапазоне от -2 до 12 в воде являются слабыми кислотами.
K a – лучший показатель силы кислоты, чем pH, потому что добавление воды в кислотный раствор не изменяет его константу кислотного равновесия, но изменяет H + концентрация ионов и pH.
Пример Ka
Константа кислотной диссоциации K a кислоты HB равна :
HB (aq) ↔ H + (aq) + B – (aq)
K a = [H + ] [B – ]/[HB]
Для диссоциации этановой кислоты:
CH 3 COOH (aq) + H 2 O (l) = CH 3 COO – (aq) + H 3 O + (aq)
K a = [CH 3 COO – (aq) ] [H 3 O + (aq) ]/[CH 3 COOH (aq) ]
Константа диссоциации кислоты от pH
Константу диссоциации кислоты можно определить, если известен pH. Например:
Рассчитайте константу диссоциации кислоты K a для 0,2 М водного раствора пропионовой кислоты (CH 3 CH 2 CO 2 H), для которого установлено значение pH 4,88.
Чтобы решить проблему, сначала напишите химическое уравнение реакции. Вы должны уметь распознать пропионовую кислоту как слабую кислоту (потому что это не одна из сильных кислот, и она содержит водород). Его диссоциация в воде:
CH 3 CH 2 CO 2 H + H 2 ⇆ H 3 O + + CH 3 CH 2 CO 2 –
Установите таблицу, чтобы отслеживать начальные условия, изменение условий и равновесную концентрацию видов. Иногда это называется таблицей ICE:
| CH 3 CH 2 CO 2 H | H 3 O + | CH 3 CH 2 CO 2 – | |
| Начальная концентрация | 0,2 M | 0 M | 0 M |
| Изменение концентрации | -x M | + x M | + x M |
| Равновесная концентрация | (0,2 – x) M | x M | x M |
x = [H 3 O +
Теперь используйте формула pH:
pH = -log [H 3 O + ]
-pH = log [H 3 O + ] = 4.88
[H 3 O + = 10 -4,88 = 1. 32 x 10 -5
Подставьте это значение для x, чтобы найти K a :
K a = [H 3 O + ] [CH 3 CH 2 CO 2 – ]/[CH 3 CH 2 CO 2 H]
K a = x 2 /(0,2 – x)
K a = (1,32 x 10 – 5 ) 2 /(0,2 – 1,32 x 10 -5 )
K a = 8,69 x 10 -10
-

Объяснение pH, pKa, Ka, pKb и Kb
-

-

Как рассчитать pH слабой кислоты
-

Что такое кислоты и основания?
-

Таблица общих значений Ka для слабых кислот
-

Взаимосвязь pH и pKa: уравнение Хендерсона-Хассельбаха
-

Определение и примеры Acid-Bas Индикатор
-

-

-

Вот как рассчитать значения pH
-

Теория кислот и оснований Бренстеда Лоури
-

Определение и примеры сильных кислот
-

Определение буфера в химии и биологии
-

Список Сильные и слабые кислоты
-

Как работает реакция нейтрализации при образовании соли
-

Пример химической проблемы полипротонной кислоты
-
Константа диссоциации
Кд
– константа диссоциации – это отношение
произведения концентрации диссоциированных
ионов к концентрации недиссоциированных
молекул электролита. Например,
К
 АK++A–
АK++A–
![]()
Кд
– показывает во сколько раз скорость
диссоциации больше скорости ассоциации.
Чем больше Кд,
тем сильнее электролит. Кд
зависит от природы электролита и
растворителя, температуры и не зависит
от концентрации раствора.
-
Взаимосвязь степени диссоциации и константы диссоциации
Напомним,
что
степень
диссоциации α – отношение числа молекул,
распавшихся на ионы, к общему числу
молекул, тогда для уравнения
К
 АK++A–
АK++A–
С∙
α – количество диссоциированных моль
электролита КА,
(С-(С∙
α)) – количество недиссоциированных
моль электролита КА.
Подставим
эти значения в формулу выражения Кд:

получим
![]() .
.
Это
математическое выражение закона
разбавления В. Оствальда (1888 г). Выражение
можно упростить, если принять α→0.
Величиной α в знаменателе пренебрегают
и уравнение принимает вид:
![]()
≈ α2C,
или α ≈ ![]()
Формулировка
закона разбавления В. Оствальда: «C
разбавлением раствора слабого электролита
степень диссоциации увеличивается».
-
Ионное произведение воды. Водородный показатель.
Согласно
протолитической теории Брэнстеда и
Лоури, вода не нейтральный растворитель.
Ее молекула может быть донором и
акцептором протонов, т.е. является
амфолитом. Явление, когда молекулы
одного и того же вещества одновременно
выступают в качестве кислоты и основания,
называются автопротолизом. Сокращенно
автопротолиз воды можно записать как
процесс ее диссоциации на ионы.
Н
 2О
2О
Н++ОН–
Применяя
закон действующих масс, запишем константу
диссоциации воды, значение которой
можно вычислить по данным измерения
электрической проводимости воды.
Кд=![]()
=1,8·10-16
(при 22ºС)
В
знаменателе дроби – концентрация
недиссоциированных молекул воды, которую
можно считать постоянной и определить
в 1 л, приняв массу 1л воды за 1000г.
[Н2О]=![]()
![]() =55,56
=55,56
молей,
тогда
Кд==1,8·10-16
Или
[Н+]·[ОН–]=1·10-14
моль-ион/л (ионное произведение воды
или константа автопротолиза).
Ионное
произведение воды
– произведение равновесных концентраций
катионов водорода и гидроксид ионов,
величина постоянная и равна 10-14
моль-ион/л.
Таким
образом, ионное произведение воды
позволяет для любого водного раствора
найти концентрацию ОН–
по
известной концентрации Н+,
и наоборот.
Кислотность
растворов обычно выражают через
концентрацию ионов Н+.
В нейтральных растворах
[Н+]=[ОН–]=√10-14=10-7моль-ион/л.
В кислых растворах [Н+]>10-7моль-ион/л,
в щелочных [Н+]<10-7моль-ион/л.
Чтобы
не писать числа с показателем степени,
кислотность раствора выражают через
отрицательный логарифм концентрации
ионов водорода, называя эту величину
водородным
показателем
и обозначая ее рН.
рН=-lg[Н+],
рОН=-lg[ОН–],
рН+рОН=14
Величина
рН впервые была введена датским химиком
С. Серенсоном. Буква «р» – начальная от
датского слова potenz
(степень), «Н»- символ водорода.
В
кислых растворах рН <7, в нейтральных
=7, в щелочных >7.
В
обычной лабораторной практике рН
измеряют с погрешностью 0,02. По этой
причине не следует приводить значение
рН раствора более чем с двумя цифрами
после запятой.
В
растворах слабых кислот НА кислотно-основное
равновесие имеет вид
Н
 А+Н2О
А+Н2О
Н3О++А–
или
Н
 А
А
Н++А–
Константа
кислотной диссоциации (константа
кислотности)
Ка
равна:
Ка=[Н+]·
[А–]/[НА]
В
растворе слабых оснований В кислотно-основное
равновесие имеет вид
В
 +
+
Н2О
ВН++ОН–
Где
В-основание, а ВН+
–
сопряженная В кислота. Константа
кислотно-основного равновесия в этом
случае в соответствии с законом
действующих масс равна:
Кb=[BН+]·
[ОН–]/[В]
Константу
Кb
называют константой диссоциации
основания В или константой
основности.
Величины
Ка
и
Кb
для
сопряженной кислотно-основной пары
связаны также простым соотношением.
Ка
Кb=10-14
или рКа+рКb=14,
рКb=14-рКа
Таким
образом, сила кислот и оснований может
быть выражена в общей шкале рКа,
подобно тому, как реакция среды
характеризуется водородным показателем
рН.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
