Как найти количество протонов, электронов,нуклонов и нейтронов?Напишите формулы и разьясните что к чему.
Daria
Знаток
(258),
закрыт
9 лет назад
Алла Калінчук
Мыслитель
(5437)
12 лет назад
число протонов=числу электронов =номеру в таблице Менделеева
чтоб найти число нейтронов, надо от массы-номер
напимер., Литий№3,масса 7.протонов, электронов будет по 3,нейтронов 7-3=4
Нуклоны это протоны+нейтроны (они в ядре) число нуклонов=массе, у лития 7
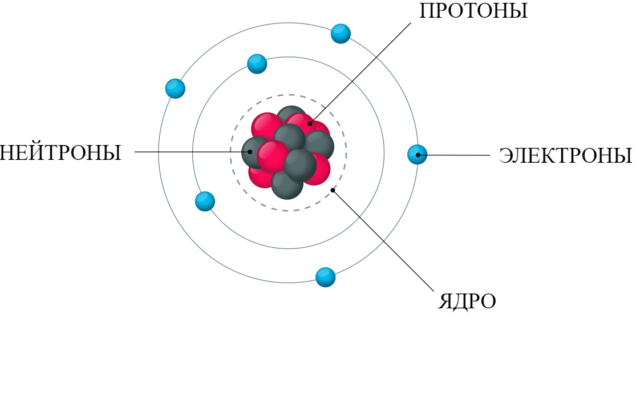
Введённое нами понятие атома рассматривает его как систему, в которой положительно заряженное ядро (состоит из протонов и нейтронов) окружено вращающимися вокруг него электронами. Рассмотрим само ядро (рис. 1). Контуры ядра не настолько округлые, но всё же ядром можно назвать область пространства в условном геометрическом центре ядра, где сосредоточены протоны и нейтроны. Протон — положительно заряженная частица, нейтрон — нейтральная частица. Вместе их удерживают внутриядерные силы (лучше пока о них много не знать) и внеядерное присутствие отрицательно заряженных электронов.

Рис. 1. Ядро
Ядра различных веществ содержат различное количество протонов. Данный факт является основой для таблицы Менделеева. В данной таблице у водорода () — первый элемент таблицы, присутствует один протон, далее ядро гелия (
) — второй элемент, имеет два протона и так далее. При этом количество нейтронов в одном и том же веществе может быть разным.
Введём некоторые понятия ядерной физики:
Количество нуклонов — суммарное количество протонов и нейтронов.
Изотопы — ядра одного и того же вещества, имеющие одно и то же количество протонов, но разное количество нейтронов.

Рис. 2. Обозначение ядра
Для рассмотрения элементов в курсе ядерной физики вводят специальные обозначения (рис. 2). Рассмотрим гипотетический элемент . В предложенной форме записи число снизу указывает на количество протонов, а сверху — количество нуклонов (протонов+нейтронов).
Примеры:
— ядро лития, состоящее из 3 протонов и 7-3=4 нейтронов,
— ядро алюминия, состоящее из 13 протонов и 27-13=14 нейтронов,
— ядро меди, состоящее из 29 протонов и 63-29=34 нейтронов.
Таким образом, исходя из таблицы Менделеева, можно сформировать внешний вид элемента (рис. 2) или, исходя из внешнего вида, определить сам элемент.
Исходя из введённых нами понятий и изображений, в ядерной физике школьного уровня выделяют три типа задач:
- задачи на уравнение радиоактивного распада
- задачи на ядерные реакции
- задачи, касающиеся энергии ядерных реакций
Как определить число нуклонов в ядре атома?
Число нуклонов в ядре атома равно массовому числу атома (относительная атомная масса химического элемента) или сумме протонов и нейтронов.
Как определить число протонов в атоме?
Число протонов в атоме равно заряду его ядра (обозначается как Z) или порядковому номеру элемента в периодической таблице Менделеева.
Как определить число нейтронов в атоме?
Очень просто!
N = A – Z
Где N – число нейтронов, A – атомная масса элемента (в целых числах), Z – заряд ядра атома или порядковый номер атома в периодической таблице Менделеева.
Развернутый ответ
Масса атома складывается из двух величин: масса протонов + масса нейтронов. Дело в том, что масса электронов пренебрежимо мала.
Масса нейтрона = 1,674 927 498 04(95)⋅10⁻²⁷ кг= 1,008 664 915 60(57) а.е.м.
Масса протона = 1,672 621 923 69(51)⋅10⁻²⁷ кг = 1,007276466621(53) а.е.м.
Масса электрона = 9,109383 7015(28)⋅10⁻³¹ кг = 0,000548579909065 а.е.м.
То есть даже 100 электронов дадут в сумме всего 0,0548579909065 а.е.м.
Первоначально Д. И. Менделеев в построении своей периодической таблицы исходил из атомных весов элементов. Однако, дальнейшее развитие науки показало, что свойства химических элементов находятся в прямой зависимости не от атомной массы химического элемента, а от заряда ядра его атома. Таким образом, в периодической таблице химические элементы выстроены в порядке возрастания заряда ядра атома и номер элемента в таблице соответствует заряду его ядра. А заряд ядра равен сумме протонов. То есть № (элемента) = Z (заряд ядра или число протонов).
Остаток массы ядра приходится на нейтроны. Поэтому чтобы определить число нейтронов в атоме нужно всего лишь вычесть из атомной массы число протонов, которое равно заряду ядра или порядковому номеру элемента в таблице Менделеева.
Примеры
Сколько протонов и нейтронов в атоме натрия?
Ar (Na) = 23 а.е.м.
Z (Na) = 11 (протонов)
N = Ar (Na) – Z (Na) = 23 – 11 = 12 (нейтронов)
Ответ: число протонов в атоме натрия равно 11, а число нейтронов в атоме натрия равно 12.
Сколько протонов и нейтронов в атоме фосфора?
Ar (P) = 31 а.е.м.
Z (P) = 15 (протонов)
N = Ar (P) – Z (P) = 31 – 15 = 16 (нейтронов)
Ответ: число протонов в атоме фосфора равно 15, а число нейтронов в атоме фосфора равно 16.
Сколько протонов и нейтронов в атоме золота?
Ar (Au) = 197 а.е.м.
Z (Au) = 79 (протонов)
N = Ar (Au) – Z (Au) = 197 – 79 = 118 (нейтронов)
Ответ: число протонов в атоме золота равно 79, а число нейтронов в атоме золота равно 118.
Сколько протонов и нейтронов в атоме кремния?
Ar (Si) = 28 а.е.м.
Z (Si) = 14 (протонов)
N = Ar (Si) – Z (Si) = 28 – 14 = 14 (нейтронов)
Ответ: число протонов и нейтронов в атоме кремния равно 14.
Сколько протонов и нейтронов в атоме углерода?
Ar (C) = 12 а.е.м.
Z (C) = 6 (протонов)
N = Ar (C) – Z (C) = 12 – 6 = 6 (нейтронов)
Ответ: число протонов и нейтронов в атоме углерода равно 6.
Сколько протонов и нейтронов в атоме калия?
Ar (K) = 39 а.е.м.
Z (K) = 19 (протонов)
N = Ar (K) – Z (K) = 39 – 19 = 20 (нейтронов)
Ответ: число протонов в атоме калия равно 19, а число нейтронов в атоме калия равно 20.
Сколько протонов и нейтронов в атоме железа?
Ar (Fe) = 39 а.е.м.
Z (Fe) = 19 (протонов)
N = Ar (Fe) – Z (Fe) = 56 – 26 = 30 (нейтронов)
Ответ: число протонов в атоме железа равно 19, а число нейтронов в атоме железа равно 30.
Сколько протонов и нейтронов в атоме алюминия?
Ar (Al) = 27 а.е.м.
Z (Al) = 13 (протонов)
N = Ar (Al) – Z (Al) = 27 – 13 = 14 (нейтронов)
Ответ: число протонов в атоме алюминия равно 13, а число нейтронов в атоме алюминия равно 14 .
Сколько протонов и нейтронов в атоме фтора?
Ar (F) = 19 а.е.м.
Z (F) = 9 (протонов)
N = Ar (F) – Z (F) = 19 – 9 = 10 (нейтронов)
Ответ: число протонов в атоме фтора равно 9, а число нейтронов в атоме фтора равно 10.
Сколько протонов и нейтронов в атоме хлора?
Ar (Cl) = 35 а.е.м.
Z (Cl) = 17 (протонов)
N = Ar (Cl) – Z (Cl) = 35 – 17 = 18 (нейтронов)
Ответ: число протонов в атоме хлора равно 17, а число нейтронов равно 18.
Сколько протонов и нейтронов в атоме кислорода?
Ar (O) = 16 а.е.м.
Z (O) = 8 (протонов)
N = Ar (O) – Z (O) = 16 – 8 = 8 (нейтронов)
Ответ: число протонов и нейтронов в атоме кислорода равно 8.
Сколько протонов и нейтронов в атоме серы?
Ar (S) = 32 а.е.м.
Z (S) = 16 (протонов)
N = Ar (S) – Z (S) = 32 – 16 = 16 (нейтронов)
Ответ: число протонов и нейтронов в атоме серы равно 16.
Сколько протонов и нейтронов в атоме магния?
Ar (Mg) = 32 а.е.м.
Z (Mg) = 16 (протонов)
N = Ar (Mg) – Z (Mg) = 24 – 12 = 12 (нейтронов)
Ответ: число протонов в атоме магния равно 16, а число нейтронов равно 12.
Сколько протонов и нейтронов в атоме цинка?
Ar (Zn) = 65 а.е.м.
Z (Zn) = 30 (протонов)
N = Ar (Zn) – Z (Zn) = 65 – 30 = 35 (нейтронов)
Ответ: число протонов в атоме цинка равно 30, а число нейтронов в атоме цинка равно 35.
Похожие вопросы:
– Какие атомы имеют одинаковое число нейтронов?
– Как определить общее число электронов в атоме?
Энергия связи ядра


4
Средняя оценка: 4
Всего получено оценок: 98.
4
Средняя оценка: 4
Всего получено оценок: 98.
Важнейшим понятием ядерной физики является понятие энергии связи ядра. Рассмотрим его подробнее.
Ядерные силы
По современным представлением ядро атома состоит из частиц, называемых элементарными – протонов и нейтронов (общее название – нуклоны).
Нуклоны похожи, но протон имеет положительный заряд и стабилен. Нейтрон не имеет заряда и в свободном состоянии распадается (период полураспада ~ 10 мин).
Казалось бы, существование ядер, состоящих из многих нуклонов невозможно – протоны, обладающие одинаковым зарядом, должны разлетаться. Нестабильные нейтроны должны распадаться.
Однако, в реальности многие атомы стабильны. Это происходит в результате ядерного взаимодействия. Ядерные силы на два порядка сильнее кулоновских сил, и их с запасом хватает на преодоление отталкивания протонов.
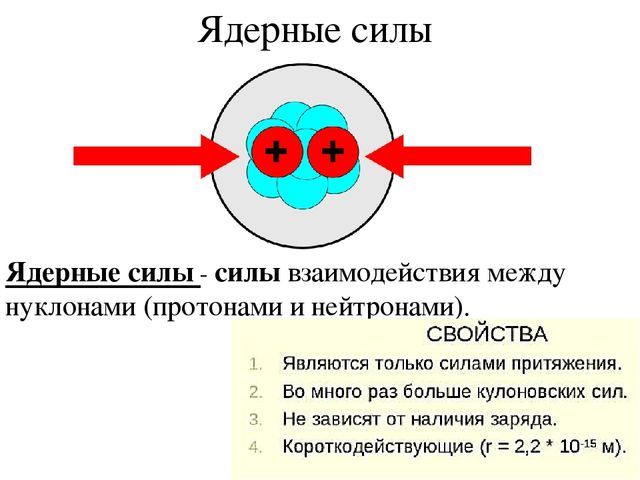
Но, если переносчики кулоновского взаимодействия – фотоны – не имеют массы покоя, и переносят взаимодействие на неограниченное расстояние, переносчики ядерного взаимодействия – глюоны или составленные из них мезоны – имеют массу, и осуществляют перенос взаимодействие на очень малые расстояния. В результате стабильными должны быть только ядра с очень небольшим числом протонов без нейтронов.
Энергия связи нуклонов
Возможность существований ядер с большим количеством протонов, а также стабильность нейтрона в составе ядра объясняется уровнем энергии связи. Ядерные силы удерживают нуклоны в ядре, и чтобы «извлечь» их оттуда, необходимо затратить энергию. Оказывается, что система из отдельных нуклонов обладает большей энергией, чем система, где нуклоны связаны. Любые процессы в Природе идут в сторону уменьшения энергии системы, поэтому нейтрон в составе ядра не распадается – это энергетически невыгодно, энергия связи удерживает его от распада. Эта же энергия удерживает протоны вместе. Лишь когда число нуклонов слишком велико, энергии связи ядра оказывается недостаточно – в этом случае протоны могут разлететься, и нейтроны также теряют стабильность.
Энергия связи – это энергия, которая выделяется при образовании ядра из отдельных частиц. Как только частицы оказываются в зоне действия ядерных сил – они устремляются друг к другу с огромным ускорением, излучая энергию связи в виде γ-квантов. Для того, чтобы расщепить ядро, необходимо вновь затратить эту энергию.
Уровень энергии связи
Для оценки энергии используется формула Эйнштейна, связывающая массу и энергию:
$$Е=mc^2$$
Теперь, если измерить массу отдельных частиц, а потом общую массу ядра – можно оценить энергию связи. Измерения показывают, что для легких элементов масса ядра оказывается меньше, чем сумма масс входящих в него частиц. А значит, подставив эту разницу в формулу энергии, можно получить формулу энергию связи ядра:
$$Е_{св} = (Zm_p+(A-Z)m_n -М_я)c^2$$
где:
- $Е_{св}$ – энергия связи ядра;
- $Z$ – число протонов в ядре (порядковый номер элемента);
- $А$ – общее число нуклонов в ядре (массовое число).
- $m_p$ – масса протона;
- $m_n$ – масса нейтрона;
- $М_я$ – масса ядра;
- с – скорость света.
Удельная энергия связи
Таким образом, наиболее устойчивыми должны оказаться ядра со средним числом нуклонов в ядре. Объясняется это тем, что энергия связи, приходящаяся на каждый нуклон, называемая удельной энергией связи, в таких ядрах максимальна. Прямые измерения подтверждают это.
Можно построить график зависимости значения удельной энергии связи от числа нуклонов в ядре:
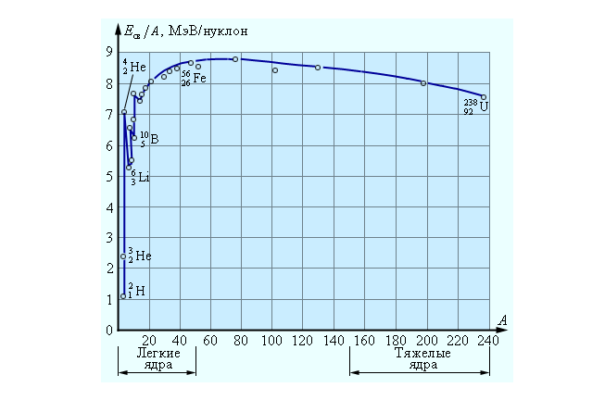
Если поглядеть на представленный график удельной энергии связи ядра, можно видеть, что реакции сливания ядер выгодны только для легких элементов вплоть до железа. Поэтому наиболее распространенными элементами в Природе (не считая простейшего водорода) являются Гелий-4 (дающий наибольший прирост удельной энергии связи при термоядерной реакции), и элементы с ядрами не тяжелее железа. Количество атомов даже стабильных, но более тяжелых элементов в Природе очень невелико.

Что мы узнали?
Частицы в ядре удерживаются ядерными силами. За счет энергии связи масса ядра получается меньше суммы масс входящих в него частиц. Наиболее стабильными являются ядра с максимальной удельной энергией связи.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
Пока никого нет. Будьте первым!
Оценка доклада
4
Средняя оценка: 4
Всего получено оценок: 98.
А какая ваша оценка?
Физика атомного ядра
Содержание
- Радиоактивность. Альфа-распад. Бета-распад. Гамма-излучение
- Закон радиоактивного распада
- Нуклонная модель ядра. Заряд ядра. Массовое число ядра
- Энергия связи нуклонов в ядре. Ядерные силы
- Ядерные реакции. Деление и синтез ядер
- Основные формулы по теме «Физика атомного ядра»
Радиоактивность. Альфа-распад. Бета-распад. Гамма-излучение
Радиоактивность – способность некоторых атомных ядер самопроизвольно превращаться в другие ядра с испусканием различных видов радиоактивных излучений.
Виды радиоактивности:
- естественная радиоактивность – это радиоактивность, которая наблюдается у неустойчивых изотопов, существующих в природе и имеющих в таблице Менделеева порядковый номер больше 83;
- искусственная радиоактивность – это радиоактивность, которая наблюдается у изотопов, полученных посредством ядерных реакций в лабораторных условиях.
Явление естественной радиоактивности открыл в 1896 году французский физик А. Беккерель. Проводя опыты с солями урана, он заметил, что они самопроизвольно испускают лучи неизвестной природы, которые проходят через бумагу, дерево, металлические пластины и делают воздух проводником электричества.
Радиоактивность данного химического элемента не зависит от того, является ли химический элемент чистым или входит в состав какоголибо химического соединения. Радиоактивность не зависит от внешних условий: температуры, освещения, давления. Это означает, что радиоактивность представляет собой внутреннее свойство атомов радиоактивного элемента.
Виды радиоактивных излучений
Излучение радиоактивных веществ имеет сложный характер и состоит из трех видов излучений. Если радиоактивное излучение пропустить через электрическое и магнитное поля, то оно распадается на три части, две из них отклоняются в противоположные стороны, а третий не отклоняется.
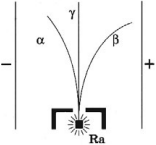
- ( alpha )-излучение представляет собой ядра атомов гелия ( {}^4_2He ), движущиеся со скоростью 107 м/с, несет положительный заряд;
- ( beta )-излучение представляет собой поток быстрых электронов, движущихся со скоростями, близкими к скорости света, несет отрицательный заряд;
- ( gamma )-излучение представляет собой электромагнитное излучение с длиной волны 10-12 м, заряда не имеет.
При одинаковой энергии частиц разные виды излучений неодинаково взаимодействуют с веществом.
Вследствие сильного ионизирующего действия глубина проникновения ( alpha )-частиц в твердых телах обычно очень мала. ( beta )-частицы менее эффективно взаимодействуют с атомами вещества, поэтому их проникающая способность больше, чем у ( alpha )-частиц. ( gamma )-кванты взаимодействуют с электронными оболочками атомов и имеют самую большую проникающую способность. Для защиты от ( gamma )-излучения необходимы защитные стены или оболочки толщиной несколько десятков сантиметров или даже метров.
Радиоактивный распад – самопроизвольный распад атомов радиоактивного вещества, в результате которого ядра одних химических элементов превращаются в ядра других химических элементов.
Превращения атомных ядер, которые сопровождаются испусканием ( alpha )- и ( beta )-частиц, называются соответственно ( alpha )— и ( beta )-распадом. Термина «( gamma )-распад» не существует, так как ( alpha )— и ( beta )-распад сопровождаются γ-излучением.
Распадающееся ядро Х называется материнским ядром, ядро продукта распада Y – дочерним ядром.
Правила радиоактивного смещения
Это правила, позволяющие установить, какое ядро возникает в результате распада данного материнского ядра.
- ( alpha )-распад:
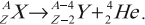
Если при радиоактивном превращении испускаются ( alpha )-частицы, то в результате такого превращения образуется ядро элемента, находящегося в таблице Менделеева на две клетки раньше исходного ядра плюс ядро атома гелия ( {}^4_2He ) (или ( alpha )-частица):
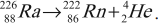
- ( beta )-распад.
Если при радиоактивном превращении испускаются ( beta )-частицы, то в результате такого превращения образуется ядро элемента, находящегося в таблице Менделеева:
– при ( beta^- )-распаде в следующей после исходного ядра клетке плюс электрон и антинейтрино (частица, не имеющая заряда и масса покоя которой равна нулю):
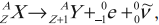
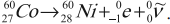
– при ( beta^+ )-распаде в предшествующей исходному ядру клетке плюс позитрон и нейтрино (частица, не имеющая заряда и масса покоя которой равна нулю):
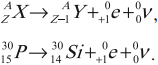
( gamma )-излучение сопровождает ( alpha )- и ( beta )-распады, а также возникает при ядерных реакциях, торможении частиц, их распаде и т. д.
( gamma )-излучение испускается дочерним ядром, которое в момент своего образования оказывается в возбужденном состоянии, а затем переходит в невозбужденное состояние.
Спектр ( gamma )-излучения является линейчатым.
Биологическое действие радиоактивных излучений
При облучении вещества ( alpha )-, ( beta )-, ( gamma )-частицами происходит возбуждение или ионизация атомов вещества. При этом сами частицы могут тормозиться, что сопровождается рентгеновским излучением. Кроме того, частицы могут упруго или неупруго соударяться с атомами вещества. Все это может привести к изменению свойств облучаемого вещества и к отрицательному воздействию на живые организмы. Вредное действие излучений на организм связано с образованием свободных химических радикалов и с мутацией в клетках, которые могут оказывать влияние на потомство, приводить к лучевой болезни и образованию злокачественных опухолей.
Методы защиты от внешнего радиоактивного облучения:
- удаление от источника излучения на большое расстояние;
- ограничение времени пребывания на загрязненной местности или вблизи радиоактивных источников;
- ограждение радиоактивных источников экранами из материалов, эффективно поглощающих радиоактивные излучения (графит, свинец, кадмий, бор).
Методы защиты от внутреннего радиоактивного облучения:
- дозиметрический контроль воздуха, осадков в близлежащей местности;
- дозиметрический контроль продуктов питания;
- применение веществ, ослабляющих воздействие радиоактивных излучений на организм.
В дозиметрии различают поглощенную и эквивалентную дозы.
Поглощенная доза равна энергии радиоактивного излучения, поглощенного единицей массы вещества.
Обозначение – ( D ), единица измерения в СИ – грей (Гр).
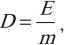
где ( E ) – энергия излучения; ( m ) – масса вещества.
Для характеристики биологического воздействия на организм используется коэффициент качества излучения ( (k) ), или коэффициент относительной биологической активности.
( k ) = 1 для ( gamma )-квантов, ( k ) = 3 для тепловых нейтронов, ( k ) = 10 для нейтронов с энергией порядка 0,5 МэВ.
Эквивалентная доза равна произведению коэффициента качества излучения и поглощенной дозы.
Обозначение – ( H ), единица измерения в СИ – зиверт (Зв).
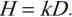
1 зиверт – это эквивалентная доза, при которой поглощенная доза равна 1 Гр при коэффициенте качества, равном 1.
Естественный фон составляет 2 мЗв за год.
Предельно допустимая доза – 5 мЗв за год.
При дозе 0,5 Зв наступает острое лучевое поражение организма.
При дозе 3–5 Зв – смертельный исход.
Допустимая доза облучения за среднее время жизни человека (70 лет) составляет 0,35 Зв.
Закон радиоактивного распада
Если имеется большое количество одинаковых радиоактивных ядер, то вероятность распада каждого из них в любой момент времени одинакова. Радиоактивный распад любого ядра является случайным процессом, поэтому момент его распада предсказать невозможно.
Однако для большого числа частиц, находящихся в образце вещества, выполняется статистический закон радиоактивного распада.
Закон радиоактивного распада:
число нераспавшихся атомных ядер при естественном радиоактивном распаде экспоненциально уменьшается с течением времени.
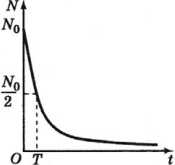
Период полураспада – это время, в течение которого распадается половина способных к распаду ядер.
В начальный момент времени ( t ) = 0, число атомных ядер ( N_0 ).
Через промежуток времени, равный периоду полураспада ( t=T_{1/2} ), число атомных ядер ( N=frac{N_0}{2} ).
Через промежуток времени, равный двум периодам полураспада ( t=2T_{1/2} ), число атомных ядер ( N=frac{N_0}{4}=frac{N_0}{2^2} ).
Через промежуток времени, равный ( n ) периодам полураспада ( t=nT_{1/2} ), число атомных ядер ( N=frac{N_0}{2^n} ).
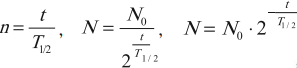
где ( N ) – число нераспавшихся атомных ядер к моменту времени ( t ); ( N_0 ) – начальное число атомных ядер; ( T_{1/2} ) – период полураспада.
На рисунке период полураспада соответствует времени, в течение которого число радиоактивных ядер (активность) уменьшается вдвое.
Нуклонная модель ядра. Заряд ядра. Массовое число ядра
Элементарные частицы:
- протон
Обозначение – ( p ), заряд ( q_p ) = 1,6·10-19 Кл, масса ( m_p ) = 1,67·10-27 кг. - нейтрон
Обозначение – ( n ), заряд отсутствует, масса ( m_n ) = 1,66·10-27 кг. - электрон
Обозначение – ( e ), заряд ( q_e ) = –1,6·10-19 Кл, масса ( m_e ) = 9,1·10-31 кг.
Нуклон – это частица, входящая в состав атомного ядра.
Атомное ядро любого химического элемента состоит из протонов и нейтронов.
Массовое число – это число, которое определяет количество протонов и нейтронов в ядре и равно округленному до целого значению массы атомного ядра в а.е.м.
Обозначение – ( A ), единица измерения – 1 атомная единица массы (а.е.м.).
Массовое число равно сумме количества протонов и нейтронов в ядре:
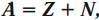
где ( A ) – массовое число; ( Z ) – количество протонов в ядре; ( N ) – количество нейтронов в ядре.
Зарядовое число – это число, которое показывает количество протонов в ядре.
Зарядовое число равно сумме зарядов протонов, входящих в состав ядра, выраженной в элементарных электрических зарядах.
Элементарный электрический заряд равен заряду электрона:
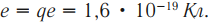
( Z ) – порядковый номер химического элемента в периодической таблице Менделеева.
Если некоторый химический элемент обозначить ( {}^A_ZX ), это означает, что в его ядре ( Z ) – протонов и ( N=A-Z ) – нейтронов.
Измерения массы атомов показали, что практически все химические элементы имеют изотопы.
Изотопы – это атомы одного и того же химического элемента, имеющие одинаковое количество протонов, но отличающиеся количеством нейтронов в ядре.
Изотопы имеют:
- одинаковый атомный номер ( Z ) (одинаковое число протонов);
- различные массовые числа ( A ) (различное число нуклонов);
- одинаковое строение электронных оболочек;
- близкие химические свойства.
Изотопы бывают:
- стабильные – это изотопы, которые сохраняются сколь угодно долго;
- радиоактивные – это изотопы, которые превращаются в ядра других элементов с течением времени.
Изотопы водорода: водород имеет два стабильных изотопа – водород ( {}^1_1H ), дейтерий ( {}^2_1H ) и один радиоактивный изотоп тритий ( {}^3_1H ).
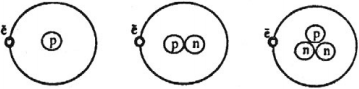
Энергия связи нуклонов в ядре. Ядерные силы
Между нуклонами ядра действуют самые мощные силы природы – ядерные силы.
Ядерные силы – это силы притяжения, связывающие протоны и нейтроны в атомном ядре и обеспечивающие существование устойчивых ядер.
Свойства ядерных сил:
- являются силами притяжения;
- являются короткодействующими силами (действуют на малых расстояниях, не превышающих 2·10-15 м; на таком расстоянии ядерные силы больше кулоновских приблизительно в 100 раз);
- обладают свойством зарядовой независимости (ядерные силы, действующие между двумя протонами, двумя нейтронами и между протоном и нейтроном, одинаковы);
- имеют свойство насыщения (каждый нуклон взаимодействует только с ограниченным числом ближайших к нему нуклонов, а не со всеми нуклонами ядра);
- не являются центральными (не действуют по линии, соединяющей центры взаимодействующих нуклонов).
Массу ядра можно точно определить с помощью масс-спектрографов, которые разделяют заряженные частицы с разными удельными зарядами с помощью электрических и магнитных полей.
Опытным путем было установлено, что благодаря действию сил притяжения масса ядра всегда меньше суммы масс протонов и масс нейтронов, входящих в состав этого ядра:
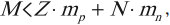
где ( M ) – масса ядра.
Дефект масс – это величина, равная разности суммы масс входящих в ядро нуклонов и массы ядра:
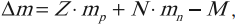
где ( Delta m ) – дефект масс.
Благодаря ядерным силам ядра атомов обладают огромной энергией связи.
Энергия связи – это энергия, которую необходимо затратить, чтобы разделить ядро на составляющие его нуклоны, или энергия, которая выделяется при образовании ядра из отдельных нуклонов:
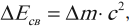
где ( Delta E_{св} ) – энергия связи, ( c ) – скорость света.
Если в формуле энергии связи массы протона и нейтрона выражены в килограммах, а скорость света – в метрах в секунду, то энергия связи будет измерена в джоулях. Однако в физике атома и атомного ядра энергию ядер и элементарных частиц чаще выражают в мегаэлектронвольтах (МэВ).
Энергетический эквивалент 1 а.е.м.
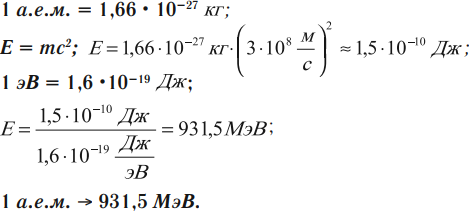
Поэтому энергию связи можно рассчитать следующим образом:
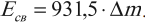
В этом случае энергия связи измеряется в мегаэлектронвольтах (МэВ).
Для характеристики прочности ядра используется величина, которая называется удельной энергией связи.
Удельная энергия связи – это энергия связи ядра, приходящаяся на один нуклон ядра:
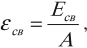
где ( A ) – массовое число.
Удельная энергия связи неодинакова для разных химических элементов и даже для изотопов одного и того же химического элемента. Удельная энергия связи нуклона в ядре меняется в среднем в пределах от 1 МэВ у легких ядер до 8,6 МэВ у ядер средней массы (с массовым числом ( A ) ≈ 100). У тяжелых ядер (( A ) ≈ 200) удельная энергия связи нуклона меньше, чем у ядер средней массы, приблизительно на 1 МэВ, так что их превращение в ядра среднего веса (деление на 2 части) сопровождается выделением энергии в количестве около 1 МэВ на нуклон, или около 200 МэВ на ядро. Превращение легких ядер в более тяжелые ядра дает еще больший энергетический выигрыш в расчете на нуклон.
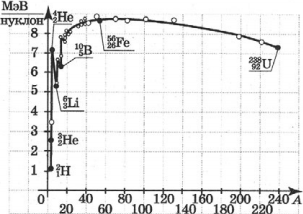
Зависимость удельной энергии связи от массового числа установили экспериментально. Из рисунка хорошо видно, что, не считая самых легких ядер, удельная энергия связи примерно постоянна и равна 8 МэВ/нуклон. Отметим, что энергия связи электрона и ядра в атоме водорода, равная энергии ионизации, почти в миллион раз меньше этого значения. Кривая на рисунке имеет слабо выраженный максимум. Максимальную удельную энергию связи (8,6 МэВ/нуклон) имеют элементы с массовыми числами от 50 до 60, т. е. железо и близкие к нему по порядковому номеру элементы. Ядра этих элементов наиболее устойчивы.
У тяжелых ядер удельная энергия связи уменьшается за счет возрастающей с увеличением ( Z ) кулоновской энергии отталкивания протонов. Кулоновские силы стремятся разорвать ядро.
Ядерные реакции. Деление и синтез ядер
Атомные ядра при взаимодействиях испытывают превращения. Эти превращения сопровождаются увеличением или уменьшением кинетической энергии участвующих в них частиц.
Ядерные реакции – это изменения атомных ядер при взаимодействии их с элементарными частицами или друг с другом.
Ядерные реакции происходят, когда частицы вплотную приближаются к ядру и попадают в сферу действия ядерных сил. Одноименно заряженные частицы отталкиваются друг от друга, поэтому сближение положительно заряженных частиц с ядрами (или ядер друг с другом) возможно, если этим частицам (или ядрам) сообщена достаточно большая кинетическая энергия. Эта энергия сообщается протонам, ядрам дейтерия, α-частицам и другим более тяжелым ядрам с помощью ускорителей.
Для осуществления ядерных реакций такой метод гораздо эффективнее, чем использование ядер гелия, испускаемых радиоактивными элементами. Во-первых, с помощью ускорителей частицам может быть сообщена энергия порядка 105 МэВ, т. е. гораздо большая той, которую имеют ( alpha )-частицы (максимально 9 МэВ). Во-вторых, можно использовать протоны, которые в процессе радиоактивного распада не появляются (это целесообразно потому, что заряд протонов вдвое меньше заряда α-частиц, и поэтому действующая на них сила отталкивания со стороны ядер тоже в 2 раза меньше). В-третьих, можно ускорить ядра более тяжелые, чем ядра гелия.
Наиболее распространенный вид ядерной реакции:
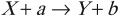
где ( X ) и ( Y ) – исходное и конечное ядра; ( a ) и ( b ) – бомбардирующая и испускающая частицы.
Эндотермическая реакция – это реакция с поглощением энергии:
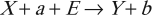
Экзотермическая реакция – это реакция с выделением энергии:
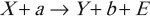
При ядерных реакциях выполняются следующие законы.
- Закон сохранения электрического заряда:
сумма электрических зарядов атомных ядер и частиц до реакции равна сумме электрических зарядов атомных ядер и частиц после реакции:
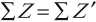
- Закон сохранения массового числа:
сумма нуклонов атомных ядер и частиц до реакции равна сумме нуклонов атомных ядер и частиц после реакции:
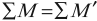
- Закон сохранения энергии.
Примеры ядерных реакций
- Первое наблюдавшееся превращение ядра (Ю. Резерфорд, 1919):
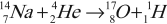
- Первая ядерная реакция на быстрых протонах (1932):
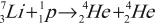
- Открытие нейтрона (Дж. Чедвик, 1932):
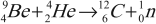
- Первое искусственное получение радиоактивного распада и открытие позитрона. Радиоактивный распад под действием ( alpha )-частиц наблюдал Ф. Жолио-Кюри:
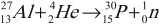
Изотоп фосфора оказался радиоактивным: его ядро распадается с испусканием позитрона и нейтрино:
Классификация ядерных реакций
Ядерные реакции классифицируются:
- по роду участвующих в них частиц – реакции под действием нейтронов, заряженных частиц, ( gamma )-квантов;
- по энергии вызывающих их частиц – реакции при малых, средних, высоких энергиях;
- по роду участвующих в них ядер – реакции на легких ядрах (А < 50), средних ядрах (50 < А < 100) и тяжелых ядрах (А > 100);
- по характеру происходящих ядерных превращений – реакции с испусканием нейтронов, заряженных частиц, реакции захвата.
Деление ядер – это деление атомного ядра урана на несколько более легких ядер (осколков), чаще всего на два ядра, близких по массе.
- Делиться могут только ядра некоторых тяжелых элементов.
- При делении ядер испускаются нейтроны и ( gamma )-лучи.
- При делении ядер выделяется большая энергия.
Механизм деления ядер (капельная модель)
В тяжелых ядрах действуют значительные ядерные силы, которые удерживают ядро от распада. Под влиянием поглощенного нейтрона ядро возбуждается и начинает деформироваться, приобретая вытянутую форму. Оно растягивается до тех пор, пока силы отталкивания половинок ядра не начинают преобладать над силами притяжения, действующими в перешейке. В результате ядро разрывается на два осколка X и Y.
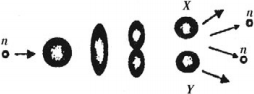
Под действием сил кулоновского отталкивания осколки разлетаются со скоростью, равной приблизительно 1/30 скорости света. Одновременно испускается излучение высокой частоты.
Цепная ядерная реакция – ядерная реакция деления тяжелых ядер нейтронами, в результате которой число нейтронов возрастает и поэтому может возникнуть самоподдерживающийся процесс деления.
В 1939 году было обнаружено, что при попадании нейтрона в ядро изотопа урана-235 происходит деление ядра на два или три осколка с испусканием 2–3 нейтронов:
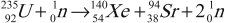
Эти нейтроны способны вызвать деление 2–3 новых ядер урана с испусканием 4–9 новых нейтронов и т. д., процесс может продолжаться самостоятельно, вовлекая все большее число новых ядер.
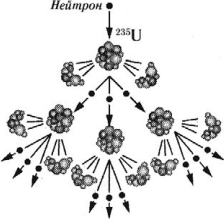
Условия протекания цепной ядерной реакции:
- должны отсутствовать примеси, поглощающие нейтроны;
- количество вещества, способного делиться, должно быть достаточным для того, чтобы образующиеся нейтроны могли соударяться с другими ядрами, не покидая объем, не испытывая взаимодействия;
- скорость нейтронов должна быть достаточной, чтобы вызвать деление ядер.
Минимальное количество вещества, необходимое для осуществления цепной ядерной реакции, называется критической массой.
Устройства, в которых осуществляются управляемые цепные ядерные реакции, называются ядерными реакторами.
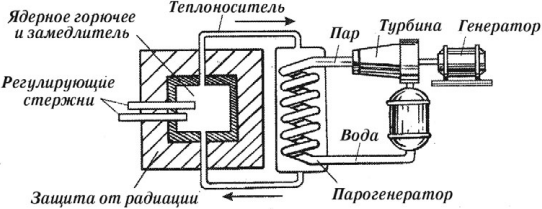
Основные элементы ядерного реактора:
- Ядерное горючее (сырьевые и делящиеся вещества в реакторах – изотопы урана, плутоний, торий).
- Замедлитель и отражатель нейтронов, которые способствуют увеличению числа медленных нейтронов, наиболее эффективных для развития цепной реакции деления (графит, тяжелая или обычная вода).
- Регулирующие стержни, которые вводят в активную зону реактора для поддержания стационарного режима реактора, так как быстрое развитие реакции сопровождается выделением большого количества тепла и перегревом реактора; стержни выполнены из материалов, сильно поглощающих тепловые нейтроны (из бора, кадмия).
- Теплоноситель, который необходим для отвода тепла, образующегося в реакторе (вода, жидкий натрий и др.).
- Защитные устройства, которые применяют для защиты персонала, обслуживающего реактор, от действия на организм нейтронных потоков и ( gamma )-лучей.
Термоядерный синтез
График зависимости удельной энергии связи нуклонов в ядре от массового числа показывает, что кроме реакции деления тяжелых ядер с выделением энергии идут реакции синтеза легких ядер.
Синтез ядер – это слияние ядер в одно ядро, сопровождающееся выделением энергии.
Для осуществления реакции синтеза легких ядер требуются высокие энергии сливающихся частиц, так как необходимо преодолеть кулоновское отталкивание. Этого можно достичь за счет высокой температуры вещества.
Термоядерная реакция – это реакция синтеза легких атомных ядер в более тяжелые, происходящая при сверхвысоких температурах (порядка 107 К и выше).
В природе термоядерные реакции происходят в недрах звезд.
При термоядерном синтезе энергетический выход на единицу массы топлива оказывается выше, чем при реакции деления тяжелых ядер урана.
Пример реакции синтеза:
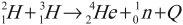
Синтез гелия из тяжелых изотопов водорода – дейтерия и трития – происходит при температуре около 5·107 К.
При синтезе 1 г гелия из дейтерия и трития выделяется 4,2·1011 Дж – такая же энергия выделяется при сгорании 10 т дизельного топлива.
Термоядерный синтез может стать одним из возможных альтернативных источников энергии. Поиск таких источников энергии важен, так как запасы нефти и газа на Земле ограничены.
В настоящее время ведется испытание установок для осуществления управляемых термоядерных реакций синтеза гелия из водорода. Запасы водорода на Земле практически неисчерпаемы. Количество дейтерия в океанической воде составляет примерно 4·1011 т, чему соответствует энергетический запас 1017 МВт·год. Наиболее заманчивой является возможность извлечения энергии дейтерия, содержащегося в обычной воде.
Основные формулы по теме «Физика атомного ядра»

Физика атомного ядра
3.1 (62.12%) 132 votes
