Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.

Основной закон светопоглощения
Суть фотометрического определения заключается в двух процессах:
- перевод определяемого вещества в поглощающее электромагнитные колебания соединение;
- замер интенсивности поглощения этих самых колебаний раствором исследуемого вещества.
Изменения в интенсивности потока света, проходящего через светопоглощающее вещество, будут вызываться также потерями света из-за отражения и рассеяния. Чтобы результат был достоверным, проводят параллельные исследования по замеру параметров при той же толщине слоя, в идентичных кюветах, с тем же растворителем. Так снижение интенсивности света зависит главным образом от концентрации раствора.
Уменьшение интенсивности света, пропущенного через раствор, характеризуют коэффициентом светопропускания (также принято называть его пропусканием) Т:
Т = I / I0, где:
- I — интенсивность света, пропущенного через вещество;
- I0 — интенсивность падающего пучка света.
Таким образом, пропускание показывает долю непоглощенного светового потока, проходящего через изучаемый раствор. Обратный алгоритм значения пропускания называют оптической плотностью раствора (D): D = (-lgT) = (-lg) * (I / I0) = lg * (I0 / I).
Это уравнение показывает, какие параметры являются главными для исследования. К ним относится длина волны света, толщина кюветы, концентрация раствора и оптическая плотность.
Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
I = I0 * 10-ε·С·ι, где:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I0 = 10-ε·С·ι.
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.

Ограничения применения закона
Этот раздел включает следующие пункты:
- Он справедлив исключительно для монохроматического света.
- Коэффициент ε связан с показателем преломления среды, особенно сильные отклонения от закона могут наблюдаться при анализе высококонцентрированных растворов.
- Температура при измерении оптической плотности должна быть постоянной (в рамках нескольких градусов).
- Световой пучок должен быть параллельным.
- рН среды должен быть постоянным.
- Закон применим для веществ, светопоглощающими центрами которых являются частицы одного вида.
Методы определения концентрации
Стоит рассмотреть метод градуировочного графика. Для его построения готовят ряд растворов (5-10) с различной концентрацией исследуемого вещества и замеряют их оптическую плотность. По полученным значениям выстраивают график зависимости D от концентрации. График является прямой линией, идущей от начала координат. Он позволяет легко определить концентрацию вещества по результатам проведенных измерений.
Также существует метод добавок. Применяется реже, чем предыдущий, но позволяет проанализировать растворы сложного состава, поскольку учитывает влияние дополнительных компонентов. Суть его состоит в определении оптической плотности среды Dx, содержащей определяемое вещество неизвестной концентрации Сх, с повторным анализом того же раствора, но с добавлением определенного количества исследуемого компонента (Сст). Величину Сх находят, используя расчеты или графики.

Условия проведения исследования
Чтобы фотометрические исследования давали достоверный результат, необходимо соблюдать несколько условий:
- реакция должна заканчиваться быстро и полностью, избирательно и воспроизводимо;
- окраска образующегося вещества должна быть устойчива во времени и не изменяться под действием света;
- исследуемое вещество берут в количестве, которого достаточно для перевода его в аналитическую форму;
- замеры оптической плотности проводят в том интервале длин волн, при котором различие в поглощении исходных реагентов и анализируемого раствора наибольшее;
- светопоглощение раствора сравнения принято считать оптическим нулем.
Оптическая плотность раствора
Колориметрия
Из оптических методов анализа в практике аналитических лабораторий наиболее широко применяются колориметрические методы (от лат. color — цвет и греч. μετρεω — измеряю). Колориметрические методы основаны на измерении интенсивности светового потока, прошедшего через окрашенный раствор.
В колориметрическом методе используются химические реакции, сопровождающиеся изменением цвета анализируемого раствора. Измеряя светопоглощение такого окрашенного раствора или сравнивая полученную окраску с окраской раствора известной концентрации, определяют содержание окрашенного вещества в испытуемом растворе.
Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества. Эта зависимость, называемая основным законом светопоглощения (или законом Бугера—Ламберта—Бера), выражается уравнением:
I = I0 10 – ε c l
где I – интенсивность света, прошедшего через раствор; I0 – интенсивность падающего на раствор света; ε- коэффициент светопоглощения, постоянная величина для каждого окрашенного вещества, зависящая от его природы; С – молярная концентрация окрашенного вещества в растворе; l – толщина слоя светопоглощающего раствора, см.
Физический смысл этого закона можно выразить следующим образом. Растворы одного и того же окрашенного вещества при одинаковой концентрации этого вещества и толщине слоя раствора поглощают равное количество световой энергии, т. е. светопоглощение таких растворов одинаковое.
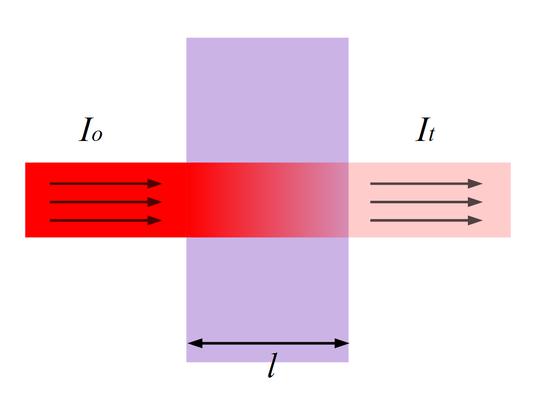
Для окрашенного раствора, заключенного в стеклянную кювету с параллельными стенками, можно сказать, что по мере увеличения концентрации и толщины слоя раствора его окраска увеличивается, а интенсивность света I, прошедшего через поглощающий раствор, уменьшается по сравнению с интенсивностью падающего света I0.
Рис.1 Прохождение света через кювету с исследуемым раствором.
Оптическая плотность раствора.
Если прологарифмировать уравнение основного закона светопоглощения и изменить знаки на обратные, то уравнение принимает вид:
Величина является очень важной характеристикой окрашенного раствора; ее называют оптической плотностью раствора и обозначают буквой A:
A = ε C l
Из этого уравнения вытекает, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Другими словами, при одинаковой толщине слоя раствора данного вещества оптическая плотность этого раствора будет тем больше, чем больше в нем содержится окрашенного вещества. Или, наоборот, при одной и той же концентрации данного окрашенного вещества оптическая плотность раствора зависит только от толщины его слоя. Отсюда может быть сделан следующий вывод: если два раствора одного и того же окрашенного вещества имеют различную концентрацию, одинаковая интенсивность окраски этих растворов будет достигнута при толщинах их слоев, обратно пропорциональных концентрациям растворов. Этот вывод очень важен, так как на нем основаны некоторые методы колориметрического анализа.
Таким образом, чтобы определить концентрацию (С) окрашенного раствора, необходимо измерить его оптическую плотность (A). Чтобы измерить оптическую плотность, следует измерить интенсивность светового потока.
Интенсивность окраски растворов можно измерять различными методами. Различают субъективные (или визуальные) методы колориметрии и объективные (или фотоколориметрические).
Визуальными называются такие методы, при которых оценку интенсивности окраски испытуемого раствора делают невооруженным глазом.
При объективных методах колориметрического определения для измерения интенсивности окраски испытуемого раствора вместо непосредственного наблюдения пользуются фотоэлементами. Определение в этом случае проводят в специальных приборах – фотоколориметрах, откуда и метод получил название фотоколориметрического.
Визуальные методы
К визуальным методам относятся:
1) метод стандартных серий;
2) метод дублирования (колориметрическое титрование);
3) метод уравнивания.
Метод стандартных серий. При выполнении анализа методом стандартных серий интенсивность окраски анализируемого окрашенного раствора сравнивают с окрасками серии специально приготовленных стандартных растворов (при одинаковой толщине поглощающего слоя).
Растворы в колориметрии обычно имеют интенсивную окраску, поэтому имеется возможность определять весьма небольшие концентрации или количества веществ. Однако это может сопровождаться определенными трудностями: так навески для приготовления серии стандартных растворов могут быть очень малы. Для преодоления этих трудностей готовят стандартный раствор А достаточно высокой концентрации, например 1 мг/мл. После этого путем разбавления из раствора А готовят стандартный раствор В значительно меньшей концентрации, а из него в свою очередь готовят серию стандартных растворов.
Для этого в пробирки или кюветы одинакового размера и одинакового цвета стекла пипеткой добавляются необходимые объемы растворов реагентов в нужной последовательности. Порции растворов определяемого вещества целесообразно добавлять из бюретки, т.к. их объемы будут различны для обеспечения различных концентраций в серии стандартных растворов. При этом начальный раствор должен содержать все компоненты, кроме определяемого вещества (нулевой раствор). В исследуемый раствор добавляют растворы необходимых реагентов. Все растворы доводят до постоянного объема, а затем визуально сравнивают интенсивность окраски исследуемого раствора с растворами серии стандартных растворов. Возможно совпадение интенсивности окраски с каким-либо раствором серии. Тогда считается, сто исследуемый раствор имеет такую же концентрацию или содержит столько же определяемого вещества. Если же интенсивность окраски покажется промежуточной между соседними растворами серии, концентрация или содержание определяемого компонента считают средним арифметическим между растворами серии.
Колориметрическое титрование (метод дублирования). Этот метод основан на сравнении окраски анализируемого раствора с окраской другого раствора— контрольного. Для приготовления контрольного раствора готовят раствор, содержащий все компоненты исследуемого раствора, за исключением определяемого вещества, и все употреблявшиеся при подготовке пробы реактивы, и к нему добавляют из бюретки стандартный раствор определяемого вещества. Когда этого раствора будет добавлено столько, что интенсивности окраски контрольного и анализируемого раствора уравняются, считают, что в анализируемом растворе содержится столько же определяемого вещества, сколько его было введено в контрольный раствор.
Метод уравнивания.Этот метод основан на уравнивании окрасок анализируемого раствора и раствора с известной концентрацией определяемого вещества — стандартного раствора. Существуют два варианта выполнения колориметрического определения этим методом.
По первому варианту уравнивание окрасок двух растворов с разной концентрацией окрашенного вещества проводят путем изменения толщины слоев этих растворов при одинаковой силе проходящего через растворы светового потока. При этом, несмотря на различие концентраций анализируемого и стандартного растворов, интенсивность светового потока, проходящего через оба слоя этих растворов, будет одинакова. Соотношение между толщинами слоев и концентрациями окрашенного вещества в растворах в момент уравнивания окрасок будет выражаться уравнением:
где l1 – толщина слоя раствора с концентрацией окрашенного вещества C1, а l2-толщина слоя раствора с концентрацией окрашенного вещества C2.
В момент равенства окрасок отношение толщин слоев двух сравниваемых растворов обратно пропорционально отношению их концентраций.
На основании приведенного уравнения, измерив толщину слоев двух одинаково окрашенных растворов и зная концентрацию одного из этих растворов, легко можно рассчитать неизвестную концентрацию окрашенного вещества в другом растворе.
Для измерения толщины слоя, через который проходит световой поток, можно применять стеклянные цилиндры или пробирки, а при более точных определениях специальные приборы — колориметры.
По второму варианту, для уравнивания окрасок двух растворов с различной концентрацией окрашенного вещества, через слои растворов одинаковой толщины пропускают световые потоки различной интенсивности.
В этом случае оба раствора имеют одинаковую окраску, когда отношение логарифмов интенсивностей падающих световых потоков равно отношению концентраций.
В момент достижения одинаковой окраски двух сравниваемых растворов, при равной толщине их слоев, концентрации растворов прямо пропорциональны логарифмам интенсивностей падающего на них света.
По второму варианту определение может быть выполнено только с помощью колориметра.
Теоретические основы определения оптической плотности раствора

Любая частица, будь то молекула, атом или ион, в результате поглощения кванта света переходит на более высокий уровень энергетического состояния. Чаще всего осуществляется переход из основного в возбужденное состояние. Это вызывает появление в спектрах определенных полос поглощения.
Поглощение излучения приводит к тому, что при пропускании его через вещество интенсивность этого излучения снижается при увеличении количества частиц вещества, обладающего некоторой оптической плотностью. Этот метод исследования предложил В. М. Севергин еще в 1795 году.
Наилучшим образом этот метод годится для реакций, где определяемое вещество способно переходить в окрашенное соединение, что вызывает изменение окраски исследуемого раствора. Измерив его светопоглощение или сравнив окраску с раствором известной концентрации, несложно найти процент содержания вещества в растворе.

Основной закон светопоглощения
Суть фотометрического определения заключается в двух процессах:
- перевод определяемого вещества в поглощающее электромагнитные колебания соединение;
- замер интенсивности поглощения этих самых колебаний раствором исследуемого вещества.
Изменения в интенсивности потока света, проходящего через светопоглощающее вещество, будут вызываться также потерями света из-за отражения и рассеяния. Чтобы результат был достоверным, проводят параллельные исследования по замеру параметров при той же толщине слоя, в идентичных кюветах, с тем же растворителем. Так снижение интенсивности света зависит главным образом от концентрации раствора.
Уменьшение интенсивности света, пропущенного через раствор, характеризуют коэффициентом светопропускания (также принято называть его пропусканием) Т:
- I — интенсивность света, пропущенного через вещество;
- I0 — интенсивность падающего пучка света.
Таким образом, пропускание показывает долю непоглощенного светового потока, проходящего через изучаемый раствор. Обратный алгоритм значения пропускания называют оптической плотностью раствора (D): D = (-lgT) = (-lg) * (I / I0) = lg * (I0 / I).
Это уравнение показывает, какие параметры являются главными для исследования. К ним относится длина волны света, толщина кюветы, концентрация раствора и оптическая плотность.

Закон Бугера-Ламберта-Бера
Он является математическим выражением, отображающим зависимость уменьшения интенсивности монохроматического потока света от концентрации светопоглощающего вещества и толщины жидкостного слоя, через который он пропущен:
I = I0 * 10 -ε·С·ι , где:
- ε — коэффициент поглощения света;
- С — концентрация вещества, моль/л;
- ι —толщина слоя анализируемого раствора, см.
Преобразовав, эту формулу можно записать: I / I0 = 10 -ε·С·ι .
Суть закона сводится к следующему: различные растворы одного и того же соединения при равной концентрации и толщине слоя в кювете поглощают одинаковую часть падающего на них света.
Прологарифмировав последнее уравнение, можно получить формулу: D = ε * С * ι.
Очевидно, что оптическая плотность напрямую зависит от концентрированности раствора и толщины его слоя. Становится ясен физический смысл молярного коэффициента поглощения. Он равен D для одномолярного раствора и при толщине слоя в 1 см.

Ограничения применения закона
Этот раздел включает следующие пункты:
- Он справедлив исключительно для монохроматического света.
- Коэффициент ε связан с показателем преломления среды, особенно сильные отклонения от закона могут наблюдаться при анализе высококонцентрированных растворов.
- Температура при измерении оптической плотности должна быть постоянной (в рамках нескольких градусов).
- Световой пучок должен быть параллельным.
- рН среды должен быть постоянным.
- Закон применим для веществ, светопоглощающими центрами которых являются частицы одного вида.
Методы определения концентрации
Стоит рассмотреть метод градуировочного графика. Для его построения готовят ряд растворов (5-10) с различной концентрацией исследуемого вещества и замеряют их оптическую плотность. По полученным значениям выстраивают график зависимости D от концентрации. График является прямой линией, идущей от начала координат. Он позволяет легко определить концентрацию вещества по результатам проведенных измерений.
Также существует метод добавок. Применяется реже, чем предыдущий, но позволяет проанализировать растворы сложного состава, поскольку учитывает влияние дополнительных компонентов. Суть его состоит в определении оптической плотности среды Dx, содержащей определяемое вещество неизвестной концентрации Сх, с повторным анализом того же раствора, но с добавлением определенного количества исследуемого компонента (Сст). Величину Сх находят, используя расчеты или графики.

Условия проведения исследования
Чтобы фотометрические исследования давали достоверный результат, необходимо соблюдать несколько условий:
- реакция должна заканчиваться быстро и полностью, избирательно и воспроизводимо;
- окраска образующегося вещества должна быть устойчива во времени и не изменяться под действием света;
- исследуемое вещество берут в количестве, которого достаточно для перевода его в аналитическую форму;
- замеры оптической плотности проводят в том интервале длин волн, при котором различие в поглощении исходных реагентов и анализируемого раствора наибольшее;
- светопоглощение раствора сравнения принято считать оптическим нулем.
Способы расчета концентрации по величине аналитического сигнала

СПОСОБЫ РАСЧЕТА КОНЦЕНТРАЦИИ ПО ВЕЛИЧИНЕ АНАЛИТИЧЕСКОГО СИГНАЛА
МЕТОД ГРАДУИРОВОЧНОГО ГРАФИКА
Пример 1. При измерении оптической плотности в одинаковых условиях (длина волны 340 нм, толщина поглощающего слоя – 1,00 см) растворов калия дихромата с разной концентрацией хрома (мкг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA + а; определите концентрацию хрома (мкг/мл) в растворе Х, имеющем оптическую плотность 0,480.
Рассчитайте массу хрома (мг) в анализируемой пробе, если ее растворили в присутствии концентрированной серной кислоты в воде дистиллированной в мерной колбе объёмом 50,00 мл (раствор Х).
1. Расчет методом наименьших квадратов

2. Расчет с помощью программы Excel

длина волны 340 нм
Ответ: с = 115,72А – 8,8397 (r = 0,9941); масса хрома в пробе 2,34 мг
Пример 2. При измерении оптической плотности в одинаковых условиях (длина волны 400 нм, толщина поглощающего слоя – 1,00 см) растворов никеля (II) нитрата с разной концентрацией никеля (мг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA + а; определите концентрацию никеля (мг/мл) в растворе Х, имеющем оптическую плотность 0,350.
Рассчитайте массу никеля (мг) в анализируемой пробе, если ее количественно перенесли в мерную колбу объёмом 25,00 мл и развели водой дистиллированной в присутствии азотной кислоты до метки (раствор Х).
1. Расчет методом наименьших квадратов

2. Расчет с помощью программы Excel

Ответ: с = 42,495А – 3,8535 (r = 0,9986); масса никеля 275 мг
Пример 3. При измерении оптической плотности в одинаковых условиях (длина волны 620 нм, толщина поглощающего слоя – 1,00 см) растворов меди (II) в виде аммиачного комплекса с разной концентрацией меди (мкг/мл) получены следующие результаты:
Изобразите примерный вид градуировочного графика; методом наименьших квадратов рассчитайте обратное уравнение градуировочного графика с = bA; определите концентрацию меди (мкг/мл) в растворе Х, имеющем оптическую плотность 0,150.
Рассчитайте массу меди (мкг) в анализируемой пробе, если ее количественно перенесли в мерную колбу объёмом 25,00 мл и до метки развели водой дистиллированной в присутствии избытка аммиака (раствор Х).
1. Расчет методом наименьших квадратов
2. Расчет с помощью программы Excel

2. Расчет с помощью программы Excel

Ответ: с = 34,595А (r = 0,9985); масса меди 130 мкг.
МЕТОД ОДНОГО СТАНДАРТНОГО РАСТВОРА
Измеряют величину аналитического сигнала (yст) для раствора с известной концентрацией вещества (сст). Затем измеряют величину аналитического сигнала (yx) для раствора с неизвестной концентрацией вещества (сx). Такой способ расчёта можно использовать в том случае, если зависимость аналитического сигнала от концентрации описывается линейным уравнением без свободного члена. Концентрация вещества в стандартном растворе должна быть такой, чтобы величины аналитических сигналов, полученных при использовании стандартного раствора и раствора с неизвестной концентрацией вещества, были бы как можно ближе друг к другу.

ПРИМЕР 1. При фотометрическом определении концентрации нитрит-ионов с помощью реактива Грисса (раствора сульфаниловой кислоты и α-нафтиламина в разбавленной уксусной кислоте) было установлено, что раствор с концентрацией нитрит-ионов 2,00 мкг/мл имеет в соответствующих условиях оптическую плотность 0,300. Рассчитайте концентрацию нитрит-ионов в растворе (мкг/мл), оптическая плотность которого в таких же условиях равна 0,250. Зависимость оптической плотности от содержания аналита линейна и проходит через начало координат.

Ответ: 1,67 мкг/мл
МЕТОД ДВУХ СТАНДАРТНЫХ РАСТВОРОВ
(метод ограничивающих растворов)
Измеряют величины аналитических сигналов для стандартных растворов с двумя разными концентрациями вещества, одна из которых (с1) меньше предполагаемой неизвестной концентрации (сx), а вторая (с2) – больше. Его используют, если зависимость аналитического сигнала от концентрации описывается линейным уравнением, не проходящим через начало координат.
Пример 1. Раствор с концентрацией никеля (II) 12,00 мг/мл имеет оптическую плотность 0,350 нм, а с концентрацией 16,00 мг/мл – 0,440. Определите концентрацию никеля (мг/мл) в растворе с оптической плотностью 0,380 (все измерения проводились в одинаковых условиях: длина волны 400 нм, толщина поглощающего слоя – 1,00 см, раствор в азотной кислоте).

Ответ: 13,33 мг/мл
Используют при анализе сложных матриц, когда матричные компоненты оказывают влияний на величину аналитического сигнала и невозможно точно скопировать матричный состав образца, в случае линейной зависимости, проходящей через начало координат.
Вначале измеряют величину аналитического сигнала (yx) для пробы с неизвестной концентрацией вещества. Затем к данной пробе прибавляют некоторое точное количество определяемого вещества (стандарта) и снова измеряют величину аналитического сигнала (yдоб). Концентрацию определяемого компонента в анализируемой пробе (без учета разбавления) рассчитывают по формуле:

Для учета разбавления раствора используем формулу:

ПРИМЕР 1. Раствор с неизвестной концентрацией вещества имел оптическую плотность 0,300. К 5,00 мл такого раствора прибавили 2,00 мл раствора с концентрацией этого же вещества 40,0 мг/л. Оптическая плотность полученного раствора при измерении её в таких же условиях оказалась равна 0,500. Рассчитайте концентрацию вещества (мг/л) в исходном растворе.
1 способ: пропорционально

2 способ: преобразуем составленную пропорцию в приведенную ранее формулу


ПРИМЕР 2. Оптическая плотность раствора с неизвестным содержанием вещества равна 0,400. При добавлении к анализируемому раствору 10,0 мкг этого же вещества оптическая плотность увеличилась до 0,500. Рассчитайте массу определяемого вещества (мкг) в исходном растворе.
1 способ: пропорционально

2 способ: преобразуем составленную пропорцию в приведенную ранее формулу
[spoiler title=”источники:”]
http://fb.ru/article/378024/teoreticheskie-osnovyi-opredeleniya-opticheskoy-plotnosti-rastvora
http://pandia.ru/text/80/260/2737.php
[/spoiler]
Оптическая
плотность
D,
мера непрозрачности слоя вещества для
световых лучей.
![]()
,
где
–
коэффициент поглощения (экстинкции)
светового потока. Зависит от природы
вещества и длины волны света.
С
– концентрация вещества в растворе в
м/л.
l
– толщина слоя светопоглощающего
раствора.
Оптическая
плотность раствора прямо пропорциональна
концентрации светопоглощающего вещества
в растворе и толщине слоя раствора.
Другими словами, при определённой
толщине слоя раствора, оптическая
плотность будет тем больше, чем больше
концентрация вещества в растворе.
Отсюда следует, что, определяя оптическую
плотность раствора, можно напрямую
определять концентрацию вещества в
растворе. При помощи современной техники
оптическая плотность может быть измерена
очень точно. Увеличивая толщину слоя l
можно измерять очень малые концентрации
веществ.
Фотоколориметр —
оптический прибор для измерения
концентрации
веществ в растворах. Действие колориметра
основано на свойстве окрашенных растворов
поглощать проходящий через них свет
тем сильнее, чем выше в них концентрация
с окрашивающего вещества. В отличие от
спектрофотометра,
измерения ведутся в луче не
монохроматического, а в полихроматического
узко спектрального света, формируемого
светофильтром. Применение различных
светофильтров с узкими спектральными
диапазонами пропускаемого света
позволяет определять по отдельности
концентрации разных компонентов одного
и того же раствора. В отличие от
спектрофотометров, фотоколориметры
просты, недороги и при этом обеспечивают
точность, достаточную для многих
применений.
Колориметры
разделяются на визуальные и объективные
(фотоэлектрические) — фотоколориметры.
В визуальных колориметрах свет, проходящий
через измеряемый раствор, освещает одну
часть поля зрения, в то время как на
другую часть падает свет, прошедший
через раствор того же вещества,
концентрация которого известна. Изменяя
толщину l слоя одного из сравниваемых
растворов или интенсивность I светового
потока, наблюдатель добивается, чтобы
цветовые тона двух частей поля зрения
были неотличимы на глаз, после чего по
известным соотношениям между l, I и с
может быть определена концентрация
исследуемого раствора.
Фотоэлектрические
колориметры (фотоколориметры) обеспечивают
большую точность измерений, чем
визуальные; в качестве приёмников
излучения в них используются фотоэлементы
(селеновые и вакуумные), фотоэлектронные
умножители,
фоторезисторы
(фотосопротивления) и фотодиоды.
Сила фототока приемников определяется
интенсивностью падающего на них света
и, следовательно, степенью его поглощения
в растворе (тем большей, чем выше
концентрация). Помимо фотоэлектрического
колориметра (фотоколориметра) с
непосредственным отсчетом силы тока,
распространены компенсационные
колориметры, в которых разность сигналов,
соответствующих стандартному
и измеряемому растворам, сводится к
нулю (компенсируется) электрическим
или оптическим компенсатором (например,
клином фотометрическим); отсчет в этом
случае снимается со шкалы компенсатора.
Компенсация позволяет свести к минимуму
влияние условий измерений (температуры,
нестабильности свойств элементов
колориметра) на их точность. Показания
колориметра не дают сразу значений
концентрации исследуемого вещества в
растворе — для перехода к ним
используют градуировочные графики,
полученные при измерении растворов с
известными концентрациями.
Измерения
с помощью колориметра отличаются
простотой и быстротой проведения.
Точность их во многих случаях не уступает
точности других, более сложных методов
химического анализа. Нижние границы
определяемых концентраций в зависимости
от рода вещества составляют от 10−3
до 10−8
моль/л.
21.Схема
ФЕКа , который основан на сопоставлении
2-х световых потоков ,где Л-лампа ,
З-зеркала ,Сф-светофильтры, К-конденсаторы,
А- кювета с контролируемым раствором,
Ф1 и Ф2-фотоэлементы,ЭУ-электронный
усилитель, ИН-индикатор нуля, ОК-оптический
клин.
Принцип
работы: световой поток от лампы Л
разделяется на 2 потока и отражаясь от
зеркал З попадает на одинаковые
фотоэлементы Ф1 и Ф2.Поток,который идет
через верхний световой канал проходит
через светофильтр Сф, конденсата К и
оптический клин ОК, а поток света ,который
идет через нижний световой канал проходит
через нижний светофильтр Сф конденсата
К и кюветы А, которая заполнена
контролируемым веществом. Фотоприёмники
Ф1 и Ф2 соединяются встречно и в их контур
включается электронный усилитель ЭУ.
Меняя положения ОК (оптический клин)
добиваются равенства световых потоков
в обоих каналах. Тогда оба канала выдадут
одинаковые фототоки и сигнал расбаланса
на входе в электронный усилитель станет
равен нулю, и индикатор ИН покажет ноль.
После выставления показания прибора
на ноль, т.е. уравновесили схему, помещаем
кювету А с контролируемым раствором в
прибор, в следствии изменения равенства
световых потоков возникнет разбаланс,
который подастся на электронный
усилитель. Для того ,чтобы уровнять
световые потоки необходимо перемещать
ОК до тех пор, пока не перестанет
подаваться сигнал расбаланса на
усилитель, т.е. выровняются фототоки и
стрелка, которая соединена с оптическим
клином не покажет действующее значение
концентрации раствора, размещенного в
кювете А.
22.
Рефрактометры предназначены для
определения показателя преломления
исследуемого вещества, на основе которого
делается вывод о его составе, наличии
примесей, определяется процентный
состав растворенных сухих веществ.
Данные приборы предназначены для
изучения неагрессивных жидкостей
средней вязкости и твердых тел.
Рефрактометры
применяются в химической промышленности,
пищевой
промышленности , для анализа продуктов
и сырья, в медицине и ветеринарии; в
фармацевтической промышленности для
исследования водных растворов
лекарственных препаратов, а также во
многих других отраслях производства.
Обычно
показатели преломления жидких и твердых
тел рефрактометрией определяют с
точностью до 0,0001 на рефрактометрах, в
которых измеряют предельные углы полного
внутреннего отражения. Наиболее
распространены рефрактометры Аббе с
призменными блоками и компенсаторами
дисперсии, позволяющие определять линии
спектра в “белом” свете по шкале
или цифровому индикатору. Максимальная
точность абсолютных измерений (10 -10)
достигается на гониометрах с помощью
методов отклонения лучей призмой из
исследуемого материала. Для измерения
показателей преломления газов наиболее
удобны интерференционные методы.
Интерферометры используют также для
точного (до 10 -7) определения разностей
показателей преломления растворов. Для
этой же цели служат дифференциальные
рефрактометры, основанные на отклонении
лучей системой двух-трех полых призм.
Автоматические
рефрактометры для непрерывной регистрации
показателей преломления в потоках
жидкостей используют на производствах
при контроле технологических процессов
и автоматическом управлении ими, а также
в лабораториях для контроля ректификации
и как универсальные детекторы жидкостных
хроматографов.
Рефрактометрия,
выполняющаяся с помощью рефрактометров,
является одним из распространённых
методов идентификации химических
соединений, количественного и структурного
анализа, определения физико-химических
параметров веществ.
23.

1—
осветитель;
2— коллиматор; 3
—
кювета; 4,
5 — призмы;
6
—
фотоэлементы.
Кювета
состоит из двух камер, разделенных
прозрачной перегородкой, одна из которых
заполнена эталонным раствором
заданной концентрации, а другая —
контролируемым раствором. При равенстве
показателей преломления эталонной п
и
контролируемой п’
жидкостей
луч света проходит через обе камеры без
отклонений, а при изменении концентрации
контролируемой среды, показатель п”
изменяется
и луч света отклоняется. Отклонение
луча тем больше, чем заметнее различие
между концентрациями эталонной и
контролируемой жидкостей. Конструкция
дифференциальной кюветы обеспечивает
температурную компенсацию, т. е. равенство
температур, при которых находятся обе
жидкости.
24.
При
измерении масс-спектрометрами используют
основной физический параметр вещества
— массу молекулы или атома. Это позволяет
определять состав вещества независимо
от его химических и физических
свойств. Преимущество масс-спектрометрическего
метода — быстрый и полный анализ
многокомпонентных газовых смесей. При
этом для анализа требуются ничтожно
малые количества вещества. ‘
В
условиях глубокого вакуума молекулы
или атомы анализируемого вещества
ионизируются с образованием положительно
заряженных ионов. Ионы, получившие
ускорение в электрическом поле,
разделяются по своим массам в магнитном
поле. Сумма электрических зарядов
движущихся ионов образует ионный ток.
Измерение силы ионного тока, создаваемого
частицами той или иной массы, позволяет
судить о концентрации частиц в общем
составе анализируемого вещества. В
масс-спектрометре любой конструкции
основной частью является масс-анализатор,
в котором происходят ионизация,
формирование ионного луча, разделение
его на составляющие ионные лучи,
соответствующие строго определенным
массам, и последовательное раздельное
собирание ионных лучей на коллекторе.
Соответственно указанным процессам
масс-анализатор любого масс-спектрометра
состоит из источника ионов, собственно
анализатора и приемника ионов.
По
конфигурации и взаимной ориентации
магнитных и электрических полей, а
также по характеру изменения этих полей
во времени масс-спектрометры делятся
на четыре группы:.с разделением ионов
в однородном магнитном поле; с разделением
ионов в неоднородном магнитном поле;
с разделением ионов по времени пролета;
радиочастотные.
Преимущественное
применение получили масс-спектрометры
с разделением ионов в однородном
магнитном поле и по времени пролета.
25.
Автоматический рефрактометр.


Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Макеты страниц
Определение концентрации вещества методом сравнения оптических плотностей эталонного и исследуемого растворов
Для определения готовят эталонный раствор определяемого вещества известной концентрации, которая приближается к концентрации исследуемого раствора. Определяют оптическую плотность этого раствора при определенной длине волны  . Затем определяют оптическую плотность исследуемого раствора
. Затем определяют оптическую плотность исследуемого раствора  при той же длине волны и при той же толщине слоя. Для эталонного раствора согласно уравнению (17) имеем:
при той же длине волны и при той же толщине слоя. Для эталонного раствора согласно уравнению (17) имеем:

где  — молярный коэффициент поглощения исследуемого раствора;
— молярный коэффициент поглощения исследуемого раствора;  — толщина слоя, см.
— толщина слоя, см.
Оптическая плотность исследуемого раствора выражается такой же формулой:

где  — концентрация исследуемого раствора,
— концентрация исследуемого раствора,  .
.
Отсюда

и

Количество  определяемого вещества (в мг) с учетом разбавления раствора находим по формуле:
определяемого вещества (в мг) с учетом разбавления раствора находим по формуле:

где  — общий объем исследуемого раствора,
— общий объем исследуемого раствора,  ;
;  — объем окрашенного исследуемого раствора,
— объем окрашенного исследуемого раствора,  — объем аликвотной части исследуемого растаора, взятой для приготовления окрашенного раствора,
— объем аликвотной части исследуемого растаора, взятой для приготовления окрашенного раствора,  .
.
Определение к онцентраци и вещества в растворе по значению молярного коэффициента поглощения
Определив значение оптической плотности  -раствора при длине волны к и зная значение молярного коэффициента поглощения
-раствора при длине волны к и зная значение молярного коэффициента поглощения  . определяемого вещества
. определяемого вещества  для лучей длины волны X, находим по формуле (17) значение концентрации
для лучей длины волны X, находим по формуле (17) значение концентрации  исследуемого вещества
исследуемого вещества  :
:

Количество  определяемого вещества (в г) находим по формуле:
определяемого вещества (в г) находим по формуле:

где  — молекулярный (атомный) вес определяемого вещества (иона).
— молекулярный (атомный) вес определяемого вещества (иона).
Значение молярного коэффициента поглощения  . устанавливают следующим образом. Готовят эталонный раствор исследуемого вещества определенной концентрации
. устанавливают следующим образом. Готовят эталонный раствор исследуемого вещества определенной концентрации  и измеряют значение оптической плотности
и измеряют значение оптической плотности  этого раствора при длине волны к и значение
этого раствора при длине волны к и значение  . вычисляют по формуле:
. вычисляют по формуле:

Если вещество трудно получить в чистом виде, то можно пользоваться табличным значением  .
.
Определение концентрации вещества с помощью калибровочного графика
Функциональная зависимость  между оптической плотностью раствора и концентрацией поглощающего вещества может быть установлена графически. Для этого предварительно готовят серию растворов определяемого вещества различной концентрации (эталонные растворы). Измеряют значения оптической плотности этих растворов для лучей с длиной волны X и по полученным данным строят кривую зависимости оптической плотности раствора от концентрации (калибровочный график). На ось ординат наносят значения оптической плотности эталонных растворов
между оптической плотностью раствора и концентрацией поглощающего вещества может быть установлена графически. Для этого предварительно готовят серию растворов определяемого вещества различной концентрации (эталонные растворы). Измеряют значения оптической плотности этих растворов для лучей с длиной волны X и по полученным данным строят кривую зависимости оптической плотности раствора от концентрации (калибровочный график). На ось ординат наносят значения оптической плотности эталонных растворов  , а на ось абсцисс — соответствующие значения концентраций этих растворов (
, а на ось абсцисс — соответствующие значения концентраций этих растворов ( ). Для получения более точных результатов рассчитывают, пользуясь методом наименьших квадратов, уравнение для калибровочного графика.
). Для получения более точных результатов рассчитывают, пользуясь методом наименьших квадратов, уравнение для калибровочного графика.
Определив значение  оптической плотности исследуемого раствора при той же толщине слоя, можно найти концентрацию
оптической плотности исследуемого раствора при той же толщине слоя, можно найти концентрацию  определяемого вещества по полученному калибровочному графику. Если раствор не подчиняется закону Бугера—Ламберта—Бера, то прямолинейная зависимость нарушается на некотором участке кривой или на всей кривой. В этом случае необходимо увеличить число эталонных растворов. Концентрацию эталонных растворов обычно выражают в
определяемого вещества по полученному калибровочному графику. Если раствор не подчиняется закону Бугера—Ламберта—Бера, то прямолинейная зависимость нарушается на некотором участке кривой или на всей кривой. В этом случае необходимо увеличить число эталонных растворов. Концентрацию эталонных растворов обычно выражают в  . Количество определяемого вещества
. Количество определяемого вещества  в миллиграммах определяют по формуле (23).
в миллиграммах определяют по формуле (23).
Определение концентрации вещества методом «уравнивания» или методом изменения толщины поглощающего слоя
Оптическую плотность исследуемого раствора  определяют по формуле:
определяют по формуле:

где  — молярный коэффициент поглощения исследуемого раствора;
— молярный коэффициент поглощения исследуемого раствора;  — концентрация определяемого вещества,
— концентрация определяемого вещества,  ;
;  — толщина слоя, см.
— толщина слоя, см.

Рис. 96. Оптическая схема колориметра погружения: 1 – зеркало; 2, 3 – кюветы; 4, 5 — стеклянные цилиндры; 6, 7— призмы; 8,9 — линзы.
Оптическую плотность эталонного раствора определяют по формуле

где  — концентрация эталонного раствора,
— концентрация эталонного раствора,  — толщина слоя, см.
— толщина слоя, см.
Изменяя толщину слоя исследуемого раствора и эталонного раствора, можно установить тождественность цвета исследуемого раствора с цветом эталонного. Тогда оба раствора будут иметь одинаковую оптическую плотность:

Отсюда

На использовании этого равенства основано устройство колориметра погружения (колориметр Дюбоска), в котором тождественность цвета достигается изменением толщины слоя растворов. Оптическая схема колориметра погружения дана на рис. 96. Один световой поток от зеркала 1 проходит через слой исследуемого раствора в кювете 2, цилиндр 4, призму 6, линзы 8 и 9 и попадает в окуляр, освещая правую половину оптического поля. Другой световой поток проходит через слой стандартного раствора в кювете 3, цилиндр 5, призму 7, линзы 8 и 9, попадает в окуляр, освещая левую половину оптического поля. Кюветы 2 и 3 установлены на держателях, которые при помощи шестеренок и реек передвигаются вертикально. Стеклянные цилиндры 4 и 5 с отшлифованными концами укреплены неподвижно. Перемещая кюветы 2 и 3 по вертикали, меняют высоту столбов раствора и добиваются исчезновения границ раздела в окуляре оптического поля. Высоты столбов эталонного раствора и исследуемого раствора отсчитывают по миллиметровой шкале.
Спектрофотометрия в ультрафиолетовой (УФ) и видимой областях (ОФС.1.2.1.1.0003.15)
Государственная фармакопея 13 издание (ГФ XIII)
ОБЩАЯ ФАРМАКОПЕЙНАЯ СТАТЬЯ
Взамен ОФС ГФ X, ОФС ГФ XI, ОФС 42-0042-07 ГФ XII, ч.1
Спектроскопические методы анализа основаны на избирательном поглощении электромагнитного излучения анализируемым веществом и служат для исследования строения, идентификации и количественного определения светопоглощающих соединений.
В зависимости or используемой аппаратуры в фармацевтическом анализе различают следующие методы анализа, основанные на поглощении электромагнитного излучения и испускании света:
- спектрофотометрия в ультрафиолетовой (УФ) и видимой областях;
- спектрометрия в инфракрасной (ИК) области;
- атомно-эмиссионная спектрометрия (АЭС);
- атомно-абсорбционная спектроскопия (ААС);
- флуоримегрия;
- спектроскопия ядерного магнитного резонанса (ЯМР);
- масс-спектрометрия;
- рамановская спектрометрия;
- рентгеновская флуоресцентная спектрометрия;
- рентгеновская порошковая дифрактометрия.
Ряд длин волн, для которых проводятся измерения методами абсорбционной спектрофотометрии, охватывает спектральную область от коротких длин волн в УФ-области до ИК-области. Для удобства отнесений этот спектральный ряд делится на следующие диапазоны длин волн: УФ (от 190 до 380 нм), видимый (от 380 до 780 нм), ИК (от 0,78 до 400 мкм).
СПЕКТРОФОТОМЕТРИЯ В УЛЬТРАФИОЛЕТОВОЙ И ВИДИМОЙ ОБЛАСТЯХ
Уменьшение интенсивности монохроматического излучения, проходящего через гомогенную поглощающую среду, количественно описывается законом Бугера-Ламберта-Бера:
![]()
где:
Т – пропускание, отношение интенсивности светового потока, прошедшего через вещество, к интенсивности падающего на вещество светового потока: Т = I/I0;
I – интенсивность прошедшего монохроматического излучения;
I0 – интенсивность падающего монохроматического излучения;
ε – молярный показатель поглощения;
с – молярная концентрация вещества в растворе;
b – длина оптического пути или толщина слоя, в сантиметрах.
Величина log10(1/Т) носит название оптической плотности, обозначается буквой А и является измеряемой величиной. В отсутствии других физико-химических факторов измеренная оптическая плотность (А) пропорциональна концентрации вещества в растворе (с) и толщине слоя (b).
Величина ![]() представляет собой удельный показатель поглощения, т.е. оптическую плотность раствора вещества с концентрацией 10 г/л (1 г/100 мл) в кювете с толщиной слоя 1 см. Величины
представляет собой удельный показатель поглощения, т.е. оптическую плотность раствора вещества с концентрацией 10 г/л (1 г/100 мл) в кювете с толщиной слоя 1 см. Величины![]() и ε связаны соотношением:
и ε связаны соотношением:
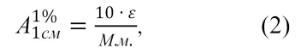
где:
М.м. – молекулярная масса исследуемого вещества.
Измерение оптической плотности
Если нет других указаний в фармакопейной статье, измерение оптической плотности проводят при указанной длине волны с использованием кювет с толщиной слоя 1 см и при температуре (20 ± 1) °С по сравнению с тем же растворителем или той же смесью растворителей, в которой растворено вещество. При измерении оптической плотности раствора при данной длине волны оптическая плотность кюветы с растворителем, измеренная против воздуха при той же длине волны, не должна превышать 0,9 и, желательно, чтобы она была не менее 0,2.
Спектр поглощения представляют таким образом, чтобы оптическая плотность или ее некоторая функция были приведены по оси ординат, а длина волны или некоторая функция длины волны – по оси абсцисс.
Если в фармакопейной статье для максимума поглощения указывается только одна длина волны, то это означает, что полученное значение максимума не должно отличаться от указанного более чем на ± 2 нм.
Приборы
Спектрофотометры, предназначенные для измерений в ультрафиолетовой и видимой областях спектра, состоят из оптической системы, выделяющей монохроматическое излучение в области от 190 до 800 нм и обеспечивающей его прохождение через образец, и устройства для измерения оптической плотности.
Основными частями этих приборов являются: источник излучения, диспергирующий прибор (призма или решетка), щель для выделения полосы длин волн, кюветы для образцов, детектор излучаемой энергии, встроенные усилители и измерительные приборы.
Проверка шкалы длин волн в ультрафиолетовой и видимой области. Точность калибровки прибора по шкале длин волн в спектральном ряду проверяют по приведенным в табл. 1 спектральным линиям водородной (Hβ) или дейтериевой (Dβ) разрядной лампы, линиям паров ртути (Hg) кварцево-ртутной дуговой лампы, а также по максимумам поглощения раствора гольмия перхлората (Ho) (готовый реактив для калибровки спектрофотометра представляет собой 4 % раствор гольмия оксида в 14,1% растворе хлорной кислоты). Допустимое отклонение составляет ± 1 нм для ультрафиолетовой и ± 3 нм для видимой области.
Таблица 1. Максимумы поглощения для проверки шкалы длин волн
| 241,15 нм (Но) | 404,66 нм (Hg) |
| 253,7 нм (Hg) | 435,83 нм (Hg) |
| 287,15 нм (Но) | 486,0 нм (Dв) |
| 302,25 нм (Hg) | 486,1 нм (Нв) |
| 313,16 нм (Hg) | 536,3 нм (Но) |
| 334,15 нм (Hg) | 546,07 нм (Hg) |
| 361,5 нм (Но) | 576,96 нм (Hg) |
| З65,48 нм (Hg) | 579,07 нм (Hg) |
Шкала длин волн может быть калибрована также при помощи подходящих стеклянных фильтров, которые имеют фиксированные полосы поглощения в видимой и ультрафиолетовой областях, а также стандартных стекол, содержащих дидим (смесь празеодима и неодима), и стекол, содержащих гольмий.
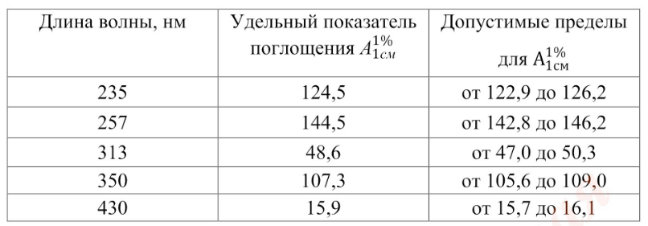
Проверка шкалы оптической плотности. Для проверки шкалы оптической плотности используют стандартные неорганические стеклянные фильтры или раствор калия дихромата при длинах волн, указанных в табл. 2, где для каждой длины волны приведено точное значение удельного показателя поглощения ![]() и допустимые пределы.
и допустимые пределы.
Раствор калия дихромата для проверки шкалы оптической плотности при 235, 257, 313 и 350 нм готовят следующим образом: от 57,0 до 63,0 мг (точная навеска) калия дихромата, предварительно высушенного до постоянной массы при температуре 130 °С, растворяют в 0,005 М растворе серной кислоты и доводят объем раствора тем же растворителем до 1000 мл. Для проверки оптической плотности при 430 нм, растворяют 57,0-63,0 мг (точная навеска) калия дихромата в 0,005 М растворе серной кислоты и доводят объём раствора тем же растворителем до метки.
Таблица 2. Удельный показатель поглощения стандартов при различных длинах волн
Предельный уровень рассеянного света. Рассеянный свет может быть обнаружен при данной длине волны с использованием соответствующих фильтров или растворов: например, оптическая плотность раствора 12 г/л калия хлорида в кювете с толщиной слоя 1 см резко увеличивается между 220 и 200 нм и должна быть больше 2 при 198 нм при использовании воды в качестве раствора сравнения.
Разрешающая способность (для качественного анализа). Если есть указание в фармакопейной статье, определяют разрешающую способность спектрофотометра следующим образом. Записывают спектр 0,02 % (об/об) раствора толуола в гексане. Минимально допустимое значение отношения оптической плотности в максимуме поглощения при 269 нм к оптической плотности в минимуме поглощения при 266 нм указывают в фармакопейной статье.
Ширина спектральной щели (для количественного анализа). В случае использования спектрофотометра с изменяемой шириной спектральной щели при выбранной длине волны возможны погрешности, связанные с шириной этой щели. Для их исключения ширина щели должна быть малой по сравнению с полушириной полосы поглощения (шириной на половине оптической плотности) и в то же время должна быть максимально велика для получения высокого значения интенсивности падающего монохроматического излучения (I0). Таким образом, ширина щели должна быть такой, чтобы дальнейшее ее уменьшение не изменяло величину измеряемой оптической плотности.
Кюветы. Допустимые отклонения в толщине слоя используемых кювет должны быть не более ±0,005 см. Кюветы, предназначенные для испытуемого раствора и раствора сравнения, должны иметь одинаковое пропускание (или оптическую плотность) при заполнении одним и тем же растворителем. В противном случае это различие следует учитывать.
Требования к растворителям. Для определений, производимых в ультрафиолетовой и видимой областях, образец анализируемого вещества растворяют в соответствующем растворителе, который должен быть оптически прозрачным в используемой области длин волн. Для этих областей длин волн пригодны многие растворители, в том числе вода, спирты, хлороформ, низшие углеводороды, эфиры и разбавленные растворы сильных кислот и щелочей.
Идентификация
Абсорбционную спектрофотометрию в ультрафиолетовой и видимой областях спектра применяют для определения подлинности лекарственных средств путем:
- сравнения спектров поглощения испытуемого раствора и раствора стандартного образца; в указанной области спектра должно наблюдаться совпадение положений максимумов, минимумов, плеч и точек перегиба;
- указания положений максимумов, минимумов, плеч и точек перегиба спектра поглощения испытуемого раствора; расхождение между наблюдаемыми и указанными длинами волн в максимумах и минимумах поглощения не должно обычно превышать ± 2 нм.
Возможны и другие варианты применения, оговоренные в фармакопейных статьях.
Количественное определение
Определение концентрации веществ спектрофотометрическим методом основано на использовании закона Бугера-Ламберта-Бера:
В ряде случаев, даже при использовании монохроматического излучения могут наблюдаться отклонения от закона Бугера-Ламберта-Бера, обусловленные процессами диссоциации, ассоциации и комплексообразования. Поэтому предварительно следует проверить линейность зависимости оптической плотности раствора от концентрации в аналитической области. При наличии отклонений от линейной зависимости следует пользоваться не формулой (3), а экспериментально найденной зависимостью.

Обычно определение концентрации спектрофотометрическим методом проводят с использованием стандартного образца. Расчет концентрации основан на использовании уравнения:
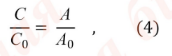 где:
где:
С и С0 – концентрации испытуемого раствора и раствора стандартного образца, соответственно;
А и А0 – оптические плотности испытуемого раствора и раствора стандартного образца, соответственно.
Концентрации испытуемого и стандартного раствора должны быть близки.
Вначале измеряют оптическую плотность раствора стандартного образца, приготовленного, как указано в фармакопейной статье, затем проводят измерение оптической плотности испытуемого раствора. Второе измерение проводят сразу после первого, с использованием той же кюветы, в тех же экспериментальных условиях.
Метод с использованием стандартного образца является более точным и надежным. Возможность применения значения удельного показателя поглощения в каждом конкретном случае следует обосновывать. Обычно метод с использованием значения удельного показателя поглощения применим при допусках содержания анализируемого вещества не менее ±10 % от номинального содержания.
Многокомпонентный спектрофотометрический анализ
Многокомпонентный спектрофотометрический анализ (анализ смесей) применяют для одновременного количественного определения нескольких компонентов лекарственных средств, каждое из которых подчиняется закону Бугера-Ламберта-Бера.
Количественное определение в многокомпонентном спектрофотометрическом анализе основывается обычно на использовании уравнения:
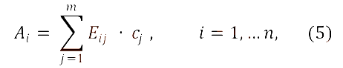 где:
где:
Аi – оптическая плотность испытуемого раствора при i-ой длине волны;
Еij – показатели поглощения (зависящие от способа выражения концентрации) j-го компонента образца при i-ой аналитической длине волны;
cj – концентрация j-го компонента образца.
Соответствующие методики проведения анализа и расчетные формулы указываются в фармакопейных статьях.
Производная спектрофотометрия
В производной спектрофотометрии исходные спектры поглощения (нулевого порядка) преобразуются в спектры производных первого, второго и более высокого порядков.
Спектр первой производной представляет собой график зависимости градиента кривой поглощения (скорость изменения оптической плотности от длины волны, dA/dλ) от длины волны.
Спектр второй производной представляет собой график зависимости кривизны спектра поглощения (d2A/dλ2) от длины волны. Вторая производная при любой длине волны связана с концентрацией следующим соотношением:

Производная спектрофотометрия может быть использована как для целей идентификации веществ, так и для их количественного определения в многокомпонентных смесях, а также в тех случаях, когда имеется фоновое поглощение, вызванное присутствием веществ, содержание которых не регламентируется.
Приборы
Используют спектрофотометры, отвечающие указанным выше требованиям и оснащенные аналоговым резистивно-емкостным дифференцирующим модулем или цифровым дифференциатором, или другими средствами получения производных спектров, в соответствии с инструкцией к прибору. Некоторые методы получения спектров второй производной приводят к смещению длин волн относительно исходного спектра, что следует учитывать там, где это необходимо.
Разрешающая способность
Если указано в фармакопейных статьях, записывают спектр второй производной для раствора 0,2 г/л толуола в метаноле, используя метанол в качестве раствора сравнения. На спектре должен присутствовать небольшой отрицательный экстремум, расположенный между двумя большими отрицательными экстремумами при 261 нм и 268 нм, в соответствии с рис. 1. Если нет других указаний в фармакопейных статьях, отношение А/B должно быть не менее 0,2.
Методика
Процедура анализа аналогична применяемой в обычной спектрофотометрии, но вместо оптических плотностей используют производные. Готовят раствор испытуемого образца, настраивают прибор в соответствии с инструкцией производителя и рассчитывают количество определяемого вещества, как указано в фармакопейной статье.

Рисунок 1. Спектр второй производной раствора толуола (0,2 г/л) в метаноле
