Практическое занятие
«Составление
полипептидных цепей из аминокислот»
Цель: научиться
составлять уравнения реакций поликонденсации пептидной связи.
Планируемый результат обучения:
обучающийся должен уметь:
– называть:
изученные вещества по тривиальной или международной номенклатуре;
– определять: принадлежность веществ к разным классам органических соединений;
– характеризовать:
строение изученных органических соединений;
– объяснять: зависимость свойств
веществ от их состава и строения, природу химической связи;
– проводить: самостоятельный
поиск химической информации с использованием различных источников
(научно-популярных изданий, компьютерных баз данных, ресурсов Интернета);
использовать компьютерные технологии для обработки и передачи химической
информации и ее представления в различных формах.
Обучающийся должен знать/понимать:
– важнейшие химические понятия: вещество, углеродный скелет, функциональная группа, изомерия;
– основные теории химии: химической связи, строения органических соединений;
– важнейшие вещества и материалы: аминокислоты,
белки.
Оборудование и материалы: таблицы и схемы по тематике.
Теоретическая
часть
Белки
(протеины, полипептиды) – высокомолекулярные органические вещества,
состоящие из соединённых в цепочку пептидной связью α-аминокислот.
В
живых организмах аминокислотный состав белков определяется генетическим кодом,
при синтезе в большинстве случаев используется 20 стандартных аминокислот.
Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме
того, аминокислоты в составе белка часто подвергаются посттрансляционным
модификациям, которые могут возникать и до того, как белок начинает выполнять
свою функцию, и во время его «работы» в клетке. Часто в живых организмах
несколько молекул белков образуют сложные комплексы, например,
фотосинтетический комплекс.

В пептидах остатки
аминокислот соединены пептидными звеньями.
По числу аминокислотных остатков различают
олигопептиды (ди-, три-, тетрапептиды и т.д.) и полипептиды, содержащие более
10 аминокислотных остатков. В состав олигопептидов могут входить остатки
аминокислот, не встречающиеся в белках, например β-аминокислот, а также
фрагменты неаминокислотной природы. К пептидам относятся многие природные
биологически активные вещества, в том числе гормоны, регуляторы иммунитета,
антибиотики, токсины. Природные полипептиды с молекулярной массой более 6000
называю белками.
Молекула пептида представляет собой
линейную или разветвленную цепь с аминогруппой (-NH2) на одном и карбоксильной
группой (- СООН) на другом конце цепи. Встречаются пептиды с
замкнутой цепью-циклопептиды.
Аминокислотный остаток пептида, несущий
свободную аминогруппу, называют N-концевым, а несущий свободную карбоксильную группу-С-концевым. Название
пептида образуется из названий входящих в его состав аминокислотных остатков,
перечисляемых последовательно, начиная с N-концевого. При
этом используют тривиальные названия аминокислот, в которых окончание «-ин»
заменяется на «-ил». Название С-концевого остатка совпадает с названием
соответствующей аминокислоты.
Все аминокислотные остатки, входящие
в полипептид, нумеруются, начиная с N-конца.
Длина связи С-N
(0,132 нм) в пептидном фрагменте меньше, чем длина одинарной связи С-N (0,147 нм). Это говорит об увеличении кратности связи за счет
сопряжения с карбонильной группой. Результатом является затрудненность
свободного вращения вокруг нее.
Упрощенно синтез полипептидов можно представить как последовательное
взаимодействие соответствующих аминокислот. Так, из глицина, аланина и цестеина
образуется трипептид глицил-алнил-цистеин:

Практическая часть
Задание 1. Первый
олигопептид был получен из мясного фарша и поэтому назван карнозином (от
латинского carnis-мясо).
Дипептид карнозин представляет собой
β-аланил-гистидин. Его химическую формулу в 1900 г. Определили профессор
Московского университета В.С. Гулевич и его ученик С. Амираджиби. Напишите ее.
Задание 2. Составьте
уравнения реакций, отражающие схему синтеза аланил-серил-фенил-аланил-глицина.
Задание 3.
Напишите формулы и названия веществ, образующихся при гидролизе соединения

Задание 4. Составьте
уравнения реакций, отражающие схему синтеза из 11 аминокислотных остатков.
Критерии оценки
практического занятия
Оценка «5»: все 4 задания
выполнены верно.
Оценка «4»: выполнено 4
задания с незначительными ошибками.
Оценка «3»: выполнено 3
задания верно.
Оценка «2»: выполнено
меньше 3-х заданий верно.
Оценка «1»: не приступил
к практической части занятия.
Строение полипептидной цепи и пептидной связи
Мономеры аминокислот,
входящие в состав полипептидов, называют
аминокислотными
остатками.
Аминокислотный остаток, имеющий свободную
аминогруппу, называют N-концевым
и записывают слева пептидной цепи, а
имеющий свободную α-карбо-ксильную
группу – С-концевым, и записывают справа.
Цепь повто-ряющихся атомов –СН – СО – NH–
в полипетидной цепи называется пептидным
остовом.
Полипептидная
цепь имеет следующий общий вид:

где R1,
R2,
R3,
… Rn
– радикалы аминокислот, образующие
боковую цепь.
В проявлении
биологических функций пептидов и белков
большую роль играет электронное и
пространственное строение пептидной
группы:

Наличие р-π-сопряжения
в пептидной группе приводит к частичной
двоесвязанности связи С – N.
Длина пептидной связи
С – N
равна 0,132 нм, а длина связи N – Сα
составляет 0,147 нм. Одинарная связь С – N
в пептидах примерно на 40% имеет характер
двойной связи, а двойная связь С = О
приблизительно на 40% является одинарной.
Это обстоятельство приводит к двум
важным последствиям:
1) иминогруппа
(– NH –)
пептидной связи не обладает заметно
выраженной способностью отщеплять или
присоединять протон;
2) свободное
вращение вокруг связи C – N
отсутствует.
Частичая
двоесвязанность связи С – N
означает, что пептидная группа представляет
собой плоский участок пептидной цепи.
Плоскости пептидных групп расположены
под углом друг к другу:

Вокруг связей
С – Сα
и N – Сα
возможно вращение, хотя и ограниченное
размерами и характером радикалов, что
позволяет полипептидной цепи принимать
различные конфигурации.
Пептидная связь
является единственной ковалентной
связью, при помощи которой аминокислотные
остатки соединяются друг с другом,
образуя остов белковой молекулы.
Пептидные связи
обычно расположены в транс-конфигурации,
т.е. α-углеродные атомы располагаются
по разные стороны от пептидной связи.
В результате боковые радикалы аминокислот
находятся в пространстве на наиболее
удаленном расстоянии друг от друга.
Hоменклатура пептидов
При названии
полипептида к названию всех аминокислотных
остатков, кроме последнего, добавляют
суффикс –ил,
концевая аминокислота имеет окончание
–ин.
Например, пептид мет-асп-вал-про имеет
полное название метиониласпарагилвалилпролин.
Кислотно-основные свойства пептидов
Многие короткие
пептиды были получены в чистом
кристал-лическом виде. Высокие температуры
их плавления указывают на то, что из
нейтральных растворов пептиды
кристаллизуются в виде диполярных
ионов. Поскольку ни одна из α-карбоксильных
групп и ни одна из α-аминогрупп, участвующих
в образовании пептидных связей, не может
ионизироваться в интервале рН от 0 до
14, кислотно-основные свойства пептидов
определяются свободной NH2
группой N-концевого
остатка и свободной карбоксильной
группой
С-концевого остатка пептида
и теми R-группами,
которые способны к ионизации. В длинных
пептидных цепях число ионизированных
R-групп
обычно велико по сравнению с двумя
ионизированными группами концевых
остатков пептида. Поэтому для характеристики
кислотно-основных свойств пептидов мы
будем рассматривать короткие пептиды.
Свободная
α-аминогруппа и свободная концевая
карбоксильная группа в пептидах разделены
значительно большим расстоянием, чем
в простых аминокислотах, и поэтому
электростатические взаимо-действия
между ними ослаблены. Величины рK
для концевых карбоксильных групп в
пептидах несколько выше, а для концевых
α-аминогрупп несколько ниже, чем в
соответствующих свободных аминокислотах.
У R-групп
в коротких пептидах и в соответствующих
свободных аминокислотах величины рK
заметно не различаются.
Для определения
области рН, в которой может находиться
изоэлектрическая точка исследуемого
короткого пептида, достаточно сравнить
число свободных аминогрупп и число
свободных карбоксильных групп, включая
N-
и С-концевые группы. Если число аминогрупп
превышает число карбоксильных групп,
изоэлектри-ческая точка пептида будет
лежать в щелочной области рН, так как
для предотвращения протонирования
аминогрупп необходима щелочь. Если
число карбоксильных групп превышает
число аминогрупп, изоэлектрическая
точка будет находиться в кислой области
рН, так как кислая среда подавляет
диссоциацию карбоксильных групп.
Соседние файлы в папке Амины, аминокислоты
- #
- #
И транскрипция, и трансляция относятся к матричным биосинтезам. Матричным биосинтезом называется синтез
биополимеров (нуклеиновых кислот, белков) на матрице – нуклеиновой кислоте ДНК или РНК. Процессы матричного биосинтеза относятся к пластическому обмену: клетка расходует энергию АТФ.
Матричный синтез можно представить как создание копии исходной информации на несколько другом или новом
“генетическом языке”. Скоро вы все поймете – мы научимся достраивать по одной цепи ДНК другую, переводить РНК в ДНК
и наоборот, синтезировать белок с иРНК на рибосоме. В данной статье вас ждут подробные примеры решения задач, генетический словарик пригодится – перерисуйте его себе 🙂

Возьмем 3 абстрактных нуклеотида ДНК (триплет) – АТЦ. На иРНК этим нуклеотидам будут соответствовать – УАГ (кодон иРНК).
тРНК, комплементарная иРНК, будет иметь запись – АУЦ (антикодон тРНК). Три нуклеотида в зависимости от своего расположения
будут называться по-разному: триплет, кодон и антикодон. Обратите на это особое внимание.
Репликация ДНК – удвоение, дупликация (лат. replicatio — возобновление, лат. duplicatio – удвоение)
Процесс синтеза дочерней молекулы ДНК по матрице родительской ДНК. Нуклеотиды достраивает фермент ДНК-полимераза по
принципу комплементарности. Переводя действия данного фермента на наш язык, он следует следующему правилу: А (аденин) переводит в Т (тимин), Г (гуанин) – в Ц (цитозин).
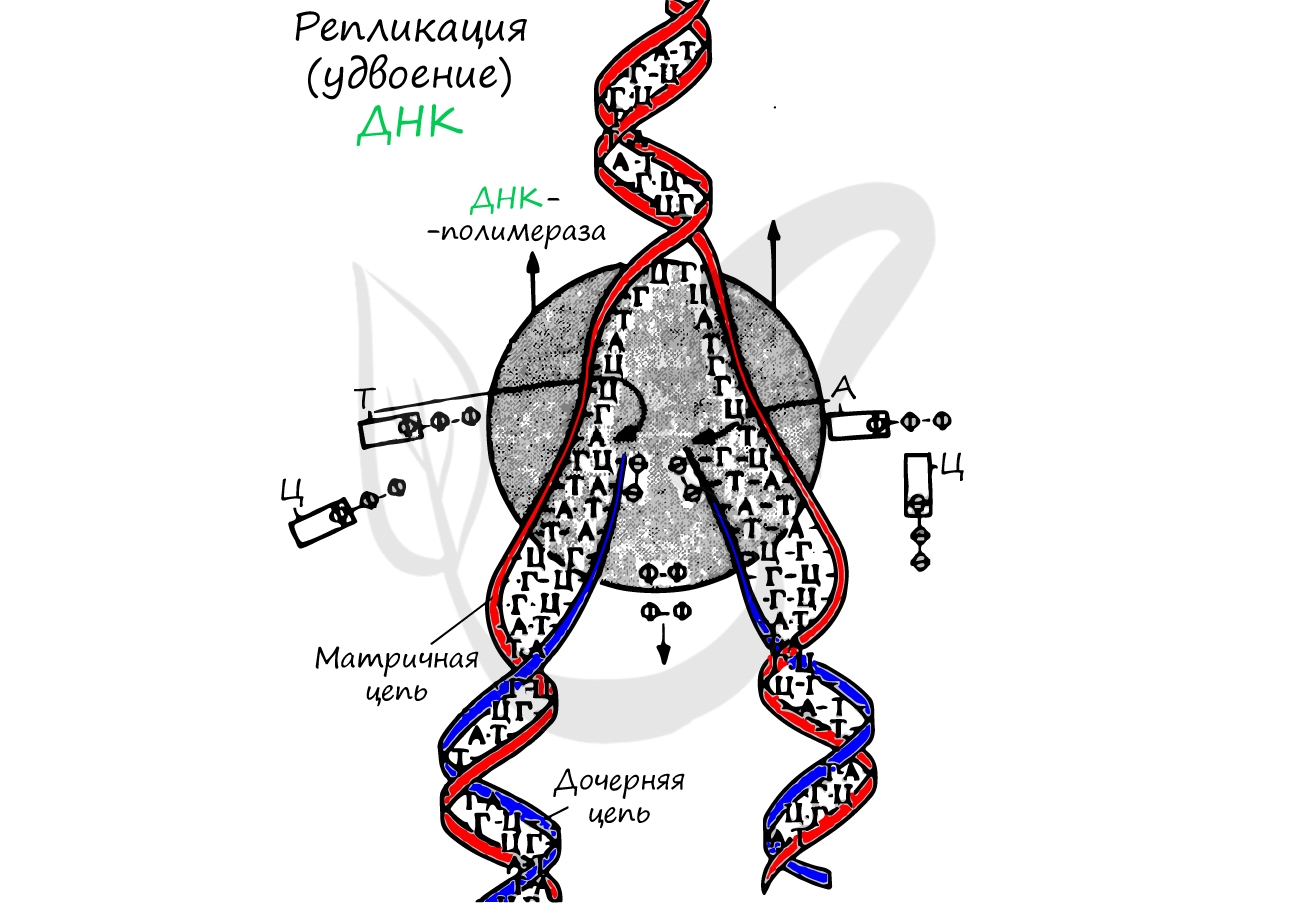
Удвоение ДНК происходит в синтетическом периоде интерфазы. При этом общее число хромосом не меняется, однако каждая из них
содержит к началу деления две молекулы ДНК: это необходимо для равномерного распределения генетического материала между
дочерними клетками.
Транскрипция (лат. transcriptio — переписывание)
Транскрипция представляет собой синтез информационной РНК (иРНК) по матрице ДНК. Несомненно, транскрипция происходит
в соответствии с принципом комплементарности азотистых оснований: А – У, Т – А, Г – Ц, Ц – Г (загляните в “генетический словарик”
выше).
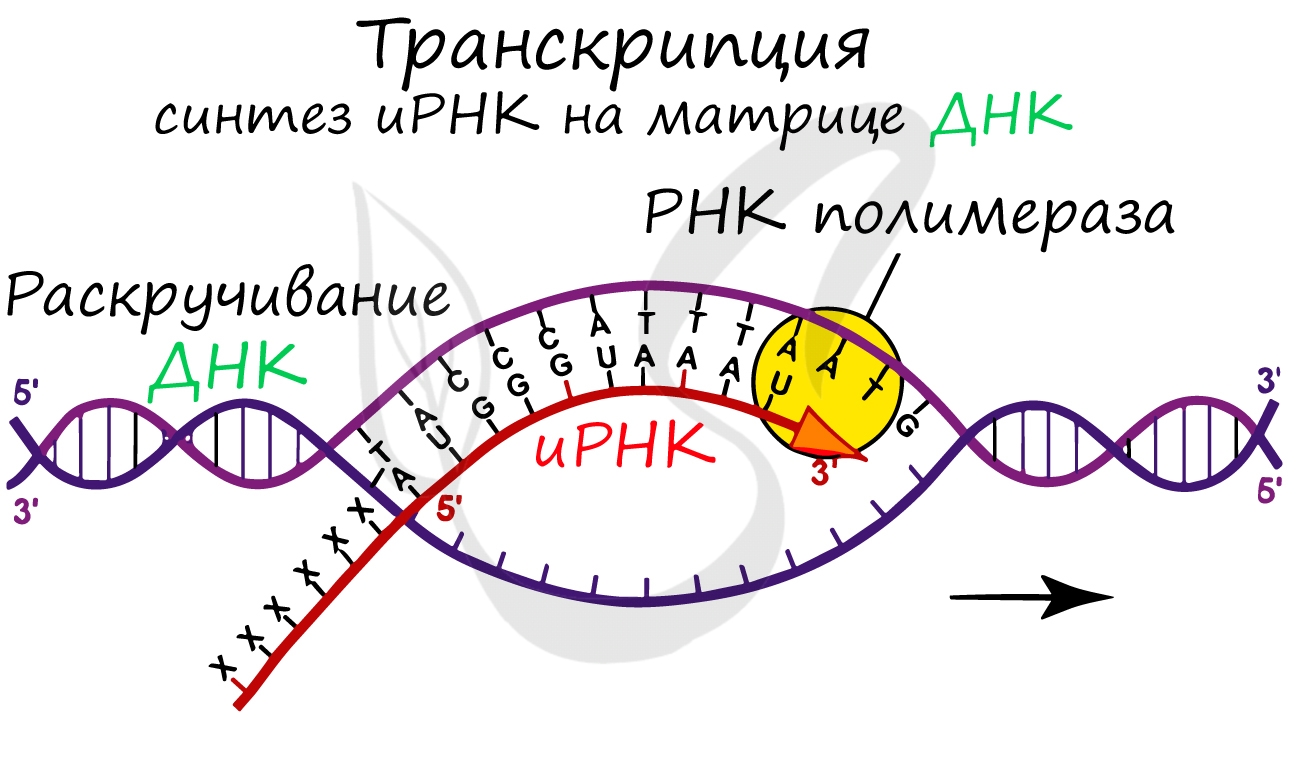
До начала непосредственно транскрипции происходит подготовительный этап: фермент РНК-полимераза узнает особый участок молекулы ДНК – промотор и связывается с ним. После связывания с промотором происходит раскручивание молекулы ДНК, состоящей из двух
цепей: транскрибируемой и смысловой. В процессе транскрипции принимает участие только транскрибируемая цепь ДНК.
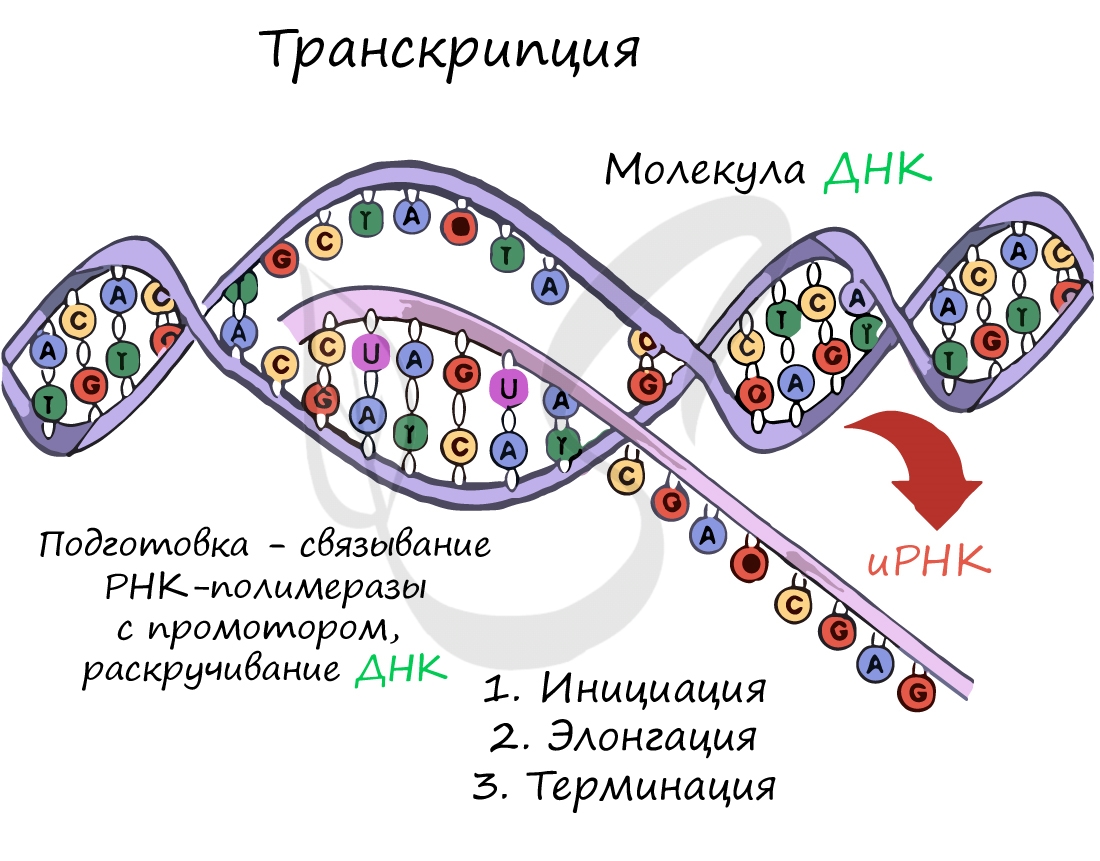
Транскрипция осуществляется в несколько этапов:
- Инициация (лат. injicere — вызывать)
- Элонгация (лат. elongare — удлинять)
- Терминация (лат. terminalis — заключительный)
Образуется несколько начальных кодонов иРНК.
Нити ДНК последовательно расплетаются, освобождая место для передвигающейся РНК-полимеразы. Молекула иРНК
быстро растет.
Достигая особого участка цепи ДНК – терминатора, РНК-полимераза получает сигнал к прекращению синтеза иРНК. Транскрипция завершается. Синтезированная иРНК направляется из ядра в цитоплазму.
Трансляция (от лат. translatio — перенос, перемещение)
Куда же отправляется новосинтезированная иРНК в процессе транскрипции? На следующую ступень – в процесс трансляции.
Он заключается в синтезе белка на рибосоме по матрице иРНК. Последовательность кодонов иРНК переводится в последовательность
аминокислот.
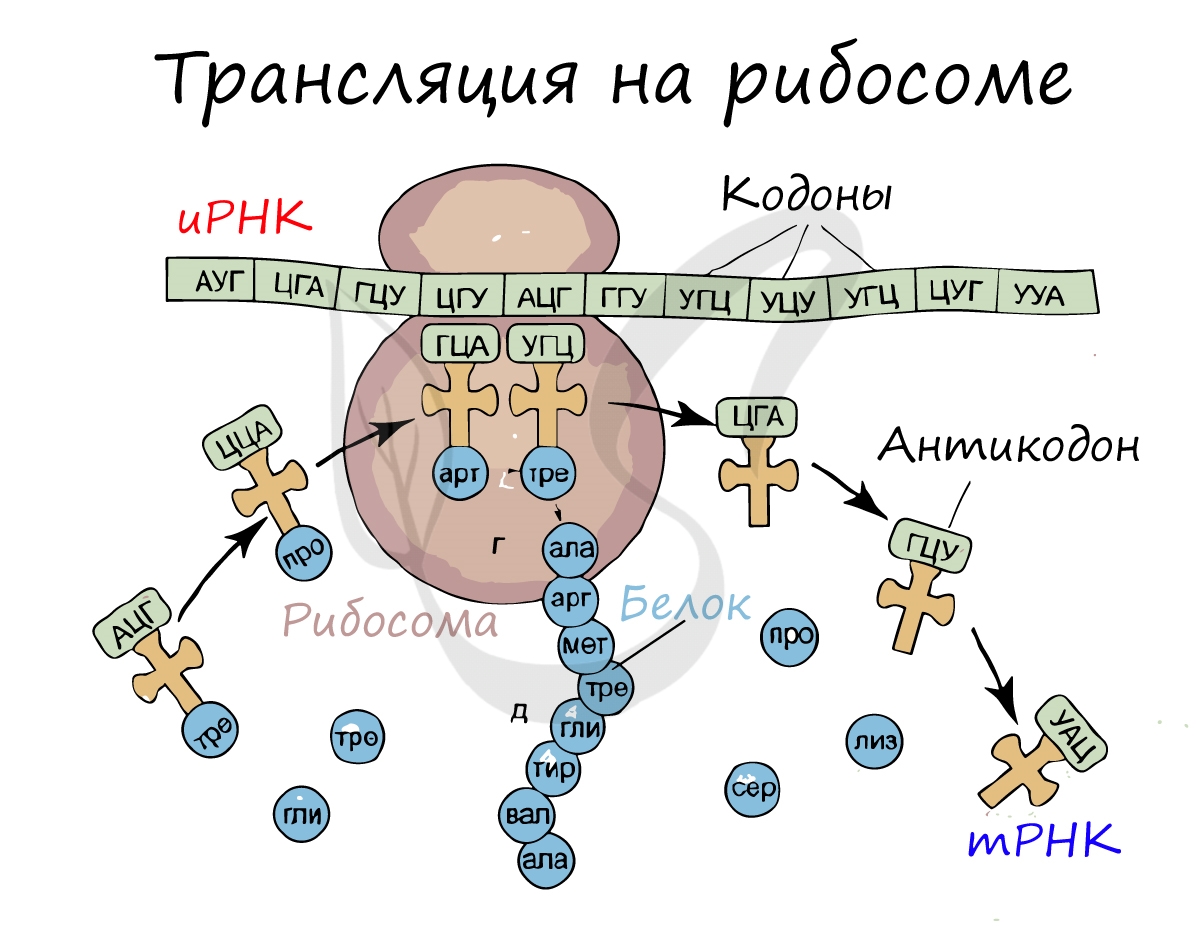
Перед процессом трансляции происходит подготовительный этап, на котором аминокислоты присоединяются к соответствующим молекулам тРНК. Трансляцию можно разделить на несколько стадий:
- Инициация
- Элонгация
- Терминация
Информационная РНК (иРНК, синоним – мРНК (матричная РНК)) присоединяется к рибосоме, состоящей из двух субъединиц.
Замечу, что вне процесса трансляции субъединицы рибосом находятся в разобранном состоянии.
Первый кодон иРНК, старт-кодон, АУГ оказывается в центре рибосомы, после чего тРНК приносит аминокислоту,
соответствующую кодону АУГ – метионин.
Рибосома делает шаг, и иРНК продвигается на один кодон: такое в фазу элонгации происходит десятки тысяч раз.
Молекулы тРНК приносят новые аминокислоты, соответствующие кодонам иРНК. Аминокислоты соединяются друг с другом: между ними образуются пептидные связи, молекула белка растет.
Доставка нужных аминокислот осуществляется благодаря точному соответствию 3 нуклеотидов (кодона) иРНК 3 нуклеотидам (антикодону) тРНК. Язык перевода между иРНК и тРНК выглядит как: А (аденин) – У (урацил), Г (гуанин) – Ц (цитозин).
В основе этого также лежит принцип комплементарности.
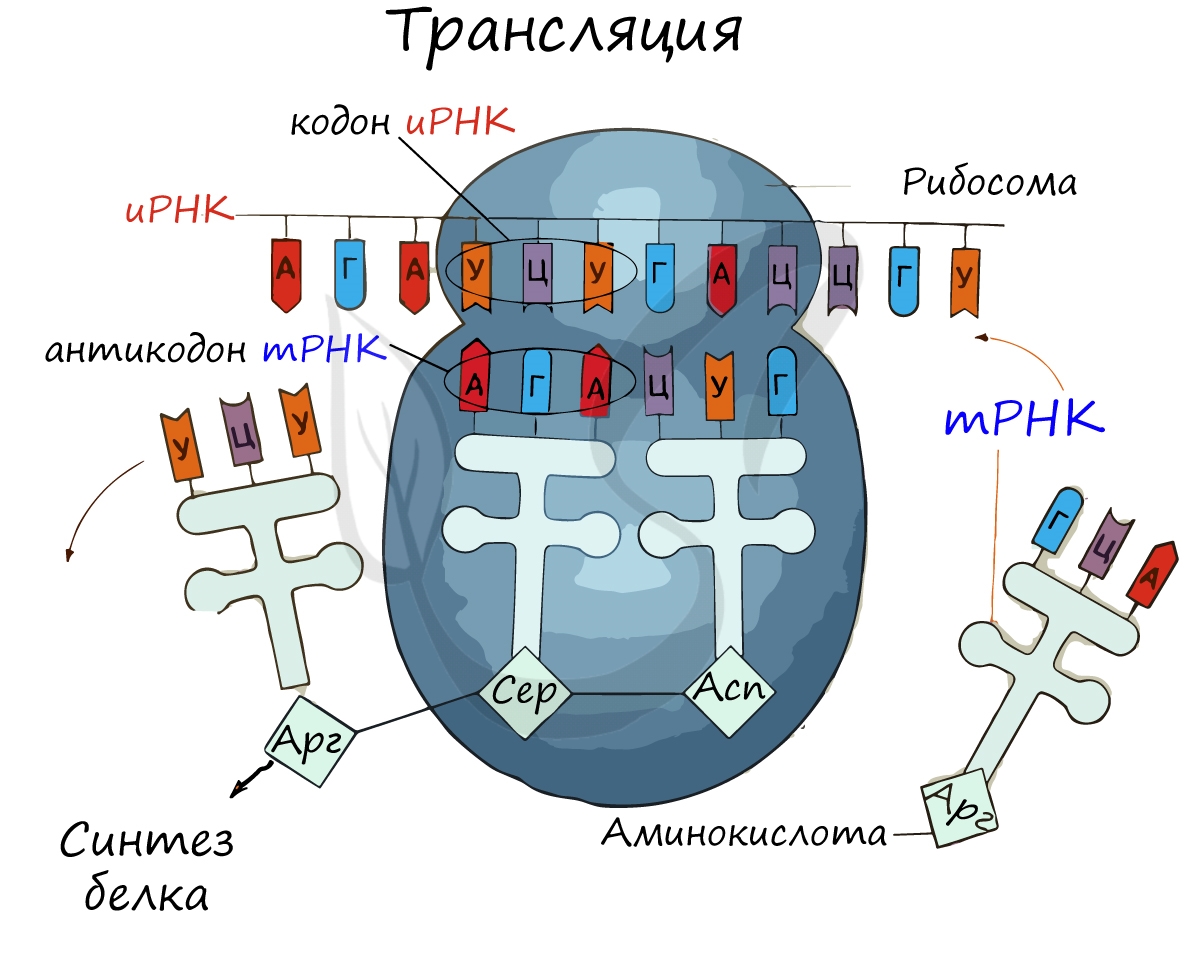
Движение рибосомы вдоль молекулы иРНК называется транслокация. Нередко в клетке множество рибосом садятся на одну молекулу
иРНК одновременно – образующаяся при этом структура называется полирибосома (полисома). В результате происходит одновременный синтез множества одинаковых белков.
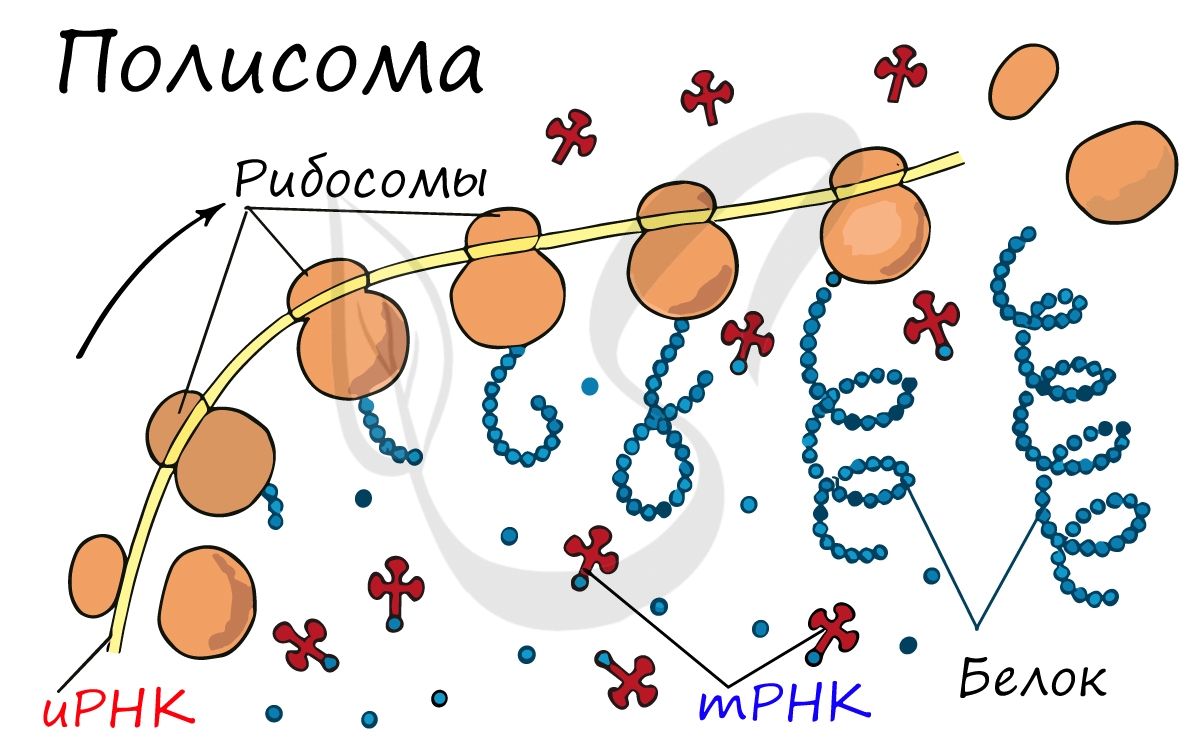
Синтез белка – полипептидной цепи из аминокислот – в определенный момент завершатся. Сигналом к этому служит попадание
в центр рибосомы одного из так называемых стоп-кодонов: УАГ, УГА, УАА. Они относятся к нонсенс-кодонам (бессмысленным), которые не кодируют ни одну аминокислоту. Их функция – завершить синтез белка.
Существует специальная таблица для перевода кодонов иРНК в аминокислоты. Пользоваться ей очень просто, если вы запомните, что
кодон состоит из 3 нуклеотидов. Первый нуклеотид берется из левого вертикального столбика, второй – из верхнего горизонтального,
третий – из правого вертикального столбика. На пересечении всех линий, идущих от них, и находится нужная вам аминокислота 🙂
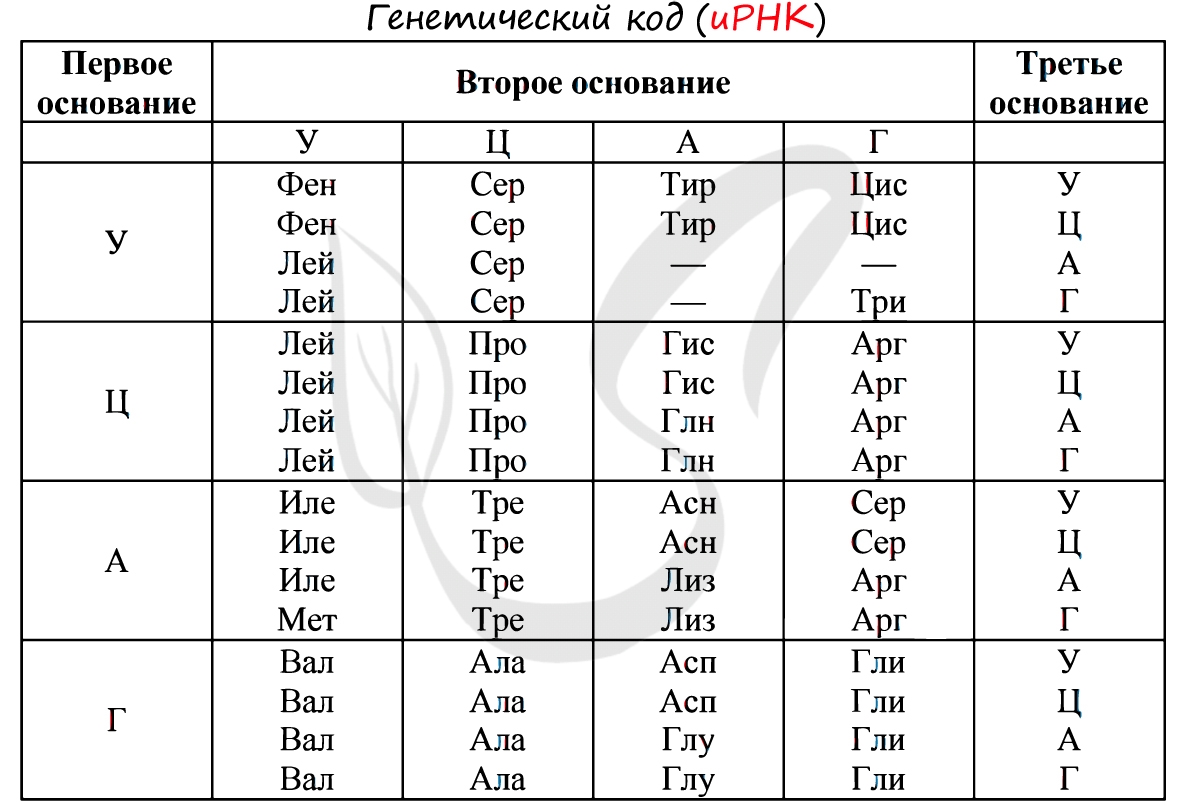
Давайте потренируемся: кодону ЦАЦ соответствует аминокислота Гис, кодону ЦАА – Глн. Попробуйте самостоятельно найти
аминокислоты, которые кодируют кодоны ГЦУ, ААА, УАА.
Кодону ГЦУ соответствует аминокислота – Ала, ААА – Лиз. Напротив кодона УАА в таблице вы должны были обнаружить прочерк:
это один из трех нонсенс-кодонов, завершающих синтез белка.
Примеры решения задачи №1
Без практики теория мертва, так что скорее решим задачи! В первых двух задачах будем пользоваться таблицей генетического кода (по иРНК),
приведенной вверху.
“Фрагмент цепи ДНК имеет следующую последовательность нуклеотидов: ЦГА-ТГГ-ТЦЦ-ГАЦ. Определите последовательность нуклеотидов
во второй цепочке ДНК, последовательность нуклеотидов на иРНК, антикодоны
соответствующих тРНК и аминокислотную последовательность соответствующего фрагмента молекулы белка, используя таблицу генетического кода”

Объяснение:
По принципу комплементарности мы нашли вторую цепочку ДНК: ГЦТ-АЦЦ-АГГ-ЦТГ. Мы использовали следующие правила при нахождении второй нити
ДНК: А-Т, Т-А, Г-Ц, Ц-Г.
Вернемся к первой цепочке, и именно от нее пойдем к иРНК: ГЦУ-АЦЦ-АГГ-ЦУГ. Мы использовали следующие правила при переводе ДНК в иРНК:
А-У, Т-А, Г-Ц, Ц-Г.
Зная последовательность нуклеотидов иРНК, легко найдем тРНК: ЦГА, УГГ, УЦЦ, ГАЦ. Мы использовали следующие правила перевода иРНК в тРНК:
А-У, У-А, Г-Ц, Ц-Г. Обратите внимание, что антикодоны тРНК мы разделяем запятыми, в отличие кодонов иРНК. Это связано с тем, что
тРНК представляют собой отдельные молекулы (в виде клеверного листа), а не линейную структуру (как ДНК, иРНК).
Пример решения задачи №2
“Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой синтезируется участок центральной петли тРНК, имеет
следующую последовательность нуклеотидов: ТАГ-ЦАА-АЦГ-ГЦТ-АЦЦ. Установите нуклеотидную последовательность участка тРНК, который синтезируется
на данном фрагменте, и аминокислоту, которую будет переносить эта тРНК в процессе биосинтеза белка, если третий триплет соответствует антикодону
тРНК”

Обратите свое пристальное внимание на слова “Известно, что все виды РНК синтезируются на ДНК-матрице. Фрагмент цепи ДНК, на которой
синтезируется участок центральной петли тРНК “. Эта фраза кардинально меняет ход решения задачи: мы получаем право напрямую и сразу
синтезировать с ДНК фрагмент тРНК – другой подход здесь будет считаться ошибкой.
Итак, синтезируем напрямую с ДНК фрагмент молекулы тРНК: АУЦ-ГУУ-УГЦ-ЦГА-УГГ. Это не отдельные молекулы тРНК (как было
в предыдущей задаче), поэтому не следует разделять их запятой – мы записываем их линейно через тире.
Третий триплет ДНК – АЦГ соответствует антикодону тРНК – УГЦ. Однако мы пользуемся таблицей генетического кода по иРНК,
так что переведем антикодон тРНК – УГЦ в кодон иРНК – АЦГ. Теперь очевидно, что аминокислота кодируемая АЦГ – Тре.
Пример решения задачи №3
Длина фрагмента молекулы ДНК составляет 150 нуклеотидов. Найдите число триплетов ДНК, кодонов иРНК, антикодонов тРНК и
аминокислот, соответствующих данному фрагменту. Известно, что аденин составляет 20% в данном фрагменте (двухцепочечной
молекуле ДНК), найдите содержание в процентах остальных нуклеотидов.

Один триплет ДНК состоит из 3 нуклеотидов, следовательно, 150 нуклеотидов составляют 50 триплетов ДНК (150 / 3). Каждый триплет ДНК
соответствует одному кодону иРНК, который в свою очередь соответствует одному антикодону тРНК – так что их тоже по 50.
По правилу Чаргаффа: количество аденина = количеству тимина, цитозина = гуанина. Аденина 20%, значит и тимина также 20%.
100% – (20%+20%) = 60% – столько приходится на оставшиеся цитозин и гуанин. Поскольку их процент содержания равен, то
на каждый приходится по 30%.
Теперь мы украсили теорию практикой. Что может быть лучше при изучении новой темы? 🙂
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
