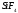Download Article
Download Article
Molecules are groups of atoms bonded together. Sometimes, molecules are bonded in a way that unevenly distributes charge and creates 2 poles (1 positive and 1 negative). When this happens, the molecule is considered polar. You can determine the polarity of a molecule by analyzing its bonds, testing how it interacts with other polar substances, or observing its reaction to an electromagnetic field.
-

1
Write the symbols for all atoms in the molecule. Atomic symbols for atoms can be found on the periodic table. These symbols are used to represent each atom in a Lewis dot structure. Be sure not to mix up the symbols, as this would cause confusion.[1]
- For example, if you are looking at a water molecule, you would write out O, H, and H.
-

2
Find the central atom. The central atom is the atom that all (or at least most) of the other atoms are bonded to. Those atoms may or may not be bonded to each other as well. As a rule of thumb, central atoms are usually atoms with low electronegativity.[2]
- The water molecule breaks this general trend since the oxygen atom (the most electronegative atom in the molecule) is the center atom.
- Carbon dioxide is an example of a molecule that follows the trend of center atoms being less electronegative. In this case, carbon is the center atom.
Advertisement
-

3
Add all of the bonds. Use the octet rule to determine the number and type of bonds present. Each atom’svalence shell should contain 8 electrons for the molecule to be stable. Some atoms may be double or triple bonded to achieve this.[3]
- In a water molecule, add a single bond from the oxygen to both hydrogens. The hydrogens are not bonded to each other.
-

4
Include unbound electrons. While most electrons are used in bonding, some atoms have a set of non-bonding electrons. These electrons should also be included in the Lewis structure, as they are very important when determining polarity. Represent all electrons (bonded and unbonded) with dots around their respective atoms.[4]
- Oxygen has 2 lone pair electrons. This means they are not used for bonding, but stay attached to the oxygen.
-

5
Look for dipoles. A dipole exists when electrons are unevenly distributed from one side of the molecule to the other. If this is present, then the molecule is polar. If the distribution looks even, the molecule is nonpolar.[5]
- Since electrons are more attracted to oxygen than hydrogen, they tend to congregate on that end of the molecule. That gives the oxygen a negative charge and the hydrogens a positive charge, creating a dipole. Thus, water is polar.
Advertisement
-

1
Fill a beaker with water. Water is a polar solvent. Put 100 mL of water into a clean beaker. Set the beaker aside to come back to later.[6]
-

2
Add a nonpolar solvent to a new beaker. Nonpolar solvents include things like toluene, gasoline, and oils. Add 100 mL of a chosen nonpolar solvent to another beaker. Let this beaker sit beside the water beaker.[7]
- Many nonpolar solvents fall into the category of volatile organic compounds (VOCs) and are quite dangerous. Be careful when heating them, and always wear a mask and gloves.
- For example, you could put vegetable oil into the second container. It is not volatile, but still acts as a nonpolar solvent.
- Acetone is also relatively safe organic solvent, but you should still keep it away from fire and wear your mask and gloves. Acetone is a volatile compound.
-

3
Place equal amounts of the substance into each beaker. Put the substance in question into the beaker filled with water and the beaker filled with the nonpolar solvent. Be sure to use the same amount in each beaker for consistency. You can start by adding 10-20 mL into each new beaker.[8]
- For example, you could put 20 mL of isopropyl alcohol into each beaker.
-

4
Stir and/or heat the mixtures. The solvents may need to be heated or stirred to spur interaction. If this is the case, be sure that you stir and heat the solvents to the same degree. That said, heating organic solvents, such as toluene, is very dangerous and you should exercise caution.[9]
- There is no need to heat when testing isopropyl alcohol. Stirring is sufficient.
- If heating, use a hot plate and heat slowly. Do not heat organic solvents with a flame.
-

5
Allow both beakers to cool. Once the substance seems to have interacted with one or both of the solvents, let them each cool. This will give the substance a chance to separate from the solvent if it is not compatible. It also makes the samples easier for you to handle.[10]
-

6
Observe the outcomes. Look for any solids or liquids separating from the solvent. This indicates that the substance is not compatible with that solvent. Since polar molecules are compatible with polar solvents and nonpolar molecules are compatible with nonpolar solvents, you can deduce that any substance that dissolves in water is polar. Any substance that does not dissolve in water, but dissolves in gasoline, toluene, acetone, or another nonpolar solvent is nonpolar.[11]
- Once both beakers settle, you will notice that the isopropyl alcohol dissolved completely in the water. However, there will be 2 distinct layers where the alcohol separated from the vegetable oil in the second beaker. This shows that isopropyl alcohol is polar.
Advertisement
-

1
Bring the substance close to a magnet. If you bring a substance close to a magnet or magnetically charged object, you may be able to tell if it is polar or nonpolar. Place the substance on a bench and bring the magnet close. Avoid touching the substance with the magnet.
-

2
Look for any interaction. If there is any attraction or repulsion from the magnet, your substance is polar. However, that does not mean that the substance is nonpolar if the magnet does not interact. Some polar molecules are not polarized enough to interact with a weak magnet.
- For example, if you have a running stream of water, a magnet will cause the stream to bend away from the magnet. This shows a clear interaction.
-

3
Heat the substance in question in a microwave. Microwaves work by using high-frequency electromagnetic radiation to cause polar molecules to spin. The spinning creates friction, which creates heat. To test the polarity of your substance, place it in the microwave.[12]
- Never put metals, flammables, or explosives into a microwave.
- If you put water in the microwave, you will notice that it gets hot. It is polar.
- If you try putting baby oil in the microwave, you will notice that the microwave doesn’t seem to heat it very well. It is nonpolar.
-

4
Observe the substance. Look for signs of deformation or melting. Check to see whether the substance is hot. If the microwave affected the substance, it is polar.[13]
- When the microwave comes on, the substance will be subjected to radiation. If it is a polar substance, the radiation will make the molecules spin (though this will not be visible). If the substance is nonpolar, the microwaves will have little effect.
Advertisement
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
About This Article
Thanks to all authors for creating a page that has been read 49,510 times.
Did this article help you?
Как определить полярность молекул
Полярность молекул – это несимметричное распределение электронной плотности, возникающее из-за различной электроотрицательности элементов, входящих в состав молекулы. Иными словами, когда один элемент как бы притягивает к себе электрон другого, вдоль невидимой оси, соединяющей центры их атомов. Как можно определить, является ли та или иная молекула полярной?

Инструкция
Прежде всего посмотрите на формулу молекулы. Легко можно понять, что если она образована атомами одного и того же элемента (например, N2, O2, Cl2 и т.п.), то она неполярна, поскольку электроотрицательность одинаковых атомов также одинакова. Поэтому смещения электронной плотности к одному из них в данном случае быть не может.
Если же молекулы состоят из разных атомов, то тут необходимо представить ее структурную форму. Она может быть как симметричной, так и несимметричной.
В том случае, если молекула симметрична (например, СО2, СН4, BF3 и т.п.), молекула является неполярной; если же она несимметрична (из-за наличия неспаренных электронов или неподеленных пар электронов), то такая молекула полярная. Характерные примеры – H2O, NH3, SO2.
А как быть в тех случаях, когда в симметричной неполярной молекуле один из боковых атомов заменяется каким-либо другим атомом? Возьмите, к примеру, молекулу метана, в структурном виде представляющую собой тетраэдр. Это симметричная фигура и, казалось бы, ее неполярность не должна измениться, ведь плоскость симметрии по-прежнему проходит через центральный атом углерода и тот атом, который заменил водород.
Поскольку электроотрицательность элемента-«заменителя» отличается от электроотрицательности водорода, в молекуле произойдет перераспределение электронной плотности и, соответственно, изменится ее геометрическая форма. Поэтому такая молекула станет полярной. Характерные примеры: СН3Cl (хлорметан), CH2Cl2 (дихлорметан), CHCl3 (трихлорметан, хлороформ).
Ну а если последний атом водорода также будет заменен хлором, то образовавшийся тетрахлорметан (четыреххлористый углерод) снова станет симметричной неполярной молекулой! Чем больше разница в электроотрицательности элементов, составляющих несимметричную молекулу, тем более полярной будет связь между этими элементами (и, соответственно, сама молекула).
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Полярные и неполярные молекулы – две группы, на которые подразделяются все диэлектрики.
Полярные по-другому называются дипольными. А неполярные являются нейтральными или бездипольными.
Что такое полярность в химии
Полярность – свойство, показывающее изменение распределения электронной плотности около ядер, если сравнивать с изначальным ее распределением в образующих данную связь нейтральных частицах.
Поляризуемость — способность поляризоваться под воздействием электрического поля.
Мерой полярности называется электрический момент диполя. В нейтральных соединениях он равен нулю. Его значение зависит от разности электроотрицательностей элементов.
Длина диполя — расстояние между его полюсами. Данная характеристика также влияет на степень полярности.
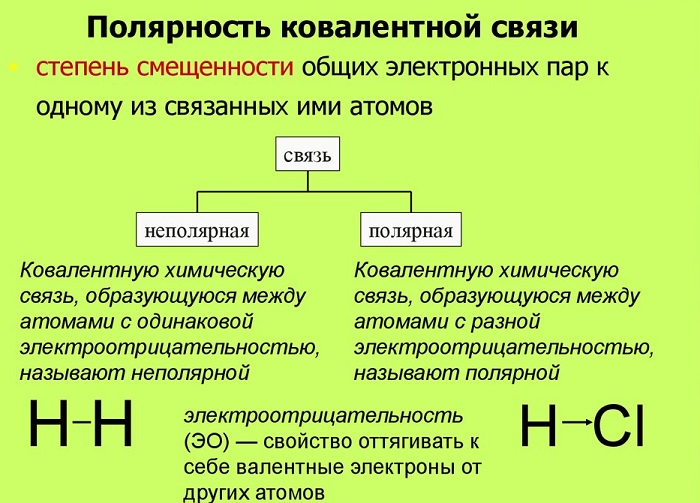
Любое соединение состоит из ядра (положительные частицы) и электронов (отрицательные частицы). И положительные, и отрицательные частицы имеют свой электрический центр тяжести.
Если центры тяжести частиц совпадают, то соединение считается неполярным. Если же полюса не накладываются друг на друга, то в этом случае речь идет о дипольной связи.
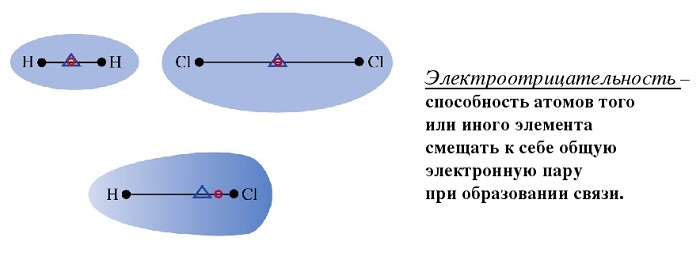
Примеры полярных молекул
Эта связь образуется, если вещество состоит из атомов разных элементов и ассиметрична (имеются неспаренные электроны). Такие соединения имеют угловую, изогнутую геометрическую форму.
Например, это такие газы как NH3, SO2, NO2 и жидкость – вода.
Примеры неполярных молекул
В качестве примера таких связей можно привести молекулы, состоящие из одинаковых атомов: H2, Cl2, O2, N2, F2 и т. д.
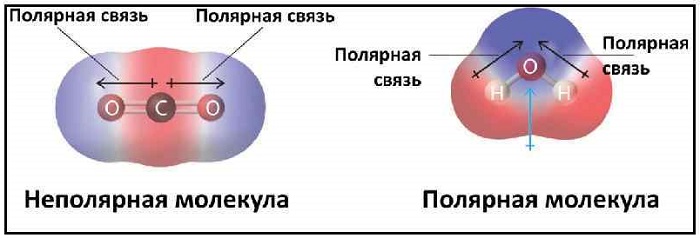
Эта связь также может встречаться в соединениях, состоящих из атомов разных элементов и при этом являющихся симметричными (линейные, тетраэдрические и т. д.). Такими веществами являются: BeH2, BF3, CH4, CO2(углекислый газ) и SO3.
При нейтральной связи электронное облако равномерно распределяется между ядрами всех атомов данного вещества. Поэтому ядра действуют на него в равной мере.
Как определить полярность молекулы и от чего она зависит
Чтобы определить, является ковалентная связь дипольной или нет, необходимо посмотреть на химическую формулу вещества.
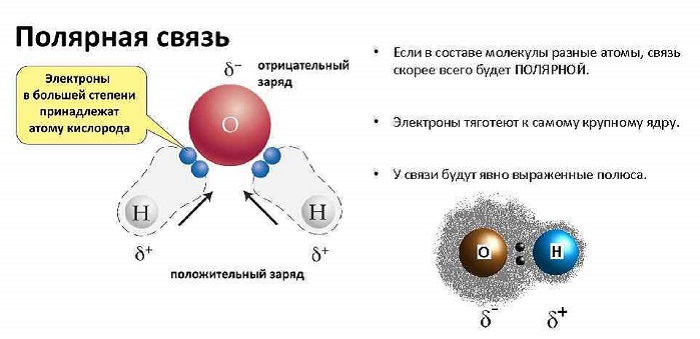
Если молекула состоит из атомов одного и того же вещества, то она в любом случае нейтральна.
Если же молекулярное строение является сложным, то речь может идти как о полярной, так и неполярной ковалентной связи. Это зависит от геометрической формы.
Следует
отличать полярность молекулы от
полярности связи. Для двухатомных
молекул типа АВ эти понятия совпадают,
как это уже показано на примере молекулы
HCl.
В таких молекулах чем
больше разность электроотрицательностей
элементов (∆ЭО), тем больше электрический
момент диполя.
Например, в ряду HF,
HCl,
HBr,
HI
он уменьшается в той же последовательности,
как и относительная электроотрицательность.
Молекулы
могут быть полярными и неполярными в
зависимости от характера распределения
электронной плотности молекулы.
Полярность
молекулы характеризуется значением
электрического момента диполя μмол,
который равен векторной сумме электрических
моментов диполей всех связей и
несвязывающих электронных пар,
расположенных на гибридных АО: →
→
n
m
м-лы
= (связи)i
+ (несвяз.эл.пары)j.
i=1
j=1
Результат
сложения зависит от полярности связей,
геометрического строения молекулы,
наличия неподеленных электронных пар.
Большое влияние на полярность молекулы
оказывает её симметрия.
Например,
молекула СО2
имеет симметричное линейное строение:
![]() .
.

Поэтому,
хотя связи С=О и имеют сильно полярный
характер, вследствие взаимной компенсации
их электрических моментов диполя
молекула СО2
в целом неполярна (
м-лы = связи
= 0). По этой
же причине неполярны высокосимметричные
тетраэдрические молекулы СН4,
СF4,
октаэдрическая молекула SF6
и т. д.
В
угловой молекуле Н2О
полярные связи О–Н располагаются под
углом 104,5º: →
→
n=2
m=2
Н2О
= O–H
+
несвяз.эл.пары
0.
i=1
j=1
Поэтому
их моменты взаимно не компенсируются
и молекула оказывается полярной ( ).
).
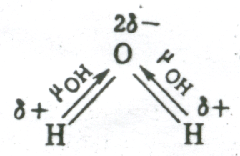


Электрическим
моментом диполя обладают также угловая
молекула SO2,
пирамидальные молекулы NH3,
NF3
и т. д. Отсутствие такого момента
свидетельствует
о высокосимметричной структуре молекулы,
наличие электрического момента диполя
– о несимметричности структуры молекулы
(табл. 3.2).
Таблица
3.2
Строение
и ожидаемая полярность молекул
|
Тип |
Пространственная |
Ожидаемая |
Примеры |
|
|
Линейная |
Неполярная |
|
|
|
Линейная |
Полярная |
|
|
|
Линейная |
Неполярная |
|
|
|
Угловая |
Полярная |
|
|
|
Линейная |
Полярная |
|
|
|
Плоскотреугольная |
Неполярная |
|
|
|
Тригонально-пирамидальная |
Полярная |
|
|
|
Тетраэдрическая |
Неполярная |
|
На
значение электрического момента диполя
молекулы сильно влияют несвязывающие
электронные пары, расположенные на
гибридных орбиталях и имеющие собственный
электрический момент диполя
 (направление вектора – от ядра, по оси
(направление вектора – от ядра, по оси
расположения гибридной АО). Например,
молекулыNH3
и NF3
имеют одинаковую тригонально-пирамидальную
форму, полярность связей N–H
и N–F
также примерно одинакова. Однако
электрический момент диполя NH3
равен 0,49·10-29
Кл·м, а NF3
всего 0,07·10-29
Кл·м. Это объясняется тем, что в NH3
направление электрического момента
диполя связывающей N–H
и несвязывающей электронной пары
совпадает и при векторном сложении
обусловливает большой электрический
момент диполя. Наоборот, в NF3
моменты связей N–F
и электронной пары направлены в
противоположные стороны, поэтому при
сложении они частично компенсируются
(рис. 3.15).
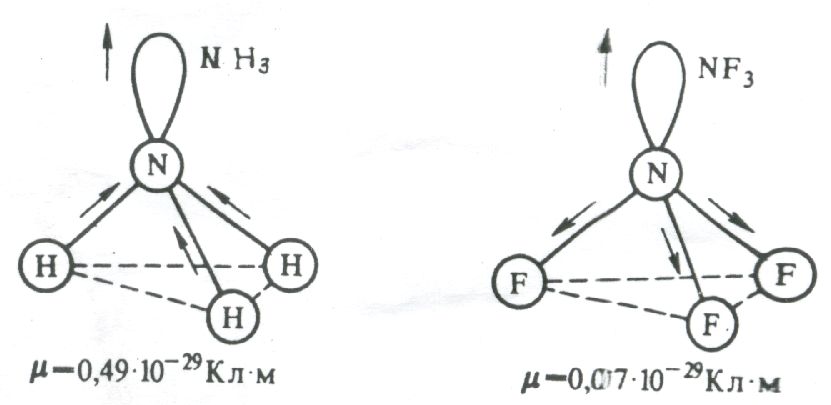

Рис 3.15. Сложение
электрических моментов диполя связывающих
и несвязывающих электронных пар молекул
NH3иNF3
Неполярную молекулу
можно сделать полярной. Для этого её
надо поместить в электрическое поле с
определенной разностью потенциалов.
Под действием электрического поля
«центры тяжести» положительных и
отрицательных зарядов смещаются и
возникает индуцированный или наведенный
электрический момент диполя. При снятии
поля молекула опять станет неполярной.
Под
действием внешнего электрического поля
полярная молекула поляризуется, т. е. в
ней происходит перераспределение
зарядов, и молекула приобретает новое
значение электрического момента диполя,
становится ещё более полярной. Это может
происходить и под влиянием поля,
создаваемого приблизившейся полярной
молекулой. Способность молекул
поляризоваться под действием внешнего
электрического поля называют
поляризуемостью.
Полярностью
и поляризуемостью молекул обусловлено
межмолекулярное взаимодействие. С
электрическим моментом диполя молекулы
связана реакционная способность
вещества, его растворимость. Полярные
молекулы жидкостей благоприятствуют
электролитической диссоциации
растворенных в них электролитов.
Независимо от того, является ли молекула полярной, полностью зависит от полярности связей, обнаруженных в данном соединении, и некоторых параметров этих связей. Но прежде чем углубляться в определение полярности, вот краткое объяснение полярности.
Что делает что-то полярным?
Молекула полярна, если одна ее часть имеет частичный положительный заряд, а другая часть имеет частичный отрицательный заряд.
В связьатомы могут либо делить электроны (ковалентные), либо отдавать их (ионные). Таким образом, атом, который удерживает электроны ближе, будет более отрицательно заряжен, чем другой атом.
Электроотрицательность – это мера того, насколько конкретный элемент хочет электронов. В разделе «Ресурсы» вы найдете периодическую таблицу, в которой указывается электроотрицательность каждого элемента. Чем выше это число, тем сильнее атом этого элемента будет «сковывать» электроны в связи.
Значения электроотрицательности могут помочь вам определить, является ли связь между двумя атомами ковалентной или полярной ковалентной. Для этого вы найдете абсолютную величину разницы между электроотрицательностями двух атомов. Основываясь на этой разнице, в следующей таблице указано, является ли связь полярной ковалентной, ковалентной или ионной.
|
Тип облигации |
Разница электроотрицательности |
|
чистый ковалентный |
<0.4 |
|
полярный ковалентный |
от 0,4 до 1,8 |
|
ионный |
>1.8 |
https://chem.libretexts.org/Courses/Oregon_Institute_of_Technology/OIT%3A_CHE_202_-_General_Chemistry_II/Unit_6%3A_Molecular_Polarity/6.1%3A_Electronegativity_and_Polarity
Например, поскольку разница электроотрицательностей между H (2.2) и O (3.44) составляет 1,24, эта связь будет полярно ковалентной. Но что это означает для молекулы, содержащей связь O-H?
Полярность связи vs. Полярность молекулы
Хотя связь внутри молекулы может быть полярной, сама молекула – нет. Почему это?
Частичная оплата или дипольные моменты (в результате полярности связи) важны для определения молекулярной полярности. Но, все облигации необходимо учитывать. Если векторы частичного заряда / дипольного момента в конечном итоге сокращаются, то молекула может быть неполярной.
Чтобы предсказать дипольные моменты, вы должны изучить геометрию связей, которую вы можете найти с помощью теории отталкивания электронных пар валентных оболочек (VSEPR). Эта теория начинается с идеи, что электронные пары в валентной оболочке атома отталкиваются друг от друга. Электронные пары вокруг атома будут таким образом ориентироваться, чтобы минимизировать силы отталкивания.
Взгляните на воду. Вода связана с двумя атомами водорода, а также имеет две неподеленные пары электронов. Из-за двух заемных пар молекула имеет тетраэдрическую изогнутую форму. Чтобы определить, полярна ли молекула, вы должны посмотреть на парциальные векторы заряда.
Во-первых, в молекуле есть две электронные пары, что означает, что в этом направлении будет большой вектор частичного заряда. Далее, кислород более электроотрицателен, чем водород, и будет захватывать электроны. Это означает, что вектор частичного заряда на каждой связи будет иметь компонент, направленный в сторону кислорода.
В то время как внутренний компонент вектора на каждой связи аннулируется, часть, указывающая на кислород, не будет. Таким образом, будет чистый частичный отрицательный заряд на кислородной стороне молекулы и чистая частичная позиция на водородной стороне молекулы. Таким образом, вода – полярная молекула.
А как насчет CO2?
Во-первых, CO2 не имеет неподеленных пар, поскольку все электроны участвуют в двух наборах двойных связей между C и O. Это означает, что CO2 имеет линейную геометрию.
Далее, связь C-O является полярно-ковалентной, так как разница в электроотрицательностях составляет 0,89. Теперь вам нужно отобразить дипольный момент, чтобы построить геометрию молекулы. Один конец молекулы имеет частичный отрицательный заряд, направленный в сторону кислорода. Но это верно и для другого конца. В результате дипольные моменты уравновешиваются.
Таким образом, CO2 представляет собой неполярную молекулу.
Проверьте себя: CH4 полярный или неполярный?
Подсказка: нарисуйте форму молекулы, а затем вычислите разницу электроотрицательностей.
Ответ: Поскольку в этой тетраэдрической молекуле все дипольные моменты сокращаются, CH4 неполярный.
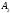
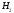 ,
,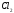 ,
,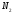
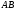
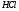 ,
,
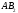
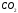 ,
,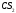 ,
,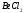
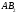
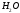 ,
,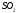 ,
,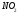
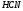
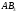
 ,
,
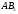
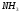 ,
, ,
,
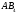
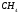 ,
,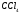 ,
,