Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-

1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-

2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-

3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-

4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-

5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-

6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-

1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-

2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-

3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 950 363 раза.
Была ли эта статья полезной?
| Протон (p, p+) | |
|---|---|
 |
|
| Семья | фермион |
| Группа | адрон, барион, N-барион, нуклон |
| Участвует во взаимодействиях | Сильное, слабое, электромагнитное и гравитационное |
| Античастица |
антипротон  |
| Масса |
938,272 088 16(29) МэВ[1] 1,672 621 923 69(51)⋅10−27 кг[2] 1,007 276 466 621(53) а. е. м.[3] |
| Время жизни | ∞ (не менее ⋅1034 лет[4]) |
| Обнаружена | Эрнест Резерфорд в 1919 году |
| В честь кого или чего названа | от др.-греч. πρῶτος «первый» |
| Квантовые числа | |
| Электрический заряд |
+1e +1,6021766208(98)⋅10−19 Кл |
| Барионное число | 1 |
| Спин | ½ ħ |
| Магнитный момент | 2,792 847 344 63(82) ядерного магнетона[5] или 1,410 606 797 36(60)×10-26 Дж/Тл[6] |
| Внутренняя чётность | 1 |
| Изотопический спин | ½ |
| Странность | 0 |
| Очарование | 0 |
| Другие свойства | |
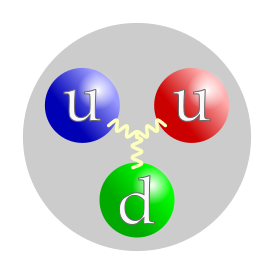
| Кварковый состав | uud |
| Схема распада | нет |
Прото́н (от др.-греч. πρῶτος «первый»[7]) — одна из трёх (вместе с нейтроном и электроном) элементарных частиц, из которых построено обычное вещество. Протоны входят в состав атомных ядер; порядковый номер химического элемента в таблице Менделеева равен количеству протонов в его ядре.
В физике протон обозначается 

Масса протона составляет 1,6726⋅10−27 кг или 938,27 МэВ, что примерно в 1836 раз больше массы электрона. Спин равен ½, поэтому протон является фермионом. Внутренняя чётность положительна.
В классификации элементарных частиц протон относится к адронам.
Он обладает способностью ко всем четырём фундаментальным взаимодействиям — сильному,
электромагнитному, слабому и гравитационному.
Электрический заряд его положителен и равен по модулю заряду электрона: e = +1,6022⋅10−19 Кл.
В отличие от, например, электрона, протон не является точечной частицей, а имеет внутреннюю структуру и конечные размеры.
Фундаментальные частицы, из которых построен протон — кварки и глюоны.
Какую именно величину считать размером протона, зависит от договорённости, но в любом случае это будет величина порядка 1 фм.
Наиболее точно измерен так называемый электрический радиус — 0,841 фм.
Протон стабилен, многочисленные эксперименты не выявили никаких свидетельств его распада.
Для объяснения этого факта было введено сохраняющееся барионное число (протону приписывается барионное число +1).
Название «протон» предложено Э. Резерфордом в 1920 году.
Свойства[править | править код]
Структура[править | править код]
Первоначально протон считался бесструктурной частицей.
Однако постепенно накапливались экспериментальные факты
(большая величина аномального магнитного момента,
результаты опытов по упругому и глубоко неупругому рассеянию), говорящие о том, что это не так.
По современным представлениям, элементарными единицами, из которых построены все сильно взаимодействующие частицы,
и протон в том числе, являются кварки.
В первоначальной версии кварковой модели считалось (и до сих пор часто говорят), что протон состоит из трёх кварков — двух верхних и одного нижнего (uud).
Хотя эта (так называемая «наивная») кварковая модель и позволяет неплохо описать некоторые свойства протона
(так, отношение магнитных моментов протона и нейтрона получается равным −3/2, что близко к экспериментальному значению −1,47[8]), на самом деле она не совсем правильна.
В действительности протон содержит, кроме этих трёх — валентных — кварков, множество глюонов и кварк-антикварковых пар (так называемых морских кварков).
Согласно данным, полученным в экспериментах по глубоко неупругому рассеянию, лишь около 40% импульса протона приходится на валентные кварки, 50% на глюоны и 10% на морские кварки[9].
Исследование коллаборации NNPDF[en] показало, что в состав протона могут временно входить очарованные кварки[10].
Кварки не могут покинуть протон из-за явления конфайнмента.
Физические характеристики[править | править код]
Масса[править | править код]
Масса протона, выраженная в разных единицах, составляет[11]:
- 938,272 088 16(29) МэВ[12];
- 1,007 276 466 621(53) а. е. м.[3];
- 1,672 621 923 69(51)⋅10−27 кг[2];
- 1836,152 673 43(11) массы электрона[13].
Магнитный момент[править | править код]
Магнитный момент протона определяется путём измерения отношения резонансной частоты прецессии магнитного момента протона
в заданном однородном магнитном поле и циклотронной частоты обращения протона по круговой орбите в том же самом
поле[14][обновить данные]. Он равен 2,792 847 344 63(82) ядерного магнетона[5]
или 1,410 606 797 36(60)×10-26 Дж/Тл[6].
Размер[править | править код]
Протон, как и любая квантовомеханическая система, не имеет чётких границ — составляющие его кварки размазаны в пространстве
в соответствии со своей волновой функцией. Поэтому нельзя однозначно сказать, что такое размер протона — это вопрос соглашения.
В качестве размера можно выбрать радиус твёрдого кора ядерных сил, электрический либо магнитный радиус
или другую характерную величину размерности длины. Однако чаще всего за размер элементарной частицы принимают
среднеквадратический радиус распределения электрического заряда (электрический радиус)[15].
Измерения электрического радиуса протона с помощью атомов обычного водорода, проводимые разными методами с 1960-х годов, привели
(CODATA-2014) к результату 0,8751 ± 0,0061 фм[16].
Первые эксперименты с атомами мюонного водорода дали для этого радиуса на 4 %
меньший результат 0,84184 ± 0,00067 фм[17][18].
Причины этого различия окончательно не выяснены. Измерения лэмбовского сдвига в атоме обычного водорода, проведённые в 2019 году,
дали значение 0,833±0,010 фм, что хотя и согласуется с данными, полученными из мюонного водорода, но по-прежнему противоречит
данным старых экспериментов[19].
Позже в 2019 году были опубликованы результаты эксперимента PRad, выполненного в Лаборатории Джефферсона группой учёных под руководством
А. Гаспаряна, в котором для определения радиуса протона использовалось рассеяние электронов.
Результат оказался равен 0,831±0,007±0.012 фм[20].
В наборе данных CODATA-2018 было зафиксировано значение радиуса, близкое к измеренному на основе спектроскопии мюонного водорода — 0,8414 ± 0.0019 фм[21], и в целом проблема зарядового радиуса протона считается решённой, однако отдельные нестыковки в измерениях всё ещё существуют и обсуждаются[22].
Слабый заряд[править | править код]
Так называемый слабый заряд протона 
определяющий его участие в слабых взаимодействиях путём обмена Z-бозоном
(аналогично тому как электрический заряд частицы определяет её участие в электромагнитных взаимодействиях путём обмена фотоном),
составляет 0,0719 ± 0,0045, согласно экспериментальным измерениям нарушения чётности при рассеянии поляризованных электронов
на протонах[23]. Измеренная величина в пределах экспериментальной погрешности согласуется с теоретическими предсказаниями
Стандартной модели (0,0708 ± 0,0003)[23].
Время жизни[править | править код]
Свободный протон стабилен, экспериментальные исследования не выявили никаких признаков его распада.
Нижнее ограничение на время жизни — 2,9⋅1029 лет независимо от канала распада[4],
1,6⋅1034 лет для распада на позитрон и нейтральный пион, 7,7⋅1033 лет для
распада на положительный мюон и нейтральный пион[24].
Поскольку протон является наиболее лёгким из барионов, стабильность протона является следствием
закона сохранения барионного числа — протон не может распасться на какие-либо более лёгкие частицы (например, позитрон и нейтрино) без нарушения этого закона. Однако многие теоретические расширения Стандартной модели предсказывают процессы (пока не наблюдавшиеся), в которых барионное число не сохраняется и, следовательно, протон может распадаться.
Взаимодействия[править | править код]
Протон участвует во всех известных взаимодействиях — сильном, электромагнитном, слабом и гравитационном.
Благодаря сильному взаимодействию, протоны и нейтроны соединяются в атомные ядра.
Благодаря электромагнитному взаимодействию, ядра и электроны образуют атомы, из которых, в свою очередь, состоят молекулы и макроскопические тела.
Слабое взаимодействие протонов приводит, например, к процессам бета-распада.
Сильное[править | править код]
При низких энергиях сильное взаимодействие протонов проявляется как ядерные силы, связывающие протоны и нейтроны в атомных ядрах[7].
В отличие, например, от электромагнитных, ядерные силы нецентральны и зависят от спинов частиц (поэтому, в частности, протон и нейтрон с параллельно направленными спинами образуют связанное состояние — дейтрон, а с антипараллельными — нет).
Как показывает эксперимент, ядерные силы обладают свойством изотопической симметрии: они не меняются при замене протонов на нейтроны и наоборот.
Поэтому в теории ядерных сил протон и нейтрон часто рассматривают как состояния одной частицы
с изотопическим спином 1/2 (нуклона), отличающиеся его проекцией (у протона +1/2, у нейтрона −1/2)[7].
Ядерные силы можно описать как обмен пионами (модель Юкавы) и в меньшей степени также другими, более тяжёлыми мезонами[7].
Эмпирически найденный потенциал ядерных сил соответствует притяжению на больших расстояниях и сильному отталкиванию на меньших (около 0,5 фм)[25].
В рамках этой модели протон состоит из тяжёлой сердцевины (кора, от англ. core),
и окружающего его облака виртуальных мезонов (на больших расстояниях — пионов, ближе к центру ро-мезонов, омега-мезонов и других).
С другой стороны, при глубоко неупругом рассеянии частиц высоких энергий на протонах дело выглядит так,
как будто рассеяние происходит на некоторых точечных частицах, находящихся внутри протона. Фейнман назвал их партонами.
Это и есть кварки[7].
При столкновениях протонов высоких энергий друг с другом или с ядрами возникает сильно разогретая ядерная материя и, возможно, кварк-глюонная плазма.
Электромагнитное[править | править код]
Электрический заряд протона равен по абсолютной величине и противоположен по знаку заряду электрона.
Тот факт, что сумма зарядов протона и электрона равна нулю, проверен с большой точностью, поскольку он означает электрическую нейтральность обычной материи[26].
Разноимённые заряды притягиваются, поэтому протон и электрон могут образовать связанное состояние — атом водорода.
Если электрон заменить отрицательно заряженным мюоном, образуется похожая на водород система, но примерно в 200 раз меньших размеров — мюонный водород.
Вообще, атомы обычного вещества обязаны своим существованием электромагнитному притяжению между протонами ядра и электронами.
Электрически заряженные элементарные частицы со спином 1/2 описываются уравнением Дирака.
Согласно этому уравнению, магнитный момент такой частицы должен быть равнен 

называется ядерным магнетоном).
Однако магнитный момент протона, как было установлено ещё в 1930-х годах, сильно отличается от предсказания теории Дирака (он в 2,79 раза больше). Уже это подсказывает, что протон не является точечной частицей, а имеет какую-то внутреннюю структуру[7][27].
Прямое доказательство было получено в опытах Хофштадтера (Нобелевская премия по физике 1961 года)[28].
При помощи упругого рассеяния электронов большой энергии на протонах (что является своего рода аналогом электронного микроскопа)
было показано, что электрический заряд протона не сосредоточен в одной точке, а распределён в области радиусом около 0,8 фм[7]. То же самое относится и к магнитному моменту.
В теории электромагнитное взаимодействие протона описывается двумя функциями — электрическим и магнитным формфакторами, которые представляют собой фурье-образ распределения плотности заряда и магнитного момента внутри протона[29]. Можно рассмотреть среднеквадратические радиусы этих распределений — это так называемые электрический и магнитный радиусы протона.
Слабое[править | править код]
Протон, как и все адроны, участвует также в слабом взаимодействии.
Известным примером этого является электронный захват — процесс, когда протон, связанный в атомном ядре,
захватывает электрон с K-, L- или M-оболочки атома, превращаясь при этом в нейтрон и испуская нейтрино:

«Дырка» в K-, L- или M-слое, образовавшаяся при электронном захвате, заполняется электроном одного из вышележащих электронных слоев атома
с излучением характеристических рентгеновских лучей, соответствующих атомному номеру 
и/или оже-электронов. Известно свыше 1000 изотопов от 7
4Be до 262
105Db,
распадающихся путём электронного захвата. При достаточно высоких доступных энергиях распада
(выше 
позитронный распад 
Ещё один слабый процесс с участием протона — обратный бета-распад, при помощи которого детектируют нейтрино:

В основе вышеприведённых процессов лежит обмен W-бозоном.
Возможен также обмен Z-бозоном, который приводит к нарушающим чётность эффектам в упругом рассеянии
(например, асимметрии упругого рассеянния продольно поляризованных электронов на неполяризованном протоне).
Роль протонов[править | править код]
В астрофизике[править | править код]
Протон — одна из часто встречающихся во Вселенной частиц. Они содержатся как в звёздах,
так и в межзвёздном пространстве.
Первые протоны образовались в эпоху адронизации — спустя 10-6—1 cек после Большого Взрыва. Сначала количество протонов и антипротонов во Вселенной было примерно одинаковым, с небольшим избытком протонов; к концу этой эпохи почти все они аннигилировали, а оставшиеся протоны существуют по сей день. В эпоху первичного нуклеосинтеза (3—20 минут спустя) часть из них вошла в состав ядер элементов тяжелее водорода (дейтерия, гелия, лития)[30].
Протоны принимают участие в термоядерных реакциях, которые являются основным источником энергии, генерируемой звёздами.
В частности, реакции pp-цикла, который является источником почти всей энергии, излучаемой Солнцем, сводятся к
соединению четырёх протонов в ядро гелия-4 с превращением двух протонов в нейтроны.
В большом количестве протоны содержатся в солнечном ветре.
Также протоны являются основным компонентом первичных космических лучей — более 90% их составляют протоны.
В космических лучах встречаются протоны с энергиями до 1020 эВ, — на много порядков больше, чем можно достичь на современных ускорителях.
В химии[править | править код]
С точки зрения химии, протон есть положительный ион водорода (точнее, его лёгкого изотопа — протия) — H+.
Он отличается от остальных химически значимых ионов тем, что не содержит ни одного электрона.
Поэтому его размер на несколько порядков меньше.
Отсюда, например, его способность проникать вглубь других молекул, образуя водородные связи[31].
Протон является мощным акцептором электронов и, соответственно, участвует в реакциях
донорно-акцепторного взаимодействия.
Протонирование — присоединение протона к молекуле — имеет важное
значение во многих химических реакциях, например, при нейтрализации, электрофильном присоединении
и электрофильном замещении, образовании ониевых соединений[32].
Источником протонов в химии являются минеральные и органические кислоты.
В водном растворе кислоты способны к диссоциации с отщеплением протона, образующего катион гидроксония.
В газовой фазе протоны получают ионизацией — отрывом электрона от атома водорода.
Потенциал ионизации невозбуждённого атома водорода составляет 13,595 эВ.
При ионизации молекулярного водорода быстрыми электронами при атмосферном давлении и комнатной температуре
первоначально образуется молекулярный ион водорода (H2+) — физическая система, состоящая из двух протонов,
удерживающихся вместе на расстоянии 1,06 Å одним электроном. Стабильность такой системы, по Полингу,
вызвана резонансом электрона между двумя протонами с «резонансной частотой»,
равной 7⋅1014 Гц[33]. При повышении температуры
до нескольких тысяч градусов состав продуктов ионизации водорода изменяется в пользу протонов.
В экспериментальной физике частиц[править | править код]
Ввиду стабильности и простоты получения (из водорода), протоны
часто используются в экспериментальной физике элементарных частиц как в качестве мишени, так и в качестве частиц пучка.
В первом случае мишенью может служить какой-нибудь богатый водородом материал, например, жидкий водород, парафин или полиэтилен[34].
Пучки протонов высокой энергии создаются на ускорителях.
Они используются для изучения всевозможных процессов рассеяния, а также для получения пучков нестабильных частиц, таких, как пионы, каоны и гипероны[7].
Большая часть открытий в физике элементарных частиц до 1980-х годов сделана на протонных синхротронах[35]. Наиболее мощный на сегодня ускоритель — Большой адронный коллайдер (англ. Large hadron collider, LHC) — разгоняет протоны до энергии 6,5 ТэВ[36].
В медицине[править | править код]
Пучки ускоренных протонов применяются для лечения онкологических заболеваний (протонная терапия)[37][38].
История открытия[править | править код]
Идея о водородоподобной частице как составной части других атомов развивалась в течение долгого времени.
В 1815 году английский химик Уильям Праут предположил, что все атомы состоят из атомов водорода (которые он назвал «protyle»),
исходя из того, что атомные массы элементов приблизительно кратны массе атома водорода (гипотеза Праута)[39].
В 1886 году Ойген Гольдштейн открыл каналовые лучи (известные также как анодные лучи) и показал, что это —
положительно заряженные частицы. Вильгельм Вин в 1898 году доказал, что самые лёгкие из них — ионы водорода (то есть протоны).
Действуя на движущиеся протоны электрическими и магнитными полями, Вин измерил отношение заряда протона
к его массе[40].
В 1917 году Резерфорд заметил, что когда альфа-частицы попадают в воздух,
на сцинтилляционных детекторах появляются вспышки от других, более лёгких (судя по длине пробега) частиц.
В чистом азоте они появлялись чаще. В 1919 году Резерфорд сделал вывод:
Исходя из полученных до сих пор результатов, трудно избежать заключения, что атомы с большой длиной пробега,
появившиеся при столкновении α-частиц с атомами азота, суть не атомы азота, а, по-видимому, атомы водорода или атомы с массой 2.
Если это действительно так, то нам следует сделать вывод, что под действием мощных сил, возникающих при столкновении
с быстрой α-частицей, атом азота расщепляется и что освободившийся при этом атом водорода является составной частью ядра азота.
Это событие часто называют открытием протона[41].
Название «протон» предложил Резерфорд в 1920 году[42].
Примечания[править | править код]
- ↑ http://physics.nist.gov/cuu/Constants/Table/allascii.txt Архивная копия от 8 декабря 2013 на Wayback Machine Fundamental Physical Constants — Complete Listing
- ↑ 1 2 2018 CODATA Recommended Values: proton mass. Дата обращения: 16 января 2009. Архивировано 30 ноября 2015 года.
- ↑ 1 2 2018 CODATA Recommended Values: proton mass in u. Дата обращения: 16 января 2009. Архивировано 30 марта 2009 года.
- ↑ 1 2 Ahmed S. et al. Constraints on Nucleon Decay via Invisible Modes from the Sudbury Neutrino Observatory (англ.) // Physical Review Letters : journal. — 2004. — Vol. 92, no. 10. — P. 102004. — doi:10.1103/PhysRevLett.92.102004. — Bibcode: 2004PhRvL..92j2004A. — arXiv:hep-ex/0310030. — PMID 15089201.
- ↑ 1 2 CODATA 2018 recommended values: proton magnetic moment to nuclear magneton ratio. Дата обращения: 12 августа 2019. Архивировано 21 октября 2019 года.
- ↑ 1 2 CODATA 2018 recommended values: proton magnetic moment. Дата обращения: 12 августа 2019. Архивировано 21 июля 2019 года.
- ↑ 1 2 3 4 5 6 7 8 Протон // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- ↑ К. Н. Мухин. Экспериментальная ядерная физика. — М., 1993. — Т. 2. — С. 327.
- ↑ Кварки // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Советская энциклопедия, 1990. — Т. 2: Добротность — Магнитооптика. — 704 с. — 100 000 экз. — ISBN 5-85270-061-4.
- ↑ Evidence for intrinsic charm quarks in the proton | Nature
- ↑ Рекомендованные значения CODATA 2018 года, в скобках указана погрешность величины в единицах последней значимой цифры, одно стандартное отклонение
- ↑ 2018 CODATA Recommended Values: proton mass energy equivalent in MeV. Дата обращения: 16 января 2009. Архивировано 30 июня 2015 года.
- ↑ 2018 CODATA Recommended Values: proton-electron mass ratio. Дата обращения: 16 января 2009. Архивировано 22 апреля 2020 года.
- ↑ Бете, Г., Моррисон Ф. Элементарная теория ядра. —
М: ИЛ, 1956. — С. 48. - ↑ «Размер» элементарной частицы // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- ↑ Proton rms charge radius (англ.). Fundamental Physical Constants. NIST (2014). Дата обращения: 3 апреля 2016. Архивировано 21 июля 2019 года.
- ↑ Pohl R. et al. The size of the proton (англ.) // Nature. — 2010. — 8 July (vol. 466, no. 7303). — P. 213—216. — doi:10.1038/nature09250. — Bibcode: 2010Natur.466..213P. — PMID 20613837.
- ↑ Proton Structure from the Measurement of 2S-2P Transition Frequencies of Muonic Hydrogen. Дата обращения: 26 января 2013. Архивировано 27 января 2013 года.
- ↑ N. Bezginov et al. A measurement of the atomic hydrogen Lamb shift
and the proton charge radius (англ.) // Science. — 2019. — Vol. 365. — P. 1007—1012. — doi:10.1126/science.aau7807. - ↑ New measurement yields smaller proton radius: Physicists get closer to solving the proton radius puzzle with unique new measurement of the charge radius of the proton (англ.). ScienceDaily. Дата обращения: 9 ноября 2019. Архивировано 7 ноября 2019 года.
- ↑ CODATA Value: proton rms charge radius. physics.nist.gov. Дата обращения: 2 февраля 2022. Архивировано 16 мая 2021 года.
- ↑ H. Gao, M. Vanderhaeghen. The proton charge radius (англ.) // Reviews of Modern Physics. — 2022-01-21. — Vol. 94, iss. 1. — P. 015002. — ISSN 1539-0756 0034-6861, 1539-0756. — doi:10.1103/RevModPhys.94.015002.
- ↑ 1 2 The Jefferson Lab Qweak Collaboration. Precision measurement of the weak charge of the proton (англ.) // Nature. — 2018. — May (vol. 557, no. 7704). — P. 207—211. — doi:10.1038/s41586-018-0096-0.
- ↑ K. Abe et al. (Super-Kamiokande Collaboration). Search for proton decay via
and
in 0.31 megaton
years exposure of the Super-Kamiokande water Cherenkov detector (англ.) // Physical Review D. — 2017-01-06. — Vol. 95, iss. 1. — P. 012004. — doi:10.1103/PhysRevD.95.012004. Архивировано 20 апреля 2019 года.
- ↑ Ядерные силы // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1999. — Т. 5: Стробоскопические приборы — Яркость. — 692 с. — 20 000 экз. — ISBN 5-85270-101-7.
- ↑ А. И. Ахиезер, М. П. Рекало. Электродинамика адронов. — К., 1977. — С. 12-13.
- ↑ К. Н. Мухин. Экспериментальная ядерная физика. — М., 1993. — Т. 1. — С. 85.
- ↑ Хофштадтер P. Структура ядер и нуклонов
// УФН. — 1963. — Т. 81, № 1. — С. 185—200. — ISSN. — URL: http://ufn.ru/ru/articles/1963/9/e/ Архивная копия от 17 сентября 2016 на Wayback Machine - ↑ В. Б. Берестецкий, Е. М. Лифшиц, Л. П. Питаевский. Квантовая электродинамика. — М., 1980. — С. 677-682.
- ↑ Галактики / ред.-сост. В. Г. Сурдин. — М.: Физматлит, 2013. — С. 12-13.
- ↑ Межатомное взаимодействие // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1992. — Т. 3: Магнитоплазменный — Пойнтинга теорема. — 672 с. — 48 000 экз. — ISBN 5-85270-019-3.
- ↑ Химический энциклопедический словарь / гл. редактор И.Л.Кнунянц. — М.: «Советская энциклопедия», 1983. — С. 484. — 792 с.
- ↑ Л. Паулинг. Природа химической связи. — Госхимиздат, 1947. — С. 26. — 440 с.
- ↑ К. Н. Мухин. Экспериментальная ядерная физика. — М., 1993. — Т. 2. — С. 64.
- ↑ Ускорители заряженных частиц // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1999. — Т. 5: Стробоскопические приборы — Яркость. — 692 с. — 20 000 экз. — ISBN 5-85270-101-7.
- ↑ Accelerator physics of colliders Архивная копия от 28 сентября 2020 на Wayback Machine — Particle Data Group.
- ↑ Гольдин Л. Л., Джелепов В. П., Ломанов М. Ф., Савченко О. В., Хорошков В. С. Применение тяжелых заряженных частиц высокой энергии в медицине // Успехи физических наук. — Российская академия наук, 1973. — Т. 110. — С. 77—99.
- ↑ Кокурина E. Лечебная подводная лодка // В мире науки. — 2017. — № 8/9. — С. 40—48.
- ↑ Department of Chemistry and Biochemistry UCLA Eric R. Scerri Lecturer. The Periodic Table : Its Story and Its Significance: Its Story and Its Significance (англ.). — Oxford University Press, 2006. — ISBN 978-0-19-534567-4.
- ↑ Wien, Wilhelm. Über positive Elektronen und die Existenz hoher Atomgewichte (нем.) // Annalen der Physik : magazin. — 1904. — Bd. 318, Nr. 4. — S. 669—677. — doi:10.1002/andp.18943180404. — Bibcode: 1904AnP…318..669W.
- ↑ Petrucci, R. H.; Harwood, W. S.; Herring, F. G. General Chemistry. — 8th. — Upper Saddle River, N.J. : Prentice Hall, 2002. — С. 41.
- ↑ Pais, A. Inward Bound (англ.). — Oxford University Press, 1986. — P. 296. — ISBN 0198519974.;
утверждается, что термин «протон» был впервые использован в статье Physics at the British Association (англ.) // Nature. — 1920. — Vol. 106, no. 2663. — P. 357—358. — doi:10.1038/106357a0. — Bibcode: 1920Natur.106..357..
Литература[править | править код]
- Многие известные свойства протона систематически изложены в публикации Particle Data Group. [1] (англ.)
- Широков Ю. М., Юдин Н. П. Ядерная физика. — М.: Наука, 1972. — 670 с.
- Резерфорд Э. Избр. научные труды. Кн. 2 — Строение атома и искусственное превращение элементов, пер. с англ. М., 1972.
- Жакоб М., Ландшофф П. Внутренняя структура протона // Успехи физических наук. — Российская академия наук, 1981. — Т. 133, вып. 3. — С. 505—524. — doi:10.3367/UFNr.0133.198103d.0505.
- Дрелл С. Д., Захариазен Ф. Электромагнитная структура нуклонов. — М.: ИЛ, 1962. — 175 с.
- Шелест В. П. Лекции о структуре и свойствах адронов. — М.: Атомиздат, 1976. — 248 с.
Как определить протон, нейтрон, электрон
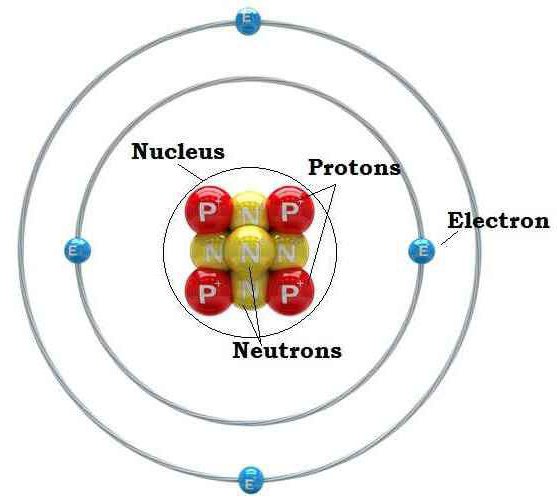
Атом – это мельчайшая частица, которую разделить на составные части химическим путем невозможно. Атом состоит из положительно заряженного ядра за счет протонов (р) с зарядом + и нейтральных частиц нейтронов (n). Вокруг него вращаются электроны (ē), имеющие отрицательный заряд.

Вам понадобится
- Периодическая система химических элементов Д.И. Менделеева.
Инструкция
Благодаря умению правильно вычислять количество протонов, нейтронов или электронов, можно определить валентность химического элемента, а также составить электронную формулу. Для этого потребуется только периодическая система химических элементов Д.И. Менделеева, которая является обязательным справочным материалом.
Таблица Д.И. Менделеева разделена на группы (располагаются вертикально), которых всего восемь, а также на периоды, расположенные горизонтально. Каждый химический элемент имеет свой порядковый номер и относительную атомную массу, что указано в каждой клетке периодической таблицы. Количество протонов (р) и электронов (ē) численно совпадает с порядковым номером элемента. Для определения числа нейтронов (n) необходимо из относительной атомной массы (Ar) вычесть номер химического элемента.
Пример № 1. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 7.Химический элемент № 7 – это азот (N). Сначала определите количество протонов (р). Если порядковый номер 7, значит, будет 7 протонов. Учитывая, что это число совпадает с количеством отрицательно заряженных частиц, электронов (ē) тоже будет 7. Для определения числа нейтронов (n) из относительной атомной массы (Ar (N) = 14) вычтите порядковый номер азота (№ 7). Следовательно, 14 – 7 = 7. В общем виде вся информация выглядит таким образом:р = +7;ē = -7;n = 14-7 = 7.
Пример № 2. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 20.Химический элемент № 20 – это кальций (Са). Сначала определите количество протонов (р). Если порядковый номер 20, следовательно, будет 20 протонов. Зная, что это число совпадает с количеством отрицательно заряженных частиц, значит электронов (ē) тоже будет 20. Для определения числа нейтронов (n) из относительной атомной массы (Ar (Са) = 40) вычтите порядковый номер кальция (№ 20). Следовательно, 40 – 20 = 20. В общем виде вся информация выглядит таким образом:р = +20;ē = -20;n = 40-20 = 20.
Пример № 3. Вычислите количество протонов, электронов и нейтронов атома химического элемента № 33.Химический элемент № 33 – это мышьяк (As). Сначала определите количество протонов (р). Если порядковый номер 33, значит, будет 33 протона. Учитывая, что это число совпадает с количеством отрицательно заряженных частиц, электронов (ē) тоже будет 33. Для определения числа нейтронов (n) из относительной атомной массы (Ar (As) = 75) вычтите порядковый номер азота (№ 33). Следовательно, 75 – 33 = 42. В общем виде вся информация выглядит таким образом:р = +33;ē = -33;n = 75 -33 = 42.
Обратите внимание
Относительную атомную массу, указанную в таблице Д.И. Менделеева, необходимо округлять до целого числа.
Источники:
- протон и нейтроны составляют ответ
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Введённое нами понятие атома рассматривает его как систему, в которой положительно заряженное ядро (состоит из протонов и нейтронов) окружено вращающимися вокруг него электронами. Рассмотрим само ядро (рис. 1). Контуры ядра не настолько округлые, но всё же ядром можно назвать область пространства в условном геометрическом центре ядра, где сосредоточены протоны и нейтроны. Протон — положительно заряженная частица, нейтрон — нейтральная частица. Вместе их удерживают внутриядерные силы (лучше пока о них много не знать) и внеядерное присутствие отрицательно заряженных электронов.

Рис. 1. Ядро
Ядра различных веществ содержат различное количество протонов. Данный факт является основой для таблицы Менделеева. В данной таблице у водорода () — первый элемент таблицы, присутствует один протон, далее ядро гелия (
) — второй элемент, имеет два протона и так далее. При этом количество нейтронов в одном и том же веществе может быть разным.
Введём некоторые понятия ядерной физики:
Количество нуклонов — суммарное количество протонов и нейтронов.
Изотопы — ядра одного и того же вещества, имеющие одно и то же количество протонов, но разное количество нейтронов.

Рис. 2. Обозначение ядра
Для рассмотрения элементов в курсе ядерной физики вводят специальные обозначения (рис. 2). Рассмотрим гипотетический элемент . В предложенной форме записи число снизу указывает на количество протонов, а сверху — количество нуклонов (протонов+нейтронов).
Примеры:
— ядро лития, состоящее из 3 протонов и 7-3=4 нейтронов,
— ядро алюминия, состоящее из 13 протонов и 27-13=14 нейтронов,
— ядро меди, состоящее из 29 протонов и 63-29=34 нейтронов.
Таким образом, исходя из таблицы Менделеева, можно сформировать внешний вид элемента (рис. 2) или, исходя из внешнего вида, определить сам элемент.
Исходя из введённых нами понятий и изображений, в ядерной физике школьного уровня выделяют три типа задач:
- задачи на уравнение радиоактивного распада
- задачи на ядерные реакции
- задачи, касающиеся энергии ядерных реакций
Поговорим о том, как найти протоны, нейтроны и электроны. В атоме существует три вида элементарных частиц, причем у каждой есть свой элементарный заряд, масса.
Строение ядра
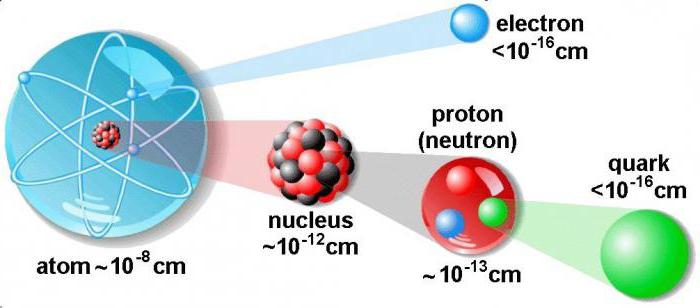
Для того чтобы понять, как найти протоны, нейтроны и электроны, представим особенности строения ядра. Оно является основной частью атома. Внутри ядра располагаются протоны и нейтроны, именуемые нуклонами. Внутри ядра эти частицы могут переходить друг в друга.
Например, чтобы найти протоны, нейтроны и электроны в атоме водорода, необходимо знать его порядковый номер. Если учесть, что именно этот элемент возглавляет периодическую систему, то в его ядре содержится один протон.
Диаметр атомного ядра составляет десятитысячную долю всего размера атома. В нем сосредоточена основная масса всего атома. По массе ядро превышает в тысячи раз сумму всех электронов, имеющихся в атоме.
Характеристика частиц
Рассмотрим, как найти протоны, нейтроны и электроны в атоме, и узнаем об их особенностях. Протон – это элементарная частица, которая соответствует ядру атома водорода. Его масса превышает электрон в 1836 раз. Для определения единицы электричества, проходящего через проводник с заданным поперечным сечением, используют электрический заряд.
У каждого атома в ядре располагается определенное количество протонов. Оно является постоянной величиной, характеризует химические и физические свойства данного элемента.
Как найти протоны, нейтроны и электроны в атоме углерода? Порядковый номер данного химического элемента 6, следовательно, в ядре содержится шесть протонов. Согласно планетарной модели строения атома, вокруг ядра по орбитам движется шесть электронов. Для определения количество нейтронов из значения относительной атомной массы углерода (12) вычитаем количество протонов (6), получаем шесть нейтронов.
Для атома железа число протонов соответствует 26, то есть этот элемент имеет 26-й порядковый номер в таблице Менделеева.
Нейтрон является электрически нейтральной частицей, нестабильной в свободном состоянии. Нейтрон способен самопроизвольно превращаться в положительно заряженный протон, испуская при этом антинейтрино и электрон. Средний период его полураспада составляет 12 минут. Массовое число – это суммарное значение количества протонов и нейтронов внутри ядра атома. Попробуем выяснить, как найти протоны, нейтроны и электроны в ионе? Если атом во время химического взаимодействия с другим элементом приобретает положительную степень окисления, то число протонов и нейтронов в нем не изменяется, меньше становится только электронов.
Заключение
Существовало несколько теорий, касающихся строения атома, но ни одна из них не была жизнеспособной. До версии, созданной Резерфордом, не было детального пояснения о расположении внутри ядра протонов и нейтронов, а также о вращении по круговым орбитам электронов. После появления теории планетарного строения атома у исследователей появилась возможность не только определять количество элементарных частиц в атоме, но и предсказывать физические и химические свойства конкретного химического элемента.
