КОРРОЗИЯ МЕТАЛЛОВ
См. также № 13/2006, с. 19
Цели. Сформировать представления о
коррозии с точки зрения
окислительно-восстановительных процессов;
показать значение коррозии для народного
хозяйства; продолжить формирование у учащихся
умений устанавливать причинно-следственные
связи между строением и свойствами металлов.
Оборудование. Железные гвозди из
поставленных ранее опытов по их коррозии в
водопроводной воде и «морской» воде (гвоздь без
контакта с другим металлом и гвозди в контакте с
медью и цинком). (Эксперимент мог быть домашним
заданием.)
ХОД УРОКА
Коррозия вызывается
окислительно-восстановительными реакциями, в
которых металл в результате взаимодействия с
каким-либо веществом из своего окружения
превращается в нежелательное соединение. Одним
из наиболее известных коррозионных процессов
является ржавление железа. 20% железа,
производимого ежегодно в США, идет на замену
железных изделий, пришедших в негодность из-за
ржавления.
Различают несколько видов коррозии.
А. По площади и характеру поражения:
сплошная, точечная, язвенная,
межкристаллическая.
Б. По природе агрессивных сред: воздушная,
почвенная, морская, биологическая (вызванная
водорослями, моллюсками, плесенью), коррозия в
смазке, газовая.
В. По механизму возникновения: химическая,
электрохимическая, электрическая (под действием
блуждающих токов).
Химическая коррозия
При химической коррозии идет окисление металла
без возникновения цепи электрического тока:
3Fe + 2O2 = Fe3O4 (FeO•Fe2O3),
4Al + 3O2 = 2Al2O3.
Для поверхности алюминия этот процесс
благоприятен, т.к. оксидная пленка плотно
прилегает к поверхности металла и нет
дальнейшего допуска кислорода к металлу.
Почему не рекомендуют варить овощи в
алюминиевой посуде? (Кислая среда растворяет
оксидную пленку, и алюминий в виде солей
поступает в организм человека.)
Оксидная пленка железа очень рыхлая (вспомните
какой-либо ржавый предмет – как только вы берете
его в руки, остаются следы ржавчины) и не
прилегает плотно к поверхности металла, поэтому
кислород проникает все дальше и дальше, коррозия
идет до полного разрушения предмета.
Электрохимическая коррозия одного
металла
При электрохимической коррозии возникает
электрическая цепь. При этом могут быть случаи
коррозии как одного металла, так и металлов в
контакте. Для возникновения электрохимической
коррозии нужно наличие кислорода и воды.
Рассмотрим случай, когда контакта металлов нет,
причем металл (железо) находится в воздухе.
Некоторые участки поверхности железа служат
анодом, на котором происходит его окисление
(E° – стандартный электродный потенциал):
Fe (тв.) = Fe2+ (водн.) + 2e, E °окисл
= 0,44 B.
Образующиеся при этом электроны перемещаются
по металлу к другим участкам поверхности,
которые играют роль катода. На них происходит
восстановление кислорода:
O2 (г.) + 4H+ (водн.) + 4e = 2H2O
(ж.),
E °восст = +1,23 B.
Этот процесс иллюстрируется на рис. 1.
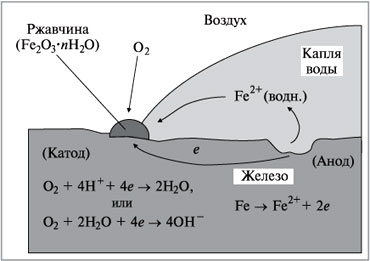 |
Рис. 1.
|
В восстановлении кислорода участвуют
ионы Н+. Если концентрация Н+
понижается (при повышении рН), восстановление О2
затрудняется. Замечено, что железо, находящееся в
контакте с раствором, рН которого выше 9–10, не
корродирует.
В процессе коррозии образующиеся на аноде ионы
Fe2+ окисляются до Fe3+ :
4Fe2+ (водн.) + O2 (г.) + (2n + 4)H2O
(ж.) = 2Fe2O3•nH2O (тв.) + 8H+
(водн.).
Поскольку роль катода обычно играет та часть
поверхности, которая лучше всего обеспечена
притоком кислорода, ржавчина чаще всего
появляется именно на этих участках. Если вы
внимательно осмотрите лопату, простоявшую
некоторое время на открытом воздухе с налипшей
на лезвии грязью, то заметите, что под грязью на
поверхности металла образовались углубления, а
ржавчина появилась повсюду, куда мог проникнуть
О2.
С усилением коррозии в присутствии солей часто
сталкиваются автомобилисты в тех местностях, где
в зимнее время для борьбы с гололедицей дороги
обильно посыпают солью. Влияние солей
объясняется тем, что образуемые ионы создают
электролит, необходимый для возникновения
замкнутой электрической цепи.
Наличие анодного и катодного участков на
поверхности железа приводит к созданию на ней
двух неодинаковых химических окружений. Они
могут возникнуть вследствие присутствия
примесей или дефектов в кристаллической решетке
(по-видимому, обусловленных напряжением внутри
металла). В местах, где есть примеси или дефекты,
микроскопическое окружение конкретного атома
железа может вызвать некоторое увеличение или
уменьшение его степени окисления по сравнению с
«нормальными» атомами в кристаллической
решетке. Поэтому такие места способны играть
роль анодов или катодов. Сверхчистое железо, в
котором количество подобных дефектов сведено к
минимуму, намного меньше корродирует по
сравнению с обычным железом.
 |
Кутубская колонна
|
Классический пример – знаменитая Кутубская
колонна в Индии близ Дели, которая уже почти
полторы тысячи лет стоит и не разрушается,
несмотря на жаркий и влажный климат. Сделана она
из железа, в котором почти нет примесей. Как
удалось древним металлургам получить такой
чистый металл, до сих пор остается загадкой.
В начале прошлого столетия по заказу одного
американского миллионера была построена
роскошная яхта «Зов моря». Днище ее было обшито
монель-металлом (сплав меди и никеля), а рама руля,
киль и другие детали были изготовлены из стали.
Когда яхту спустили на воду, возник гигантский
гальванический элемент, состоящий из катода
(монель-металла), стального анода и раствора
электролита – морской воды.
Последствия были ужасными! Еще до выхода в
открытое море яхта полностью вышла из строя, так
что «Зов моря» остался в истории мореплавания
как пример конструкторской недальновидности и
самонадеянного невежества. Попробуем
разобраться, что же произошло.
Рассмотрим контакт двух металлов на примере
олова и железа.
Железо часто покрывают другим металлом,
например оловом, цинком или хромом, чтобы
защитить от коррозии. Так называемую «белую
жесть» получают, покрывая тонким слоем олова
листовое железо. Олово защищает железо до тех
пор, пока защитный слой остается неповрежденным.
Стоит его повредить, как на железо начинают
воздействовать воздух и влага, олово даже
ускоряет процесс коррозии, потому что служит
катодом в электрохимическом процессе. Сравнение
окислительных электродных потенциалов железа и
олова показывает, что железо окисляется легче
олова:
Fe (тв.) = Fe2+ (водн.) + 2e, E °окисл
= 0,44 B,
Sn (тв.) = Sn2+ (водн.) + 2e, E °окисл
= 0,14 B.
Поэтому железо служит в этом случае анодом и
окисляется, как показано на рис. 2.
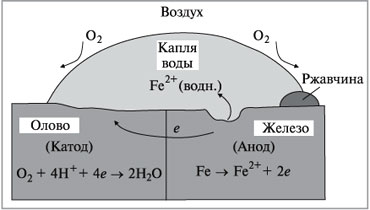 |
Рис. 2.
|
Оцинкованное железо получают, покрывая
его тонким слоем цинка. Цинк защищает железо от
коррозии даже после нарушения целостности
покрытия. В этом случае железо в процессе
коррозии играет роль катода, потому что цинк
окисляется легче железа (рис. 3):
Zn (тв.) = Zn2+ (водн.) + 2e, E °окисл
= 0,76 B.
Следовательно, цинк играет роль анода и
корродирует вместо железа.
 |
Рис. 3.
|
Электрическая коррозия
(электрокоррозия)
Блуждающие токи, исходящие от трамвая, метро,
электрических железных дорог и различных
электроустановок, работающих на постоянном токе,
вызывают электрокоррозию. Такие токи разрушают
подземные металлические сооружения,
трубопроводы, электрокабели, приводят к
появлению на металлических предметах,
находящихся в земле, участков входа и выхода
постоянного тока. Вследствие этого на металле
образуются катодные и анодные зоны, причем
анодные зоны, т.е. места выхода тока, подвергаются
коррозии (рис. 4).
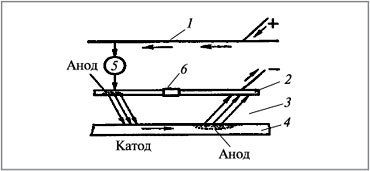 |
Рис. 4.
|
Блуждающие токи достигают 300 А и
действуют в радиусе нескольких десятков
километров. Процесс в анодных зонах:
Fe – 2e = Fe2+.
Процессы в катодных зонах:
2H+ + 2e = H2
или
O2 + 2H2O + 4e = 4OH–.
Блуждающие токи от источников переменного тока
вызывают слабую коррозию у подземных изделий из
стали и сильную у изделий из цветных металлов.
Коррозия металлов протекает непрерывно и
причиняет огромные убытки. Подсчитано, что
прямые потери от коррозии железа составляют
около 10% от его ежегодной выплавки. В результате
коррозии металлические изделия теряют свои
ценные технические свойства.
Ежегодные потери металла при коррозии
оборудования, используемого только в
животноводстве, составляют около 60 тыс. тонн.
Поэтому защита металлов от коррозии – очень
важная задача.
Основные способы защиты от коррозии
1. Защищаемый металл играет роль катода. Такой
способ защиты называется катодным (другое
название – протекторная защита). Тот
металл, который заведомо будет разрушаться в
паре, называется протектором. Примеры такой
защиты – оцинкованное железо (железо – катод,
цинк – анод), «белая жесть» (оловом покрывают
листовое железо), контакт магния и железа (магний
– протектор). Магниевый анод окружают смесью
гипса, сульфата натрия и глины, чтобы обеспечить
проводимость ионов. Труба играет роль катода в
гальваническом элементе (рис. 5).
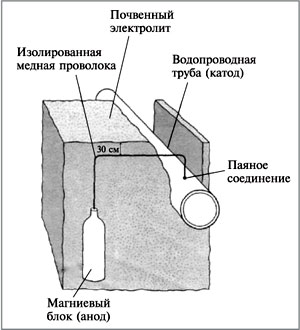 |
Рис. 5.
|
2. Электрозащита. Конструкция,
находящаяся в среде электролита, соединяется с
другим металлом (обычно куском железа, рельсом и
т.п.), но через внешний источник тока. При этом
защищаемую конструкцию подключают к катоду, а
металл – к аноду источника тока. В этом случае
электроны отнимаются от анода источником тока,
анод (защищающий металл) разрушается, а на катоде
происходит восстановление окислителя.
Электрозащита имеет преимущество перед
протекторной защитой: радиус действия первой
около 2000 м, второй – 50 м.
3. Если металл, например хром, создает плотную
оксидную пленку, его добавляют в железо, и
образуется сплав – нержавеющая сталь. Такие
стали называются легированными.
Многие сплавы, которые содержат незначительное
количество добавок дорогих и редких металлов,
приобретают замечательную устойчивость к
коррозии и прекрасные механические свойства.
Например, добавки родия или иридия к платине так
сильно повышают ее твердость, что изделия из нее
– лабораторная посуда, детали машин для
получения стекловолокна – становятся
практически вечными.
4. Металл можно пассивировать – обработать
его поверхность так, чтобы образовалась тонкая и
плотная пленка оксида, которая препятствует
разрушению основного вещества. Например,
концентрированную серную кислоту можно
перевозить в стальных цистернах, т.к. она
образует на поверхности металла тонкую, но очень
прочную пленку.
5. Ингибиторы (замедлители) коррозии тоже
переводят металл в пассивное состояние, образуя
на его поверхности тонкие защитные пленки.
Пример такого замедлителя коррозии –
гексаметилентетрамин (CH2)6N4. В
последние годы разработаны летучие, или
атмосферные, ингибиторы. Ими пропитывают бумагу,
которой обертывают металлические изделия. Пары
ингибиторов адсорбируются на поверхности
металла и образуют на ней защитную пленку.
6. Защитить металл можно, препятствуя
проникновению к нему влаги и кислорода, –
например, нанося на металл слой краски или лака.
(На покраску Эйфелевой башни уже затратили
средств больше, чем при ее создании.)
ПРАКТИЧЕСКАЯ РАБОТА
За неделю до урока были поставлены опыты по
коррозии металлов в пробирках с водопроводной
(№ 1–4) и «морской» (№ 5–8) водой (рис. 6).
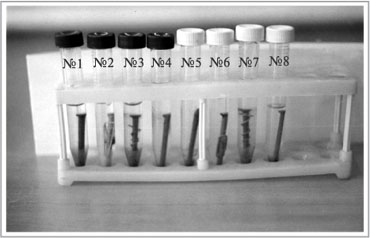 |
Рис. 6.
|
№ 1 и № 5 – железный гвоздь;
№ 2 и № 6 – железный гвоздь в контакте с цинком;
№ 3 и № 7 – железный гвоздь в контакте с медью;
№ 4 и № 8 – железный гвоздь, покрытый лаком для
ногтей.
«Морскую» воду готовят, растворяя в ней соли
кальция, магния и натрия.
Рис. 7 демонстрирует результаты опытов по
коррозии металлов в «морской» воде.
 |
Рис. 7.
|
№ 5 – наличие слабой ржавчины;
№ 6 – гвоздь не подвергся коррозии, но цинк
уменьшился в размере;№ 7 – наличие сильной ржавчины, гвоздь
уменьшился в размере;№ 8 – гвоздь не подвергся коррозии (покрыт
лаком).
ЗАДАНИЯ
1. Рассмотрите коррозию железа в
водопроводной и «морской» воде (пробирки № 1
и № 5). Где процесс протекает быстрее и чем вы это
объясните?
(П р и м е р н ы й о т в е т. В «морской»
воде более заметно выражены все проявления
коррозии из-за агрессивности среды, которая
создается растворимыми солями (гидролиз солей).)
2. Сравните результаты опытов по коррозии
при контакте железа и цинка в водопроводной и
«морской» воде (пробирки № 2 и № 6).
(П р и м е р н ы й о т в е т. При контакте
железа с цинком явление коррозии железа
практически не выражено. В данном случае
электрохимическая коррозия затронула цинк, как
более активный металл.)
3. Сравните результаты опытов по коррозии
при контакте железа и медной проволоки в
водопроводной и «морской» воде (пробирки № 3 и №
7).
(П р и м е р н ы й о т в е т. При контакте
железа с медью усиливается разрушение железа
вследствие электрохимической коррозии, т. к.
железо более активный металл, чем медь (в
электрохимическом ряду напряжений металлов
железо стоит левее меди).)
4. Зарисуйте результаты опытов. Используя рис.
1–3, составьте схемы реакций, происходящих в
каждом опыте.
ДОМАШНЕЕ ЗАДАНИЕ
1. Напишите схему коррозии на яхте «Зов моря».
2. Поставьте опыты по коррозии железных
гвоздей в «Фанте» и в растворе соды. Через неделю
принесите гвозди в школу, чтобы обсудить
результаты опытов.
3. Рассмотрите процесс коррозии при
соединении медной трубы с гальванизированной
(оцинкованной) стальной трубой, если обе трубы
находятся в земле.
4. Как будет протекать процесс коррозии в
том случае, если железную водосточную трубу
прибить к дому алюминиевыми гвоздями?
(О т в е т. В местах соприкосновения двух
металлов образуется гальванический элемент.
Металл, который окисляется легче, играет при этом
роль анода, а второй металл – роль катода. Из
сравнения стандартных электродных потенциалов
алюминия и железа следует, что алюминий будет
играть роль анода. Таким образом, вблизи
алюминиевого гвоздя водосточная труба будет
защищена от коррозии, потому что железо в этой
паре играет роль катода. Однако алюминиевый
гвоздь в этих условиях быстро корродирует, и в
конце концов труба упадет.)
5. Почему цинк не используют при
изготовлении консервных банок для покрытия им
железа?
(О т в е т. Цинк менее пригоден, чем олово, при
изготовлении консервных банок, т. к. расположен
левее олова в ряду напряжений металлов, поэтому
цинк легче подвергается действию кислот,
содержащихся во фруктовых соках.)
Литература
Маршанова Г.Л. 500 задач по химии. М.:
Издат-школа «РАЙЛ», 1997; Хомченко Г.П., Цитович
И.Г. Неорганическая химия, М.: Высшая школа, 1987; Фримантл
М. Химия в действии. М.: Мир, 1991; Браун Т., Лемей
Г.Ю. Химия в центре наук. М.: Мир, 1983; Химия.
Пособие-репетитор. Под ред. А.С.Егорова.
Ростов-на-Дону: Феникс, 1996; Венецкий С.И.
Рассказы о металлах. М.: Металлургия, 1986.
М.А.Александрова,
учитель химии школы № 81
(Москва)
Содержание
- КОРРОЗИЯ МЕТАЛЛОВ
- Химическая коррозия
- Электрохимическая коррозия одного металла
- Электрическая коррозия (электрокоррозия)
- Основные способы защиты от коррозии
- Литература
- Контактная коррозия металлов
См. также № 13/2006, с. 19
Цели. Сформировать представления о коррозии с точки зрения окислительно-восстановительных процессов; показать значение коррозии для народного хозяйства; продолжить формирование у учащихся умений устанавливать причинно-следственные связи между строением и свойствами металлов.
Оборудование. Железные гвозди из поставленных ранее опытов по их коррозии в водопроводной воде и «морской» воде (гвоздь без контакта с другим металлом и гвозди в контакте с медью и цинком). (Эксперимент мог быть домашним заданием.)
Коррозия вызывается окислительно-восстановительными реакциями, в которых металл в результате взаимодействия с каким-либо веществом из своего окружения превращается в нежелательное соединение. Одним из наиболее известных коррозионных процессов является ржавление железа. 20% железа, производимого ежегодно в США, идет на замену железных изделий, пришедших в негодность из-за ржавления.
Различают несколько видов коррозии.
А. По площади и характеру поражения: сплошная, точечная, язвенная, межкристаллическая.

Б. По природе агрессивных сред: воздушная, почвенная, морская, биологическая (вызванная водорослями, моллюсками, плесенью), коррозия в смазке, газовая.
В. По механизму возникновения: химическая, электрохимическая, электрическая (под действием блуждающих токов).
Химическая коррозия
При химической коррозии идет окисление металла без возникновения цепи электрического тока:
Для поверхности алюминия этот процесс благоприятен, т.к. оксидная пленка плотно прилегает к поверхности металла и нет дальнейшего допуска кислорода к металлу.
Почему не рекомендуют варить овощи в алюминиевой посуде? (Кислая среда растворяет оксидную пленку, и алюминий в виде солей поступает в организм человека.)
Оксидная пленка железа очень рыхлая (вспомните какой-либо ржавый предмет – как только вы берете его в руки, остаются следы ржавчины) и не прилегает плотно к поверхности металла, поэтому кислород проникает все дальше и дальше, коррозия идет до полного разрушения предмета.
При электрохимической коррозии возникает электрическая цепь. При этом могут быть случаи коррозии как одного металла, так и металлов в контакте. Для возникновения электрохимической коррозии нужно наличие кислорода и воды.
Рассмотрим случай, когда контакта металлов нет, причем металл (железо) находится в воздухе.
Некоторые участки поверхности железа служат анодом, на котором происходит его окисление
(E° – стандартный электродный потенциал):
Fe (тв.) = Fe 2+ (водн.) + 2e, E °окисл = 0,44 B.
Образующиеся при этом электроны перемещаются по металлу к другим участкам поверхности, которые играют роль катода. На них происходит восстановление кислорода:
Этот процесс иллюстрируется на рис. 1.
Рис. 1.
Схема электрохимической коррозии железа
без контакта с другими металлами
В восстановлении кислорода участвуют ионы Н + . Если концентрация Н + понижается (при повышении рН), восстановление О2 затрудняется. Замечено, что железо, находящееся в контакте с раствором, рН которого выше 9–10, не корродирует.
В процессе коррозии образующиеся на аноде ионы Fe 2+ окисляются до Fe 3+ :
Поскольку роль катода обычно играет та часть поверхности, которая лучше всего обеспечена притоком кислорода, ржавчина чаще всего появляется именно на этих участках. Если вы внимательно осмотрите лопату, простоявшую некоторое время на открытом воздухе с налипшей на лезвии грязью, то заметите, что под грязью на поверхности металла образовались углубления, а ржавчина появилась повсюду, куда мог проникнуть О2.
С усилением коррозии в присутствии солей часто сталкиваются автомобилисты в тех местностях, где в зимнее время для борьбы с гололедицей дороги обильно посыпают солью. Влияние солей объясняется тем, что образуемые ионы создают электролит, необходимый для возникновения замкнутой электрической цепи.
Наличие анодного и катодного участков на поверхности железа приводит к созданию на ней двух неодинаковых химических окружений. Они могут возникнуть вследствие присутствия примесей или дефектов в кристаллической решетке (по-видимому, обусловленных напряжением внутри металла). В местах, где есть примеси или дефекты, микроскопическое окружение конкретного атома железа может вызвать некоторое увеличение или уменьшение его степени окисления по сравнению с «нормальными» атомами в кристаллической решетке. Поэтому такие места способны играть роль анодов или катодов. Сверхчистое железо, в котором количество подобных дефектов сведено к минимуму, намного меньше корродирует по сравнению с обычным железом.
 |
Кутубская колонна
в Индии
Классический пример – знаменитая Кутубская колонна в Индии близ Дели, которая уже почти полторы тысячи лет стоит и не разрушается, несмотря на жаркий и влажный климат. Сделана она из железа, в котором почти нет примесей. Как удалось древним металлургам получить такой чистый металл, до сих пор остается загадкой.
В начале прошлого столетия по заказу одного американского миллионера была построена роскошная яхта «Зов моря». Днище ее было обшито монель-металлом (сплав меди и никеля), а рама руля, киль и другие детали были изготовлены из стали. Когда яхту спустили на воду, возник гигантский гальванический элемент, состоящий из катода (монель-металла), стального анода и раствора электролита – морской воды.
Последствия были ужасными! Еще до выхода в открытое море яхта полностью вышла из строя, так что «Зов моря» остался в истории мореплавания как пример конструкторской недальновидности и самонадеянного невежества. Попробуем разобраться, что же произошло.
Рассмотрим контакт двух металлов на примере олова и железа.
Железо часто покрывают другим металлом, например оловом, цинком или хромом, чтобы защитить от коррозии. Так называемую «белую жесть» получают, покрывая тонким слоем олова листовое железо. Олово защищает железо до тех пор, пока защитный слой остается неповрежденным. Стоит его повредить, как на железо начинают воздействовать воздух и влага, олово даже ускоряет процесс коррозии, потому что служит катодом в электрохимическом процессе. Сравнение окислительных электродных потенциалов железа и олова показывает, что железо окисляется легче олова:
Fe (тв.) = Fe 2+ (водн.) + 2e, E °окисл = 0,44 B,
Sn (тв.) = Sn 2+ (водн.) + 2e, E °окисл = 0,14 B.
Поэтому железо служит в этом случае анодом и окисляется, как показано на рис. 2.
 |
Рис. 2.
Схема электрохимической коррозии
при контакте железа и олова
Оцинкованное железо получают, покрывая его тонким слоем цинка. Цинк защищает железо от коррозии даже после нарушения целостности покрытия. В этом случае железо в процессе коррозии играет роль катода, потому что цинк окисляется легче железа (рис. 3):
Zn (тв.) = Zn 2+ (водн.) + 2e, E °окисл = 0,76 B.
Следовательно, цинк играет роль анода и корродирует вместо железа.
 |
Рис. 3.
Схема электрохимической коррозии
при контакте железа и цинка
Электрическая коррозия (электрокоррозия)
Блуждающие токи, исходящие от трамвая, метро, электрических железных дорог и различных электроустановок, работающих на постоянном токе, вызывают электрокоррозию. Такие токи разрушают подземные металлические сооружения, трубопроводы, электрокабели, приводят к появлению на металлических предметах, находящихся в земле, участков входа и выхода постоянного тока. Вследствие этого на металле образуются катодные и анодные зоны, причем анодные зоны, т.е. места выхода тока, подвергаются коррозии (рис. 4).
 |
Рис. 4.
Схема электрокоррозии
под действием блуждающих токов:
1 – провод; 2 – рельс; 3 – влажный грунт;
4 – труба; 5 – электродвигатель трамвая;
6 – сопротивление в стыке рельса
Блуждающие токи достигают 300 А и действуют в радиусе нескольких десятков километров. Процесс в анодных зонах:
Процессы в катодных зонах:
Блуждающие токи от источников переменного тока вызывают слабую коррозию у подземных изделий из стали и сильную у изделий из цветных металлов.
Коррозия металлов протекает непрерывно и причиняет огромные убытки. Подсчитано, что прямые потери от коррозии железа составляют около 10% от его ежегодной выплавки. В результате коррозии металлические изделия теряют свои ценные технические свойства.
Ежегодные потери металла при коррозии оборудования, используемого только в животноводстве, составляют около 60 тыс. тонн. Поэтому защита металлов от коррозии – очень важная задача.
Основные способы защиты от коррозии
1. Защищаемый металл играет роль катода. Такой способ защиты называется катодным (другое название – протекторная защита). Тот металл, который заведомо будет разрушаться в паре, называется протектором. Примеры такой защиты – оцинкованное железо (железо – катод, цинк – анод), «белая жесть» (оловом покрывают листовое железо), контакт магния и железа (магний – протектор). Магниевый анод окружают смесью гипса, сульфата натрия и глины, чтобы обеспечить проводимость ионов. Труба играет роль катода в гальваническом элементе (рис. 5).
 |
Рис. 5.
Катодная защита
железных водопроводных труб
2. Электрозащита. Конструкция, находящаяся в среде электролита, соединяется с другим металлом (обычно куском железа, рельсом и т.п.), но через внешний источник тока. При этом защищаемую конструкцию подключают к катоду, а металл – к аноду источника тока. В этом случае электроны отнимаются от анода источником тока, анод (защищающий металл) разрушается, а на катоде происходит восстановление окислителя. Электрозащита имеет преимущество перед протекторной защитой: радиус действия первой около 2000 м, второй – 50 м.
3. Если металл, например хром, создает плотную оксидную пленку, его добавляют в железо, и образуется сплав – нержавеющая сталь. Такие стали называются легированными.
Многие сплавы, которые содержат незначительное количество добавок дорогих и редких металлов, приобретают замечательную устойчивость к коррозии и прекрасные механические свойства. Например, добавки родия или иридия к платине так сильно повышают ее твердость, что изделия из нее – лабораторная посуда, детали машин для получения стекловолокна – становятся практически вечными.
4. Металл можно пассивировать – обработать его поверхность так, чтобы образовалась тонкая и плотная пленка оксида, которая препятствует разрушению основного вещества. Например, концентрированную серную кислоту можно перевозить в стальных цистернах, т.к. она образует на поверхности металла тонкую, но очень прочную пленку.
5. Ингибиторы (замедлители) коррозии тоже переводят металл в пассивное состояние, образуя на его поверхности тонкие защитные пленки. Пример такого замедлителя коррозии – гексаметилентетрамин (CH2)6N4. В последние годы разработаны летучие, или атмосферные, ингибиторы. Ими пропитывают бумагу, которой обертывают металлические изделия. Пары ингибиторов адсорбируются на поверхности металла и образуют на ней защитную пленку.
6. Защитить металл можно, препятствуя проникновению к нему влаги и кислорода, – например, нанося на металл слой краски или лака. (На покраску Эйфелевой башни уже затратили средств больше, чем при ее создании.)
ПРАКТИЧЕСКАЯ РАБОТА
За неделю до урока были поставлены опыты по коррозии металлов в пробирках с водопроводной (№ 1–4) и «морской» (№ 5–8) водой (рис. 6).
 |
Рис. 6.
Гвозди, помещенные в водопроводную
(пробирки с темными крышками) и «морскую»
(пробирки со светлыми крышками) воду
№ 2 и № 6 – железный гвоздь в контакте с цинком;
№ 3 и № 7 – железный гвоздь в контакте с медью;
№ 4 и № 8 – железный гвоздь, покрытый лаком для ногтей.
«Морскую» воду готовят, растворяя в ней соли кальция, магния и натрия.
Рис. 7 демонстрирует результаты опытов по коррозии металлов в «морской» воде.
 |
Рис. 7.
Гвозди, вынутые через неделю
из «морской» воды
№ 6 – гвоздь не подвергся коррозии, но цинк уменьшился в размере;
№ 7 – наличие сильной ржавчины, гвоздь уменьшился в размере;
№ 8 – гвоздь не подвергся коррозии (покрыт лаком).
1. Рассмотрите коррозию железа в водопроводной и «морской» воде (пробирки № 1 и № 5). Где процесс протекает быстрее и чем вы это объясните?
(П р и м е р н ы й о т в е т. В «морской» воде более заметно выражены все проявления коррозии из-за агрессивности среды, которая создается растворимыми солями (гидролиз солей).)
2. Сравните результаты опытов по коррозии при контакте железа и цинка в водопроводной и «морской» воде (пробирки № 2 и № 6).
(П р и м е р н ы й о т в е т. При контакте железа с цинком явление коррозии железа практически не выражено. В данном случае электрохимическая коррозия затронула цинк, как более активный металл.)
3. Сравните результаты опытов по коррозии при контакте железа и медной проволоки в водопроводной и «морской» воде (пробирки № 3 и № 7).
(П р и м е р н ы й о т в е т. При контакте железа с медью усиливается разрушение железа вследствие электрохимической коррозии, т. к. железо более активный металл, чем медь (в электрохимическом ряду напряжений металлов железо стоит левее меди).)
4. Зарисуйте результаты опытов. Используя рис. 1–3, составьте схемы реакций, происходящих в каждом опыте.
1. Напишите схему коррозии на яхте «Зов моря».
2. Поставьте опыты по коррозии железных гвоздей в «Фанте» и в растворе соды. Через неделю принесите гвозди в школу, чтобы обсудить результаты опытов.
3. Рассмотрите процесс коррозии при соединении медной трубы с гальванизированной (оцинкованной) стальной трубой, если обе трубы находятся в земле.
4. Как будет протекать процесс коррозии в том случае, если железную водосточную трубу прибить к дому алюминиевыми гвоздями?
(О т в е т. В местах соприкосновения двух металлов образуется гальванический элемент. Металл, который окисляется легче, играет при этом роль анода, а второй металл – роль катода. Из сравнения стандартных электродных потенциалов алюминия и железа следует, что алюминий будет играть роль анода. Таким образом, вблизи алюминиевого гвоздя водосточная труба будет защищена от коррозии, потому что железо в этой паре играет роль катода. Однако алюминиевый гвоздь в этих условиях быстро корродирует, и в конце концов труба упадет.)
5. Почему цинк не используют при изготовлении консервных банок для покрытия им железа?
(О т в е т. Цинк менее пригоден, чем олово, при изготовлении консервных банок, т. к. расположен левее олова в ряду напряжений металлов, поэтому цинк легче подвергается действию кислот, содержащихся во фруктовых соках.)
Литература
Маршанова Г.Л. 500 задач по химии. М.: Издат-школа «РАЙЛ», 1997; Хомченко Г.П., Цитович И.Г. Неорганическая химия, М.: Высшая школа, 1987; Фримантл М. Химия в действии. М.: Мир, 1991; Браун Т., Лемей Г.Ю. Химия в центре наук. М.: Мир, 1983; Химия. Пособие-репетитор. Под ред. А.С.Егорова. Ростов-на-Дону: Феникс, 1996; Венецкий С.И. Рассказы о металлах. М.: Металлургия, 1986.
Источник
Электрохимическая коррозия
Наиболее распространенным видом коррозии является электрохимическая коррозия, которая протекает при контакте металлов с водными растворами электролитов – морской и речной водой, почвенной и атмосферной влагой и т.д. На границе раздела металл–электролит возникает разность потенциалов (стационарный потенциал), от величины которой зависит скорость окисления металла и восстановления окислителя коррозионной среды.
Отличительными признаками электрохимической коррозии являются:
· протекание в растворах электролитов;
· зависимость скорости коррозии от электродного потенциала металла в данной коррозионной среде;
· возникновение электрического тока;
Электрохимическая коррозия протекает, как минимум, в три стадии.
1. Окисление металла Me → Me n + + ne.
2. Восстановление окислителя коррозионной среды зависит от характера коррозионной среды:
а) в нейтральных средах (морская, речная, водопроводная вода, атмосферные условия, почва) окислителем является кислород О2, который восстанавливается по реакции
б) в кислых средах окислителем является ион Н + :
в) в щелочных средах окислителем является вода:
г) в слабокислых средах в присутствии кислорода может протекать реакция
Таким образом, коррозия может протекать либо с поглощением кислорода (а,г), либо с выделением водорода (б,в).
3. Образование продуктов коррозии (чаще всего оксидов и гидроксидов).
Продукты коррозии довольно часто пассивируют металл. Пассивация – это замедление коррозии благодаря формированию на поверхности металла защитной пленки из продуктов коррозии. Они являются барьером между металлом и окружающей средой. Пленки обладают защитным действием, если они сплошные, обладают хорошей адгезией (сцеплением) к поверхности металла и химически стойки в данной среде.
Самый распространенный и важный пассиватор – кислород. Таким образом, кислород влияет на скорость коррозии в двух направлениях: с одной стороны он ускоряет коррозию как мощный окислитель, с другой – пассивирует металл.
Наиболее склонны к пассивации титан, нержавеющая сталь и алюминий.
Теории коррозии
В настоящее время существуют две теории электрохимической коррозии.
1. Теория микрокоррозионных элементов.
2. Кинетическая теория сопряженных реакций.
Теория микрокоррозионных элементов. По этой теории на поверхности сплавов и технических металлов при соприкосновении с электролитом возникает электрохимическая гетерогенность (неоднородность), т.е. участки с разными электродными потенциалами. В результате этого вся поверхность металла покрывается короткозамкнутыми микрокоррозионными элементами, которые действуют по принципу гальванического элемента (рис.2). При этом участки с меньшим значением потенциала φа являются анодными, и на них протекает анодная реакция – окисление металла. Участки с большим значением потенциала φк являются катодными, на них происходит восстановление окислителя коррозионной среды. Электроны перетекают от анодных участков к катодным по металлу, а в электролите происходит диффузия ионов.

Рис.2. Возникновение микрокоррозионных элементов
при электрохимической коррозии: 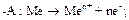
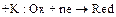
Причинами электрохимической неоднородности поверхности металла могут быть:
· наличие примесей в металле (пример 1);
· структурная неоднородность сплава (пример 2);
· нарушение целостности оксидных пленок (пример 3);
· неоднородная аэрация (пример 4);
· неоднородная обработка поверхности металла;
· неоднородность внутренних напряжений;
· неравномерные физические условия (перепад температур, освещенность).
Пример 1. Коррозия латуни в морской воде. Структурная неоднородность латуней (сплавы меди, содержащие до 45% цинка) приводит к обесцинкованию, т.е. к окислению цинка, который является анодным компонентом по отношению к меди
(φ мв (Zn) мв (Сu)). Возникает микрокоррозионный элемент:
Суммарная реакция (образование продукта коррозии):
Чугуны (сплавы железа и более 2% углерода) подвергаются графитизации, т.е. окислению железа, в результате чего чугун обогащается углеродом.
Пример 2. Коррозия углеродистой стали в атмосферных условиях. Углеродистая сталь представляет собой смесь микрочастиц химического соединения железа с углеродом Fe3C (цементит) и смеси железа с углеродом (перлит). В атмосферных условиях на поверхности стали конденсируется вода, образуя тонкую пленку, в которой растворяются различные оксиды и кислород, т.е. образуется электролит. В результате соприкосновения цементита и перлита с этим электролитом возникают электродные потенциалы, при этом φ(Fe) 2+
Первичный продукт коррозии железа Fe(OH)2 затем окисляется, образуя вторичный продукт – ржавчину Fe(OH)3:

Рис.3. Возникновение микрокоррозионного элемента
на поверхности стали
Пример 3. Коррозия алюминия в щелочной среде. Поверхность металлического алюминия покрыта сплошной оксидной пленкой, которая под действием щелочи частично растворяется (рис.4):
В результате в пленке образуются поры, которые будут являться анодными участками, а частички Al2O3 – катодными участками, так как φ(Al) 3+
Поскольку гидроксид алюминия обладает амфотерными свойствами, протекает следующая реакция:
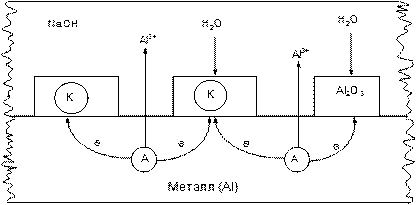
Рис.4. Возникновение микрокоррозионных элементов
на поверхности алюминия
Пример 4. Коррозия металлов в условиях дифференциальной аэрации, т.е. в условиях неодинакового поступления кислорода к различным участкам поверхности металла. Такая коррозия часто протекает в щелях, зазорах, трещинах, под каплями влаги и т.д. Рассмотрим коррозию стали, возникающую под каплей морской воды, находящейся на поверхности металла (рис.5). Так как в центре капли концентрация кислорода меньше, чем на периферии, то участки под центром капли будут анодными, а по периметру капли – катодными.
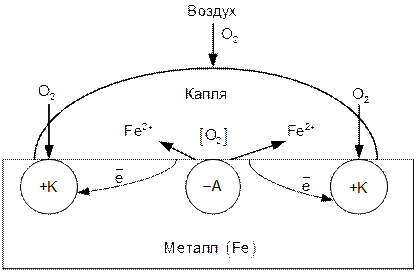
Рис.5. Возникновение микрокоррозионных элементов
в условиях дифференциальной аэрации
Рассмотренные примеры показывают, что с помощью теории микрокоррозионных элементов можно объяснить протекание коррозии технических металлов и сплавов, т.е. тех случаев, когда имеется электрохимическая разнородность поверхности. Коррозию химически чистых металлов объясняет кинетическая теория сопряженных реакций.
Кинетическая теория исходит из того, что металлы термодинамически неустойчивы в окружающей среде, а поэтому коррозия может протекать и при отсутствии электрохимической разнородности. При этом окисление металла и восстановление окислителя может протекать в одной точке, чередуясь во времени. Для протекания электрохимической коррозии необходимо присутствие в среде окислителя, потенциал которого больше потенциала металла: φмет + ). Медь не корродирует в кислоте, так как φ(Cu) > φ(H + ).
Таким образом, кинетическая теория является обобщающей теорией электрохимической коррозии.
4. Факторы, влияющие на скорость
коррозии металлов
Скорость коррозии зависит от многих факторов, которые делятся на внутренние и внешние.
Внутренние факторы коррозии.Характеристикой склонности металла к электрохимической коррозии является его стандартный равновесный потенциал, положение металла в периодической системе Д.И.Менделеева, чистота металла или сплава, величина зерен, термическая или механическая обработка металла, склонность к пассивации и т.д. Так, чем меньше величина равновесного потенциала, тем больше склонность металла к коррозии: (φ(Fe 2+ /Fe) = –0,44 B – железо корродирует во многих средах; φ(Au + /Au) = +1,68 B – золото (благородный металл) не корродирует).
Однако существует группа очень активных, но коррозионно-стойких металлов (Al, Ti и др.). Их стойкость обусловлена большой склонностью к пассивации. На их поверхности образуются защитные оксидные пленки (на алюминии – Al2O3, на титане – TiO2). Коррозионная стойкость других металлов также повышается благодаря пассивации.
На устойчивость металла к коррозии оказывает влияние чистота металла: наличие примесей чаще всего ее снижает. Большинство сплавов более подвержены коррозии, чем чистые металлы. Тщательная обработка поверхности (полировка, шлифовка) повышает устойчивость металла, облегчает формирование более совершенных и однородных пленок. На гладкой поверхности условия для конденсации водяных паров менее благоприятны, чем на шероховатой. Шероховатая поверхность увеличивает истинную поверхность металла, затрудняет формирование защитных пленок.
Влияет на скорость коррозии и наличие внутренних напряжений. На напряженных участках разрушаются защитные пленки и ухудшаются условия их формирования. Большое влияние на скорость коррозии оказывают также структура сплава, строение кристаллической решетки и т.д.
Внешние факторы коррозии.К внешним факторам коррозии относятся факторы, связанные с составом коррозионной среды, рН, температурой, скоростью движения коррозионной среды
и т.д.
1. Зависимость скорости коррозии от концентрации водородных ионов (рН).
Все металлы по характеру зависимости скорости коррозии от рН можно разбить на несколько групп (рис.6):
а) благородные металлы (Au, Pt, Ag), устойчивые в кислых, нейтральных и щелочных средах;
б) металлы, нестойкие в кислых средах, малостойкие в нейтральных и стойкие в щелочных средах – Mg, Fe, Mn. Это объясняется свойствами оксидных пленок, которые хорошо растворяются в кислотах и не растворяются в щелочах;
в) металлы нестойкие как в кислых, так и в щелочных средах (амфотерные металлы) – Al, Zn, Pb, Sn и т.д.;
г) металлы нестойкие в кислых средах, стойкие в нейтральных и щелочных средах (Ni, Co).
 |
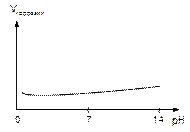
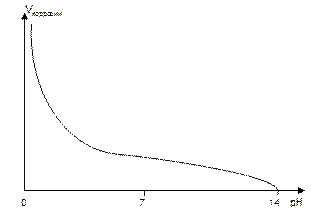
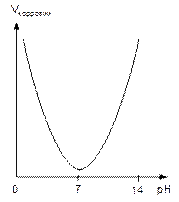
Рис.6. Зависимость скорости коррозии металлов
от рН коррозионной среды: а – благородные металлы;
б – Mg, Fe, Mn; в – амфотерные металлы
2. Зависимость скорости коррозии от состава коррозионной среды.
В коррозионной среде могут присутствовать вещества, усиливающие коррозию (они называются активаторами) и замедляющие ее (замедлители коррозии).
Вещества, ускоряющие коррозию, разрушают защитные пленки на поверхности металла. Наиболее агрессивными активаторами являются ионы Cl — , Br — , I — (они ускоряют коррозию практически всех металлов). Данные ионы вытесняют кислород из оксидной пленки, что делает пленку растворимой. Это приводит к образованию в пленках пор, которые являются анодными участками.
Замедлителями называются вещества, значительно снижающие скорость коррозии. К ним относятся:
– вещества, образующие на поверхности металла защитные пассивные пленки: NaNO3, NaNO2, Cr2O7 2- , O2 и т.д.:
– вещества, образующие труднорастворимые солевые пленки с ионами корродирующего металла: SiO2 2- , CO3 2- , OH — и т.д.:
Необходимо отметить, что одни и те же вещества могут замедлять коррозию одних металлов и усиливать коррозию других. Например, в растворах щелочей сталь устойчива, а амфотерные металлы неустойчивы. В растворах, содержащих аммиак NH3, сталь устойчива, а медь неустойчива.
3. Зависимость скорости коррозии от концентрации растворенных солей (рис.7).
В присутствии окислителя О2 повышение концентрации растворенных веществ (солености) приводит к усилению коррозии (участок а на рис.7) вследствие увеличения электропроводности среды. С другой стороны, увеличение концентрации солей уменьшает растворимость кислорода, поэтому при высоких значениях солености скорость коррозии уменьшается (участок б на рис.7).
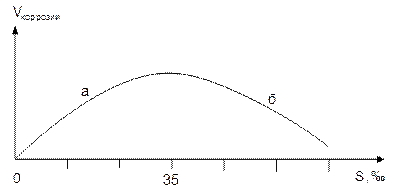
Рис.7. Зависимость скорости коррозии от солености
коррозионной среды
4. Зависимость скорости коррозии от температуры.
Температура оказывает значительное влияние на скорость электрохимической коррозии. Согласно законам химической кинетики, повышение температуры приводит к увеличению скорости коррозии. Эта зависимость сохраняется при постоянной концентрации кислорода в системе, например, при работе паровых котлов (линия а на рис.8).
Если кислород может выделяться из раствора с повышением температуры (открытый водонапорный бак), то зависимость скорости коррозии от температуры будет иметь иной вид – с максимумом при t ≈ 80 о C (кривая б на рис.8). Уменьшение скорости коррозии с дальнейшим увеличением температуры будет обусловлено уменьшением концентрации кислорода.
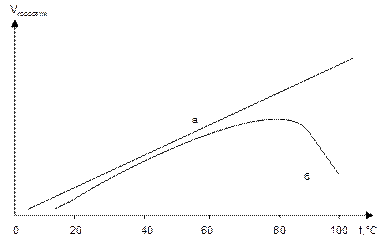
Рис.8. Зависимость скорости коррозии от температуры:
а – закрытая система; б – открытая система
5. Зависимость скорости коррозии от движения коррозионной среды.
Особенно большое значение этот фактор имеет для трубопроводов, при движении судов и т.д. Причем в пресной воде в присутствии кислорода зависимость будет иметь сложный характер (рис.9, кривая 1). На кривой можно отметить несколько участков. Участок а соответствует усилению коррозии за счет увеличения подвода кислорода к поверхности металла. Участок б – снижение скорости коррозии за счет образования пассивной пленки вследствие высокой концентраций кислорода, подводимого к поверхности металла движущимся потоком. Участок в – при очень больших скоростях движения воды происходит срыв защитной пленки и усиление коррозии (при скорости коррозии более
10 м/с).
Кривая 2 соответствует коррозии стали в морской воде. Содержание в воде большого количества ионов Cl — препятствует образованию защитных пленок, поэтому с увеличением скорости движения коррозионной среды усиливается коррозия металла.


Рис.9. Зависимость скорости коррозии стали от движения
коррозионной среды: 1 – коррозия в пресной воде;
2 – коррозия в морской воде
Контактная коррозия металлов
Контактная коррозия – это электрохимическая коррозия, вызванная контактом двух и более металлов, имеющих различные стационарные потенциалы в данной коррозионной среде. При контакте металлов возникает коррозионный макрогальванический элемент, его работа влияет на скорость коррозии каждого контактирующего металла. При этом по сравнению со скоростью коррозии металлов вне их контакта усиленной коррозии подвержен активный металл А с более электроотрицательным потенциалом φа. Коррозия металла с более положительным потенциалом φк резко замедляется или полностью прекращается. Сила тока коррозионного элемента, а следовательно, и скорость контактной коррозии, зависит от разности потенциалов контактирующих металлов
Δφ = φк – φА. Более активный металл разрушается при прочих равных условиях тем быстрее, чем больше разность потенциалов Δφ контактирующих металлов.
В морской воде стационарные потенциалы металлов увеличиваются в ряду Mg → Zn → Al → Cd → Fe → Pb → Sn → Ni → Cu → Ti → Au. Поэтому каждый последующий металл при контактировании с предыдущим усиливает его коррозию. Чем больше удалены металлы друг от друга в указанном ряду, тем больше скорость контактной коррозии.
Так, например, стационарный потенциал дюралюмина (сплав системы Al–Cu) в морской воде более отрицательный, чем у меди, никеля, свинца, железа, но более положительный, чем у кадмия, алюминия, цинка. В соответствии с этим коррозия дюралюмина в морской воде усиливается при контакте его с Cu, Ni, Pb, Fe. При контакте с Cd, Al, Zn коррозия дюралюмина уменьшается.
Другим примером опасного контакта является возникновение макрокоррозионного элемента в кормовой части судна. Стальной корпус судна является анодом, а контактирующий с ним гребной винт из бронзы – катодом:
Рассмотрим, как влияет на скорость контактной коррозии соотношение площадей контактирующих поверхностей металлов. Плотность коррозионного тока анодного металла 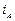 определяется по формуле
определяется по формуле
 ,
,
где 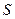 – площадь поверхности металла (
– площадь поверхности металла ( 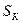 – катода,
– катода,  – анода). В связи с тем, что плотность тока и скорость растворения металла при коррозии прямо пропорциональны, скорость растворения анодного металла
– анода). В связи с тем, что плотность тока и скорость растворения металла при коррозии прямо пропорциональны, скорость растворения анодного металла 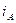 тем выше, чем больше соотношение
тем выше, чем больше соотношение 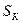 :
:  .
.
Поэтому при контактной коррозии особенно опасно такое сочетание металлов, при котором анод имеет малую площадь, а катод – большую ( 
Источник
Контактной
коррозией называется электрохимическая
коррозия, вызванная контактом металлов,
имеющих разные стационарные потенциалы
в данном электролите. При этом возникает
коррозионный гальванический элемент,
работа которого влияет на скорость
коррозии контактирующих металлов.
Работа коррозионного элемента
определяется сопротивлением анодного
и катодного процессов и омическим
сопротивлением. С увеличением разности
между стационарными потенциалами
катода и анода, уменьшением омического
сопротивления и сопротивления катодного
и анодного процессов контактная коррозия
возрастает. Как правило, коррозия
металла, имеющего более отрицательный
потенциал (анод) увеличивается, а
скорость коррозии металла с более
положительным потенциалом (катод)
снижается по сравнению со скоростью в
отсутствие контакта.
На
контактную коррозию металлов большое
влияние оказывают площади катодов и
анодов, состав среды, перемешивание
нейтрального раствора и др.
С
увеличением площади катода при постоянной
площади анода скорость контактной
коррозии растет. Если скорость коррозии
контролируется скоростью диффузии,
например диффузией кислорода при
коррозии с кислородной деполяризацией,
то с увеличением площади катода скорость
контактной коррозии повышается. При
перемешивании нейтрального раствора
растет диффузия кислорода к поверхности
катода, следовательно, увеличивается
контактная коррозия.
Контактная
коррозия может проявляться и в атмосферных
условиях. При этом максимальная скорость
коррозии наблюдается на участках,
непосредственно прилегающих к месту
контакта. По мере удаления от места
контакта плотность тока коррозионного
элемента падает и, следовательно,
скорость контактной коррозии снижается.
Для
защиты от контактной коррозии в основном
применяются следующие методы:
–
подбор контактируемых металлов и
сплавов с минимальной разницей
потенциалов;
–
изоляция металлов в местах контакта;
–
введение в закрытые системы ингибиторов,
снижающих коррозию контактируемых
металлов.
5.3.4. Щелевая коррозия
Щелевой
коррозией называется усиление коррозии
в щелях и зазорах между металлами,
прокладочными материалами и металлом,
в морских условиях (между слоем
микроорганизмов и обшивкой корабля).
Наиболее чувствительны к щелевой
коррозии пассивирующиеся металлы
(нержавеющие стали, алюминиевые сплавы,
титан и др.).
Механизм
щелевой коррозии состоит в следующем.
С течением времени из-за затруднения
доступа окислителя и расходования его
в процессе коррозии в щели снижается
концентрация окислителя и, тем самым,
снижается скорость катодного процесса.
Происходит уменьшение катодного тока,
при этом потенциал катода смещается в
отрицательную сторону, что приводит к
переходу поверхности металла щели в
активное состояние и скорость его
растворения увеличивается. Появление
в растворе продуктов коррозии и их
гидролиз приводят к подкислению
раствора. Дальнейшее протекание
коррозионного процесса при ограниченной
скорости подвода свежего электролита
способствует понижению рН, что облегчает
анодный процесс растворения металла
и создает возможность протекания
коррозии с водородной деполяризацией.
Это приводит к увеличению коррозионного
тока, процесс подкисления раствора в
щели ускоряется, и металл в щели при
смещении потенциала в отрицательную
сторону становится анодом по отношению
к металлу открытой поверхности. Это
обычно наблюдается в практических
случаях щелевой коррозии.
В
зависимости от вида контроля
электрохимической коррозии затруднение
доступа кислорода может вызывать
увеличение или уменьшение скорости
коррозии металла в зазоре. Если скорость
коррозии контролируется анодным
процессом, то торможение доступа
кислорода вызывает увеличение скорости
коррозии металла в зазоре. Если же
скорость коррозии контролируется
катодным процессом, затруднение доступа
кислорода вызывает уменьшение скорости
коррозии металла в зазоре.
Особенно
чувствительны к щелевой коррозии
металлы и сплавы, пассивное состояние
которых связано с наличием в электролите
растворенного кислорода и других
пассиваторов. Затруднение доступа этих
веществ в зазор, приводит к снижению
их концентрации ниже критического
значения, в результате чего металл
переходит из пассивного в активное
состояние и происходит щелевая коррозия.
Нержавеющие
стали в условиях, когда в зазоре,
вследствие затруднения доступа
окислителя, они находятся в активном
состоянии, подвергаются интенсивной
щелевой коррозии. Снижение рН раствора
до 3,5 – 4,0 способствует усилению щелевой
коррозии.
Соседние файлы в папке Часть 1
- #
- #
- #
| Рис. 341. Образцы для изучения контактной коррозии металлов |  |
Исследования проводят на установке (рис.3.3) для изучения контактной коррозии металлов (модель короткозамкнутого гальванического элемента) в интересующей среде, например, в модели морской воды (3%-нь[й раствор хлористого натрия). [c.41]
Для изучения контактной коррозии, т. е. коррозии металлов и сплавов в контакте с другими металлами, применяют различные виды образцов и методы контактирования. Используют, например, [c.454]
К числу специальных методов коррозионных испытаний относятся определение склонности металлов к межкристаллитной коррозии исследования в условиях совместного действия агрессивных сред и напряжений изучение контактной, щелевой и газовой коррозии металлов. Наибольшее значение имеют методы испытания металлов на склонность к межкристаллитной коррозии. [c.344]
Изучение контактной коррозии металлов [c.38]
Коррозия, развивающаяся при соприкосновении двух или нескольких разнородных в электрохимическом отношении металлов в электролитической среде, называется контактной. В атмосферных условиях она обусловлена усилением анодного процесса на относительно небольшом участке поверхности металла. В основе изучения контактной коррозии лежит теория многоэлектродных систем, разработанная Г. В. Акимовым и его учениками [2, 7, 8]. [c.82]
Более совершенные образцы показаны на рис. 82, в. Они часто применяются при изучении контактной коррозии разных металлов с нержавеющими сталями. При их использовании отпадает необходимость изолировать часть исследуемой поверхности краской, невелика поверхность, корродирующая без контакта, и, кроме того, обеспечивается хороший контакт между образцами. Возможное капиллярное затекание электролита в тонкий зазор считается положительным фактором. Использование таких образцов позволяет сократить время испытания по сравнению с образцами типа а и б. Недостатки образцов типа в заключаются в том, что эти образцы позволяют получить сведения о коррозии только анода, тогда как образцы в виде дисков позволяют одновременно изучать протекторное действие анодного материала. Для этого достаточно определить изменение веса катодного материала и сравнить его с изменением веса того же материала, испытанного без контакта. К недостаткам относится также то, что анодный материал может испытываться только в виде проволоки. [c.147]
На рис. 97 приведена схема установки, разработанной И. Л. Розенфельдом [40] для изучения контактной коррозии трубных материалов и определения дальности действия контакта. Установка позволяет производить измерения при движении жидкости различной температуры (от 20 до 80° С). Исследуемый электрод представляет собой составную трубку. Разные отрезки трубы (электроды) изолированы друг от друга. Одна половина трубы собирается из электродов одного металла, вторая половина — из электродов другого. Общая длина трубы зависит от ее диаметра и электропроводности электролита. В морской воде, например, труба общей длиной один метр была собрана из образцов длиной 100—125 мм при диаметре 20—30 мм. Циркуляция электролита в установке осуществляется за счет разрежения в колбе, создаваемого водоструйным насосом. От каждого электрода выводится электрический контакт на панель, служащую для измерения тока. Во время испытаний каждая пара электродов соединяется друг с другом поочередно. Схема позволяет измерять ток при любой комбинации электродов, а также приво- [c.156]
Для изучения контактной коррозии, т, е, коррозии металлов и сплавов в контакте с другими металлами, применяют различные ви- [c.386]
Цинкование стали делает ее анодной по отношению ко всем изученным нами сплавам, за исключением магниевого сплава МЛ1. Хромирование обычной стали хотя и снижает заметно ток контактной коррозии и делает сталь более благородной, однако она еще продолжает работать в качестве анода в контакте с такими металлами, как анодированный с последующим наполнением водой и хромпиком сплав Д16,, латунь в состоянии поставки, а также посеребренная и никелированная сталь, бериллиевая и фосфористая бронзы. [c.117]
Контактная коррозия исследуется с двумя целями [4, 239] для изучения защитного действия протекторов или для оценки дополнительных коррозионных потерь, связанных с контактом разнородных Металлов. Этот вид коррозии связан главным образом с различием электрохимических характеристик контакти-руемых металлов или различных участков на одном и том же металле. Последние чаще всего обусловлены различием в обработке. На контактную коррозию существенное влияние оказывают размеры и физическое состояние электродов, свойства коррозионной среды, температура. В этой связи моделирование [c.143]
Цель настоящей работы — изучение процесса контактной коррозии (расчет потерь массы и контролирующего фактора коррозионного процесса) по коррозионной диаграмме. Последнюю получают измерением величины тока и потенциалов электродов коррозионной пары в нейтральном электролите. Если в качестве электродов гальванического элемента служат анодные и катодные составляющие структуры какого-либо металла, то такая пара может моделировать работу коррозионных микроэлементов данного металла. [c.117]
Коррозионные диаграммы имеют большое значение для изучения и расчетов процессов электрохимической коррозии металлов. На основании коррозионной диаграммы можно определить величину тока пары и, следовательно, скорость коррозии анода (саморастворение — растворение вследствие работы микропар при этом не учитывается, так как оно мало по сравнению с контактной коррозией), установить контроль коррозионного процесса и дать его количественную оценку. [c.117]
При помощи лабораторного анализа данных по распределению потенциала можно рассчитать распределение тока на различных поверхностях, близких или далеких от места контакта разнородных металлов. Эта методика была использована Роу [107] для изучения коррозионного поведения образцов с покрытиями и без них на контактную коррозию. [c.561]
На скорость атмосферной коррозии значительно влияет контакт двух металлов, обладающих различными значениями электродных потенциалов. Изучением механизма контактной коррозии применительно к алюминиевым и медным сплавам занимались в Советском Союзе И. Л. Розенфельд -с сотрудниками (ИФХ АН СССР) и за рубежом К. Г. Комптон с сотрудниками. На основе этих исследований авторы рекомендуют следующие количественные показатели. Абсолютно допустимыми контактами являются такие, при которых скорость коррозии анода составляет О—50 гЦм -год), относительно допустимыми — при которых скорость коррозии составляет 50—150 гЦм -год) кон- [c.181]
При изучении интенсивности коррозии исследуемых жидкостей электрическим методом использовалась установка для изучения контактной коррозии металлов. Металлом (анод) в наших опытах служила сталь марки 40ХН, изготовленная в виде прямоугольника размером 9x9x20 мм. [c.14]
При потенциостатическом изучении пленок на основе ПЭ обнаружен неожиданный эффект минеральное масло, выделяясь из студней, обнаруживает в контакте с металлами свойства специфического ингибитора коррозии [31]. Выделение масла из пленок, изолирующих рабочий электрод, вызывает анодное смещение стационарного потенциала коррозии. Наибольшее смещение соответствует содержанию масла М= 15-5-30%, когда скорость синерезиса в 4-5 раз ниже максимальной. Возрастание пористости пленок с М > 30% сопровождается уменьшением анодного смещения потен1щала из-за увеличения проницаемости пленок для кислорода и электролита. Потенциал коррозии стали под пленкой на основе ПЭ, содержащего масляный раствор контактного ингибитора, такой же, как под пленкой этого раствора. [c.155]
Простейщим методом при изучении галп-занической коррозии является измерение ра.1ности потенциалов в разомкнутой цепи между металлами, находящимися в контакте, в исследуемых условиях. Это по меньшей мере показывает вероятность направ-.яения контактного тока, не обеспечивая при этом данных по скорости процесса. Более подходящим является метод измерения потенциалов разомкнутой цепи между металлами, но с применением электродов сравнения, которые будут давать ту же самую информацию, а также возможность следить за изменением потенциалов каждО го металла во времени, поскольку общая разность потенциалов во времени будет меняться. Для больщинства практических лабораторных исследований насыщенный каломельный полуэлемент является наиболее удобным. Точность измерений отвечает требованиям, и концентрация хлорида калия легко поддерживается постоянной. [c.560]
Контактная коррозия металлов – это одно из часто встречающихся явлений, способных привести к их повреждению, потере эксплуатационных характеристик и полному разрушению.
Явление наблюдается, когда контактируют два металла, отличающиеся по электромеханическим свойствам.
Большинство рекомендаций по производству и эксплуатации металлоконструкций отмечают, что компоновать металлы нужно с учетом их совместимости.
Но это требование не всегда соблюдается.
Рассмотрим особенности коррозийного процесса и постараемся ответить на вопрос о том, какие материалы совмещаются между собой.
В зависимости от типа металлов, при контакте они ведут себя по-разному.
К примеру, контактная коррозия распространена при соприкосновении углеродистой стали и алюминия, меди и железа, цинка и алюминия. И это – только часть возможных сочетаний.
Иногда контактная коррозия наблюдается и в случае, если происходит контакт одинаковых металлов. Также появляются проблемы в месте соединения при сварке, по шву, из-за использования специальных присадочных проволок и других материалов.
Почему появляется контактная коррозия
Причина распространения коррозии – возникновение компромиссного потенциала. Он отличается по своим показателям от соприкасающихся металлов.

В итоге появляется пересечение анодной и катодной кривой.
В качестве анода выступает металл, у которого электроотрицательный потенциал выше, чем у другого. Электроположительный металл становится катодом.
Многое зависит и от типа электролита. Это приводит к тому, что увеличится скорость растворения и протекания процесса.
Стоит также учесть и скорость растворения анода. На нее влияет разность катодных и анодных потенциалов.
Значение также имеет уровень компромиссного потенциала. На него влияет тип металлов, которые вступают в контакт.
Есть и 4 внешних фактора, которые оказывают на него воздействие. К ним относятся такие, как:
- Температура самого металла и среды, в которой он находится.
- Уровень аэрации, доступ кислорода.
- Особенности окружающей среды, степень загрязненности и типы рассеянных в воздухе частиц.
- Уровень влажности, наличие прямого контакта с водой, постоянного намокания.
Процесс контактной коррозии развивается в различных средах. Это – открытый воздух, вода, почва.
Если при распространении коррозии, на материал неравномерно воздействует кислород, велика вероятность появления дифференциальной аэрации.
Это затрудняет катодную реакцию и влияет на саму интенсивность протекания процесса.
Особенности проявления катодной коррозии для разных типов металлов и сплавов
На особенности протекания коррозии влияет тип сплавов и металлов, которые контактируют друг с другом.
Все особенности сочетаний указаны в таблице ниже.
|
Тип металла |
Сочетания |
Примечания |
|
Алюминий и оксидированные сплавы. |
Магний и его оксидированные сплавы, прошедший пассивацию кадмий, разные типы стали – как окрашенной, так и оцинкованной, фосфатированной. |
Допускается применение сочетаний с низким риском появления коррозии как в жестких, так и в средних условиях. |
|
Магний и разные виды сплавов |
Магний и сплавы, в том числе, при покрытии грунтом и лаком, анодированный алюминий и сплавы, сталь с хромовым покрытием, а также с нанесенным сверху цинком, кадмием, оловом и другими видами продукции. |
Допускается применение сочетаний с низким риском появления коррозии как в жестких, так и в средних условиях. |
|
Медь и разные виды сплавов |
Никель, олово, хром, золото, анодированный алюминий. Допускается применение припоя оловянно-свинцового типа. Допускается сочетание с разными вариантами сплавов анодированного алюминия, окрашенной или фосфатированной стали. |
Допускается применение сочетаний с низким риском появления коррозии как в жестких, так и в средних условиях. |
|
Ценные металлы -родий, серебро, палладий, золото |
Все перечисленные виды металлов отлично сочетаются друг с другом с низким риском появления контактной коррозии. Можно также использовать изделия с оловом, никелем, алюминием, хромом и различными вариантами сплавов. |
—- |
|
Цинк и сплавы |
Сочетаются с разными вариантами стали, в том числе, хромникелевой, фосфатированной, окрашенной. В процессе обработки можно использовать в качестве припоя олово, а также его сочетание со свинцом. Среди других допустимых сочетаний – никель, анодированный алюминий и разные типы сплавов. |
—- |
|
Олово и сплавы |
Среди допустимых сочетаний можно назвать никель, хром, олово, медь, припои из сплава свинца и олова. Сталь в контакте может быть покрытой цинковым слоем, окрашенной или анодированной, если планируется использование в контакте с морской водой. Можно также использовать такой вариант материала с золотом и серебром. |
—- |
|
Хром и никель |
Одни из наиболее сочетаемых с другими разновидностями сырья. Список допустимых для контакта металлов очень большой – от золота, меди и сплавов до хрома, никеля, меди, цинка, кадмия и других. |
—- |
|
Кадмий |
Может соприкасаться с хромом, прошедшим процесс пассивации оловом, цинком, никелем, кадмием, припоем из олова и свинца. Сталь может быть как хромникелевой, так и хромистой, а также с дополнительным полимерным покрытием. |
—- |
Меры предосторожности для недопущения развития контактной коррозии
Чтобы риск контактной коррозии металла снизился, нужно соблюдать 3 рекомендации. К ним относятся следующие:
- Будьте осторожны с покрытиями. Это актуально в том случае, если планируется использовать изделие в районах с тропическим климатом и рядом с морем. Дополнительное покрытие не стоит наносить на участки деталей, где планируется сварка внахлест, установка заклепок из других видов сырья. Причина заключается в особенностях поведения электролита, когда коррозия значительно усиливается.
- При проведении сварки и клепки деталей, покрытие нужно снимать. После того, как все работы проведены, сверху можно будет наносить полимерное покрытие для борьбы с негативным воздействием окружающей среды.
- Не стоит использовать гальваническое покрытие в том случае, если перед вами деталь из черных или цветных металлов, прошедшие через литьевые формы.
Чтобы не допустить появления коррозии, всегда нужно понимать, с какими металлами вы работаете, и как они сочетаются друг с другом. Чтобы уменьшить степень интенсивности разрушения металла, нужно как можно скорее удалить соприкасающиеся отрезки сырья друг от друга.
Когда деталь используется в агрессивных средах, можно предусмотреть специальные прокладки. Хорошо справляется с задачей использования в морской воде магний и большинство его сплавов, цинк, алюминий и другие.
В качестве изоляции между элементами могут выступать металлические или полимерные лакокрасочные покрытия. Хорошим решением станут свинцовые детали.
Защитим ваши металлические изделия от коррозии
Наша компания выполняет задачи по проведению горячей оцинковки разных видов материалов. Среди преимуществ работы с нами есть такие, как:
- Опыт работы с 2007 года. Регулярно сотрудничаем со многими постоянными клиентами.
- Большая производственная база. У нас есть три цеха горячего цинкования. Мощность предприятия составляет 120 тысяч тонн в год.
- Универсальность. Работаем даже со срочными заказами и любыми видами изделий. На предприятии установлена одна из самых глубоких ванн в ЦФО. Ее глубина составляет 3,43 метра.
- Качественное оборудование. Используем в обработке технику от таких крупных брендов, как KVK KOERNER и EKOMOR.
Мы гарантируем полное соответствие требованиям ГОСТ 9.307-89. Готовы ответить на все интересующие вас вопросы и быстро приступить к выполнению поставленной задачи.
