Как определить окисления фосфора
Фосфор – химический элемент, имеющий 15-й порядковый номер в Таблице Менделеева. Он расположен в ее V группе. Классический неметалл, открытый алхимиком Брандом в 1669-м году. Существует три основных модификации фосфора: красный (входящий в состав смеси для розжига спичек), белый и черный. При очень высоких давлениях (порядка 8,3*10^10Па) черный фосфор переходит в другое аллотропическое состояние («металлический фосфор») и начинает проводить ток. Как определить степень окисления фосфора в различных веществах?

Инструкция
Вспомните, что такое степень окисления. Это величина, соответствующая заряду иона в молекуле, при условии, что электронные пары, осуществляющие связь, смещены в сторону более электроотрицательного элемента (расположенного в Таблице Менделеева правее и выше).
Надо также знать главное условие: сумма электрических зарядов всех ионов, входящих в состав молекулы, с учетом коэффициентов всегда должна равняться нулю.
Необходимо помнить, что степень окисления элементов, входящих в состав простого вещества (например, C, O2, Cl2), всегда равна нулю.
Степень окисления далеко не всегда количественно совпадает с валентностью. Наилучший пример – углерод, который в органических молекулах всегда имеет валентность, равную 4, а степень окисления может быть равной и -4, и 0, и +2, и +4.
Какова степень окисления фосфора в молекуле фосфина PH3, например? С учетом всего вышесказанного дать ответ на этот вопрос очень легко. Поскольку водород – самый первый элемент в Таблице Менделеева, он по определению не может располагаться там «правее и выше», чем фосфор. Следовательно, именно фосфор притянет к себе электроны водорода.
Каждый атом водорода, лишившись электрона, превратится в положительно заряженный ион со степенью окисления +1. Следовательно, суммарный положительный заряд равен +3. Значит, с учетом правила, гласящего, что суммарный заряд молекулы равен нулю, степень окисления фосфора в молекуле фосфина равна -3.
Ну, а какова степень окисления фосфора в оксиде P2O5? Возьмите Таблицу Менделеева. Кислород расположен в VI группе, правее фосфора, и к тому же выше, следовательно, он однозначно более электроотрицателен. То есть степень окисления кислорода в этом соединении будет со знаком «минус», а фосфора – со знаком «плюс». Каковы же эти степени, чтобы молекула в целом была нейтральна? Легко можно увидеть, что наименьшее общее кратное для чисел 2 и 5 – это 10. Следовательно, степень окисления кислорода -2, а фосфора +5.
Видео по теме
Полезный совет
Фосфор – один из важнейших элементов, входящий в состав белков, нуклеиновых кислот, аденозиндифосфорной и аденозинтрифосфорной кислот. Он незаменим для жизни. Его соединения широко используются в разных отраслях промышленности.
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
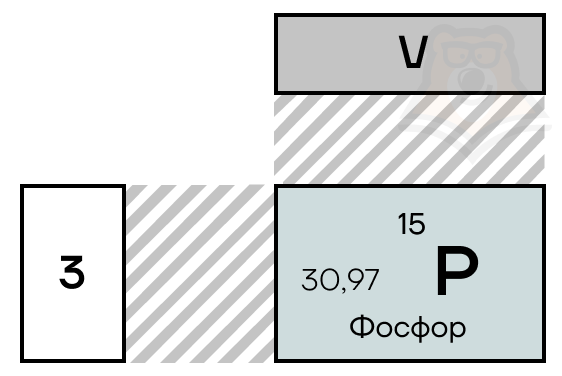
Фосфор в таблице менделеева занимает 15 место, в 3 периоде.
| Символ | P |
| Номер | 15 |
| Атомный вес | 30.9737620 |
| Латинское название | Phosphorus |
| Русское название | Фосфор |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
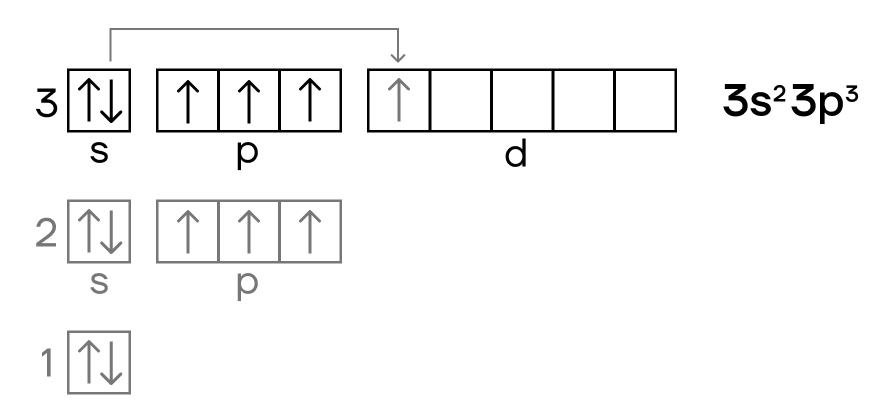
Электронная схема фосфора
P: 1s2 2s2 2p6 3s2 3p3
Короткая запись:
P: [Ne]3s2 3p3
Одинаковую электронную конфигурацию имеют
атом фосфора и
Si-1, S+1, Cl+2
Порядок заполнения оболочек атома фосфора (P) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Фосфор имеет 15 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
3 электрона на 3p-подуровне
Степень окисления фосфора
Атомы фосфора в соединениях имеют степени окисления 5, 4, 3, 2, 1, 0, -1, -2, -3.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы фосфора
Валентность P
Атомы фосфора в соединениях проявляют валентность V, IV, III, II, I.
Валентность фосфора характеризует способность атома P к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа P
Квантовые числа определяются последним электроном в конфигурации,
для атома P эти числа имеют значение N = 3, L = 1, Ml = 1, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:

Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации P:
Eo = 1012 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где P в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
На этой странице вы узнаете
- О трех фосфорных братах;
- P2O5-разбойник: разберем, почему;
Фосфор был открыт в результате поисков философского камня. Хотели получить золото и бессмертие, а вместо этого обнаружили элемент, который светится зеленым цветом в темноте. Чем ещё отличается фосфор — расскажем в статье.
Общая характеристика
Фосфор находится в VA-группе третьего периода таблицы Менделеева, прямо под азотом. Электронная конфигурация фосфора в основном состоянии 1s22s22p63s23p3.
Конфигурация его внешнего слоя такая же, как и у азота. Но фосфор имеет на этом слое полностью свободный d-подуровень, куда в случае возбуждения атома может переехать его электрон.
Поэтому в возбужденном электронном состоянии атом фосфора имеет конфигурацию внешнего электронного уровня 3s13p33d1.
Таким образом, благодаря наличию в возбужденном состоянии пяти неспаренных электронов, фосфор может максимально образовывать в соединениях пять химических связей.
В отличие от азота, у фосфора максимальная валентность (V) и высшая степень окисления (+5) численно совпадают.
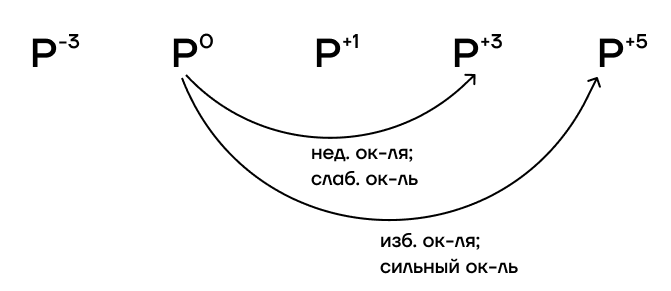
Какие степени окисления фосфора возможны?
- Высшая степень окисления равна номеру группы: +5.
- Низшая степень окисления определяется по формуле «номер группы — 8»: -3.
- Промежуточные степени окисления, как и сам номер группы, нечётные: +1, +3.
Физические свойства
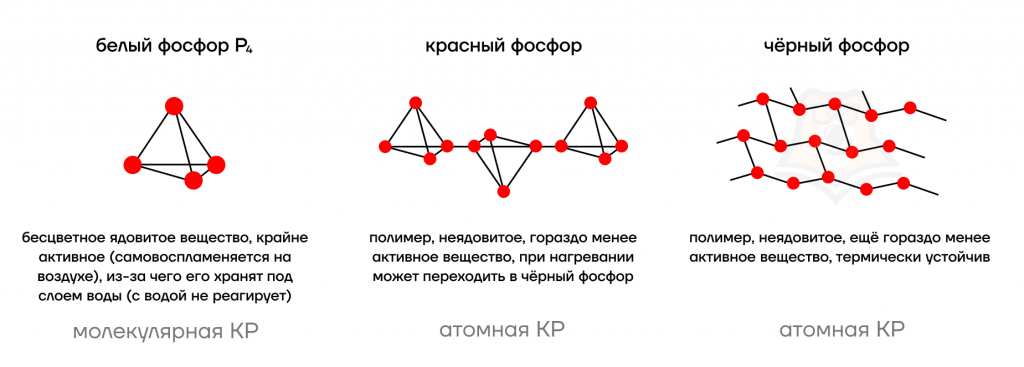
Фосфор как простое вещество, аналогично углероду, имеет несколько аллотропных модификаций.
О трех фосфорных братах
Можно запомнить основные свойства по “характерам” модификаций:
- Белый фосфор — токсичный взрывной парень, который отравляет всем жизнь и легком можно возгореться. Поэтому его от греха подальше упрятали под воду.
- Красный фосфор не очень ценит качества своего белого “брата”. Поэтому он неядовит и при высокой температуре просто превращается в любимого брата — в черный фосфор.
- Черный фосфор — полная противоположность белому, самый мирный брат из тройки. Он неядовит, фактически не реагирует на температуру. Дзен среди фосфоров.
Химические свойства
Фосфор имеет низкое значение электроотрицательности. Это значит, что фосфор проявляет ярко выраженные восстановительные свойства. Онплохо притягивает к себе электроны, поэтому у него их легко отобрать.
При избытке окислителя или воздействии такого сильного окислителя, как F2, фосфор переходит в степень окисления +5. При недостатке окислителя или воздействии такого слабого окислителя, как I2, фосфор переходит только в степень окисления +3.
- Реакции с простыми веществами
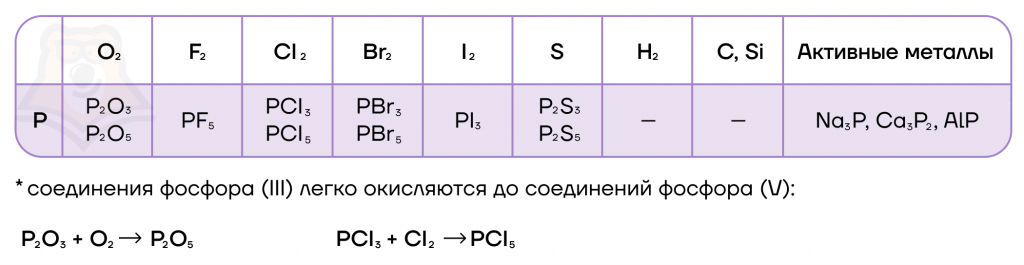
Как и многие бинарные соединения, галогениды фосфора способны гидролизоваться в различных средах (нейтральной, щелочной, кислой). Эти реакции мы, как и всегда, пишем по принципу «притяни плюс к минусу».
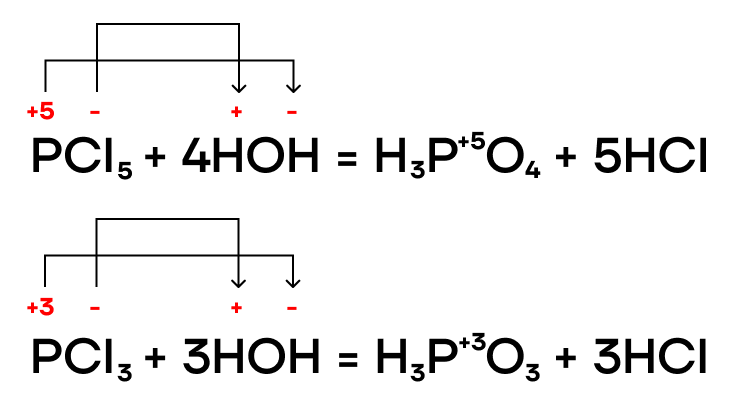
Фосфиды металлов также подвергаются гидролизу в разных средах.
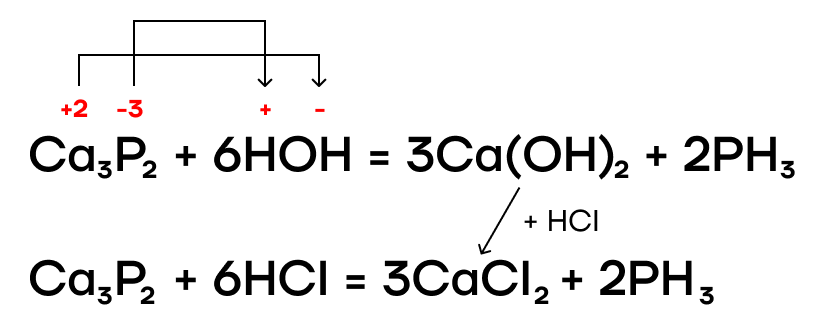
В результате протекания этих реакций образуется ядовитый газ с неприятным запахом чеснока (или тухлой рыбы) — фосфин PH3. Он проявляет очень слабые основные свойства.
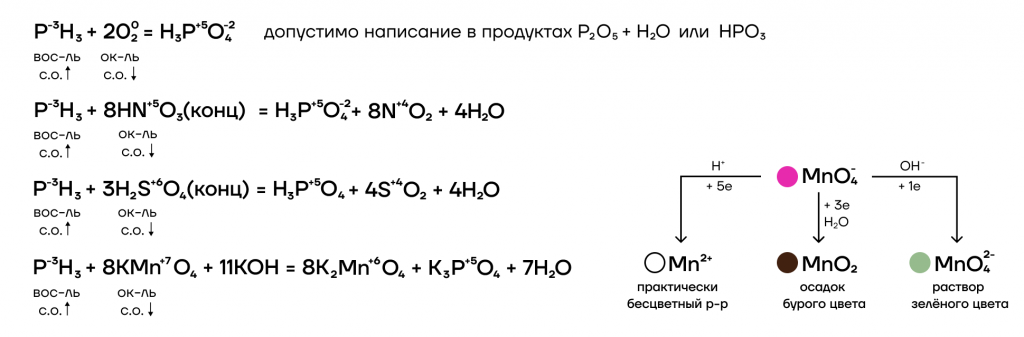
За счет степени окисления фосфора -3 он проявляет ярко выраженные восстановительные свойства. Он богат, поэтому во время реакции можно его ограбить. Следовательно, способен взаимодействовать с окислителями.
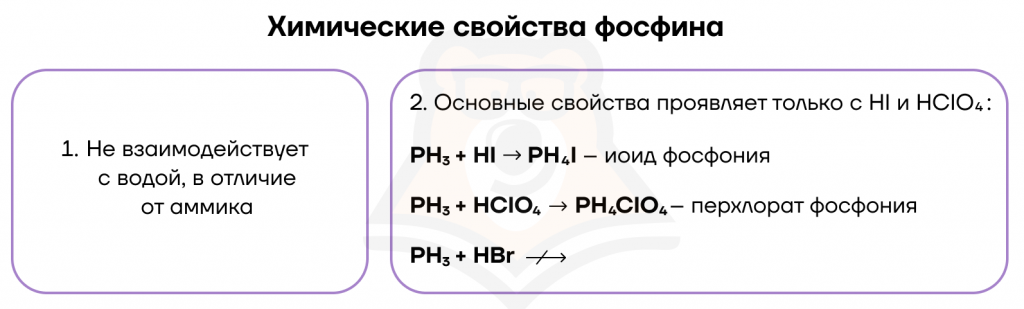

- Реакция со щелочами
Фосфор — один из тех неметаллов, который способен взаимодействовать со щелочами (выражение для запоминания — «LiPSSi Ha»). Так как щёлочь не проявляет выраженных окислительных или восстановительных свойств, фосфору в этой реакции приходится отдуваться за двоих: играть роль как окислителя, так и восстановителя.
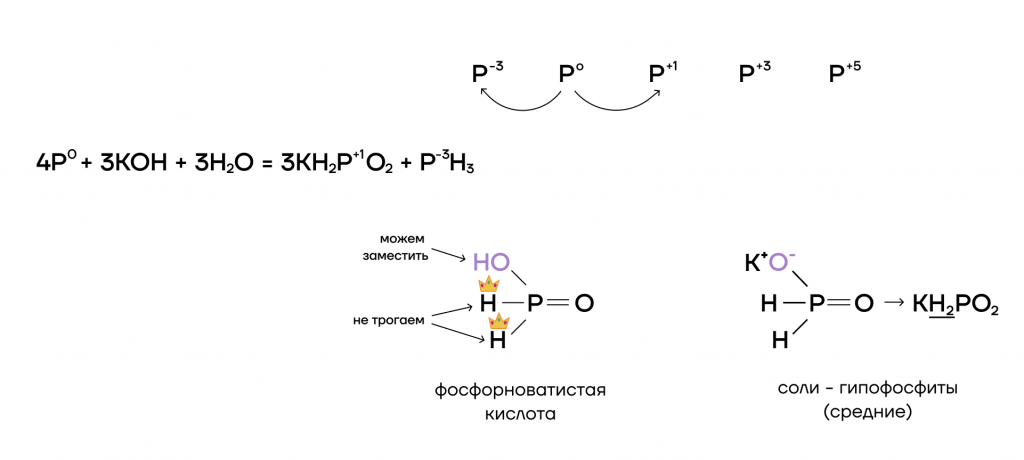
- Реакции с окислителями
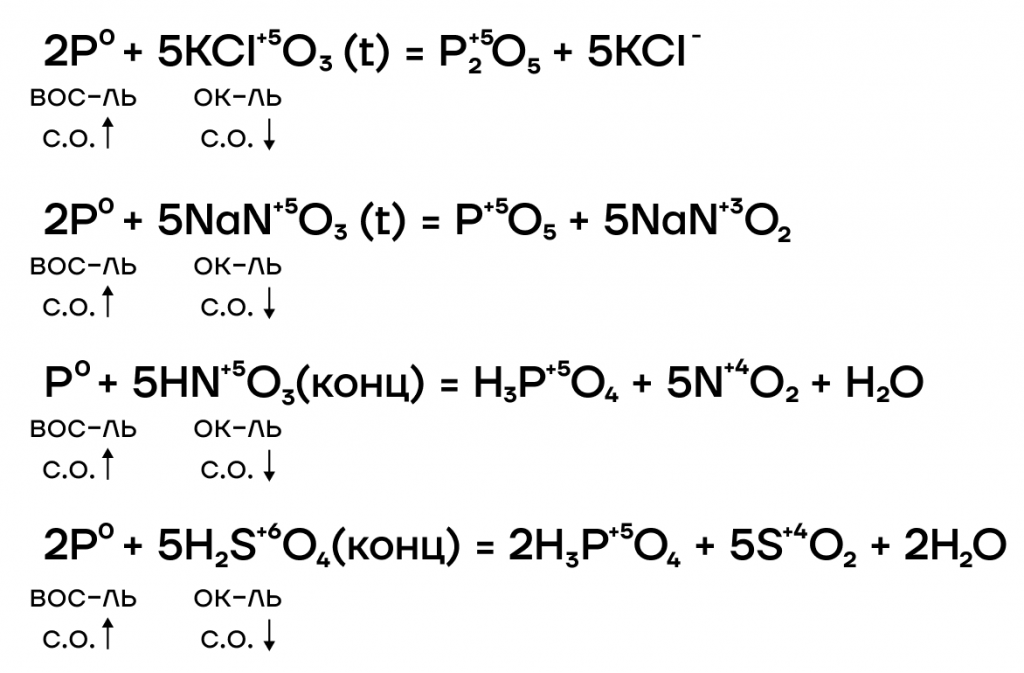
Из-за низкой электроотрицательности фосфор является типичным восстановителем («жертвой»). Поэтому он способен взаимодействовать с окислителями. В ОВР он в подавляющем большинстве случаев как восстановитель повышает свою степень окисления до +5. Она является крайне устойчивой для него. Из-за этого соединения фосфора (V) не являются типичными окислителями, потому что фосфор не хочет уходить из любимой степени окисления.
Получение фосфора
В промышленности главным способом получения фосфора является спекание фосфорита (ортофосфата кальция) с диоксидом кремния и коксом. Для чего это делают?
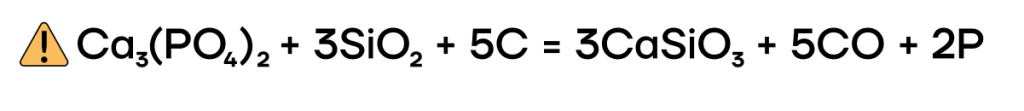
Оксид фосфора (III) P2O3 и фосфористая кислота H3PO3
Оксид фосфора (III) — типичный кислотный оксид. Это значит, он способен реагировать с водой с образованием соответствующей кислоты и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами.
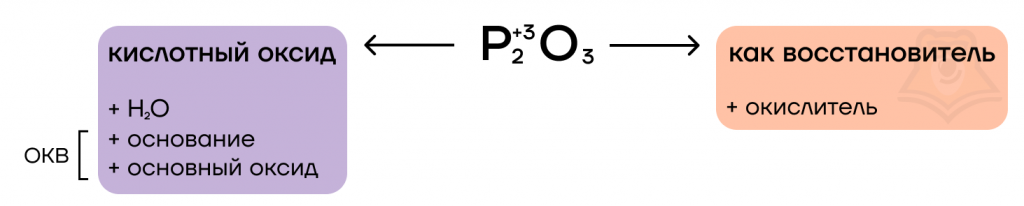
За счет степени окисления +3 оксид фосфора (III) проявляет восстановительные свойства, повышая в реакциях степень окисления до +5.
- Реакция с водой
Как типичный кислотный оксид, P2O3 способен взаимодействовать с водой с образованием соответствующего гидроксида (кислоты).
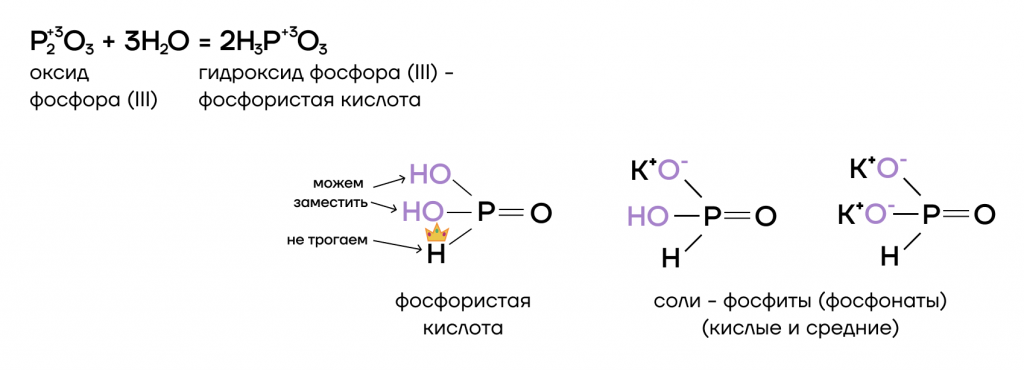
- Основно-кислотное взаимодействие
Тут все очень просто! P2O3 — кислотный оксид, он проявляет кислотные свойства. Значит, он способен вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами — с образованием солей.
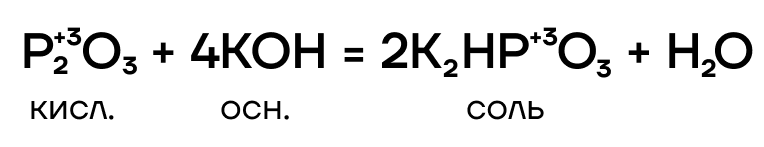
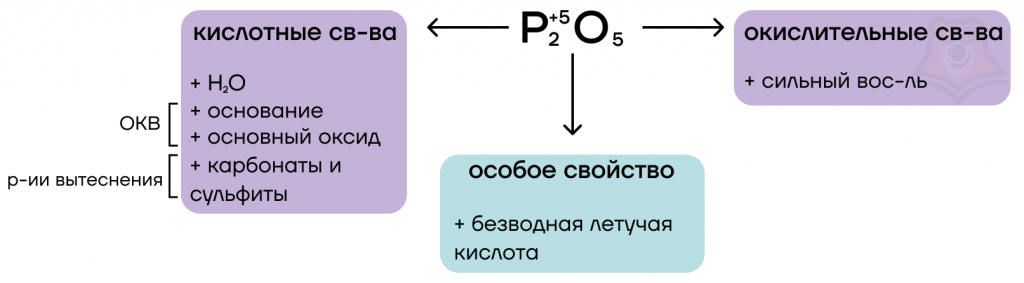
Оксид фосфора (V) P2O5
Оксид фосфора (V) P2O5 как типичный кислотный оксид будет реагировать с водой и вступать в основно-кислотные взаимодействия со своими противоположностями — основаниями и основными оксидами. Также как условно «сильный» оксид он способен вытеснять условно «слабые» из их солей при сплавлении.
- Реакция с водой
При взаимодействии с водой оксид фосфора (V) образует соответствующий гидроксид — ортофосфорную кислоту.

- Кислотно-основные реакции
Происходят с основаниями и основными оксидами. При этом образуются соли.
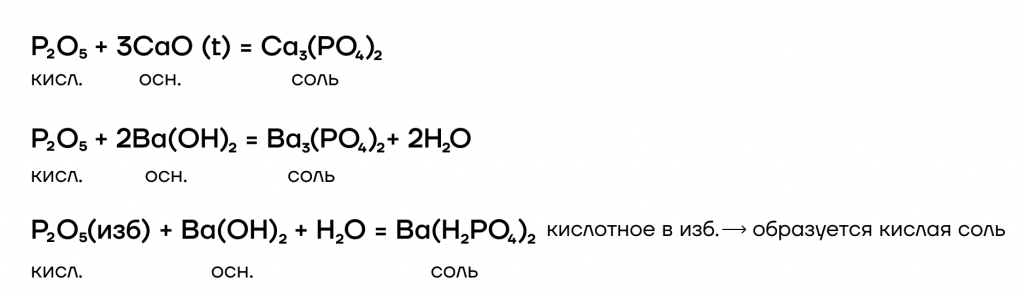
- Реакции вытеснения
В отношении реакций вытеснения P2O5 — это условно «сильный» оксид. Он способен вытеснять условно «слабые» (CO2 и SO2) из их солей при сплавлении (t).
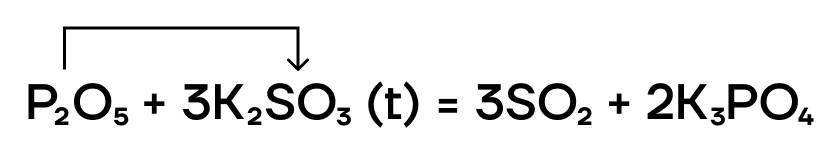
- P2O5-разбойник
Это вещество обладает крайне сильными дегидратирующими свойствами: оно активно осушает что?, отбирает воду. Он настолько жаден до воды, что может её отобрать даже у безводных кислородсодержащих летучих кислот.
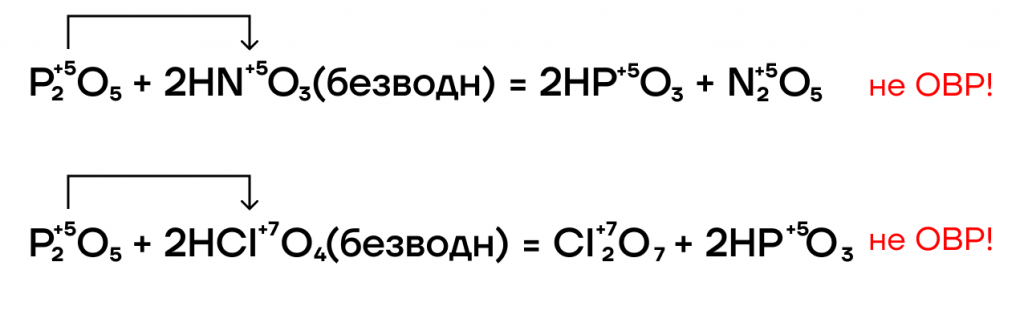
Ортофосфорная кислота H3PO4 и ортофосфаты
Ортофосфорная кислота — ничем не примечательная слабая кислота.
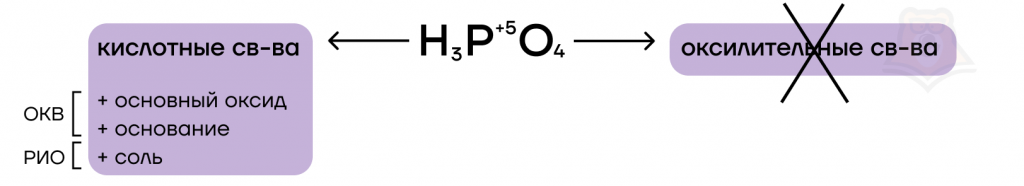
Как и все кислоты, она обладает кислотными свойствами. Она способна вступать в основно-кислотные взаимодействия с веществами, проявляющими основные свойства.
Опять же как и другие кислоты, она является электролитом. Это значит, она может распадаться на ионы и обмениваться ими с другими электролитами, то есть вступать в реакции ионного обмена.
Фактчек
- Фосфор — химический элемент VA-группы третьего периода; электронная конфигурация 1s22s22p63s23p3;
- Возможные степени окисления фосфора: -3, 0, +1, +3, +5;
- Существует несколько аллотропных модификаций фосфора: белый фосфор, черный фосфор, красный фосфор;
- Фосфор является типичным восстановителем в ОВР из-за низкой электроотрицательности;
- Фосфор образует следующие соединения: фосфин, оксиды, кислоты и соответствующие соли.
Проверь себя
Задание 1.
Количество электронов на внешнем энергетическом уровне атома фосфора равно:
- 3
- 4
- 5
- 6
Задание 2.
Какой аллотропной модификации фосфора не существует?
- Белый фосфор
- Желтый фосфор
- Черный фосфор
- Красный фосфор
Задание 3.
Фосфин можно получить реакцией:
- Фосфора и водорода
- Оксида фосфора(III) и водорода
- Оксида фосфора(V) и водорода
- Фосфора и раствора гидроксида калия
Задание 4.
Фосфористая кислота H3PO3 является:
- Трехосновной кислотой
- Двухосновной кислотой
- Одноосновной кислотой
- Четырехосновной кислотой
Ответы: 1. — 3; 2. — 2; 3. — 4; 4. — 2.
Таблица окисления химических элементов


4.7
Средняя оценка: 4.7
Всего получено оценок: 558.
4.7
Средняя оценка: 4.7
Всего получено оценок: 558.
Чтобы определить условный заряд атомов в окислительно-восстановительных реакциях, используют таблицу окисления химических элементов. В зависимости от свойств атома элемент может проявлять положительную или отрицательную степень окисления.
Что такое степень окисления
Условный заряд атомов элементов в сложных веществах называется степенью окисления. Значение заряда атомов записывается в окислительно-восстановительных реакциях, чтобы понять, какой элемент является восстановителем, а какой – окислителем.
Степень окисления взаимосвязана с электроотрицательностью, которая показывает возможность атомов принимать или отдавать электроны. Чем выше значение электроотрицательности, тем больше способность атома отнимать электроны в реакциях.

Степень окисления может иметь три значения:
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степени окисления в реакции натрия с хлором выглядят следующим образом:
2Na0 + Cl20 → 2Na+1Cl-1
В реакции металлов с неметаллами металл всегда является восстановителем, а неметалл – окислителем.
Как определить
Существует таблица, в которой указаны все возможные степени окисления элементов.
|
Название |
Символ |
Степень окисления |
|
Водород |
H |
+1, -1 |
|
Гелий |
He |
0 |
|
Литий |
Li |
+1 |
|
Бериллий |
Be |
+2 |
|
Бор |
B |
-1, 0, +1, +2, +3 |
|
Углерод |
C |
-4, -3, -2, -1, 0, +2, +4 |
|
Азот |
N |
-3, -2, -1, 0, +1, +2, +3, +4, +5 |
|
Кислород |
O |
-2, -1, 0, +1, +2 |
|
Фтор |
F |
-1 |
|
Неон |
Ne |
0 |
|
Натрий |
Na |
+1 |
|
Магний |
Mg |
+2 |
|
Алюминий |
Al |
+3 |
|
Кремний |
Si |
-4, 0, +2, +4 |
|
Фосфор |
P |
3, 0, +3, +5 |
|
Сера |
S |
2, 0, +4, +6 |
|
Хлор |
Cl |
1, 0, +1, +3, +5, +7, редко +2 и +4 |
|
Аргон |
Ar |
0 |
|
Калий |
K |
+1 |
|
Кальций |
Ca |
+2 |
|
Скандий |
Sc |
+3 |
|
Титан |
Ti |
+2, +3, +4 |
|
Ванадий |
V |
+2, +3, +4, +5 |
|
Хром |
Cr |
+2, +3, +6 |
|
Марганец |
Mn |
+2, +3, +4, +6, +7 |
|
Железо |
Fe |
+2, +3, редко +4 и +6 |
|
Кобальт |
Co |
+2, +3, редко +4 |
|
Никель |
Ni |
+2, редко +1, +3, +4 |
|
Медь |
Cu |
+1, +2, редко +3 |
|
Цинк |
Zn |
+2 |
|
Галлий |
Ga |
+3, редко +2 |
|
Германий |
Ge |
-4, +2, +4 |
|
Мышьяк |
As |
-3, +3, +5, редко +2 |
|
Селен |
Se |
-2, +4, +6, редко +2 |
|
Бром |
Br |
-1, +1, +5, редко +3, +4 |
|
Криптон |
Kr |
0 |
|
Рубидий |
Rb |
+1 |
|
Стронций |
Sr |
+2 |
|
Иттрий |
Y |
+3 |
|
Цирконий |
Zr |
+4, редко +2, +3 |
|
Ниобий |
Nb |
+3, +5, редко +2, +4 |
|
Молибден |
Mo |
+3, +6, редко +2, +3, +5 |
|
Технеций |
Tc |
+6 |
|
Рутений |
Ru |
+3, +4, +8, редко +2, +6, +7 |
|
Родий |
Rh |
+4, редко +2, +3, +6 |
|
Палладий |
Pd |
+2, +4, редко +6 |
|
Серебро |
Ag |
+1, редко +2, +3 |
|
Кадмий |
Cd |
+2, редко +1 |
|
Индий |
In |
+3, редко +1, +2 |
|
Олово |
Sn |
+2, +4 |
|
Сурьма |
Sb |
-3, +3, +5, редко +4 |
|
Теллур |
Te |
-2, +4, +6, редко |
|
Иод |
I |
-1, +1, +5, +7, редко +3, +4 |
|
Ксенон |
Xe |
0 |
|
Цезий |
Cs |
+1 |
|
Барий |
Bа |
+2 |
|
Лантан |
La |
+3 |
|
Церий |
Ce |
+3, +4 |
|
Празеодим |
Pr |
+3 |
|
Неодим |
Nd |
+3, +4 |
|
Прометий |
Pm |
+3 |
|
Самарий |
Sm |
+3, редко +2 |
|
Европий |
Eu |
+3, редко +2 |
|
Гадолиний |
Gd |
+3 |
|
Тербий |
Tb |
+3, +4 |
|
Диспрозий |
Dy |
+3 |
|
Гольмий |
Ho |
+3 |
|
Эрбий |
Er |
+3 |
|
Тулий |
Tm |
+3, редко +2 |
|
Иттербий |
Ib |
+3, редко +2 |
|
Лютеций |
Lu |
+3 |
|
Гафний |
Hf |
+4 |
|
Тантал |
Ta |
+5, редко +3, +4 |
|
Вольфрам |
W |
+6, редко +2, +3, +4, +5 |
|
Рений |
Re |
+2, +4, +6, +7, редко -1, +1, +3, +5 |
|
Осмий |
Os |
+3, +4, +6, +8, редко +2 |
|
Иридий |
Ir |
+3, +4, +6, редко +1, +2 |
|
Платина |
Pt |
+2, +4, +6, редко +1, +3 |
|
Золото |
Au |
+1, +3, редко +2 |
|
Ртуть |
Hg |
+1, +2 |
|
Талий |
Tl |
+1, +3, редко +2 |
|
Свинец |
Pb |
+2, +4 |
|
Висмут |
Bi |
+3, редко +3, +2, +4, +5 |
|
Полоний |
Po |
+2, +4, редко -2, +6 |
|
Астат |
At |
– |
|
Радон |
Ra |
0 |
|
Франций |
Fr |
– |
|
Радий |
Ra |
+2 |
|
Актиний |
Ac |
+3 |
Или использовать на уроках этот вариант таблицы.

Кроме того, степени окисления химических элементов можно определить по периодической таблице Менделеева:
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Большинство неметаллов имеют положительную и отрицательную степени окисления. Например, кремний находится в IV группе, значит, его максимальная степень окисления +4, а минимальная -4. В соединениях неметаллов (SO3, CO2, SiC) окислителем является неметалл с отрицательной степенью окисления или с большим значением электроотрицательности. Например, в соединении PCl3 фосфор имеет степень окисления +3, хлор -1. Электроотрицательность фосфора – 2,19, хлора – 3,16.
Второе правило не работает для щелочных и щелочноземельных металлов, которые всегда имеют одну положительную степень окисления, равную номеру группы. Исключения составляют магний и бериллий (+1, +2). Также постоянную степень окисления имеют:
- алюминий (+3);
- цинк (+2);
- кадмий (+2).
Остальные металлы имеют непостоянную степень окисления. В большинстве реакций выступают в качестве восстановителя. В редких случаях могут быть окислителями с отрицательной степенью окисления.
Фтор – самый мощный окислитель. Его степень окисления всегда -1.

Что мы узнали?
Из урока 8 класса узнали о степени окисления. Это условная величина, показывающая, сколько электронов может отдать или принять атом в ходе химической реакции. Значение связано с электроотрицательностью. Окислители принимают электроны и имеют отрицательную степень окисления, восстановители отдают электроны и проявляют положительную степень окисления. Большинство металлов – восстановители с постоянной или переменной степенью окисления. Неметаллы могут проявлять свойства окислителя и восстановителя в зависимости от вещества, с которым реагируют.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Александр Котков
5/5
-

Паша Кривов
4/5
-

Александр Котков
5/5
-

Лидия Маслова
5/5
Оценка доклада
4.7
Средняя оценка: 4.7
Всего получено оценок: 558.
А какая ваша оценка?

Как определить степень окисления
Материал по химии
Что такое степень окисления?
Степень окисления – это условная величина, отражающая количество принятых или отданных электронов при образовании заряженной частицы из электронейтрального атома при условии, что электроны переходят от одного атома к другому полностью.
Вспомним, что идеальное количество электронов на внешнем электронном уровне атома равно восьми. Такую конфигурацию внешнего слоя имеют атомы большинства благородных газов (кроме гелия). И к такой электронной конфигурации стремятся атомы других элементов.
Как определить степень окисления
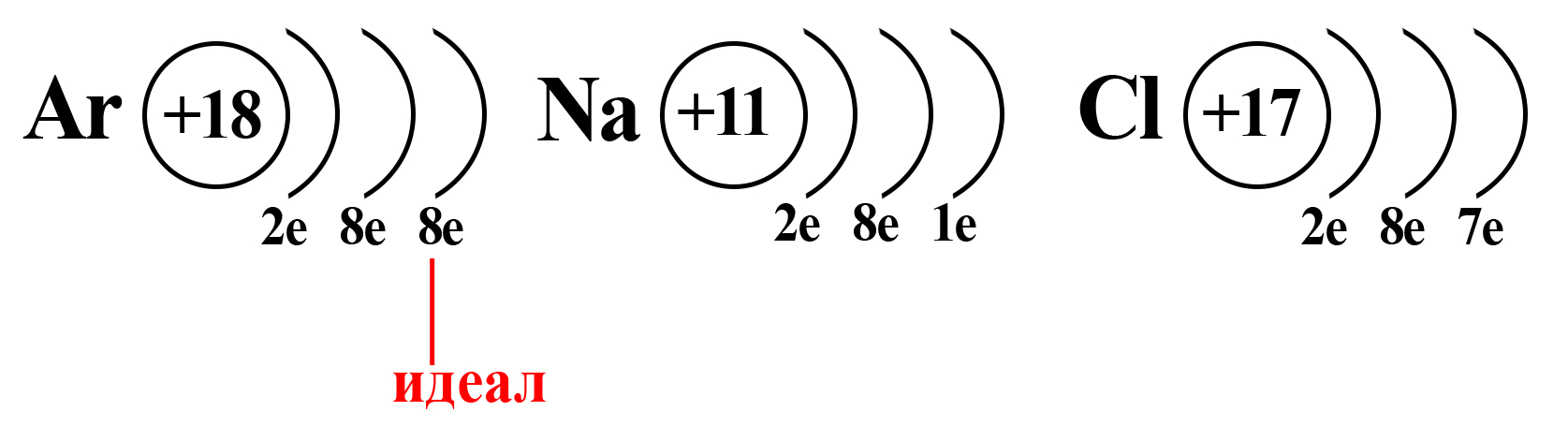
Конфигурация благородного газа
Натрий и хлор не так далеки от «идеала», как может показаться. Если атомы этих элементов столкнуться, внешний электрон натрия притянется на внешний электронный уровень хлора (из-за большей электроотрицательности хлора):
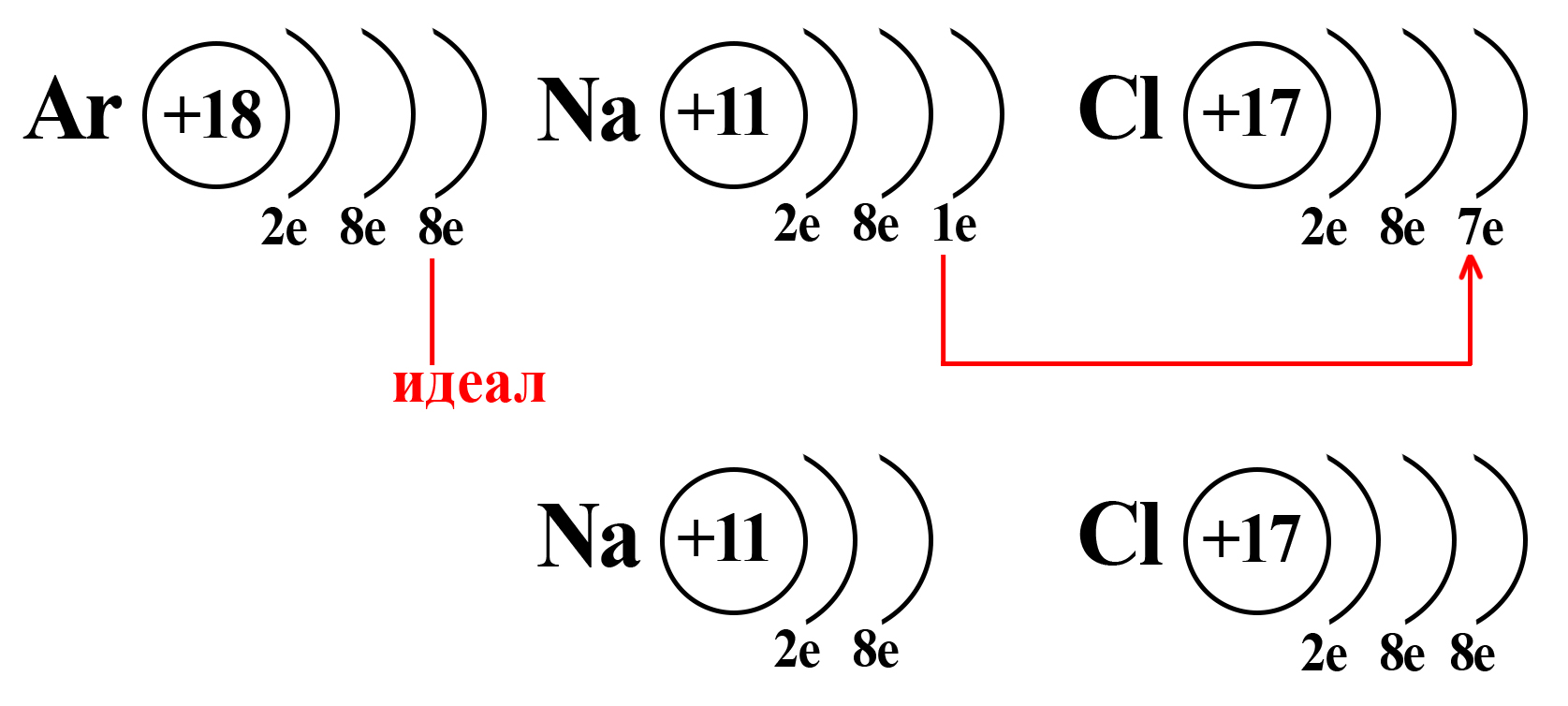
Таким образом, натрий и хлор как будто вступают в симбиоз: натрию, для приобретения «благородной» конфигурации необходимо избавиться от внешнего электрона (при потере внешнего электрона теряется и внешний уровень, а предвнешний уровень, имеющий идеальное количество электронов, становится внешним), тогда как хлору необходимо получить один электрон, чтобы завершить внешний энергетический уровень.
Потеряв один электрон, натрий приобретает положительный заряд, становится катионом (положительно заряженной частицей). Это объясняется тем, что ядро натрия по-прежнему имеет 11 протонов, а вот электронная оболочка, после взаимодействия с хлором, содержит 10 электронов. Таким образом, натрий будет иметь 11 положительно заряженных частиц и 10 отрицательно заряженных частиц. По простейшему уравнению: +11 – 10 = +1, становится ясно, откуда взялся положительный заряд.
Аналогичный расчет можно привести и для хлора. После взаимодействия с натрием ядро атома хлора не изменяется, оно содержит 17 положительно заряженных частиц (протонов), а оболочка – 18 отрицательно заряженных частиц (электронов). +17 – 18 = ‒1.
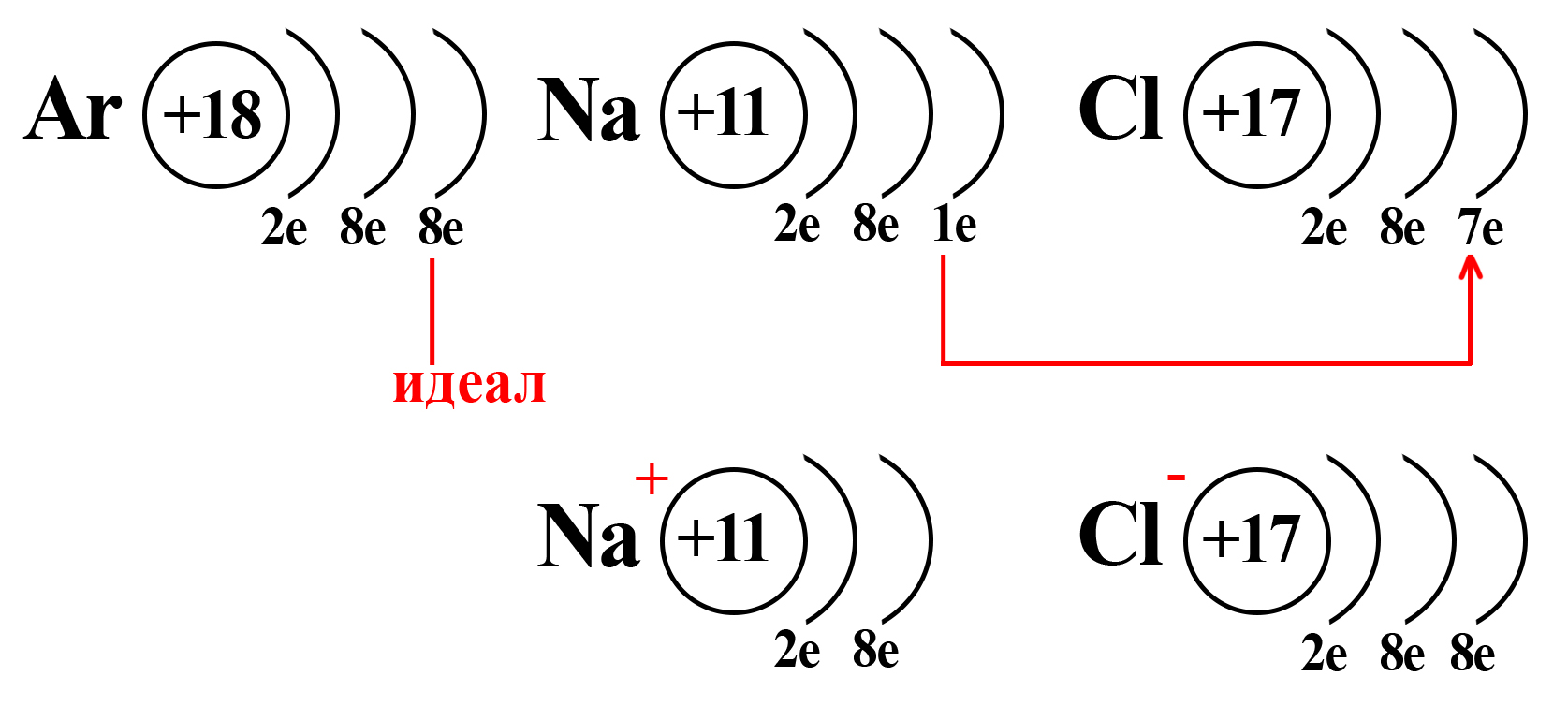
Полученные заряды и являются степенями окисления.
Также степень окисления можно выразить количеством электронов, которые иону нужно получить или отдать для того, чтобы стать электронейтральным атомом. Так, катион натрия, имеющий заряд «+1», должен получить 1 электрон, чтобы превратиться в атом натрия: Na+ +1ē = Na0. А анион хлора (хлорид-ион), имеющий заряд «‒1» должен отдать один электрон: Cl– -1ē = Cl0.
Для упрощения понятие «степень окисления» применяется не только для веществ с ионным строением (металл + неметалл), но и для веществ с ковалентными полярными связями. Несмотря на то, что в таком типе связи полного перехода электронов от одного атома к другому не происходит, полученные частичные заряды превращаются в целые.
Постоянные степени окисления.
Знания этой простой, базовой темы помогут Вам решать не только тестовые задания. Одно из самых сложных заданий ЕГЭ – расстановка коэффициентов с помощью электронного баланса – не решается без знания степеней окисления.
Таблица «Элементы, имеющие постоянную степень окисления»
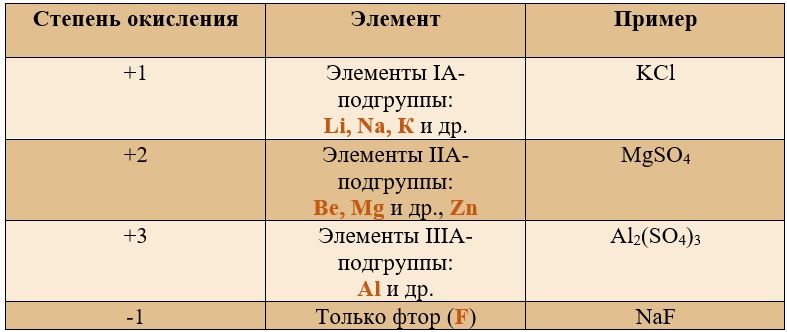
Таблица «Наиболее популярные степени окисления у остальных элементов» (Выделены бурым)*
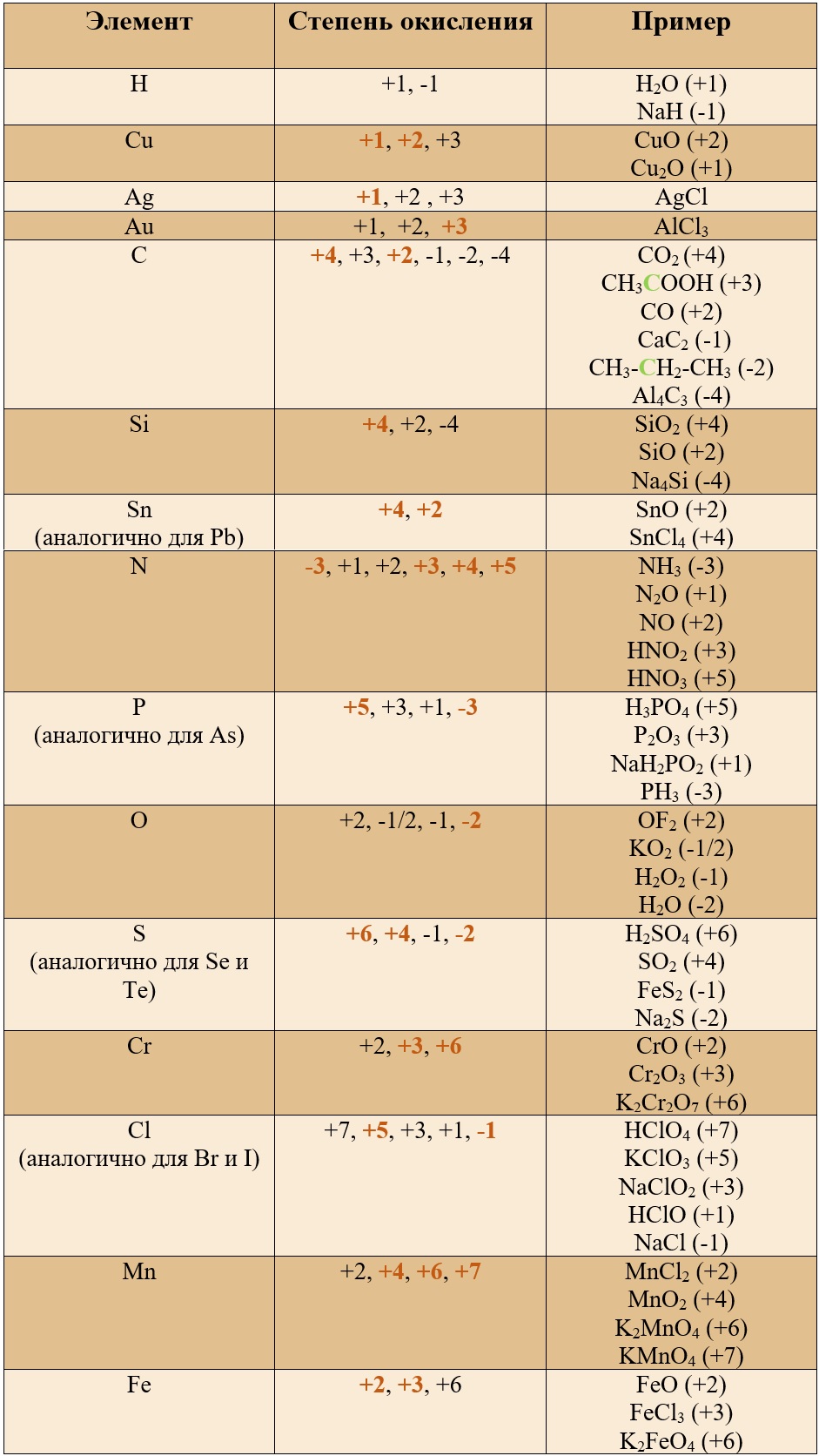
*В таблице указаны не все возможные степени окисления.
Таким образом, медь, серебро, золото и железо не проявляют высшей степени окисления, равной номеру группы, у остальных же элементов высшая степень окисления равна номеру группы.
Для определения степени окисления не нужно учить всю таблицу, и тем более все степени окисления. Они приведены для справки, наиболее важными являются:
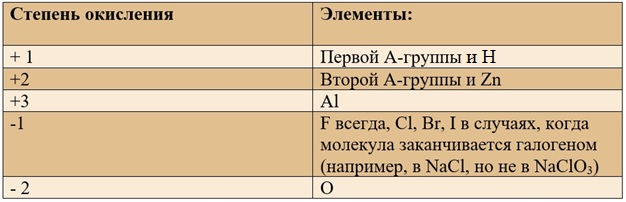
Определение степеней окисления в бинарных соединениях
Для примера возьмём оксид фосфора (P2O5)
- Определим степень окисления известного элемента (в нашем случае это кислород).

- Условно разделим молекулу на две части: чаще всего первая часть молекулы положительная, а вторая – отрицательная (искл: NH3 и PH3).

- Индекс после кислорода указывает на, что в молекуле содержится пять атомов кислорода, каждый из них имеет степень окисления «-2», поэтому общее количество отрицательных зарядов будет равно «-10».
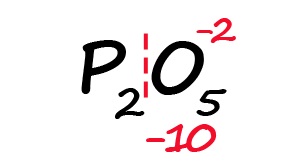
- Молекула должна быть электронейтральной, то есть количество положительных и отрицательных зарядов должны быть равными. Из этого следует, что все атомы фосфора в данной молекуле в сумме должны иметь десять положительных зарядов.
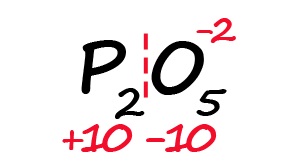
- Индекс «2» после фосфора означает, что в молекуле содержится два атома фосфора, между которыми поровну нужно разделить общий положительный заряд (+10:2=+5)
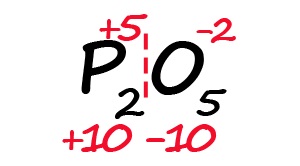
Аналогичным образом происходит определение степени окисления в более сложных веществах, для примера возьмём перманганат калия (KMnO4):
- Подпишем степени окисления для элементов, имеющих постоянные их значения:

- Разделим молекулу на положительный и отрицательный «полюс» (в соединениях, состоящих из атомов трех элементов, чаще всего первые два являются положительными, а третий – отрицательным).

- Посчитаем общее количество положительных и отрицательных зарядов с учетом индексов:
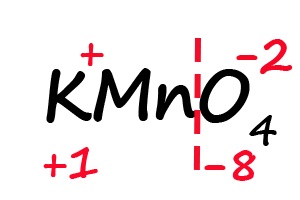
- Ответим на вопрос: какого количества плюсов не хватает, что бы положительные и отрицательные заряды имели одинаковое значение? До +8 не хватает семи положительных зарядов, откуда следует, что степень окисления марганца равна «+7».
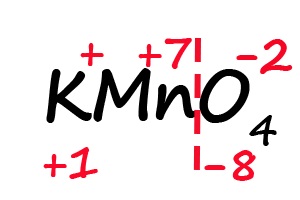
Ну и напоследок разберем степени окисления элементов в дихромате калия (K2Cr2O7):
- Подписываем известные степени окисления:
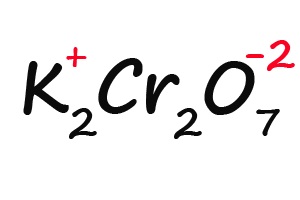
- Делим молекулу на положительную и отрицательную части:
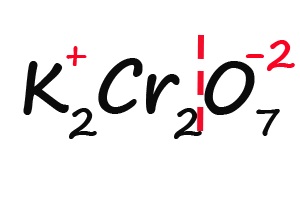
- Считаем общее количество «плюсов» и «минусов»:
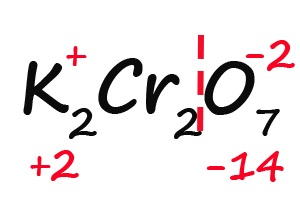
- Подсчитываем, сколько положительных зарядов не достает для того, чтобы молекула стала электронейтральной (т. е. такой молекулой, в которой количество положительных и отрицательных зарядов было одинаковым):
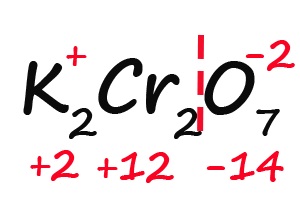
- Так как молекула содержит два атома хрома, двенадцать положительных зарядов должны распределиться между ними поровну, то есть, каждый хром имеет заряд +6:
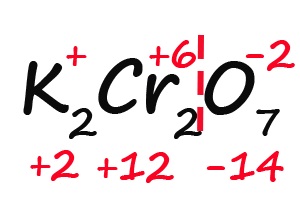
Как быть, если в формуле встретились скобки? Например, как посчитать степень окисления брома в пербромате кальция?

- Для начала определим все известные степени окисления, как делали в предыдущих примерах:
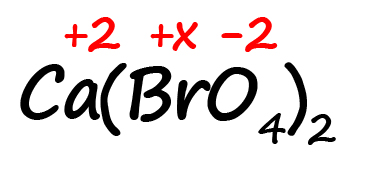
- Посчитаем сумму положительных и отрицательных зарядов. Важно учесть все индексы. Помните, что индекс. Расположенный за атомом действует только на этот атом, а индекс, расположенный за скобкой, действует на всё содержимое скобок:
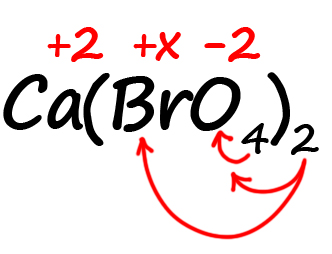
Таким образом, в пербромате кальция содержится: один атом кальция, два атома брома и 8 атомов кислорода (индексы, относящиеся к одному и тому же атому перемножаются).
Следовательно, мы имеем два положительных заряда от кальция и шестнадцать отрицательных от кислорода. Так как индекс «2» за скобками действует и на бром, его заряд можно выразить как 2х.
Получаем уравнение:
2 + 2х ‒ 16 = 0
2х = 14
х = 7
Степень окисления брома в пербромате кальция равна «+7».
